Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Ginecología y Obstetricia
versión On-line ISSN 2304-5132
Rev. peru. ginecol. obstet. vol.64 no.1 Lima ene./mar. 2018
SIMPOSIO manejo terapéutico en el climaterio y menopausia, evidencias actuales
Modificaciones del endotelio en la vida de la mujer climatérica
Endothelium modifications in the climacteric woman
Edgardo Romero Galván1
1. Centro Médico Especialidades, Tacuarembó, Uruguay
RESUMEN
El endotelio es el mayor órgano endocrino vascular que en la mujer está protegido por la acción de los estrógenos y mediado a través del óxido nítrico, un potente vasodilatador. La mujer se ve protegida de la aterotrombosis hasta la menopausia. Al comenzar la etapa climatérica se va perdiendo dicha protección entrando a una disfunción endotelial que conlleva a la aparición de factores de riesgo cardio- y cerebrovascular como la hipertensión, diabetes, dislipemia, aumentando el daño vascular y riesgos de infartos.
Palabras clave. Endotelio, Disfunción endotelial, Climaterio.
ABSTRACT
The endothelium is the largest vascular endocrine organ protected in women by estrogens and mediated through nitric oxide, a potent vasodilator. The woman is protected from atherothrombosis until the menopause. At the beginning of the climacteric this protection is lost and endothelial dysfunction leads to cardiac and brain vascular risk factors such as hypertension, diabetes and dyslipidemia, which increase the vascular damage and the risk of heart attack.
Keywords: Endothelium, Endothelial dysfunction, Climacteric.
Introducción
Debido al alto impacto en la morbimortalidad de la aterosclerosis y todos sus síndromes asociados es necesario nuevos abordajes tanto en la prevención como en el tratamiento, además del control de todos los factores de riesgos (FR) clásicos, los modificables así como de los nuevos FR emergentes (lipoproteína - Lp(a), homocisteína, proteína C reactiva - PCR, fibrinógeno, microalbuminuria) en las pacientes que comienzan la etapa climatérica.
Es importante evaluar la disfunción endotelial (DE), una herramienta más para valorar el comienzo de la aterosclerosis, entidad esta que comienza con el descenso de estrógenos y progesterona en el climaterio que se acentúan en la etapa posmenopáusica.
Funciones del endotelio
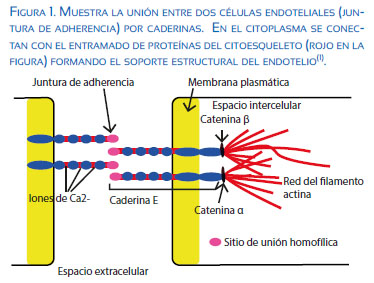
El endotelio vascular es una monocapa celular de células elongadas con su eje en dirección del flujo sanguíneo y que miden de 25 a 50 micrómetros de longitud y un ancho de 10 a 15 micrómetros, interconectadas por proteínas de adhesión de transmembrana de la familia de las caderinas. Presentan dos tipos de uniones, las estrechas (TIGH) y otras más débiles (GAP). La importancia de estas uniones radica en su capacidad para limitar el transporte de sustancias y moléculas, esta capa endotelial actuando como barrera mecánica (Figura 1).
El endotelio es el órgano paracrino y endocrino más grande del organismo y el de mayor actividad, llegando a pesar 1,5 kg y abarcando una superficie de más de 800 m2; produce más de 250 sustancias activas. Pasa constantemente por ciclos de regeneración y muerte celular programada (apoptosis), de forma tal que cada 3 meses todas las células endoteliales se van renovando. Estas células endoteliales son muy ricas en vesículas pinocíticas entre las que son características los ‘cuerpos de Weibel-Palade’ que contienen factor von Willebrand, selectina P, endotelina y otros factores. Por ello, el endotelio es considerado la mayor glándula de secreción interna del organismo.
Este órgano que recubre toda la superficie luminal de las arterias es responsable de la vasorregulación, desagregación plaquetaria, desadhesión de monocitos, inhibición de la trombogénesis, es intercambiador de nutrientes y metabolitos y una verdadera barrera inmunológica. Cuando el endotelio está inactivo es anticoagulante, antiadhesivo y vasodilatador y, cuando se activa, es procoagulante, proadhesivo y vasoconstrictor.
Endotelio como órgano endocrino
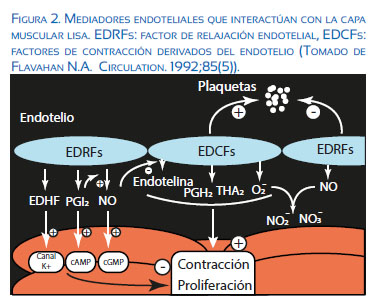
Dentro de los factores secretados por el endotelio encontramos el óxido nítrico, descrito en un principio como factor de relajación endotelial (EDRF) por Robert Furchgott. Produce vasodilatación vascular a través del GMPc en la célula del músculo liso y se sintetiza a partir de la L-arginina por efecto de la NO sintasa (NOS). Otros factores vasodilatadores sintetizados por el endotelio son el factor hiperpolarizante (EDHF) que estimula entrada de potasio a través de sus canales de membrana de la célula muscular lisa, y la prostaciclina (PGI2) que actúa a través del AMPc, inhibiendo la contracción, la proliferación y la agregación plaquetaria.
Contrariamente a estos efectos, también se sintetizan factores de contracción endotelial derivados del endotelio (EDCF), siendo los más importante la endotelina-1, prostaglandina H2 (PGH2), tromboxano A2 (TBA2) y el anión superóxido (O2-). Estos factores estimulan la contracción y la proliferación de las células musculares lisas así como la agregación plaquetaria (Figura 2).
Otra función endotelial es la síntesis de macromoléculas del tejido conectivo, como ser colágeno, proteínas de membranas basales y proteoglicanos, los cuales detectan los cambios físicos (estrés mecánico, hemodinámico) y químicos (liberación de moléculas), para transformarlos en respuestas funcionales adaptativas del endotelio.
Los FR están asociados con una disfunción endotelial, la cual conlleva a la pérdida de la función reguladora de la homeostasis vascular. La severidad de dicha disfunción se asocia con un mayor riesgo CV y ciertas acciones farmacológicas que reducen dicho riesgo mejoran la función endotelial, entre ellas las estatinas, IECA, ARA II y nebivolol.
La disfunción endotelial es la primera manifestación de la aterosclerosis. La monocapa celular actúa como sensor y transmisor de señales, regulando la interacción celular y de proteínas circulantes; además modula la vasorrelajación o la vasoconstricción a través de mecanorreceptores, como los sensores de flujo de potasio de transmembrana que abren selectivamente los canales de K según la velocidad del flujo sanguíneo, produciendo un aumento del factor relajante del endotelio (EDRF: NO).
El endotelio tiene funciones antitrombóticas, inhibiendo la adhesión plaquetaria y la coagulación; además de regular el sistema fibrinolítico, controla la actividad de las células musculares lisas de la capa media (tono vascular y proliferación) y modula el tránsito de lipoproteínas y de leucocitos (monocitos/linfocitos T) a través de la pared arterial.
Disfunción endotelial y factores de riesgo vascular
Los diversos factores de riesgo pueden provocar disfunción endotelial, la cual se define como un desequilibrio en la biodisponibilidad de sustancias activas endoteliales, predisponiendo a la inflamación, vasoconstricción y aumento en la permeabilidad vascular, facilitando el desarrollo de la placa de ateroma y la trombosis (aterotrombosis) por agregabilidad plaquetaria. Hay un desequilibrio entre los factores vasodilatadores (NO) y los vasoconstrictores (angiotensina II, tromboxano y endotelina 1).
Todos los FR, tanto los clásicos como los emergentes, producen cambios en esta permeabilidad endotelial. El aumento de la permeabilidad endotelial estaría vinculado a una desorganización del citoesqueleto y por la contracción celular que es mediada por el calcio. En la hipertensión arterial hay una inhibición en la producción del NO; a mayor tiempo de inhibición de la NO-sintetasa más ascienden las cifras tensionales, acompañada a una sobreproducción de angiotensina II y noradrenalina.
Para las lipoproteínas como LDL, el flujo se produce a favor de la gradiente de concentración (transcitosis), potenciada por la dislipemia. Esto se observa ya con valores de LDL por encima de 100 mg/dL y, en aquellos pacientes con alto riego, por encima de 70 mg/dL(2). El efecto de las LDL estaría vinculado con la desorganización que se produce sobre los filamentos de actina y con la inhibición de la fosfatasa de la cadena ligera de miosina(3,4).
Las LDL susceptibles a oxidación (LDLox), las pequeñas y densas (IDL), las LDL ricas en TG y la LDL glicada promueven la disfunción endotelial por inhibir la expresión de la NO sintasa endotelial, disminuyendo la biodisponibilidad del NO; son también trombogénicas por inhibir la fibrinólisis y estimular la hipercoagulabilidad.
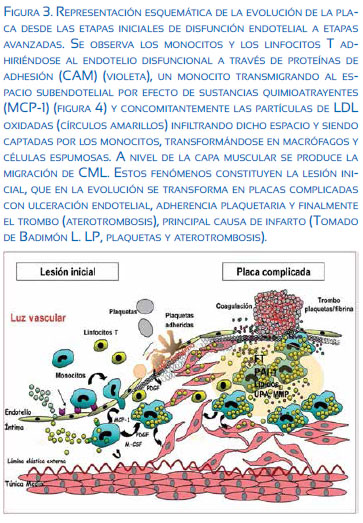
Niveles elevados de LDL y LDLox aumentan la degradación de proteoglicanos, componente de la matriz extracelular en el espacio subendotelial, aumentando la secreción de heparinasa endotelial, favoreciendo la permeabilidad(5) y produciendo un aumento en la expresión de las moléculas de adhesión(6) (Figura 3).
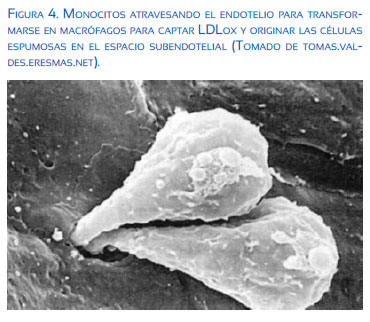
En la disfunción endotelial, la célula endotelial expresa moléculas de adhesión como VCAM (vascular), ICAM 1, 2, 3 (adhesión intercelular), citocinas (IL-1), factores de crecimiento (PDGF) y quimiotácticos (MCP-1) para receptores de monocitos y linfocitos T circulantes 11 y 12, confirmándose las descripciones de Virchow a principios del siglo XX, en relación al origen inflamatorio de la aterosclerosis.
A nivel de la placa complicada, las metaloproteinasas de la matriz o matrixinas (MMP, Figura 3) producen degradación de las proteínas, que según los trabajos de Blankenberg es un marcador pronóstico y de daño coronario (MMP-9), ya que MMP son más activas en las regiones inestables de la placa, favoreciendo su rotura; y con esto, la presentación de SICA (síndrome isquémico coronario agudo). Los genes que codifican las MMP y las variaciones que pueden haber en ellos son candidatos para determinar el riesgo de enfermedad coronaria en un futuro(7-10).
Los niveles de expresión de las CAM (ICAM y VCAM) son muy superiores en las lesiones ateroscleróticas a diferencia de las áreas sin lesiones que prácticamente no las expresan. Se destaca el valor de los fragmentos solubles de estas moléculas como biomarcadores de evolución de lesiones ateroscleróticas y su correlación con marcadores de inflamación como la PCR ultrasensible, desde los trabajos de Ridker(11) en 1996 y los niveles de selectina E (familia de CAM) que se ven francamente disminuidos en pacientes con hipercolesterolemia familiar (HCF) tratados con estatinas(12).
Entre otros biomarcadores de activación endotelial tenemos el aumento de IL 6, de PAI 1, del TNF alfa, las LDLox, Lp-PLA 2 (lipoproteína asociada a la fosfolipasa A2), PCR y la disminución de PGI2 y de NO. Esta disminución de óxido nítrico no inhibe la proliferación de células musculares lisas ni la expresión de las moléculas de adhesión, favoreciendo el desarrollo de la placa(13-15).
La inflamación está en la base de la disfunción endotelial, llevando eventualmente a la formación de placa. El grado de inflamación define la ‘vulnerabilidad’ de la placa a la rotura. Numerosas estrategias se han adoptado para identificar y eventualmente tratar la placa vulnerable. La fosfolipasa asociada a la lipoproteína A (Lp-PLA) (2) s e ha convertido en un marcador de la inflamación que puede desempeñar un papel directo en la formación de la placa con tendencia a la rotura. Los estudios epidemiológicos han demostrado claramente la capacidad de pronóstico del aumento de los niveles de la Lp-PLA(2) y su asociación con un mayor riesgo de eventos coronarios y cerebrovasculares futuros.
Factor de relajación endotelial: óxido nítrico
Los primeros estudios sobre el NO los realiza el Dr. Robert Furchgott junto a Louis Ignarro y Ferid Murad. El NO es una molécula sintetizada por el endotelio a partir de L-arginina y por efecto de la enzima óxido nítrico sintetasa (NOS III o eNOS), dando NO y citrulina. Requiere calcio para su activación y el NO difunde al músculo liso vascular activando la guanilato ciclasa, aumentando los niveles de GMPc y provocando relajación del tejido muscular(16). También inhibe la adhesión y agregación plaquetaria, inhibe la proliferación de las CML, es antioxidante e inhibeexpresión de CAM y la adhesión de monocitos. La alteración en la producción de NO perturba la homeostasis vascular y potencia el desarrollo de lesiones ateroscleróticas. La pérdida de la dilatación vascular dependiente de NO es la manifestación más temprana de la disfunción del endotelio, observándose en todos aquellos pacientes con FR. Destacamos la importancia clínica de detectar dicha disfunción en estos pacientes por diferentes métodos.
El déficit de estrógenos, presente desde la perimenopausia, tiene una influencia negativa en el endotelio vascular y produce disfunción del endotelial(17,18), desequilibrio en la biodisponibilidad de sustancias activas de origen endotelial que predisponen a la inflamación (endotelitis), a la vasoconstricción y al incremento de la permeabilidad vascular, mediando el desarrollo y las manifestaciones clínicas de la aterosclerosis a nivel cardio y cerebrovascular(19,20).
Los estrógenos, además de marcar diferencias fenotípicas, ejercen una protección vascular, actuando como antioxidante, prolongando la vida media del NO que es de tan solo 5 segundos; este efecto antioxidante es ejercido por el anillo aromático presente en dicha hormona. El efecto protector vascular se ejerce por modificaciones en la composición de la membrana basal, de los canales iónicos de Ca y K, mecanismos logrados por efecto sobre los receptores de E (R/E)(21).
Los diferentes tipos de R/E alfa y beta se expresan en el endotelio, plaquetas y en las células musculares lisas; el R/alfa activa directamente la producción de NO con un efecto vasodilatador, mientras que el R/beta se vincula con un efecto antiaterogénico y antiproliferativo, también involucrando al NO(22,23). El nivel basal de este mediador (NO) es mayor en mujeres que en los varones, probablemente porque estos presentan una mayor inactivación del NO por alta concentración del inactivador de la NO sintasa endotelial (ADMA: asymmetrical dimetil L arginina).
La función endotelial es cambiante con el ciclo menstrual, desde la menarquía hasta la menopausia. Hay una vasodilatación máxima dependiente del NO cuando la mujer pasa de la fase folicular a la lútea, correlacionada con los altos niveles de estradiol; el ciclo menstrual es un verdadero modulador del endotelio(24).
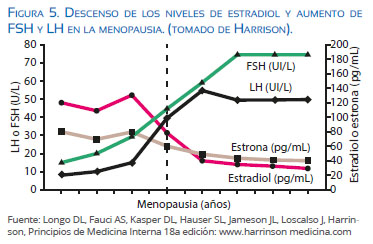
En la etapa climatérica se producen cambios hormonales y clínicos importantes con pérdida gradual de la función ovárica, franco descenso de E y aumento de FSH y LH (Figura 5), manifestándose clínicamente con las tuforadas o bochornos, sudoración, trastornos del sueño y del estado de ánimo (angustia y depresión), disminución de la lubricación vaginal y pérdida de la libido.
Este disbalance hormonal produce un aumento en la vulnerabilidad al daño vascular, con tendencia a la hipertensión arterial, aumento de la rigidez vascular y por consiguiente un mayor riesgo de ACV. Varios trabajos clínicos han demostrado que la mayor disfunción del endotelio se establece en los primeros 5 años de la posmenopausia (comparada a aquellas que están en menopausia tardía), al igual que ocurre con los síntomas vasomotores y con el contenido mineral óseo cuya pérdida se hace más pronunciada en el primer quinquenio, etapa más crítica del climaterio; posteriormente habría una adaptación al hipoestrogenismo que sería menos lesiva tanto a nivel endotelial como óseo(25,26).
Métodos para evaluar el endotelio y estado de las placas
Podemos estudiar la disfunción endotelial por diferentes métodos, entre ellos:
1. De laboratorio: marcadores lipídicos y marcadores inflamatorios: PCR ultrasensible mayor a 2 mg, homocisteinemia (4,45 a 13,56 microMol/ L), microalbuminuria entre 30 y 300 mg/24 h (este es el marcador de disfunción endotelial de más fácil acceso y de bajo costo; al estar elevada expresa lesión mesangial).
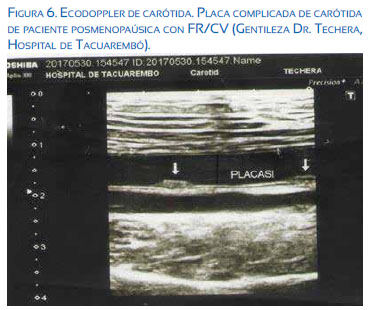
2. Imagenológico: eco Doppler vascular, midiendo el complejo íntima media carotídea (CIMC) cuyo valor normal es menor a 0,9 mm.
Este estudio que debería solicitarse en todas aquellas pacientes climatéricas y posmenopáusicas con FR vascular por su costo bajo y no invasivo (Figura 6).
Otro método de estudiar las placas es a través de una eco intravascular (IVUS), siendo invasivo, de costo alto y alta especificidad. El estudio de la velocidad onda de pulso (VOP) se correlaciona con la rigidez arterial, con el CIMC y con la disfunción del endotelio, en pacientes hipertensos, diabéticos y dislipémicos. El PET es otro método de estudio con un marcador radioactivo (18F. NaF); permite hacer visibles las placas coronarias de riesgo, gran captación del radiofármaco, indicando un aumento del riesgo de rotura(27).
Conclusiones
La disfunción del endotelio es un evento frecuente en las mujeres aparentemente sanas en etapa climatérica. La transición hacia la posmenopausia constituye una etapa de grandes cambios vasculares. El descenso de estrógenos en la posmenopausia tiene un impacto negativo a nivel endotelial que, sumado a los diferentes factores de riesgo, tienen importantes repercusiones negativas para la salud. En el futuro este déficit endocrino será blanco y diana terapéutico.
Financiamiento: Autofinanciado
Conflicto de interés: El autor declara no tener algún conflicto de interés
Citar como: Romero Galván E. Modificaciones del endotelio en la vida de la mujer climatérica. Rev Peru Ginecol Obstet. 2018;64(1): 31-37
Referencias bibliográficas
1. Dejana E. et al. Cell adhesion in vascular biology. J Clin Invest. 1996;9:1949-53. [ Links ]
2. Nordestgaard B, Nielsen L. Atherosclerosis and arterial influx of lipoproteins. Curr Opin Lipidol. 1994;5:252-7. [ Links ]
3. Zhao B, Ehringer WD, Dierichs R, Miller FN. Oxidized low-density lipoprotein increases endothelial intracellular calcium and alters cytoskeletal f-actin distribution. Eur J Clin Invest. 1997;27:48-54. [ Links ]
4. Essler M, Retzer M, Bauer M, Heemskerk JW, Aepfelbacher M, Siess W. Midly oxidized low density lipoprotein induces contraction of human endothelial cells through activation of Rho/Rho kinase and inhibition of myosin light chain phosphatase. J Biol Chem. 1999;274:30361-4. [ Links ]
5. Pillarisetti S. Lipoprotein modulation of subendothelial heparan sulfate proteoglycans (Perlecan) and atherogenicity. Trends Cardiovasc Med. 2000;10:60-5. [ Links ]
6. Smalley DM, Lin JH.C, Curtis ML, Kobari Y, Stemerman MB, Prichard KA. Native LDL increases endothelial cell adhesiveness by inducing intercellular adhesion molecule- 1. Arterioscler Thromb Vasc Biol. 1996;16:585-90. [ Links ]
7. Blankenberg S, Rupprecht HJ, Poirier O, et al. Plasma concentrations and genetic variation of matrix metalloproteinase 9 and prognosis of patients with cardiovascular disease. Circulation. 2003;107:1579-85. [ Links ]
8. Kalela A, Koivu TA, Sisto T, et al. Serum matrix metalloproteinase- 9 concentration in angiographically assessed coronary artery disease. Scand J Clin Lab Invest. 2002;62:337-42. [ Links ]
9. Uzui H, Harpf A, Liu M, et al. Increased expression of membrane type 3-matrix metalloproteinase in human atherosclerotic plaque: role of activated macrophages and inflammatory cytokines. Circulation. 2002;106:3024-30. [ Links ]
10. 7. Zeng B, Prasan A, Fung KC, et al. Elevated circulating levels of matrix metalloproteinase-9 and -2 in patients with symptomatic coronary artery disease. Intern Med J. 2005;35:331-5. [ Links ]
11. Ridker P, Hennekens C, Roitman-Johson B, Stampfer M, Allen J. Plasma concentration of soluble intercellular adhesion molecule 1 and risk of future myocardial infarction in apparently healthy men. Lancet. 1998;351:88-92. [ Links ]
12. Alonso R, Mata P, De Andrés R, Villacastin BP, Martínez- González J, Badimon L. Sustained long-term improvement of arterial endothelial function in heterozygous familial hypercholesterolemia patients treated with simvastatin. Atherosclerosis. 2001;157:423-9. [ Links ]
13. Nguyen et al. Am.Epidemiol. 2010 [ Links ]
14. Aragonés et al. Eur J Clin Invest. 2012;42:34-41. [ Links ]
15. Bhatti S , Hakeem A , Cilingiroglu M. Lp-PLA2 como marcador de enfermedades cardiovasculares. Curr Atheroscler Rep. 2010;12 (2):140-4. [ Links ]
16. Moncada S, Higes EA. Importancia clínica del óxido nítrico en el sistema cardiovascular. Madrid: Edicomplet, 1992. [ Links ]
17. Dessapt AL, Gourdy P. Menopause and cardiovascular risk. J Gynecol Obstet Biol Reprod. 2012;41(7):13-9. [ Links ]
18. Hernández M, Blanco O. Los estrógenos como protectores cardiovasculares. Medicentro Electrónica. 2012;16(3):148-53. [ Links ]
19. Simón A, Castro A, Kaski J. Avances en el conocimiento de la disfunción endotelial y su aplicación en la práctica clínica. Rev Cubana Med. 2001; 40(3):212-22. [ Links ]
20. Poredos P, Jezovnik MK. Testing endothelial function and its clinical relevance. J Atheroscler Thromb. 2013; 20(1):1-8. [ Links ]
21. Bechlioulis A, Kalantaridou SN, Naka KK, Chatzikyriakidou A, Calis KA, Makrigiannakis A, et al. Endothelial function, but not carotid intima-media thickness, is affected early in menopause and is associated with severity of hot flushes. J Clin Endocrinol Metab. 2010; 95(3):1199-206. doi: 10.1210/jc.2009-2262. [ Links ]
22. Darblade B, Pendaries C, Krust A, Dupont S, Fouque M-J, Rami J, Chambon P, et al. Estradiol alters nitric oxide production in the mouse aorta through the alpha-, but not beta-, estrogen receptor. Circ Res. 2002;90(4):413–9. [ Links ]
23. Sumi D, Ignarro LJ. Estrogen-related receptor alpha 1 up-regulates endothelial nitric oxide synthase expression. Proc Natl Acad Sci. 2003;100:14451–6. [ Links ]
24. Miller VM, Mulvagh SL. Sex steroids and endothelial function: translating basic science to clinical practice. Trends Pharmacol Sci. 2007;28:263-70. [ Links ]
25. Maeda M, Nakamura C, Uchigaki A, Yuba K, Utsumi M, Siba M, et al. Effects of aging and menopause on women’s vascular systems. Nihon Ronen Igakkai Zasshi. 2011;48(2):158-62.
26. Moreau KL, Hildreth KL, Meditz AL, Deane KD, Kohrt WM. Endothelial function is impaired across the stages of the menopause transition in healthy women. J Clin Endocrinol Metab. 2012;97(12):4692-700. doi: 10.1210/jc.2012-2244. [ Links ]
27. Joshi NV, Vesey AT, Williams MC, Shah AS, Calvert PA, Craighead FH, et al. 18F-fluoride positron emission tomography for identification of ruptured and high- risk coronary atherosclerotic plaques: a prospective clinical trial. Lancet.2014; 383(9918): 705-13. doi: 10.1016/S0140-6736(13)61754-7. [ Links ]
Correspondencia: romlab@hotmail.com
Recibido: 3 noviembre 2017
Aceptado: 22 diciembre 2017