Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Ginecología y Obstetricia
versión On-line ISSN 2304-5132
Rev. peru. ginecol. obstet. vol.64 no.1 Lima ene./mar. 2018
SIMPOSIO manejo terapéutico en el climaterio y menopausia, evidencias actuales
Manejo terapéutico de la sintomatología climatérica
Therapeutic management of climacteric symptomatology
Carolina Monsalve1, Verónica Reyes1, Joaquín Parra1, Rosa Chea1
1. Departamento de Medicina Sur. Facultad de Medicina. Universidad de Chile. Santiago de Chile
RESUMEN
La menopausia ha sido definida por la Sociedad Internacional de Menopausia como el cese permanente de la menstruación en la mujer, suceso determinado por la disminución de la producción hormonal. Trae consigo, por una parte, una sintomatología que interfiere en la calidad de vida de la mujer, la cual incluye síntomas vasomotores, psíquicos, atrofia urogenital; y, por otra, cambios metabólicos que implican aumento del riesgo de enfermedades crónicas como las enfermedades cardiovasculares y la osteoporosis. Con el progresivo aumento de la esperanza de vida, los grupos de mayor edad comienzan a ser parte importante de la población mundial. Por lo tanto, el manejo clínico de la posmenopausia pasa a ser un problema relevante de salud pública. Tiene como objetivo mejorar la calidad de vida y disminuir el riesgo de enfermedades crónicas. Para medir la existencia de síntomas y signos asociados a la menopausia se puede utilizar la Menopause Rating Scale (MRS), escala que permite evaluar la intensidad de la sintomatología. Se debe valorar además el riesgo cardiovascular y de osteoporosis. El tratamiento incluye mejorar los estilos de vida, el uso de terapia hormonal y de terapias para las comorbilidades. Estas orientaciones tienen como objetivo ser una ayuda para el médico al momento de evaluar a una mujer en este periodo de la vida. Se han basado principalmente en las ‘Orientaciones Técnicas para la atención integral de la mujer en edad de climaterio en el nivel primario de red de salud’ del Programa de Salud de la Mujer, Ministerio de Salud, Chile. Sin embargo, son solo orientaciones; cada decisión terapéutica debe ser siempre individualizada acorde a las características particulares de cada paciente.
Palabras clave. Menopausia, Terapia hormonal, Estrógenos, Tratamiento.
ABSTRACT
Menopause has been defined by the International Menopause Society as the permanent cessation of menstruation in women, an event determined by the decrease in hormonal production. On one hand, the associated symptomatology interferes with the quality of life of the woman, and includes vasomotor and psychic symptoms and urogenital atrophy; on the other hand, metabolic changes that imply an increase in the risk of chronic diseases such as cardiovascular disease and osteoporosis. With the progressive increase in life expectancy, the older groups begin to be an important part of the world population. Therefore, the clinical management of the postmenopause becomes a relevant public health problem. Its objective is to improve the quality of life and reduce the risk of chronic diseases. The Menopause Rating Scale (MRS) is a scale to assess the existence and intensity of symptoms. Cardiovascular risk and osteoporosis should also be assessed. Treatment includes improving lifestyle, the use of hormonal therapy and therapies for comorbidities. These guidelines are intended to be an aid to the physician when evaluating a woman in this period of life. They have been based mainly on the "Technical Guidelines for the comprehensive care of women of climacteric age at the primary level of the health network" of the Women’s Health Program, Ministry of Health, Chile. However, they are only orientations. Every therapeutic decision should be individualized according to the particular characteristics of each patient.
Keywords: Menopause, Hormone therapy, Estrogen, Treatment.
Introducción
La menopausia ha sido definida por la Sociedad Internacional de Menopausia como el cese permanente de la menstruación en la mujer, suceso determinado por la disminución de la producción hormonal consecuencia del agotamiento folicular ovárico, siendo los 50 años la edad promedio para que ocurra, con límites que oscilan entre los 42 y 56 años(1-3). Este evento de la vida de la mujer está inserto en el climaterio, periodo que representa un proceso de adaptación y transición desde una etapa reproductiva a un estado no reproductivo(3), que transcurre en promedio entre 2 y 8 años antes de la fecha de la menopausia y finaliza 2 a 6 años posterior a esta(4-5).
El climaterio está caracterizado por un aumento en las oscilaciones de los niveles séricos de estradiol, no existiendo base científica que permita considerarlo como una entidad patológica(2). Sin embargo, trae consigo una sintomatología que interfiere en la calidad de vida de la mujer, en donde se incluyen síntomas vasomotores, psíquicos, atrofia urogenital, aumento de enfermedad cardiovascular y osteoporosis, entre otros. No es suficiente con que el médico identifique un síntoma particular, sino que también interesa la apreciación subjetiva de la mujer respecto al efecto que tienen estos síntomas en su calidad de vida(6-7).
La terapia hormonal en la menopausia constituye una forma de reposición hormonal que tiene como objetivo aminorar las manifestaciones de la menopausia, disminuir el riesgo de enfermedades asociadas y mejorar la calidad de vida de la mujer durante este periodo(2-8).
Epidemiología
Con el progresivo aumento de la esperanza de vida, los grupos de mayor edad comienzan a ser parte importante de la población mundial. En América Latina, en el año 2012 se realizó un estudio que involucró a 8 373 mujeres para evaluar la presencia de síntomas asociados a la menopausia; este estudio reveló la existencia de al menos un síntoma menopáusico en 90% de las participantes, destacando la prevalencia mayor al 60% tanto de dolores osteomusculares como fatigabilidad, irritabilidad y trastornos del ánimo(5).
En Chile, la población femenina entre los 45 y 64 años corresponde a poco más de 2 millones, siendo las principales causas de mortalidad para este grupo (año 2010) los tumores malignos, con 16,1 muertes por 10 mil habitantes, principalmente cáncer de mama, seguidas por las enfermedades del sistema circulatorio con 7,1 muertes(9).
Estrategia de atención: ¿Qué es la evaluación integral de la mujer?
Estas estrategias se basan y resumen las ‘Orientaciones Técnicas para la Atención Integral de la Mujer en Edad de Climaterio en el Nivel Primario de la Red de Salud’ del Ministerio de Salud de Chile.
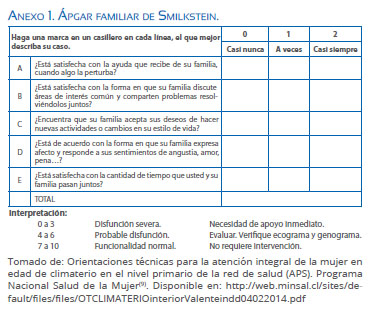
Los cambios vividos por la mujer en esta etapa hacen imposible pensar en este proceso como únicamente biológico, por lo que la evaluación que se realiza a la mujer en esta etapa de la vida debe involucrar tanto aspectos biológicos como psicosociales en forma completa. Idealmente, durante laprimera entrevista se aplicará Ápgar familiar (Anexo 1), instrumento que muestra cómo perciben los miembros de la familia el nivel de funcionamiento de la unidad familiar de forma global(10). Igualmente pudiera incluirse: tamizaje de violencia contra la mujer, genograma y ecomapa(9-11).
Clínica
La sintomatología en el climaterio afecta severamente la calidad de vida de la mujer; se manifiesta fundamentalmente en 3 ámbitos. El psicológico, que incluye insomnio, dificultades para conciliar el sueño, ánimo disminuido, irritabilidad, sensación de tensión, ansiedad y fatigabilidad tanto física como mental. El somático, caracterizado por bochornos, sudoraciones inexplicadas, sensación de opresión al pecho, palpitaciones y dolores osteoarticulares y musculares. Por último, el urogenital, en el que destaca la sequedad vaginal, la incontinencia urinaria y la disfunción sexual(4-5).
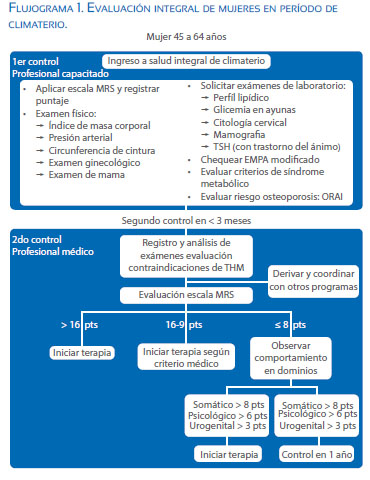
Para medir la existencia de síntomas y signos asociados a la menopausia existen múltiples instrumentos. Se propone utilizar la Menopause Rating Scale (MRS) que corresponde a un cuestionario estandarizado de autoevaluación integrado por 11 ítems que conforman 3 dominios sintomáticos: somático, psicológico y urogenital (Anexo 2)(12). Esta escala se puede aplicar a cualquier mujer en forma relativamente rápida y sencilla, evaluando la calidad de vida sin injerencia del encuestador, además de permitir determinar el impacto de las intervenciones médicas en el tiempo. Cada ítem contiene cinco grados de severidad en la evaluación: asintomático (0 puntos), leve (1 punto), moderado (2 puntos), severo (3 puntos) e intenso (4 puntos); por lo tanto, el puntaje total oscila entre 0 (asintomática) y 44 (máximo). Heinemann y cols expresan que diversos estudios efectuados en diferentes países han permitido validar esta escala y estandarizar la intensidad total de la sintomatología en asintomática o escasa (0 a 4 puntos), leve (5 a 8 puntos), moderada (9 a 15 puntos), y severa (más de 16 puntos)(12,13).
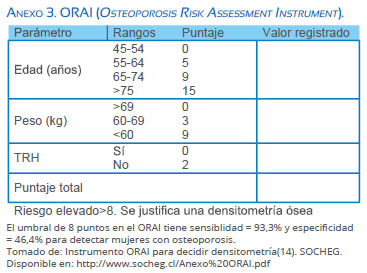
La recomendación es realizar la escala de medición de calidad de vida asociada a síntomas del climaterio y luego evaluar el riesgo cardiovascular mediante un examen físico completo que conlleve medición de presión arterial, circunferencia de cintura, cálculo del índice de masa corporal - IMC y utilización de la escala Framingham modificada. Realizar examen físico de mama, tamizar para cáncer de mama y cérvico-uterino con mamografía y citología cervical, respectivamente. Finalmente, se puede utilizar el instrumento ORAI (Anexo 3) para identificar a aquellas pacientes mayores de 45 años con alta sospecha de osteoporosis que requerirán una densitometría ósea que confirme el diagnóstico, siendo el corte 8 puntos(14). Dicho plan de evaluación está diagramado en detalle en el Flujograma 1.
Actitud terapéutica
La escala MRS ha sido validada en español(12). Se determina la necesidad de terapia a aquellas pacientes con un compromiso de la calidad de vida severo definido como un puntaje mayor a 16 puntos o como compromiso grave en un dominio determinado, es decir, en el dominio psicológico un puntaje mayor a 6, en el somático mayor a 8 y en el urogenital mayor a 4, como se muestra en el Flujograma 1.
Antes de iniciar cualquier terapia se debe evaluar la presencia de contraindicaciones. Los estrógenos, utilizados sin progesterona asociada, generan un aumento del riesgo de cáncer de endometrio; las progestinas, neutralizan este mayor riesgo. En relación con el tejido mamario, nuevos estudios no muestran una incidencia significativa en el aumento de riesgo de cáncer de mama(15).
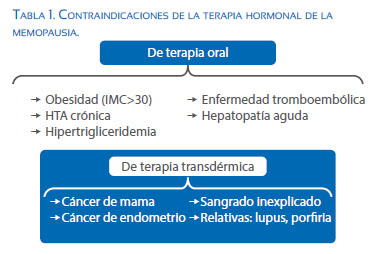
Existe un riesgo aumentado de trombosis con la terapia hormonal vía oral debido a los efectos proinflamatorios y procoagulantes de esta relacionados al paso hepático. Por tal motivo, se recomienda en mujeres con obesidad (IMC >30), hipertensión arterial (HTA) crónica, diabetes mellitus, hipertrigliceridemia o antecedentes de enfermedad tromboembólica indicar terapia transdérmica(16-18). Las contraindicaciones de la terapia hormonal transdérmica se encuentran resumidas en la Tabla 1. La terapia oral, por sus efectos metabólicos en el paso hepático, podría ser además no adecuada en pacientes obesas, hipertensas, con hipertrigliceridemia, con antecedentes de enfermedad hepática o tromboembólica. Sin embargo, el balance global se inclina claramente hacia los beneficios en las pacientes sintomáticas, principalmente con la terapia transdérmica, dado que no modifica los parámetros de coagulación.
Elección de la terapia hormonal
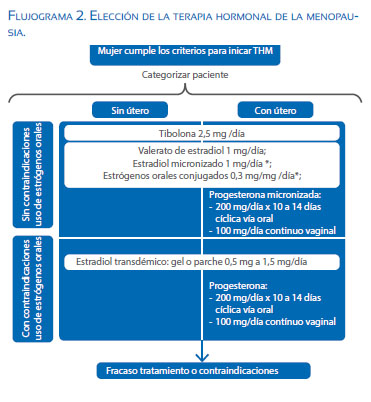
Una vez determinada la necesidad de iniciar terapia hormonal de la menopausia (THM), en ausencia de contraindicaciones, se debe determinar el tratamiento más adecuado para realizarla. Para ello se requieren al menos dos disquisiciones mayores: distinguir las mujeres que tienen contraindicaciones de terapia oral; y aquellas que tienen útero, de las que no. Si bien el pilar del tratamiento se realiza con estradiol, la forma de uso es la que varía, y los fármacos a los que debemos asociarlo, como se muestra en el Flujograma 2.
En mujeres sin contraindicaciones de terapia oral se inicia con estrógeno oral (elegir entre valerato de estradiol 1 mg/día, 17-β estradiol micronizado 1 mg/día, o estrógenos conjugados 0,3 mg/día). Si la paciente tiene contraindicaciones para la terapia oral, simplemente se cambia la vía de administración de la terapia hormonal a la transdérmica, con estradiol en gel 0,5 a 1,5 mg/día o parche 0,5 mg/día. Esta última vía de administración es actualmente considerada la ideal por no implicar cambios protrombóticos y/o metabólicos.
Si la mujer tiene útero, es imprescindible la adición de una progestina. Se debe administrar de 10 a 14 días en forma cíclica, con el fin de simular la fase lútea o en forma continua. La administración cíclica puede producir sangrado y se aconseja al inicio de la posmenopausia, ya que la forma continua puede originar sangrados irregulares en esta etapa. La progestina se encuentra disponible en presentaciones orales, parenteral, transdérmica o endoceptivas, todas utilizables en la terapia. Aunque en posmenopausia, podemos continuar con el mismo esquema utilizado en la perimenopausia; también es posible utilizar la progesterona de forma continua, especialmente cuando existe un fundamento clínico para preferirla, como dismenorrea persistente.
Entre las opciones encontramos:
• Opciones orales
Progesterona micronizada.
• Usarla continua: 100 mg por noche.
• Cíclica: 200 mg por noche por 10 a 14 días.
• Alternativas a la progesterona micronizada: dihidroprogesterona, didrogesterona, trimegestona, nomegestrol, drospirenona, dienogest, clormadinona.
• MPA (acetato de medroxiprogesterona) (alternativa: noretisterona): 5 mg c/día
• Perimenopausia: 10 días cada mes.
• Posmenopausia: 10 días cada 3 meses.
• Opción vaginal: 100 mg/10 días al mes o 100 mg/día. Cano ha propuesto usar 100 mg 2 veces por semana todo el mes.
• Opciones transdérmicas:
• Levonorgestrel 10 μg de liberación por día.
• Noretisterona 250 μg de liberación por día
• Opción endoceptiva (SIU o DIU): levonorgestrel 20 ug liberados en 24 h, endoceptivo.
Aparece como alternativa a considerar el uso de tibolona, un esteroide sintético sin actividad biológica por sí mismo, pero que tiene la característica de descomponerse en varios metabolitos provistos de efecto estrogénico, androgénico y progestacional, dependiendo del tipo de tejido. Cuenta con acción estrogénica en el hueso, la vagina y el cerebro, efecto progestacional sobre el endometrio y androgénico sobre el hígado y el cerebro(19,20).
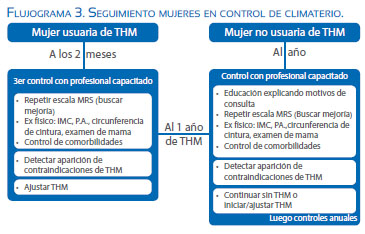
Seguimiento de las mujeres en control de climaterio
Para el seguimiento del climaterio, en las mujeres se debe separar a la población objetivo en dos grupos: mujeres usuarias de THM y mujeres no usuarias de THM. Las tratadas se deberían controlar cada 2 meses, y una vez controlados los síntomas, una vez al año. Si no se logran los resultados esperados, se debe aumentar la dosis de la terapia hormonal. Las mujeres que no requirieron terapia, deberían controlarse una vez al año, porque pueden aparecer nuevos síntomas.
Cada control deberá ser realizado por personal capacitado y deberá incluir: repetir escala MRS (buscar mejoría), examen físico, control de comorbilidades, detectar aparición de contraindicaciones de THM y ajustar o iniciar (en caso de no usuaria) THM(9) (Flujograma 3).
Alternativas para la terapia hormonal menopáusica
Para la sequedad vaginal
Para la sequedad vaginal existe la opción de hormona tópica y lubricantes.
Como hormona tópica se utiliza estrógeno vaginal, que es la opción de tratamiento más eficaz para las mujeres con sequedad vaginal. Esta puede continuar durante muchos años después de la menopausia debido a que solo cantidades mínimas entran en el torrente sanguíneo (100 veces menos que los comprimidos de estrógenos). Sobre esta base, el estrógeno de dosis baja no aumenta el riesgo de trombosis, cáncer de mama, infarto agudo al miocardio o accidente cerebrovascular. Está disponible en 3 presentaciones: 1) En tableta vaginal, la cual se inserta a través de aplicador, todos los días durante 2 semanas, luego dos por semana; 2) En crema de estrógenos, con difícil indicación de dosis, insertándose en la vagina todos los días durante 2 a 3 semanas, luego 1 a 2 veces por semana; y, 3) En anillo vaginal estrogénico, el cual es un anillo de plástico flexible que se coloca dentro de la vagina y es reemplazado cada tres meses por la mujer o su profesional de la salud. El anillo no tiene que ser eliminado durante el sexo o el baño. No es sentido por la mayoría de las mujeres o sus parejas sexuales. En las mujeres que anteriormente han tenido una histerectomía, el anillo podría caerse. El estrógeno vaginal es seguro y, probablemente, se puede utilizar de forma indefinida, aunque no existen estudios a largo plazo que confirmen su seguridad.
Los lubricantes vaginales están diseñados para reducir la fricción y la incomodidad de la sequedad durante las relaciones sexuales. Estos productos no contienen ningún tipo de hormonas y prácticamente no tienen efectos secundarios.
Otra alternativa son las cremas hidratantes se aplican en la vagina tres veces a la semana para permitir un efecto hidratante continuo. Estas no deben usarse justo antes de tener relaciones sexuales, ya que pueden ser irritantes.
Para el control de los bochornos
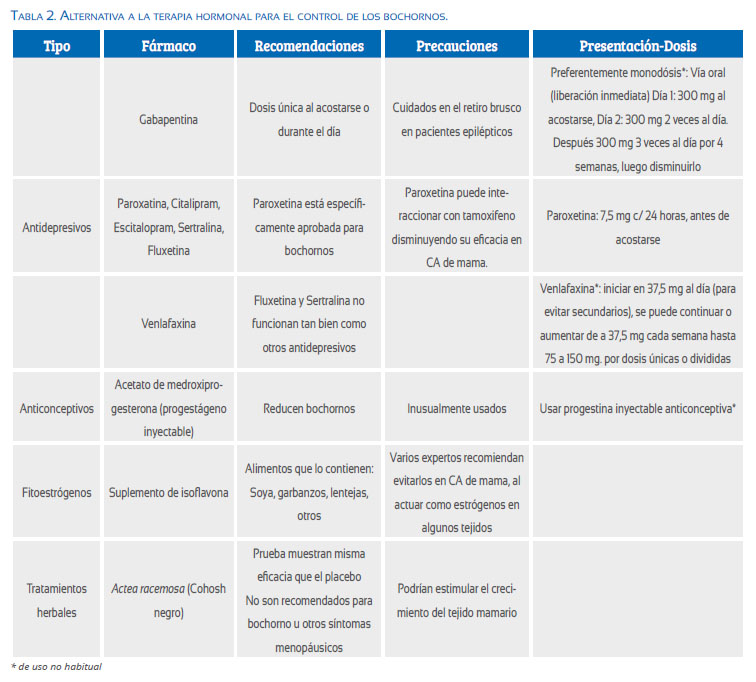
Los tratamientos no estrogénicos para los bochornos son eficaces para muchas mujeres; ninguno es tan efectivo como el estrógeno, pero son mejores que el placebo. Las opciones incluyen( 21,22) (Tabla 2):
Antidepresivos: Se les recomienda como tratamiento de primera línea para los sofocos en las mujeres que no pueden tomar estrógeno.
• Paroxetina: Es el único tratamiento no hormonalque está aprobado en Estados Unidos, específicamente para los sofocos, en dosis bajas (7,5 mg). No se debe tomar paroxetina si se padece cáncer de mama y está tomando tamoxifeno, ya que puede interferir con el tamoxifeno y hacer que sea menos efectivo. Se indica 7,5 mg c/24 horas, antes de acostarse.
• Gabapentina: Alivia los sofocos en algunas mujeres, dado como una dosis única durante el día o al acostarse. Cuidado en el retiro brusco en pacientes epilépticos. Preferentemente monodosis (off-label): Vía oral (liberación inmediata). Día 1: 300 mg al acostarse. Día 2: 300 mg 2 veces al día. Después 300 mg 3 veces al día por 4 semanas, luego disminuirlo.
• Venlafaxina, citalopram, escitalopram son tratamientos efectivos para los sofocos. Venlafaxina: (off-label) iniciar 37,5 mg al día (para evitar efectos secundarios), se puede continuar o aumentar 37,5 mg cada semana hasta 75 o 150 mg. Por dosis únicas o divididas.
• Fluoxetina y sertralina, no funcionan tan bien como los otros antidepresivos enumerados.
Progesterona: El acetato de medroxiprogesterona inyectable ayuda a reducir los sofocos, pero se utiliza con poca frecuencia.
Estrógenos de origen vegetal (fitoestrógenos): Alternativa natural a las hormonas para las mujeres con síntomas menopáusicos. Los fitoestrógenos se encuentran en alimentos que incluyen soja, garbanzos, lentejas, semillas de lino, lentejas, granos, frutas, verduras, trébol rojo y suplementos de isoflavonas. Sin embargo, no se sabe si los fitoestrógenos ayudan a reducir los sofocos y sudores nocturnos; la mayoría de los estudios no han reportado beneficios. Además, algunos fitoestrógenos pueden actuar como estrógeno en algunos tejidos del cuerpo, por lo que muchos expertos sugieren que las mujeres que tienen un historial de cáncer de mama deben evitarlos.
Tratamientos herbales: Promovido como un remedio ‘natural’ para los sofocos. Muchas mujeres posmenopáusicas utilizan Actaea racemosa (cohosh negro), pero los ensayos clínicos no han demostrado su eficacia sobre placebo y existe preocupaciones de seguridad.
Fuera de las terapias farmacológicas es necesario mejorar los estilos de vida. Realizar actividad física 30 minutos 5 veces a la semana, abandonar el hábito de fumar y mantener un peso adecuado. La actividad física no solo origina bienestar físico y psíquico y disminuye el riesgo de enfermedades en la mujer climatérica, también disminuye la sintomatología menopáusica. El alza de peso no solo es un importante factor de riesgo de enfermedades crónicas, sino que también se asocia a riesgo de cáncer de mama, de ovario y de colon. Debemos aportar calcio, especialmente a través de la ingesta de leche para asegurar su suministro adecuado al sistema óseo. No hay que olvidar vigilar los niveles de 25 OH vitamina D dado la alta prevalencia de este déficit vitamínico. Resumiendo, el manejo del climaterio incluye una visión holística de la salud de la mujer, no es solo un problema hormonal.
Financiamiento: Autofinanciado
Conflicto de interés: Los autores declaran no tener algún conflicto de interés.
Citar como: Monsalve C, Reyes V, Parra J, Chea R. Manejo terapéutico de la sintomatología climatérica. Rev Peru Ginecol Obstet. 2018;64(1):43-50
Referencias bibliográficas
1. Castelo-Branco C, Blümel JE, Chedraui P, Calle A, Bocanera R, Depiano E, et al. Age at menopause in Latin America. Menopause.2006;13:706-12. DOI:10.1097/01.gme.0000227338.73738.2d. [ Links ]
2. Menopause, blog Reporting and interpreting new menopause research & midlife health news for you. http://www.menopause.org/ NAMS. December 5, 2016. [ Links ]
3. The International Menopause Society. http://www.imsociety. org/. IMS. December 5, 2016. [ Links ]
4. Castelo-Branco C. Pubertad y climaterio. En: González- Merlo J, González E, González J. Ginecología, 9ª edición, Madrid: Elsevier; 2014:94-118. [ Links ]
5. Blümel JE, Chedraui P, Baron G, Belzares E, Bencosme A, Calle A, et al. Collaborative Group for Research of the Climacteric in Latin America (REDLINC). Menopausal symptoms appear before the menopause and persist 5 years beyond: A detailed analysis of a multinational study. Climacteric. 2012;15:542-51. DOI:10.3109/1 3697137.2012.658462. [ Links ]
6. Hardy R, Kuh D. Change in psychological and vasomotor symptom reporting during the menopause. Soc Sci Med. 2002;55:1975-88. [ Links ]
7. Porter M, Penney GC, Russell D, Russell E, Templeton A. A population based survey of women’s experience of the menopause. Br J Obstet Gynaecol. 1996;103:1025- 8
8. Brett KM, Chong Y. Hormone replacement therapy: knowledge and use in the United States. Hyattsville, Maryland: National Center for Health Statistics, 2001. https://www.cdc.gov/ nchs/data/misc/hrt_booklet.pdf.
Research on Women’s Health, National Institutes of Health. USA. Diciembre 18, 2017.
9. Brantes S, Porcil A, Vanhauwaert P, Parra M, Blümel JE (2014, January). Orientaciones técnicas para la atención integral de la mujer en edad de climaterio en el nivel primario de la red de salud (aps). Programa Nacional Salud de la Mujer. http://web.minsal.cl/sites/ default/ files/files/OTCLIMATERIOinteriorValenteindd04022014. pdf. Ministerio de Salud. Gobierno de Chile. Diciembre 18, 2017. [ Links ]
10. Bellón Saameño JA, Delgado Sánchez A, Luna del Castillo JDD, Lardelli Claret P. Validez y fiabilidad del cuestionario de función familiar Apgar-familiar. Atención primaria. 1996;18:289-96. [ Links ]
11. Mello DFD, Vieira CS, Simpionato É, Biasoli-Alves Z M, Nascimento LC. Genograma e ecomapa: possibilidades de utilização na estratégia de saúde da família. Revista brasileira de crescimento e desenvolvimento humano. 2005;15:78-91. [ Links ]
12. Aedo S, Porcile A, Irribarra C. Calidad de vida relacionada con el climaterio en una población Chilena de mujeres saludables. Rev Chil Obstet Ginecol. 2006;71:402-9. [ Links ]
13. Heinemann K, Ruebig A, Potthoff P, Schneider HP, Strelow F, Heinemann LA, al. The Menopause Rating Scale (MRS): a methodological review. Health Qual Life Outcomes. 2004;2:45. DOI: 10.1186/1477-7525-2-45. [ Links ]
14. SOCHEG. Anexo Nº 3. Instrumento ORAI para decidir densitometría. Disponible en: http://www.socheg.cl/ Anexo%20ORAI.pdf. Diciembre 18, 2017. [ Links ]
15. Aedo S, Cavada G, Blümel JE, Chedraui P, Fica J, Bariga P, et al. (2015). Women’s Health Initiative estrogen plus progestin clinical trial: a study that does not allow establishing relevant clinical risks. Menopause. 2015;22:1317-22. DOI: 10.1097/ gme.0000000000000472.
16. McKenzie J, Jaap AJ, Gallacher S, Kelly A, Crawford L, Greer IA, et al. Metabolic, inflammatory and haemostatic effects of a low-dose continuous combined HRT in women with type 2 diabetes: potentially safer with respect to vascular risk? Clin Endocrinol (Oxf). 2003;59:682-9. [ Links ]
17. Zegura B, Guzic-Salobir B, Sebestjen M, Keber I. The effect of various menopausal hormone therapies on markers of inflammation, coagulation, fibrinolysis, lipids, and lipoproteins in healthy postmenopausal women. Menopause. 2006;13:643-50. [ Links ]
18. Straczek C, Oger E, Yon de Jonage-Canonico MB, Plu-Bureau G, Conard J, Meyer G, et al. Prothrombotic mutations, hormone therapy, and venous thromboembolism among postmenopausal women: impact of the route of estrogen administration. Circulation. 2005;112:3495- 500. DOI:10.1161/CIRCULATIONAHA.105.565556. [ Links ]
19. Zarate, A. Mecanismo molecular de la acción de la tibolona sobre los tejidos determina el efecto clínico en el reemplazo hormonal en la menopausia. Rev Colomb Menopausia. 2002;8:115-22. [ Links ]
20. Hernández Valencia, M, Fonseca ME, Ochoa R, Zárate A. Efecto metabólico en la posmenopausia de un esteroide sintético (tibolona) con acción estrogénica característica. Ginecol Obstet Mex. 1997;65:145-7. [ Links ]
21. Nedrow A, Miller J, Walker M, Nygren P, Huffman LH, Nelson HD. Complementary and alternative therapies for the management of menopause-related symptoms: a systematic evidence review. Arch Intern Med. 2006;166:1453-65. DOI:10.1001/archinte.166.14.1453. [ Links ]
22. North American Menopause Society. Treatment of menopause-associated vasomotor symptoms: position statement of The North American Menopause Society. Menopause. 2004;11:11-33. DOI:10.1097/01. GME.0000108177.85442.71. [ Links ]
Correspondencia: Dra. Carolina Monsalve , Orquídeas 1068, dpto 302. Providencia. Santiago de Chile
Recibido: 3 noviembre 2017
Aceptado: 22 diciembre 2017