Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Ginecología y Obstetricia
versión On-line ISSN 2304-5132
Rev. peru. ginecol. obstet. vol.64 no.1 Lima ene./mar. 2018
SIMPOSIO manejo terapéutico en el climaterio y menopausia, evidencias actuales
Terapia hormonal de la menopausia, ¿por qué prescribirla?
Hormone therapy after menopause, why prescribe it?
Soledad Vallejo Maldonado1
1. Clínica Quilín; Profesor de Universidad de Chile, Santiago de Chile
RESUMEN
Durante el climaterio, la mayoría de las mujeres presenta muchos síntomas que afectan su calidad de vida. Estos síntomas han sido vinculados con trastornos de la neuroquímica provocados por la carencia de estrógenos. El sistema nervioso central-SNC también está involucrado en los cambios de la composición corporal y en el aumento de tejido adiposo que se produce durante el climaterio. El adipocito del obeso produce adipocitoquinas que llevan a un estado inflamatorio crónico con incremento del riesgo de diabetes, hipertensión e hipercoagulabilidad, aumentando el riesgo cardiovascular. El déficit de estrógenos también modula señales celulares (RANKL, NPY) que favorecen la reabsorción ósea y el riesgo de osteoporosis. La obesidad asociada al climaterio incrementa además el riesgo de cáncer de mama, endometrio, colon y vesícula al aumentar la leptina e interleucina 6. Estas adipocitoquinas modulan una serie señales celulares (STAT3, AP-1, MAPK, ERKs) que a su vez aumentan la aromatasa, la síntesis de estrógenos y la activación de receptores alfa en las células malignas, estimulando la proliferación celular. También, algunos estudios experimentales sugieren una acción anti-Alzheimer de los esteroides ováricos.
Palabras clave. Terapia hormonal, Menopausia, Calidad de vida, Enfermedades crónicas.
ABSTRACT
During the climacteric, most women have many symptoms that affect their quality of life. These symptoms have been linked to neurochemical disorders caused by the lack of estrogen. The CNS is also involved in changes in body composition and in the gain in adipose tissue that occurs during the climacteric. Obese adipocytes produce adipocytokines that lead to a chronic inflammatory status with a higher risk for diabetes, hypertension and hypercoagulability; all these increase the cardiovascular risk. Estrogen deficiency also modulates cellular signals (RANKL, NPY) that favor bone resorption and osteoporosis risk. Obesity associated with menopause also increases the risk of breast, endometrial, colon and bladder cancer by raising the levels of leptin and interleukin 6. These adipocytokines modulate a series of cellular signals (STAT3, AP-1, MAPK, ERKs) series which in turn increase aromatase, the synthesis of estrogens and the activation of alpha receptors in malignant cells, stimulating cell proliferation. Also, some experimental studies suggest an anti-Alzheimer action of ovarian steroids.
Keywords: Hormone therapy, Menopause, Quality of life, Chronic diseases.
Introducción
La terapia hormonal de la menopausia (THM) disminuye la sintomatología menopáusica y mejora la calidad de vida. Varios estudios sugieren que la THM, por sus efectos metabólicos modulados desde el sistema nervioso central, tendría un rol en la prevención de enfermedades crónicas y disminuiría la mortalidad. El no prescribir THM a las mujeres que la necesiten significa privarlas de una terapia potencialmente beneficiosa para su salud.
Calidad de vida
El climaterio se asocia al incremento de enfermedades crónicas como osteoporosis y enfermedad cardiovascular(1-3) y deterioro de la calidad de vida. La terapia hormonal de la menopausia (THM) y los cambios en el estilo de vida saludables constituyen las principales armas terapéuticas para contrarrestar los efectos de la menopausia en la salud de la mujer(1). Sin embargo, la THM, después de haber alcanzado una gran popularidad entre los médicos y las mujeres hace algunas décadas fue abandonada masivamente a partir del año 2002 como consecuencia de la publicación del estudio de Iniciativa de Salud de la Mujer (WHI), que señaló que los riesgos de esta terapia superaban a los beneficios(2,3). En este artículo analizaremos el impacto que puede provocar en la salud de la mujer la no prescripción de THM.
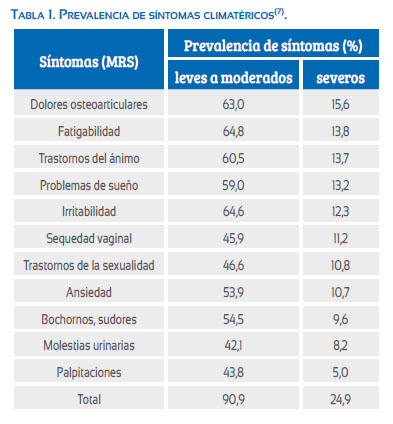
Un estudio realizado en América Latina en 8 373 mujeres de 40 a 59 años, al aplicar la escala MRS, muestra la prevalencia de diversos síntomas climatéricos(4). Globalmente, el 90,9% de la población estudiada tenía al menos un síntoma climatérico y en 24,9% de estas mujeres algunos de estos síntomas eran severos (puntaje del síntoma superior a 2 en escala MRS). Tabla 1.
Las molestias osteoarticulares, el cansancio físico y mental y el ánimo depresivo fueron prevalentes; la intensidad de estos síntomas fue severa en 15,6%, 13,8% y 13,7% de las mujeres, respectivamente. Los trastornos osteoarticulares representan el síntoma severo más prevalente en este grupo de mujeres y esta observación es compatible con el hecho que es sintomatología responsable de 44,3% del ausentismo laboral femenino en un hospital chileno(5). En los EE. UU., los dolores musculoesqueléticos provocan pérdidas estimadas en 61,2 billones de dólares(6). Un estudio realizado en Finlandia determinó que los médicos generales piden exámenes de laboratorio a 12% de los pacientes con molestias musculoesqueléticas, imágenes a 24%, a 61% de las pacientes se les prescribe analgésicos, 16% van al kinesiólogo y 7% es derivado al especialista(7). Por otra parte, los trastornos vasomotores, bochornos y diaforesis, los síntomas más relacionados con el climaterio, tienen una prevalencia de solo 9,6%.
La sexualidad es un aspecto importante de la calidad de vida de la mujer y es reflejo de su bienestar físico, psicológico y social(8). Durante el climaterio, el síndrome genitourinario, los trastornos del ánimo e irritabilidad pueden afectar la sexualidad femenina. Un estudio que aplicó el índice de función sexual femenina en 7 243 mujeres sanas de 40 a 59 años de edad en 19 centros de salud de América Latina, mostró que 56,8% de ellas presentaba disfunción sexual y 25,6% no había tenido actividad sexual en los últimos doce meses. El principal factor de riesgo asociado con falla sexual fue la mala lubricación vaginal (OR: 3,86; IC 95% 3,37 a 4,43)(9).
Si consideramos que la 'calidad de vida en salud' representa la evaluación del impacto que una condición de salud tiene en la vida diaria, la sintomatología climatérica cuando es severa afectará la calidad de vida de la mujer(10). Según la escala MRS, hay un compromiso severo de la calidad de vida (puntaje total de MRS >16 puntos) en 12,9% de las mujeres premenopáusicas de 40 a 44 años, cifra que aumenta a 26,4% en la perimenopausia, 31,6% en la posmenopausia temprana y 29,9% en la posmenopáusica tardía (> 5 años)(7).
Un metaanálisis muestra que la terapia de reemplazo hormonal reduce en 77% la frecuencia de síntomas vasomotores y en 87% su intensidad(11). Pero la THM mejora no solo los bochornos, sino también otros síntomas climatéricos como los trastornos del ánimo, dolores osteoarticulares, mala calidad de sueño, entre otros. Un estudio realizado en EE. UU. con 459 mujeres evaluadas durante 1 año con el Women's Health Questionnaire, el cuestionario 15D y una escala visual analógica de síntomas climatéricos, encontró que la terapia combinada continua de estrógenos y progestinas producía una mejoría significativa de la calidad de vida ya a las 12 semanas y que esta mejoría se incrementaba hasta la semana 52 del estudio en todos los dominios de calidad de vida(12).
Podemos concluir indicando que las molestias climatéricas afectan a muchas mujeres, que aparecen antes de la menopausia y que deterioran significativamente su calidad de vida. El no prescribir THM a las mujeres con síntomas climatéricos que no tengan contraindicación para su uso les estaría privando de la oportunidad de revertir estos síntomas y mejorar su calidad de vida.
Enfermedades crónicas
Uno de los principales factores que podría aumentar el riesgo de enfermedades crónicas en el climaterio serían los trastornos neuroquímicos del sistema nervioso, tanto central como periférico, asociados a la deficiencia de estrógenos. Estos trastornos no solo están involucrados en la etiopatogenia de la sintomatología climatérica, sino también en los cambios de la composición corporal, especialmente en el aumento de tejido adiposo que se observa en las mujeres de mediana edad, un factor central en la etiopatogenia de las enfermedades crónicas. Así, por ejemplo, hay una serie de evidencias que respaldan una etiología común para los trastornos del estado de ánimo y la obesidad, siendo los mecanismos de señalización celular los principales implicados, ya que estas señales modulan el equilibrio de la energía y la estabilidad del ánimo. La leptina, por ejemplo, tiene muchas acciones dentro del cerebro, incluyendo la reducción de la ingesta de alimentos y el aumento del gasto energético. Morris ha señalado que, en la obesidad, más que un déficit de leptina, hay una resistencia a su acción y, en consecuencia, una disminución de sus señales, lo cual llevaría a una mayor ingesta alimentaria y disminución del gasto calórico. Este autor concluye que la leptina se asocia a depresión y que esta relación parece ser mediada por un aumento de la adiposidad(13). También hay otras señales implicadas: neuropéptidos orexigénicos y anorexígenos, factores metabólicos, hormonas de estrés, citocinas y factores neurotróficos(14). Después de la menopausia se alteran muchas de estas vías metabólicas de señalización. Por ejemplo, el hipoestrogenismo altera la sensibilidad a la leptina a nivel del SNC y en consecuencia modifica la distribución de la grasa corporal(15). Esto sería consistente con la resistencia a la leptina observada durante el climaterio, que se expresa por un aumento del apetito, obesidad y depresión. El hipoestrogenismo se asocia con un aumento de la adiposidad, asociada a aumento de los neuropéptidos oxigénicos (neuropéptido Y, grelina y de la hormona concentradora de melanina) y disminución de los neuropéptidos anorexígenos (insulina, la leptina y la serotonina)(16). También se ha descrito que los trastornos del ánimo se asocian a sedentarismo, otro factor que incrementa el riesgo de obesidad (OR 1,50; IC 95% 1,30 a 1,53)(17). Por lo tanto, el déficit de estrógeno influye en muchos mecanismos que podrían explicar el aumento de peso observado en mujeres de mediana edad.
Enfermedad cardiovascular
En los últimos años hemos comprendido mejor los mecanismos a través de los cuales la obesidad abdominal aumenta el riesgo cardiovascular. Estos conceptos se han centrado en un nuevo paradigma conocido como síndrome metabólico, un cuadro caracterizado por obesidad abdominal asociada a la presencia de factores de riesgo cardiovascular, tales como trastornos del metabolismo glucídico, lipídico y función endotelial(18). En su etiopatogenia, el rol central parece tenerlo el aumento de la grasa abdominal, lo cual conlleva un incremento en la producción de una serie de proteínas proinflamatorias y a disminución de las antiinflamatorias, las que, actuando por mecanismos endocrinos, autocrinos y paracrinos, llevan a un estado inflamatorio crónico, aumentando por esta vía el riesgo cardiovascular. Estos mediadores incluyen al factor de necrosis tumoral α, leptina, adiponectina, resistina, PAI-1, interleucina-6, angiotensinógeno, amiloide sérico A y proteína C reactiva(19). Un modelo clásico de la relación de la obesidad con el riesgo cardiovascular lo constituye la diabetes mellitus tipo II. El adipocito obeso modula la secreción de una serie de adipoquinas como resistina, leptina, adiponectina, entre otros, las cuales van a influir en la función de las células beta del páncreas, e incluso en su sobrevida. Si a esto agregamos que la resistina bloquea a los receptores de insulina, entenderemos el rol central que tiene el adipocito obeso en la etiopatogenia de la diabetes, uno de los principales factores de riesgo cardiovascular(20).
Recientemente se ha descrito que no solo la grasa del abdomen se asocia a un mayor riesgo cardiovascular, sino que también el tejido adiposo que rodea al corazón está asociado con aumento del riesgo(21). El tejido adiposo cardiaco localmente podría modular la morfología, la función del corazón y de los vasos sanguíneos, a través de la producción de citocinas, las que posiblemente tendrían un papel en la aterosclerosis relacionada con la adiposidad cardíaca. Se ha demostrado que la cantidad de tejido adiposo epicárdico está significativamente relacionado con el espesor de la íntima media de la carótida, un índice de la aterosclerosis subclínica. Un reciente estudio señala una clara relación entre la menopausia, los niveles de estrógenos endógenos, grasa cardíaca y el riesgo cardiovascular, lo cual es una razón más para evitar el aumento de peso en esta etapa de la vida femenina(22).
Pero no solo la obesidad aumenta el riesgo cardiovascular en la mujer posmenopáusica, sino que también el déficit de estrógenos per se es determinante del desarrollo de la aterosclerosis. El estrógeno disminuye la apoptosis celular y aumenta la resistencia a la injuria, disminuye el paso de LDL plasmático hacia el endotelio, es antioxidante, disminuye la adhesión de monocitos, la respuesta quimiotáctica de los monocitos y la proliferación de células musculares lisas(23). Por lo tanto, no es sorprendente que en conejas castradas con dieta hipercolesterolémica se observe un aumento de casi tres veces en la extensión de las placas ateroscleróticas en la aorta que no se observa en las no ooforectomizadas(24). Otro mecanismo que pudiera estar en juego en el incremento del riesgo cardiovascular es la pérdida de la vasodilatación mediada por los receptores tipo II de angiotensina, la cual sería modulada por los estrógenos y mediada vía óxido nítrico, generada por la sintetasa endotelial del óxido nítrico y por el factor hiperpolarizante derivado del endotelio. Este efecto vasodilatador requiere estradiol y la presencia de cromosomas XX(25).
Antes de la publicación del estudio WHI, en muchos estudios observacionales existía la idea generalizada que la THM disminuía el riesgo cardiovascular. Sin embargo, el WHI comunicó que la terapia hormonal combinada aumentaba en 29% el riesgo de enfermedad coronaria y en 41% los accidentes cardiovasculares(6). Estos sorprendentes resultados se atribuyeron al uso de terapia oral en mujeres mayores que probablemente ya tenían lesiones ateroscleróticas, en las cuales el uso de hormonas ováricas por vía oral aumentaba el riesgo trombótico por inestabilidad de las placas ateroscleróticas(26). Esta hipótesis parece confirmarse en un análisis del Nurses' Health Study, el cual encontró que las mujeres que iniciaron la THM combinada en los primeros 10 años tenían un RR de enfermedad coronaria de 0,72 (IC 95% 0,56 a 0,92), mientras que las que la iniciaron posteriormente tenían un RR de 0,90, (IC 95% 0,62 A 1,29)(27). Igualmente, el mismo WHI mostró que las mujeres que usaban THM en los primeros 10 años de posmenopausia no tenían aumento del riesgo coronario, mientras que las que iniciaban su uso 20 años después de la menopausia sí tenían un mayor riesgo en 52% (IC 95% 7,0 a 117%)(28). Aquí se ha planteado el concepto de ventana de oportunidad de la THM; en mujeres menopáusicas recientes, con sistema cardiovascular más sano, la THM sería cardioprotectora, fenómeno más evidente aun en mujeres con insuficiencia ovárica primaria, a diferencia de las mujeres mayores de 60 años, con arterias dañadas y con placas de ateroesclerosis inestables, en quienes sería perjudicial.
Aunque el estudio WHI provocó un abandono masivo de la THM, muchas mujeres aun continuaron con THM, permitiendo la realización de nuevos estudios, los cuales continúan y sugieren un efecto cardioprotector de la terapia hormonal. La Dra. Schierbeck observó durante 11 años a 1 006 mujeres con una edad promedio de 50 años, la mitad tratada con THM; el riesgo cardiovascular en las mujeres tratadas fue 0,48, (IC 95% 0,26 a 0,87)(29). Un estudio observacional danés que siguió a 489 105 mujeres que usaron THM entre 1994 hasta el año 2009 mostró que el riesgo de muerte coronaria se redujo en 54% y el de accidente cerebrovascular en 39% en las mujeres que usaron la terapia por más de 10 años (30). Interesantemente, Lobo comparó la THM con otros fármacos usados para la prevención primaria de enfermedad coronaria, señalando que mientras la aspirina y las estatinas no tienen un claro efecto preventivo en mujeres, la THM disminuye el riesgo coronario en forma significativa en mujeres jóvenes (RR 0,68; IC 95% 0,48 a 0,9) .
Osteoporosis
La osteoporosis es una epidemia silenciosa y emergente que se caracteriza por una baja masa ósea y deterioro de la microarquitectura ósea, con el consiguiente aumento del riesgo de fracturas. Los mecanismos etiopatogénicos a través de las cuales el déficit de estrógenos afecta a la masa ósea son múltiples; no solo puede modificar la neuroquímica involucrada en la osteoporosis, como hemos analizado previamente, sino también actuar directamente en el tejido óseo. En la menopausia el déficit de estrógeno afecta el ciclo normal de recambio óseo mediante el aumento de la resorción osteoclástica sin un aumento compensatorio en la actividad osteoblástica, siendo la cantidad de hueso reabsorbido mayor que la cantidad depositada (recambio óseo desbalanceado), lo que conduce a una pérdida neta de hueso. Este desequilibrio es consecuencia de un aumento de la producción del factor de necrosis tumoral (TNFα) e IL-1. Estas citocinas estimulan a las células estromales/ preosteoblastos para liberar varias citocinas que modulan el recambio óseo (IL-6, M-CSF, IL-11, factor estimulante de colonias de granulocitos y macrófagos, factor de crecimiento transformante). La citocina final en la cascada de la osteoclastogénesis es el RANKL (receptor activator of nuclear factor B ligand) que es sintetizado por los osteoblastos y que se une a su receptor RANK en los preosteoclastos, aumentando su maduración. RANKL tiene un antagonista natural, la osteoprotegerina (OPG), que es un receptor soluble que es secretada por las células de la línea estromal/osteoblástica y cuya producción es estimulada por los estrógenos, los cuales además disminuyen M-CSF y RANK, factores necesarios para la estimulación de los osteoclastos, lo que redunda finalmente en disminución de la reabsorción ósea con el uso de estrógenos(32).
La THM contrarresta los efectos metabólicos óseos que provoca el déficit de estrógenos que se produce durante el climaterio. Un metaanálisis que combina los resultados de estudios de prevención y tratamiento de la osteoporosis, tanto con estrógenos solos como combinados con progestinas, muestra un efecto positivo sobre la masa ósea en diferentes sitios de medición. Después de un año de uso de THM, la densidad ósea aumenta 5,4% en la columna lumbar, 3,0% en el antebrazo y 2,5% en el cuello femoral; después de dos años de tratamiento, la densidad ósea aumenta otro 1,5% en promedio en todos los sitios estudiados(33). Por lo tanto, no es sorprendente que la THM disminuya el riesgo de fractura. Un metaanálisis de la base de datos Cochrane que incluyó 23 estudios aleatorizados y controlados con placebo, entre los cuales figuraba el WHI y el HERS, y que incluyó a 42 839 mujeres posmenopáusicas mostró que, después de 5,6 años de THM combinada, el riesgo absoluto de fractura disminuía en 86 casos por 1 000 mujeres tratadas (comparado con los controles) y con estrógenos solos el riesgo absoluto después de 7,1 años caía a 102 por 1 000(34). Probablemente, la disminución del riesgo de fractura con la THM no solo se deba a su efecto antireabsortivo, sino que también pueden estar influyendo otros efectos positivos que tiene esta terapia. El estudio WHI evaluó el efecto de la THM sobre las caídas, un fuerte predictor de fractura, señalando que las mujeres que toman al menos el 80% de su terapia sufren menos caídas que las mujeres controles(35). En ello puede estar influyendo el rol que los estrógenos tienen en la función neuromuscular, el cual se refleja en la existencia de más de 200 genes que son modulados por el estradiol y que tienen que ver con el trofismo muscular; a ello hay que agregar que la THM disminuye microRNAs (miRNA-182, miRNA-223), lo cual activa vías anabólicas (IGF-1/PI3K/AKT) que impactan positivamente al sistema muscular(36). El déficit de estrógenos puede explicar en algún grado la sarcopenia que presentan las mujeres de avanzada edad.
Cáncer
La menopausia per se no implica un aumento del riesgo de cáncer; sin embargo, los cambios de la composición corporal que llevan a un incremento de la grasa, especialmente abdominal, sí pueden aumentar el riesgo de algunos cánceres. La leptina no está vinculada solo al consumo calórico, sino que también a la proliferación celular. El crecimiento de células cancerosas está regulado por varias señales celulares (STAT3, AP1, MAPK, ERKs) moduladas por la leptina e IL-6, las cuales incrementan la aromatasa, la síntesis de estrógenos y la activación de receptores alfa en las células malignas, llevando a estas células a una mayor proliferación(37). El incremento del riesgo de cáncer de mama con la obesidad se observa solo en las mujeres posmenopáusicas, encontrándose un RR de 1,12 (IC 95% 1,01 a 1,24) y 1,26 (IC 95% 1,07 a 1,50) cuando el IMC es de 30 y 35 kg/m2, respectivamente(38). La obesidad también aumenta el riesgo de cáncer de endometrio, riñón, colon y vesícula en mujeres posmenopáusicas. Un estudio europeo señala que el exceso de peso es responsable del 6% de todos los cánceres en la Unión Europea, variando entre 3,9% en Dinamarca y 8,8% en España; el mayor impacto de la obesidad en mujeres se observó en cáncer de endometrio (la obesidad es responsable del 39% de los casos), riñón (25%) y vesícula (24%)(39). Este estudio estima que 36 000 casos podrían haber sido evitados anualmente si se hubiera disminuido en 50% los casos de obesidad.
El estudio WHI con estrógenos solos, después de estudiar a 10 mil mujeres histerectomizadas de 50 a 79 años de edad seguidas por 10 años, mostró un 23% menos riego de cáncer de mama en las usuarias de THM (HR 0,77; IC 95% 0,62 a 0,95)(40). En cambio, en las mujeres con terapia combinada el riesgo de cáncer de mama aumentaba 28% (HR 1,28; IC 95% 1,11 a 1,48)(41). Sin embargo, los resultados de este último estudio han sido objetados porque el riesgo se calculó aplicando el modelo de riesgo proporcional de Cox, sin cumplir con las exigencias que tiene este modelo, lo cual invalida sus resultados. Al aplicar otro modelo matemático (Royston & Palmer) a los mismos pacientes del WHI se observó que, después de cinco años, las usuarias de THM presentaron cáncer de mama 1 día antes que las controles(42). Por lo tanto, la relación descrita entre cáncer de mama y THM permanece aún bastante confusa.
Demencias
El Reporte Mundial de Alzheimer 2015 estima que la prevalencia de demencia en los mayores de 60 años fluctúa entre 4,6% en Europa Central y 8,7% en el norte de África y Medio Oriente(43). La epidemiología muestra que la enfermedad de Alzheimer es más prevalente en mujeres que en hombres. Igualmente, la medicina experimental señala que en lauchas transgénicas que sobreexpresan características propias de la enfermedad de Alzheimer, los depósitos de β- amiloide son mayores en las hembras que en los machos, pudiendo deberse la diferencia de prevalencia observada en los humanos a que la caída posmenopáusica de los esteroides ováricos priva al cerebro femenino de una serie de efectos antiAlzheimer que tienen estas hormonas, entre las cuales hay que mencionar una mejoría de la conectividad sináptica, neurotransmisión, menor muerte neuronal y menor acumulación de beta amiloides(44). Sin embargo, estos efectos positivos de los estrógenos no fueron demostrados en el estudio WHI (WHIMS); el uso de THM combinada en mujeres mayores de 65 años dobló el riesgo de demencia(45). Contrariamente, en mujeres menores de 65 años la THM se asocia a una disminución de 65% del riesgo de enfermedad de Alzheimer (OR 0,35; IC 95%: 0,19 a 0,66) (46). Estas observaciones han llevado a plantear que existiría una 'ventana de oportunidad' para prevenir las demencias con THM; pasado los 60 años, la terapia hormonal incluso podría aumentar el riesgo(47).
Los estrógenos facilitan funciones cognitivas superiores al ejercer efectos tanto en la corteza prefrontal como en el hipocampo, facilitando la sinaptogénesis(48). Existen receptores de estrógeno α y β en el cerebro, siendo el más trascendente el α; en ausencia de estrógenos desaparece el receptor de estrógenos α del cerebro, pudiendo ser reinducidos solo si se reemplazan los estrógenos en forma relativamente precoz. Las mujeres ooforectomizadas previo a la menopausia muestran consistentemente aumento del riesgo de declinación cognitiva y de demencia. Varios estudios han demostrado neuroprotección cuando la THM se inicia en la posmenopausia temprana (mayoritariamente entre los 50 a 60 años)(49). Si la reposición hormonal se inicia más tardíamente, en cambio, no se verifican los beneficios cognitivos antes mencionados. Este fenómeno da sustento a la 'tteoría de ventana de oportunidad' para los beneficios cerebrales de la THM en la posmenopausia y permite entender los resultados negativos del estudio WHIMS.
Mortalidad
Los efectos positivos de la THM en la calidad de vida y en el riesgo de enfermedades crónicas debieran traducirse en una menor mortalidad en las mujeres que usan THM. Un metaanálisis de 19 estudios aleatorios con 16 000 mujeres seguidas por 83 000 pacientes-años, mostró que la mortalidad en las usuarias de THM disminuía en 27% (RR 0,73; IC 95% 0,52 a 0,96); cuando se agregaron 8 estudios observacionales al análisis previo, el menor riesgo de muerte se mantuvo inalterado (RR 0,72; IC 95% 0,62 a 0,82)(50). Un gran estudio finlandés que siguió a casi medio millón de mujeres que usaron THM por períodos variables entre 1994 y 2009 señaló que el riesgo de morir de cualquier causa se redujo en 38% en las mujeres que usaron la terapia más de 10 años(51). Contrariamente, otro metaanálisis que analizó 10 estudios, incluyendo a 38 908 mujeres posmenopáusicas, no mostró disminución de la mortalidad con THM(52); sin embargo, este análisis incluyó 27 347 mujeres del WHI que tenían al inicio del estudio una edad promedio de 63,2 años, las cuales están fuera de la ventana de oportunidad de protección cardiovascular de la THM, como analizamos previamente. Por lo tanto, todo parece indicar que en mujeres con menopausia reciente el uso de THM podría asociarse a menor mortalidad. Contrariamente el no usar de THM podría implicar incluso mayor riesgo de mortalidad. Sarrel estimó que alrededor de 50 000 mujeres histerectomizadas de 50 a 59 años murieron en EE. UU. antes de lo que correspondía, por no usar terapia hormonal(53).
Conclusiones
La menopausia afecta la calidad de vida de la mujer e incrementa el riesgo de enfermedades crónicas. La THM al disminuir la sintomatología climatérica mejora la calidad de vida y por sus múltiples acciones metabólicas, especialmente a nivel del sistema nervioso central, atenúa el riesgo de enfermedades crónicas. Al no indicar THM a las mujeres con sintomatología, que no tienen contraindicaciones para su uso, las estamos privando de los beneficios de esta terapia.
Financiamiento: Autofinanciado
Conflicto de interés: La autora declara no tener algún conflicto de interés
Citar como: Vallejo Maldonado S. Terapia hormonal de la menopausia, ¿por qué prescribirla? Rev Peru Ginecol Obstet. 2018;64(1):51-59
Referencias Bibliográficas
1. Lobo RA, Davis SR, De Villiers TJ, Gompel A, Henderson VW, Hodis HN, et al. Prevention of diseases after menopause. Climacteric. 2014;17:540-56. DOI: 10.3109/13697137.2014.933411. [ Links ]
2. Jewett PI, Gangnon RE, Trentham-Dietz A, Sprague BL. Trends of postmenopausal estrogen plus progestin prevalence in the United States between 1970 and 2010. Obstet Gynecol. 2014;124:727-33. DOI: 10.1097/ AOG.0000000000000469. [ Links ]
3. Rossouw JE, Anderson GL, Prentice RL, LaCroix AZ, Kooperberg C, Stefanick ML, et al; Writing Group for the Women's Health Initiative Investigators. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results from the Women's Health Initiative Randomized Controlled. JAMA. 2002;288:321-33 [ Links ]
4. Collaborative Group for Research of the Climacteric in Latin America (REDLINC). Menopausal symptoms appear before the menopause and persist 5 years beyond: a detailed analysis of a multinational study. Climacteric. 2012;15:542-51. doi: 10.3109/13697137.2012.658462. [ Links ]
5. Blümel JE, Sáez L, Roncagliolo ME, Tacla X, Brandt A. Decrease of labor absenteeism associated with hormone replacement therapy in postmenopausal women. Rev Med Chil. 1995;123:948-53. [ Links ]
6. Stewart WF, Ricci JA, Chee E, Morganstein D, Lipton R. Lost productive time and cost due to common pain conditions in the US workforce. JAMA. 2003;290:244354. [ Links ]
7. Mäntyselkä PT, Kumpusalo EA, Ahonen RS, Takala JK. Direct and indirect costs of managing patients with musculoskeletal pain-challenge for health care. Eur J Pain. 2002;6:141-8. DOI:10.1053/eujp.2001.0311. [ Links ]
8. Ojaniatva A, Makinen J, Helenius H, Korkeiia K, Sundell J, Rautava P. Sexual activity and perceived health among Finnish middle-aged women. Health Qual Life Outcomes. 2006;4:29. doi: 10.1186/1477-7525-4-29. [ Links ]
9. Collaborative Group for Research of the Climacteric in Latin America (REDLINC). Sexual dysfunction in middle-aged women: a multicenter Latin American study using the Female Sexual Function Index. Menopause. 2009;16:1139-48. DOI: 10.1097/gme. 0b013e3181a4e317. [ Links ]
10. Acquadro C, Berzon R, Dubois D, Leidy NK, Marquis P, Revicki D, et al; PRO Harmonization Group. Incorporating the patient's perspective into drug development and communication: an ad hoc task force report of the Patient-Reported Outcomes (PRO) Harmonization Group meeting at the Food and Drug Administration, February 16, 2001. Value Health. 2003;6:522-31. [ Links ]
11. MacLennan A, Lester S, Moore V. Oral estrogen replacement therapy versus placebo for hot flushes: a systematic review. Climacteric. 2001;4:58-74. [ Links ]
12. Pitkin J, Smetnik VP, Vadász P, Mustonen M, Salminen K, Ylikangas S; Indivina 321 Study Group. Continuous combined hormone replacement therapy relieves climacteric symptoms and improves health-related quality of life in early postmenopausal women. Menopause Int. 2007;13:116-23. DOI:10.1258/175404507781605622. [ Links ]
13. Morris AA, Ahmed Y, Stoyanova N, Hooper WC, De Staerke C, Gibbons G, et al. The association between depression andleptin is mediated by adiposity. Psychosom Med. 2012;74:483-8. DOI: 10.1097/PSY. 0b013e31824f5de0. [ Links ]
14. Rossetti C, Halfon O, Boutrel B. Controversies about a common etiology for eating and mood disorders. Front Psychol. 2014;5:1205. doi: 10.3389/fpsyg.2014.01205. doi: 10.3389/fpsyg.2014.01205. [ Links ]
15. Clegg DJ, Brown LM, Woods SC, Benoit SC. Gonadal hormones determine sensitivity to central leptin and insulin. Diabetes. 2006;55:978-87. [ Links ]
16. Brown LM, Clegg DJ. Central effects of estradiol in the regulation of adiposity. J Steroid Biochem Mol Biol. 2010;122:65-73. doi: 10.1016/j.jsbmb.2009.12.005. [ Links ]
17. Blümel JE, Chedraui P, Aedo S, Fica J, Mezones-Holguín E, Barón G, et al. Obesity and its relation to depressive symptoms and sedentary lifestyle in middle-aged women. Maturitas. 2015; 80:100-5. [ Links ]
18. Grundy SM, Cleeman JI, Daniels SR, Donato KA, Eckel RH, Franklin BA, et al. Diagnosis and management of the metabolic syndrome: an American Heart Association/National Heart, Lung, and Blood Institute Scientific Statement. Circulation. 2005;112:2735-52. doi: 10.1016/j.maturitas.2014.10.007. [ Links ]
19. Nakamura K, Fuster JJ, Walsh K. Adipokines: a link between obesity and cardiovascular disease. J Cardiol. 2014;63:250-9. doi: 10.1016/j.jjcc.2013.11.006. [ Links ]
20. Cantley J. The control of insulin secretion by adipokines: current evidence for adipocyte-beta cell endocrine signalling in metabolic homeostasis. Mamm Genome. 2014;25:9-10. doi: 10.1007/s00335-014-9538-7. [ Links ]
21. Ding J, Kritchevsky SB, Harris TB, Burke GL, Detrano RC, Szklo M, et al; Multi-Ethnic Study of Atherosclerosis. The association of pericardial fat with calcified coronary plaque. Obesity (Silver Spring). 2008;16:1914-9. [ Links ]
22. El Khoudary SR, Shields KJ, Janssen I, Hanley C, Budoff MJ, Barinas-Mitchell E, et al. Cardiovascular fat, menopause and sex hormones in women: The SWAN Cardiovascular Fat Ancillary Study. J Clin Endocrinol Metab. 2015:JC20152110. [Epub ahead of print]. PMID: 26176800. doi: 10.1210/JC.2015-2110. [ Links ]
23. Resanovic I1, Rizzo M, Zafirovic S, Bjelogrlic P, Perovic M, Savic K, et al. Anti-atherogenic effects of 17β-estradiol. Horm Metab Res. 2013;45:701-8. doi: 10.1055/s0033-1343478.
24. Blümel JE, Castelo-Branco C, González P, Moyano C, Iturriaga M, Videla L, et al. Transdermal estrogens do not appear to modify the extent of lesional areas of aortic atherosclerosis in oophorectomized rabbits on a cholesterol-rich diet. Atherosclerosis. 2000; 148:303-8. [ Links ]
25. Danser AH, Slump DE, Grefhorst A, van Veghel R, Garrelds IM, Roks AJ, et al. angiotensin ii type 2 receptorand acetylcholine-mediated relaxation: The essential contribution of female sex hormones and chromosomes. J Hypertens. 2015;33 Suppl 1:e115. doi: 10.1097/01.hjh.0000467660.69156.d5. [ Links ]
26. Rosano GM, Vitale C, Fini M. Hormone replacement therapy and cardioprotection: what is good and what is bad for the cardiovascular system?. Ann N Y Acad Sci. 2006;1092:341-8. [ Links ]
27. Grodstein F, Manson JE, Stampfer MJ. Hormone therapy and coronary heart disease: the role of time since menopause and age at hormone initiation. J Womens Health (Larchmt). 2006;15:35-44. [ Links ]
28. Manson JE, Chlebowski RT, Stefanick ML, Aragaki AK, Rossouw JE, Prentice RL, et al. Menopausal hormone therapy and health outcomes during the intervention and extended poststopping phases of the Women's Health Initiative randomized trials. JAMA. 2013;310:1353-68. doi: 10.1001/jama.2013.278040. [ Links ]
29. Schierbeck LL, Rejnmark L, Tofteng CL, Stilgren L, Eiken P, Mosekilde L, et al. Effect of hormone replacement therapy on cardiovascular events in recently postmenopausal women: randomised trial. BMJ. 2012;345:e6409. doi: https://doi.org/10.1136/bmj.e6409. [ Links ]
30. Mikkola TS, Tuomikoski P, Lyytinen H, Korhonen P, Hoti F, Vattulainen P, et al. Estradiol-based postmenopausal hormone therapy and risk of cardiovascular and all-cause mortality. Menopause. 2015; 22:976-83. doi: 10.1097/GME.0000000000000450. [ Links ]
31. Lobo RA, Davis SR, De Villiers TJ, Gompel A, Henderson VW, Hodis HN, et al. Prevention of diseases after menopause. Climacteric. 2014;17:540-56. doi: 10.3109/13697137.2014.933411. [ Links ]
32. Tella SH, Gallagher JC. Prevention and treatment of postmenopausal osteoporosis. J Steroid Biochem Mol Biol. 2014;142:155-70. doi: 10.1016/j. jsbmb.2013.09.008. [ Links ]
33. Wells G, Tugwell P, Shea B, Guyatt G, Peterson J, Zytaruk N, et al; Osteoporosis Methodology Group and The Osteoporosis Research Advisory Group. Meta-analyses of therapies for postmenopausal osteoporosis. V. Meta-analysis of the efficacy ofhormone replacement therapy in treating and preventing osteoporosis in postmenopausal women. Endocr Rev. 2002;23:529-39. [ Links ]
34. Marjoribanks J, Farquhar C, Roberts H, Lethaby A. Long term hormone therapy for perimenopausal and postmenopausal women. Cochrane Database Syst Rev. 2012;7:CD004143. doi: 10.1002/14651858.CD004143.pub4. [ Links ]
35. Bea JW, Zhao Q, Cauley JA, LaCroix AZ, Bassford T, Lewis CE, et al. Effect of hormone therapy on lean body mass, falls, and fractures: 6-year results from the Women's Health Initiative hormone trials. Menopause. 2011;18:44-52. doi: 10.1097/gme.0b013e3181e3aab1. [ Links ]
36. Sipilä S, Finni T, Kovanen V. Estrogen influences on neuromuscular function in postmenopausal women. Calcif Tissue Int. 2015;96:222-33. doi: 10.1007/s00223014-9924-x. [ Links ]
37. Wolfson B, Eades G, Zhou Q. Adipocyte activation of cancer stem cell signaling in breast cancer. World J Biol Chem. 2015;6:39-47. doi: 10.4331/wjbc.v6.i2.39. [ Links ]
38. Xia X, Chen W, Li J, Chen X, Rui R, Liu C, et al. Body mass index and risk of breast cancer: a nonlinear dose-response meta-analysis of prospective studies. Sci Rep. 2014;4:7480. doi: 10.1038/srep07480. [ Links ]
39. Bergström A, Pisani P, Tenet V, Wolk A, Adami HO. Overweight as an avoidable cause of cancer in Europe. Int J Cancer. 2001;91:421-30. [ Links ]
40. LaCroix AZ, Chlebowski RT, Manson JE, Aragaki AK, Johnson KC, Martin L, et al; WHI Investigators. Health outcomes after stopping conjugated equine estrogens among postmenopausal women with prior hysterectomy: a randomized controlled trial. JAMA. 2011;305:1305-14. doi: 10.1001/jama.2011.382. [ Links ]
41. Manson JE, Chlebowski RT, Stefanick ML, Aragaki AK, Rossouw JE, Prentice RL, et al. Menopausal hormone therapy and health outcomes during the intervention and extended poststopping phases of the Women's Health Initiative randomized trials. JAMA. 2013;310:1353-68. doi: 10.1001/jama.2013.278040. [ Links ]
42. Aedo S, Cavada G, Blümel JE, Chedraui P, Fica J, Barriga P, et al. Women's Health Initiative estrogen plus progestin clinical trial: a study that does not allow establishing relevant clinical risks. Menopause. 2015 May 11. [Epub ahead of print]. DOI: 10.1097/ gme.0000000000000472. [ Links ]
43. Alzheimer`s Disease International. World Alzheimer Report 2015. Disponible en: http://www.alz.co.uk/research/WorldAlzheimerReport2015-sheet.pdf. Accedida 27 Nov. 2015. [ Links ]
44. Rebekah SV, Pike CJ. Gender, sex steroid hormones, and Alzheimer's disease. Horm Behav. 2013;63:301-7. doi: 10.1016/j.yhbeh.2012.04.006. [ Links ]
45. Shumaker SA, Legault C, Kuller L, Rapp SR, Thal L, Lane DS, el al; Women's Health Initiative Memory Study. Estrogen plus progestin and the incidence of dementia and mild cognitive impairment in postmenopausal women: the Women's Health Initiative. Memory Study (WHIMS). JAMA. 2003;289:2651-62. [ Links ]
46. Henderson VW, Benke KS, Green RC, Cupples LA, Farrer LA; MIRAGE Study Group. Postmenopausal hormone therapy and Alzheimer's disease risk: interaction with age. J Neurol Neurosurg Psychiatry. 2005;76:103-5. [ Links ]
47. Jamshed N, Ozair FF, Aggarwal P, Ekka M. Alzheimer disease in post-menopausal women: Intervene in the critical window period. J Mid-life Health. 2014;5:38-40 [ Links ]
48. Hara Y, Waters EM, McEwen BS, Morrison JH. Estrogen effects on cognitive and synaptic health over the life course. Physiol Rev. 2015;95:785-807. doi: 10.4103/0976-7800.127791. [ Links ]
49. Rocca WA, Grossardt BR, Shuster L. Oophorectomy, estrogen and dementia: A 2014 uptodate. Molecular and Cellular Endocrinology. 2014;389:7-12. doi: 10.1016/j. mce.2014.01.020. [ Links ]
50. Salpeter SR, Cheng J, Thabane L, Buckley NS, Salpeter EE. Bayesian meta-analysis of hormone therapy and mortality in younger postmenopausal women. Am J Med. 2009;122:1016-22. doi: 10.1016/j.amjmed.2009.05.021. [ Links ]
51. Mikkola TS, Tuomikoski P, Lyytinen H, Korhonen P, Hoti F, Vattulainen P, et al. Estradiol-based postmenopausal hormone therapy and risk of cardiovascular and all-cause mortality. Menopause. 2015;22:976-83. doi: 10.1097/GME.0000000000000450. [ Links ]
52. Yang D, Li J, Yuan Z, Liu X. Effect of hormone replacement therapy on cardiovascular outcomes: a meta-analysis of randomized controlled trials. PLoS One. 2013;8(5):e62329. doi: 10.1371/journal.pone.0062329. [ Links ]
53. Sarrel PM, Njike VY, Vinante V, Katz DL The mortality toll of estrogen avoidance: an analysis of excess deaths among hysterectomized women aged 50 to 59 years. Am J Public Health. 2013;103:1583-8. doi: 10.2105/AJPH.2013.301295. [ Links ]
Correspondencia:
Recibido: 3 noviembre 2017
Aceptado: 22 diciembre 2017