Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Peruana de Ginecología y Obstetricia
On-line version ISSN 2304-5132
Rev. peru. ginecol. obstet. vol.64 no.1 Lima Jan./Mar. 2018
SERIE DE CASOS
Manejo prenatal de la malformación adenomatoidea quística pulmonar, variedad macroquística. Reporte de los primeros casos tratados intraútero en el Perú y revisión de la literatura
Prenatal management of congenital cystic adenomatoid lung malformation, macrocystic type. Report of a series of cases treated in utero in Peru and review of the literature
Walter Ventura Laveriano1,2 a,b, Kristen Chang Wong3,c, Rommel Lacunza Paredes4,d, Conny Nazario Redondo2,a,b, Pedro Saldaña Montes5,e, Renato Moreno Gonzales5,e, Jackelyne Alvarado Zelada6,f, Walter Castillo Urquiaga1,d, Mario Zárate Girao1,d, Antonio Limay Ríos1,d
1. Servicio de Medicina Fetal, Instituto Nacional Materno Perinatal, Lima, Perú
2. Unidad de Salud Fetal, Clínica Delgado, Lima, Perú
3. Universidad Nacional Pedro Ruiz Gallo, Hospital Provincial Docente Belén de Lambayeque, Chiclayo, Perú
4. Unidad Materno Fetal, Hospital Daniel A. Carrión, Callao, Perú
5. Servicio de Anestesiología, Instituto Nacional Materno Perinatal, Lima, Perú
6. Servicio de Cirugía Neonatal, Instituto Nacional Materno Perinatal, Lima, Perú
a Médico Ginecólogo-Obstetra, Subespecialista en Medicina Fetal
b Past Fellow Harris Birthright Research Centre for Fetal Medicine, King’s College Hospital, Londres, Reino Unido
c Médico Residente de Ginecología y Obstetricia
d Médico especialista en Ginecología y Obstetricia
e Médico especialista en Anestesiología Obstétrica
f Médico especialista en Cirugía Neonatal y Pediátrica
RESUMEN
Se reporta una serie de 3 casos con diagnóstico prenatal de malformación adenomatoide quística pulmonar variedad macroquística sometida a terapia intraútero con derivación tóraco-amniótica. Se muestra que esta intervención intrauterina altamente especializada puede ser realizada con éxito en nuestro país. Los tres casos sobrevivieron. Se presenta una revisión corta de esta patología y se propone un flujograma de manejo.
Palabras clave. Cirugía fetal, Cirugía intrauterina, Malformación adenomatoide quística pulmonar, Malformación congénita pulmonar.
ABSTRACT
We report a series of three cases with prenatal diagnosis of congenital cystic adenomatoid malformation of the lung, macrocystic type, treated in utero with thoraco-amniotic shunting. This highly specialized intervention is feasible in our local setting. The three cases survived. A mini-review of this condition is presented and an algorithm of prenatal management is proposed.
Keywords: Fetal surgery, Intrauterine surgery, Congenital cystic adenomatoid malformation.
Introducción
La malformación adenomatoidea (adenomatoide) quística pulmonar (MAQP) es una lesión pulmonar rara con una incidencia de 1 en 25 000 embarazos, aunque la incidencia real se estima mayor(1). Bartholinus fue el primero en describir una lesión quística pulmonar, en 1687, pero su reporte pasó desapercibido por varias décadas(2). Chin y Tang fueron los primeros en considerarlos como una enfermedad única de naturaleza congénita(3). Las MAQPs son lesiones pulmonares caracterizadas por proliferación adenomatoide excesiva de las estructuras bronquiales terminales. Histológicamente forman quistes de varios tamaños, siempre conectadas al árbol traqueobronquial pero sin función en el intercambio gaseoso. Usualmente estas lesiones son irrigadas por las arterias pulmonares. Stocker definió histológicamente 3 tipos de MAQP basado en el tamaño de los quistes, esto es tipo I macroquísticas, tipo II intermedias y tipo III microquísticas( 4). Esta clasificación es casi universalmente usada, sin embargo, incorrectamente aplicada en el diagnóstico prenatal, primero por ser una clasificación histológica y segundo porque se las obtuvo de recién nacidos de varios días. Se propone usar la clasificación de Adzick y col, del Hospital de Niños de Filadelfia CHOP de Estados Unidos, que se basa en criterios ultrasonógraficos en la etapa prenatal(5) y que considera dos tipos: la variedad macroquística -lesión pulmonar donde se reconocen quistes mayores de 5 mm de diámetro en el ultrasonido fetal- y la variedad microquística, que se caracteriza por una lesión que por el contrario aparece como una masa sólida hiperecogénica. Es reconocido que el pronóstico global depende principalmente del tamaño de la lesión más que de la apariencia ecográfica o tipo histológico. La presente revisión está enfocada al manejo de la variedad macroquística.
Diagnóstico
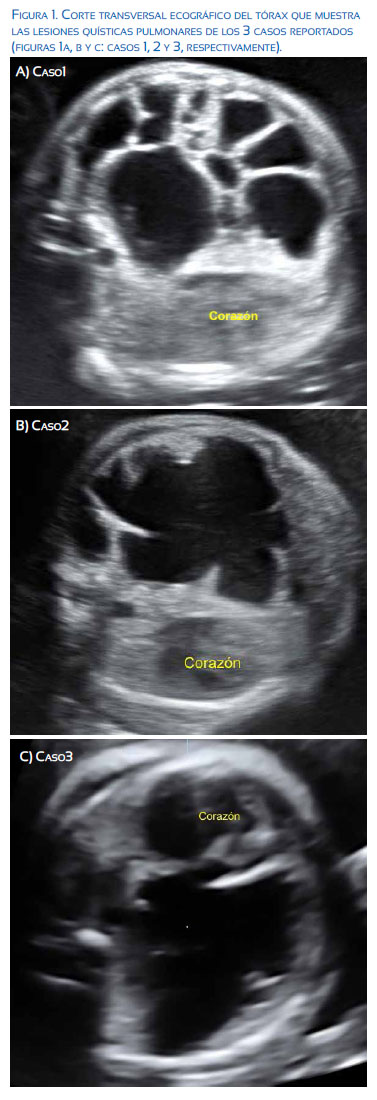
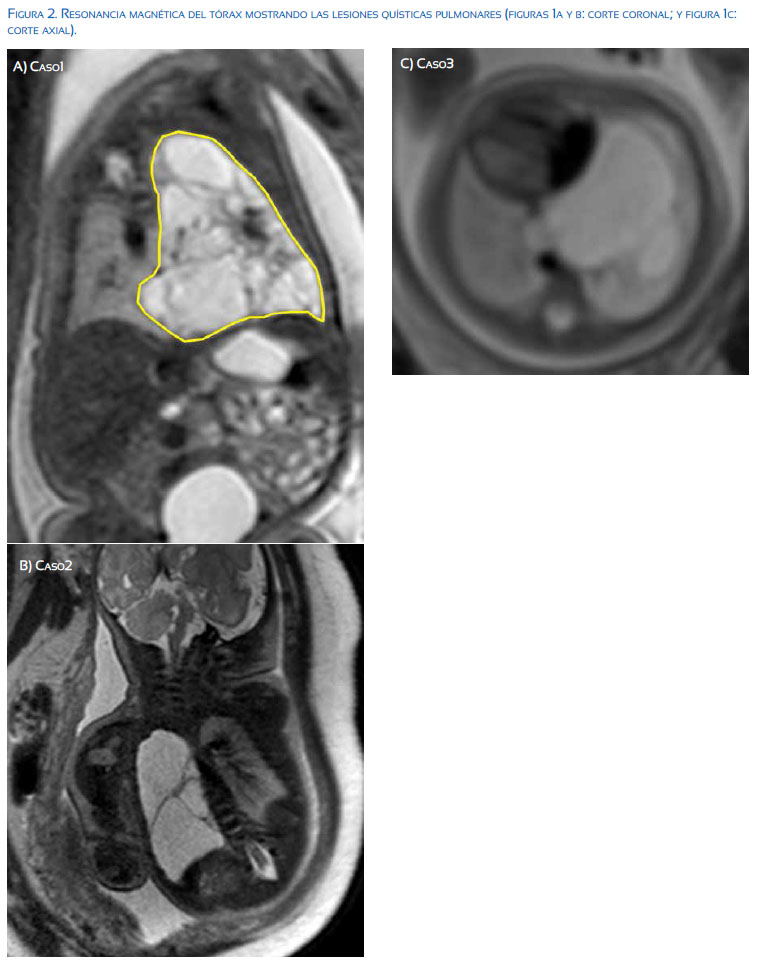
La MAQP es diagnosticada fácilmente en la ecografía de rutina del segundo trimestre cuando la lesión es grande (Figura 1). Sin embargo, las malformaciones muy pequeñas pueden pasar desapercibidas sobre todo en el tercer trimestre. La resonancia RMN fetal es crucial en el planeamiento del manejo perinatal, sobre todo cuando se piensa en la reseccíon final del tumor en el período neonatal inmediato (Figura 2). El curso de la malformación durante el embarazo varía desde una regresión en el tamaño hasta el desarrollo de hidropesía fetal y muerte intrauterina. Existen en la literatura mundial casos con regresión completa; sin embargo, el seguimiento ha sido clínico o con rayos X y pocas veces con tomografía computarizada, que es el estándar de oro actual de diagnóstico, por lo que sus resultados son cuestionables(6). Nuestro grupo considera que estas lesiones confirmadas prenatalmente persisten en la etapa posnatal, aunque algunos muy disminuídos de tamaño. Por eso se plantea que una vez hecho el diagnóstico prenatal debe activarse un programa de seguimiento que incluya seguimiento posnatal por neumología pediátrica y cirugía de tórax pediátrica.
La sensibilidad del ultrasonido prenatal es de aproximadamente 80% y el valor predictivo positivo es 55%(7). Con el mejoramiento de los equipos y el mejor reconocimiento de esta patología es probable que la sensibilidad en la actualidad sea mayor del 90%.
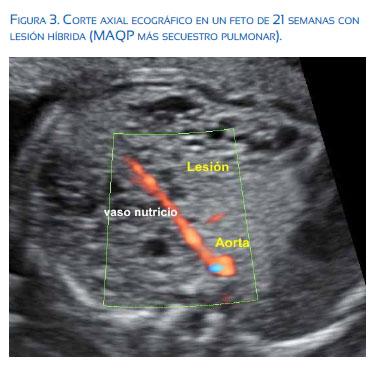
El diagnóstico diferencial incluye la atresia bronquial, el quiste broncogénico, la obstrucción de vías aéreas superiores como la atresia laríngea, y enfisema lobar congénito. Asimismo, un diagnóstico siempre a considerar es el secuestro broncopulmonar, el cual es reconocido porque tiene una arteria nutricia proveniente de la arteria aorta reconocida a la exploración power Doppler-color. Sin embargo, es muy frecuente también encontrar una lesión mixta o híbrida, es decir MAQP asociado a secuestro pulmonar, el cual está siendo cada vez más encontrado en la etapa prenatal(8) (Figura 3).
La MAQP afecta igualmente el pulmón derecho o izquierdo y raras veces puede ser bilateral, en cuyo caso hay que considerar el diagnóstico de obstrucción de vías aéreas superiores (CHAOS, en inglés) o blastoma pleuro-pulmonar.
Manejo
El manejo de la MAQP depende de la afectación que esté produciendo la lesión en el feto. El crecimiento exagerado de la lesión puede provocar polihidramnios e hidropesía fetal. El polihidramnios es el resultado de la compresión esofágica directa de la tumoración en el mediastino, interfiriendo con la deglución del líquido amniótico. La hidropesía fetal es secundaria a la compresión de la vena cava inferior y desviación severa del mediastino y compresión cardíaca. El otro mecanismo planteado de hidropesía fetal es el flujo hiperdinámico originado por una rama nutricia proveniente de la arteria aorta en los casos de lesión híbrida. En estos casos la hidropesía fetal no es consecuencia de fallo cardíaco y por eso hay algunos casos de fetos que aun con hidropesía fetal han evolucionado favorablemente sin tratamiento intrauterino(9). Sin embargo, el manejo estándar actual incluye el tratamiento intrauterino en los casos complicados con hidropesía fetal(10).
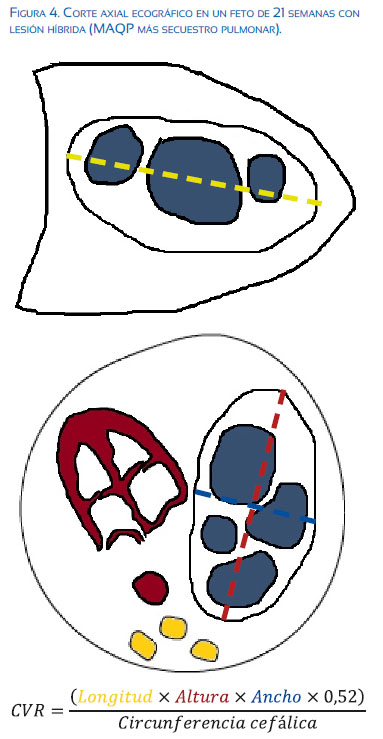
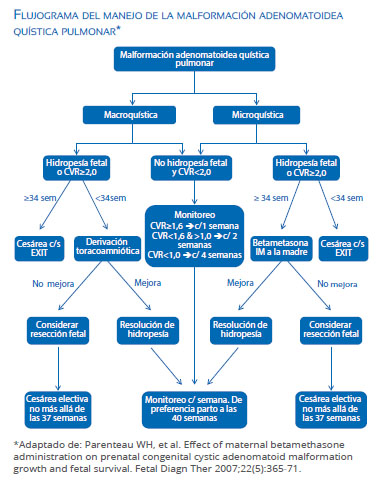
También se ha propuesto que el tamaño de la lesión normalizado para el tamaño de la cabeza fetal y valorado a través de un índice CVR (CCAM volume ratio) (Figura 4) puede clasificar los pacientes con riesgo bajo o alto de desarrollar hidropesía fetal cuando usamos un punto de corte de 1,6, sobre todo cuando no hay un quiste dominante, prediciendo la aparición de hidropesía hasta en más de 80% de casos(11). En nuestra experiencia y en la de otros investigadores, los fetos con un CVR >2,0 son los que tienen mayor riesgo de hidropesía fetal y que ameritarán un seguimiento más estricto o intervención intrauterina( 12). Se propone un algoritomo de manejo basado en las evidencias actuales y en nuestra propia experiencia (ver flujograma).
Derivación toracoamniótica
La derivación toracoamniótica en manos experimentadas tiene un riesgo muy bajo de complicaciones. Sin embargo, hay que tener presente los potenciales riesgos como sangrado intraamniótico, separación de membranas, rotura prematura de membranas y parto pretérmino. El objetivo de la terapia intrauterina es disminuir la presión intratorácica ocasionada por los quistes que siempre conectan al quiste mayor. Esto se logra colocando un extremo de un catéter ‘doble cola de chancho’ (Figura 5) en el quiste dominante y el otro extremo en la cavidad amniótica, de tal forma que se produzca la descompresión de todos los quistes.
La derivación toracoamniótica fue informada por primera vez por Nicolaides y col.(13) para el tratamiento de una MAQP, y desde entonces, este procedimiento ha sido adoptado en muchos centros del mundo. Se realiza bajo visión con ultrasonido y utilizando una técnica similar a la de Seldinger para los accesos vasculares. En algunos casos se puede presentar desplazamiento del catéter dentro de la cavidad amniótica o menos frecuentemente en la cavidad torácica, con reacumulación del líquido.
Hasta el momento se han reportado series pequeñas de casos intervenidos con derivación toracoamniótica que, incluido el del presente trabajo, suman 152, con resultados favorables (Tabla 1). Asimismo se ve en el resumen de datos que la principal indicación es la hidropesía fetal y la edad gestacional promedio de 25 semanas.
Otros manejos
En el caso de identificarse una arteria nutricia de la lesión proveniente de la arteria aorta, el tratamiento actual es la ablación láser del vaso nutricio( 14). En caso de no identificarse algún vaso nutricio y ante la presencia de un quiste dominante se plantea la opción de la derivación toracoamniótica( 15).
Aunque la evidencia no es consistente, en los casos de lesión microquística se puede administrar betametasona a dosis de maduración pulmonar estándar. Peranteau y col, en un estudio de 11 pacientes que recibieron betametasona comparado con controles históricos que no lo recibieron, observaron disminución de las tasas de crecimiento de las lesiones en 8 de 11 fetos y la resolución de hidropesía en 4 de 5 fetos(16). Por otro lado, Morris y col informaron una tasa de supervivencia de 75% y resolución de la hidropesía de 66% en las gestantes con MAQP microquística. En la variedad macroquística, los resultados fueron menos favorables(17).
Para las lesiones sólidas o en caso no se logre reducir de tamaño el quiste dominante y siempre que exista riesgo de muerte intrauterina, la lobectomía por cirugía intrauterina abierta ha sido practicada en algunos centros; pero este tratamiento debe ser reservado para centros expertos. Nuestro grupo ha realizado la primera cirugía intrauterina abierta para la corrección de espina bífida (en publicación) y en un futuro esta será una opción de tratamiento en nuestro país. En la variedad microquística severa se ha comunicado algunos casos aislados de escleroterapia percutánea intralesional guiada por ecografía de la lesión, con etanolamina o polidocanol(18,19). Sin embargo, no está demostrada la efectividad de esta terapia en series mayores y las complicaciones de esta terapia pueden ser severas(20). En la actualidad, la escleroterapia no es un tratamiento aceptado y solo debe ser realizada dentro de un protocolo de investigación y requerir de la aprobación del comité de ética de la institución.
Serie de casos
En nuestra institución se ha desarrollado en los últimos 3 años un programa de cirugía fetal para las principales patologías fetales tratadas en el mundo, dentro de las cuales se ha intervenido 3 pacientes con MAQP, variedad macroquística, ya sea porque hicieron hidropesía fetal o polihidramnios severo (Tabla 2). Los resultados han sido favorables, con tasa de sobrevida de 100% hasta los 6 meses de nacimiento por seguimiento de los infantes.
La técnica de derivación intrauterina utilizada en todos los casos es como sigue.
1. Paciente en sala de operaciones bajo sedoanalgesia
2. Asepsia con cloerhexidina al 2% del abdomen materno
3. Identificación de la lesión y ubicación del feto y placenta por ecografía
4. Anestesia local en pared abdominal materna
5. Analgesia fetal con fentanilo y paralizante con vecuronio inyectados en el glúteo fetal
6. Inserción de aguja trócar de 2,5 mm de diámetro (set de derivación fetal tipo Harrison, Cook Medical™) guiado por ecografía hasta la lesión pulmonar fetal
7. Introducción del catéter doble pig-tail en el tórax fetal, de tal modo que un asa se ubique dentro del quiste mayor y el otro en la cavidad amniótica
8. Visualización de los latidos fetales.
Manejo posnatal
Cada vez es más recomendada la resección completa del tumor dentro de los seis primeros meses de vida, debido al riesgo reportado (1 a 4%) de transformación maligna a blastoma pleuropulmonar o carcinoma bronquioalveolar. Además, las potenciales infecciones que podrían ocurrir ocasionarían distorsión del parénquima pulmonar incluida la lesión, haciendo más difícil la cirugía. Cabe señalar que más que el riesgo de transformación maligna es la incapacidad de dicernir, con los métodos actuales, entre una lesión benigna y maligna, debido a que son prácticamente idénticas(18). La lobectomía por vía toracoscópica es una técnica quirúrgica muy segura en esta patología congénita y que se está usando cada vez más(19).
Conclusiones
La MAQP es una enfermedad congénita cada vez más diagnosticada prenatalmente, de curso generalmente benigno y susceptible de tratamiento quirúrgico intrauterino en los casos complicados. Se presenta nuestros primeros casos sometidos a derivación toraco-amniótica para las lesiones macroquísticas complicadas. En otra publicación se presentará la experiencia con cirugía intrauterina de las lesiones pulmonares microquísticas híbridas y secuestro pulmonar.
Agradecimientos
Al aporte invalorable del personal del Centro Quirúrgico, en la persona de la Lic. Carmen Rosa Fuertes Gamarra (Jefa de enfermeras del Centro Quirúrgico). Asimismo, el agradecimiento a Medicina Fetal Perú (www.medicinafetalperu.pe) por el apoyo logístico de todo el proceso.
Conflictos de interés: Los autores declaran que no existe conflicto de intereses relacionado con el artículo.
Fuente de financiamiento: Autofinanciado.
Citar como: Ventura Laveriano W, Chang Wong K, Lacunza Paredes R, Nazario Redondo C, Saldaña Montes P, Moreno Gonzales R, Alvarado Zelada J, Castillo Urquiaga W, Zárate Girao M, Limay Ríos A. Manejo prenatal de la malformación adenomatoidea quística pulmonar, variedad macroquística. Reporte de los primeros casos tratados intraútero en el Perú y revisión de la literatura. Rev Peru Ginecol Obstet. 2018;64(1):91-97
Referencias Bibliográficas
1. Laberge JM, Flageole H, Pugash D, Khalife S, Blair G, Filiatrault D, et al. Outcome of the prenatally diagnosed congenital cystic adenomatoid lung malformation: a Canadian experience. Fetal Diagn Ther. 2001 May;16(3):178–86. DOI: 10.1159/000053905. [ Links ]
2. Fischer CC, Tropea F Jr, Bailey CP. Congenital pulmonary cysts. The Journal of Pediatrics. Elsevier; 1943 Aug;23(2):219– 23. DOI: 10.1016/S0022-3476(43)80125-6. [ Links ]
3. Ch’in KY, Tang MY. Congenital adenomatoid malformation of one lobe of a lung with general anasarca. Arch Pathol (Chic). 1949 Sep;48(3):221–9.
4. Stocker JT, Madewell JE, Drake RM. Congenital cystic adenomatoid malformation of the lung. Classification and morphologic spectrum. Hum Pathol. 1977 Mar;8(2):155–71. [ Links ]
5. Adzick NS, Harrison MR, Glick PL, Golbus MS, Anderson RL, Mahony BS, et al. Fetal cystic adenomatoid malformation: prenatal diagnosis and natural history. J Pediatr Surg. 1985 Oct;20(5):483–8. [ Links ]
6. van Leeuwen K, Teitelbaum DH, Hirschl RB, Austin E, Adelman SH, Polley TZ, et al. Prenatal diagnosis of congenital cystic adenomatoid malformation and its postnatal presentation, surgical indications, and natural history. J Pediatr Surg. 1999 May;34(5):794–8–discussion798–9. [ Links ]
7. Gornall AS, Budd JLS, Draper ES, Konje JC, Kurinczuk JJ. Congenital cystic adenomatoid malformation: accuracy of prenatal diagnosis, prevalence and outcome in a general population. Prenat Diagn. John Wiley & Sons, Ltd; 2003 Dec 15;23(12):997–1002. DOI: 10.1002 / pd.739. [ Links ]
8. Achiron R, Hegesh J, Yagel S. Fetal lung lesions: a spectrum of disease. New classification based on pathogenesis, two-dimensional and color Doppler ultrasound. Ultrasound Obstet Gynecol. John Wiley & Sons, Ltd; 2004 Aug;24(2):107–14. DOI: 10.1002 / uog.1110. [ Links ]
9. Adzick NS. Management of fetal lung lesions. Clinics in Perinatology. 2009 Jun;36(2):363–76. DOI: 10.1016 / j. clp.2009.03.001. [ Links ]
10. Azizkhan RG, Crombleholme TM. Congenital cystic lung disease: contemporary antenatal and postnatal management. Pediatr Surg Int. 4 ed. Springer-Verlag; 2008 Jun;24(6):643– 57. DOI: 10.1007 / s00383-008-2139-3. [ Links ]
11. Crombleholme TM, Coleman B, Hedrick H, Liechty K, Howell L, Flake AW, et al. Cystic adenomatoid malformation volume ratio predicts outcome in prenatally diagnosed cystic adenomatoid malformation of the lung. J Pediatr Surg. 2002 Mar;37(3):331–8. DOI: 10.1053/jpsu.2002.30832. [ Links ]
12. Cass DL, Olutoye OO, Cassady CI, Moise KJ, Johnson A, Papanna R, et al. Prenatal diagnosis and outcome of fetal lung masses. J Pediatr Surg. 2011 Feb;46(2):292–8. DOI: 10.1016 / j.jpedsurg.2010.11.004. [ Links ]
13. Nicolaides KH, Azar GB. Thoraco-amniotic shunting. Fetal Diagn Ther. 1990;5(3-4):153–64. [ Links ]
14. Cruz-Martinez R, Méndez A, Dueñas-Riaño J, Ordorica-Flores R, Nieto-Zermeño J, Malagón-Salazar P, et al. Fetal laser surgery prevents fetal death and avoids the need for neonatal sequestrectomy in cases with bronchopulmonary sequestration. Ultrasound Obstet Gynecol. 2015 Nov;46(5):627–8. DOI: 10.1002 / uog.14921. [ Links ]
15. Schrey S, Kelly EN, Langer JC, Davies GA, Windrim R, Seaward PGR, et al. Fetal thoracoamniotic shunting for large macrocystic congenital cystic adenomatoid malformations of the lung. Ultrasound Obstet Gynecol. John Wiley & Sons, Ltd; 2012 May;39(5):515–20. DOI: 10.1002 / uog.11084. [ Links ]
16. Peranteau WH, Wilson RD, Liechty KW, Johnson MP, Bebbington MW, Hedrick HL, et al. Effect of maternal betamethasone administration on prenatal congenital cystic adenomatoid malformation growth and fetal survival. Fetal Diagn Ther. 2007;22(5):365–71. DOI: 10.1159 / 000103298. [ Links ]
17. Morris LM, Lim F-Y, Livingston JC, Polzin WJ, Crombleholme TM. High-risk fetal congenital pulmonary airway malformations have a variable response to steroids. J Pediatr Surg. 2009 Jan;44(1):60–5. DOI: 10.1016 / j.jpedsurg.2008.10.012. [ Links ]
18. Bermúdez C, Pérez-Wulff J, Arcadipane M, Bufalino G, Gómez L, Flores L, Sosa C, Bornick PW, Kontopoulos E, Quintero RA. Percutaneous fetal sclerotherapy for congenital cystic adenomatoid malformation of the lung. Fetal Diagn Ther. 2008;24(3):237-40. doi: 10.1159/000151345. [ Links ]
19. Lee FL, Said N, Grikscheit TC, Shin CE, Llanes A, Chmait RH. Treatment of congenital pulmonary airway malformation induced hydrops fetalis via percutaneous sclerotherapy. Fetal Diagn Ther. 2012;31(4):264-8. doi: 10.1159/000336226. [ Links ]
20. H Chon A, Takeda MR, Felix JC, Chmait RH. A Complication of Percutaneous Sclerotherapy for Congenital Pulmonary Airway Malformation: Intravascular Injection and Cardiac Necrosis. Fetal Pediatr Pathol. 2017 Dec;36(6):437-444. doi: 10.1080/15513815.2017.1346017. [ Links ]
21. Nasr A, Himidan S, Pastor AC, Taylor G, Kim PCW. Is congenital cystic adenomatoid malformation a premalignant lesion for pleuropulmonary blastoma? J Pediatr Surg. 2010 Jun;45(6):1086–9. DOI: 10.1016 / j.jpedsurg.2010.02.067. [ Links ]
22. Albanese CT, Rothenberg SS. Experience with 144 consecutive pediatric thoracoscopic lobectomies. J Laparoendosc Adv Surg Tech A. Mary Ann Liebert, Inc. 2 Madison Avenue Larchmont, NY 10538 USA; 2007 Jun;17(3):339–41. DOI: 10.1089/ lap.2006.0184. [ Links ]
Correspondencia:
Walter R. Ventura Laveriano
, Servicio de Medicina Fetal, Instituto
Nacional Materno Perinatal. Av.
Miroquesada 941, Lima, Perú
• 328 8078. Anexo 1394
Recibido: 11 noviembre 2017
Aceptado: 6 enero 2018