Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Ginecología y Obstetricia
versión On-line ISSN 2304-5132
Rev. peru. ginecol. obstet. vol.64 no.2 Lima abr./jun. 2018
http://dx.doi.org/https://doi.org/10.31403/rpgo.v64i2081
SIMPOSIO biología en reproducción asistida
Freeze-all en reproducción asistida
Freeze-all in assisted reproduction
Natalia Basile1
1. Bioquímica y Embrióloga sénior en el IVIRMA, Madrid; Maestría en embriología clínica y andrología; Profesor de maestría de la Universidad Rey Juan Carlos; Profesor de maestría en la Universidad Europea de Madrid, España
RESUMEN
Los avances en los protocolos de vitrificación y los resultados obtenidos tras la transferencia de embriones congelados han dado lugar a una versión distinta de los ciclos estándar de reproducción asistida: los ciclos freeze-all. Independientemente de su uso frente a las indicaciones más comunes (progesterona elevada, riesgo de hiperestimulación, entre otros), este nuevo concepto hoy representa una práctica habitual en muchas clínicas siendo aplicado a todas las pacientes. En este artículo analizaremos los distintos factores que pudieron haber contribuido a este cambio de política y la evidencia científica en relación al tema. Basados en esta evidencia concluiremos si las clínicas deberían cambiar su forma de trabajo pasando de transferencias de embriones frescos a solo transferencia de embriones congelados o si deberíamos mantener el protocolo estándar.
Palabras clave. Vitrificación; Freeze-all; Síndrome de hiperestimulación ovárica-OHSS, Tamizaje genético preimplantacional-PGS; Resultados perinatales; Segmentación.
ABSTRACT
Breakthroughs in vitrification protocols and the results obtained after frozen embryo transfer have resulted in a different version of the assisted reproduction standard cycles: the "freeze-all" cycles. Regardless of their use beyond the usual indications (elevated progesterone, risk of hyperstimulation, among others), this new concept currently represents a common practice in many institutions and is applied to all patients. In this article, we will discuss the various factors that may have contributed to this change in policy and the scientific evidence for this topic. Based on this evidence, we will conclude if clinics should change their way of working from fresh embryo transfers to only transfer frozen embryos, or if we should maintain the standard protocol.
Keywords: Vitrification; Freeze-All; Ovarian hyperstimulation syndrome-OHSS, Preimplantation genetic screening-PGS; Perinatal results; Segmentation.
Introducción
Existe un nuevo concepto en reproducción asistida llamado Freeze-all. Este concepto surge como consecuencia de los grandes avances en los protocolos de vitrificación, que nos permiten 'aplazar' de forma optativa la transferencia de embriones de un ciclo en fresco a un ciclo congelado. Más allá de las indicaciones más comunes -prevención del síndrome de hiperestimulación ovárica (OHSS), niveles elevados de progesterona, estudios genéticos, entre otros-, el concepto de freeze-all ha pasado de representar una solución cuando existía una indicación, a una práctica habitual en muchos programas de reproducción asistida. Sin embargo, debemos analizar cuándo y para qué pacientes es este enfoque más apropiado. Basados en el principio de que la estimulación ovárica podría causar un entorno menos fisiológico para la implantación embrionaria, el concepto de freeze-all representa una oportunidad de proporcionar un entorno más natural para el embrión. Sin embargo, debemos equilibrar esto con los posibles cambios no fisiológicos que podemos causar al embrión como resultado de la congelación. Las distintas opciones de tratamientos médicos suelen estar influenciadas por una serie de factores incluyendo las pautas, la medicina basada en evidencia, las experiencias pasadas y en cierta medida el hábito(1). Este capítulo repasará los diferentes hitos que podrían habernos llevado al establecimiento del concepto de freeze-all, incluirá una revisión crítica de la literatura publicada sobre el tema para terminar con una conclusión sobre si debemos o no cambiar las prácticas clínicas habituales.
Factores que contribuyen a la política de Freeze-all
1. La Introducción de la vitrificación: una técnica segura
Hoy en día, la criopreservación es crucial en medicina reproductiva. Los avances en las técnicas de criopreservación han dado como resultado una calidad embrionaria y un potencial de implantación similar entre los embriones frescos y los congelados(2,3). Durante décadas, la congelación lenta fue el método de elección para la criopreservación de embriones, tanto en etapa de clivaje como en estadio de blastocisto. Sin embargo, en el caso de los ovocitos, si bien se han reportado varios embarazos y nacimientos tras la transferencia de embriones derivados de ovocitos de congelación lenta(4-6), las tasas de supervivencia han sido solo cercanas al 50%(7-10) y las tasas de fertilización también han sido bajas en comparación con los ovocitos frescos (poco más del 50% en general(11). Por otro lado, la vitrificación ha demostrado ser más efectiva en relación a las tasas de supervivencia y los resultados clínicos(12-14), lo que representa sin duda el método de elección hoy en día en prácticamente todas las clínicas de reproducción asistida. La vitrificación es un método de criopreservación rápida que implica la exposición de los ovocitos y embriones a concentraciones altas de crioprotectores y a velocidades de enfriamiento ultrarrápidas que terminan causando una solidificación instantánea (estado vítreo), evitando así los daños que normalmente sufre una célula por la formación de cristales de hielo durante la congelación lenta. Aquí es tal vez donde recae la mayor ventaja con respecto a la congelación lenta. Dados los excelentes resultados proporcionados por esta técnica, la vitrificación ya no puede tomarse como un complemento de los tratamientos de FIV, sino como una herramienta fundamental para el manejo de nuestras pacientes. Por ejemplo, las bajas respondedoras pueden beneficiarse de la acumulación de ovocitos a través de la vitrificación, lo que les permite alcanzar resultados clínicos similares a las normo-respondedoras(15). Asimismo, esta estrategia también es atractiva para las pacientes con edad materna avanzada (un grupo más difícil de tratar) las cuales, además de ser bajas respondedoras, requieren un tamizaje (screening) genético preimplantacional(16). Además, la vitrificación de ovocitos y embriones también ha demostrado ser una herramienta para las pacientes con riesgo de desarrollar síndrome de hiperestimulación ovárica (SHO, u OHSS por sus siglas en inglés), ya que nos permite criopreservar ambos de forma segura y así demorar su posterior transferencia (17,18). Por último y aunque no menos importante, la vitrificación de ovocitos permite a las mujeres de hoy preservar su fertilidad (la llamada 'congelación social') y a las clínicas establecer bancos de óvulos de donantes con resultados similares que con ovocitos frescos(19).
En cuanto a las tasas de natalidad, un estudio de cohortes poblacional que comparó la criopreservación mediante la vitrificación y la congelación lenta teniendo en cuenta una casuística importante (más de 30 000 casos entre los dos grupos) reveló que los ciclos de transferencia de blastocistos criopreservados a través de la vitrificación resultaron en una tasa de recién nacido vivo significativamente mayor en comparación con los ciclos de transferencia de blastocistos de congelación lenta. Una limitación de este estudio fue la falta de información disponible sobre los protocolos y procesos de criopreservación específicos de cada clínica tanto para la congelación lenta como para la vitrificación y el descongelamiento, con el potencial impacto que esto puede tener en los resultados(20).
Teniendo en cuenta todos estos hechos, sería plausible discutir la introducción de la política freeze-all que implica la vitrificación electiva de todos los embriones viables de un ciclo. El objetivo de una futura transferencia de embriones desvitrificados sería colocarlos en un entorno intrauterino más favorable, evitando los posibles efectos adversos que los niveles hormonales suprafisiológicos pueden ejercer sobre la receptividad endometrial(21).
2. La implementación de clínicas libres de OHSS
El síndrome de OHSS representa una de las principales complicaciones que se pueden presentar tras una estimulación ovárica. El síndrome tiene un amplio espectro de manifestaciones clínicas, desde una enfermedad leve que solo requiere una observación cuidadosa, hasta una enfermedad grave que requiere hospitalización y cuidados intensivos(22). Ocurre en aproximadamente 1 a 14% de los ciclos y está relacionado con un aumento en la permeabilidad vascular (PV). La gonadotropina coriónica humana (hCG), ya sea exógena o endógena, es probablemente el factor que más frecuentemente desencadene este síndrome(25). Tras la administración de hCG, la expresión del factor de crecimiento endotelial vascular (VEGF) y el ARNm del receptor 2 de VEGF (VEGFR-2) aumentan significativamente, aumentando a un nivel máximo que coincide con un pico en la PV. Estos hallazgos sugieren que el síndrome se puede prevenir induciendo la ovulación con un agonista de GnRH (GnRHa) en lugar de hCG, evitando así la sobreexpresión de VEGF(26). Esta estrategia evitaría la aparición temprana, pero no tardía, del SHO.
Durante muchos años, los agonistas de GnRH fueron consideraros el protocolo estándar de estimulación, especialmente para las pacientes jóvenes normo-respondedoras. Sin embargo, un gran inconveniente de estos protocolos era el riesgo de OHSS. La introducción de los antagonistas de GnRH, por otra parte, pareció abrir una nueva vía hacia una reproducción asistida más 'amigable'(27). A diferencia de la supresión indirecta de la hipófisis inducida por los agonistas de GnRH, la administración de antagonistas de GnRH provoca una supresión inmediata y dosis dependiente de la liberación de gonadotropinas por la ocupación competitiva de los receptores de GnRH en la hipófisis(28), dando como resultado una estimulación de duración más corta y en ausencia de los efectos secundarios causados por la hipoestrogenemia profunda(29,30). Además, los protocolos de estimulación ovárica con antagonistas pueden combinarse con medidas complementarias para evitar aún más el riesgo de OHSS como desencadenar la ovulación con aGnRH en lugar de hCG(31-34). Sin embargo, este enfoque no es 100% seguro, dado que se han reportado unos pocos casos anecdóticos de OHSS grave después de haber desencadenado la ovulación con aGnRH en ausencia de soporte lúteo(35-37). Además, la inducción de la ovulación con aGnRH se ha asociado a defectos en la fase lútea presumiblemente debido a una retroalimentación ( feedback) negativa excesiva por parte de los esteroides(38-40). Dos revisiones consecutivas de Cochrane por el mismo autor afirman que: 'la inducción de la ovulación con aGnRH está asociada a una tasa de embarazo evolutivo más baja en comparación con la de hCG convencional'(34,41,42). Esta conclusión ha sido criticada como prematura y errónea en base a que: 1) las revisiones Cochrane no deberían realizarse durante la fase de investigación cuando se están desarrollando nuevos conceptos; y, 2) los autores omitieron el hecho de que la variable que afecta los resultados es el soporte de fase lútea en sí y no el uso del aGnRH para la maduración final de los ovocitos(40). Por lo tanto, si la activación con aGnRH (que es la estrategia preferida para reducir el riesgo de OHSS) está asociada con defectos en la fase lútea, tal vez no deberíamos realizar la transferencia en ese mismo ciclo sino que deberíamos segmentarlo. Es aquí donde el concepto de freeze-all comienza a ser atractivo.
3. El incremento del screening genético
El screening genético preimplantacional (PGS, por sus siglas en inglés) es cada vez más utilizado en reproducción asistida. El consorcio de diagnóstico genético preimplantacional (PGD) de la Sociedad Europea de Reproducción Humana y Embriología (ESHRE) ha recopilado datos de PGD de varias clínicas en todo el mundo y, de acuerdo con el último informe, el 52% de los ciclos PGD en 2010 se usó como PGS. Las indicaciones más comunes para PGS en FIV incluyen pacientes con edad materna avanzada (EMA), fallo de implantación recurrente (FI), aborto de repetición (AR) y, en menor medida, pacientes con infertilidad por factor masculino(43,44) y donantes de óvulos(45). Desde el punto de vista técnico, el screening genético ha evolucionado considerablemente desde los primeros años del FISH ( fluorescent in situ hibridization) hasta el uso de arrays de CGH y del next generation sequencing (NGS). Asimismo, hemos evolucionado con respecto al material biopsiado pasando de las biopsias del primer y segundo corpúsculo polar(46,47) a las biopsias de embriones en etapa de clivaje a las biopsias de blastocistos. Los primeros estudios clínicos con biopsias de embriones en etapa de clivaje mostraron una mayor implantación y tasas de embarazo en curso, así como menores tasas de aborto(48,49).
La idea inicial de hacer biopsias en día 3 tenía como fin dar al laboratorio suficiente tiempo para realizar los estudios genéticos y realizar una transferencia en el día 5 o 6 de desarrollo del mismo ciclo; sin embargo, surgieron varios inconvenientes, como el mosaicismo y el posible daño al embrión debido a la eliminación de un gran porcentaje de sus células(50). Afortunadamente, los avances en las formulaciones de los medios de cultivo permitieron el cultivo de embriones hasta etapas más tardías del desarrollo, dando entonces lugar a las primeras biopsias de trofoectodermo por el año 2005(51). Hoy en día, la biopsia de trofoectodermo es el método de elección no solo debido a una menor probabilidad de mosaicismo, sino también a un aumento en la cantidad de ADN disponible para realizar el screening y a un menor daño al embrión. La transferencia electiva de un único embrión (SET) euploide ha comprobado ser tan efectiva como la transferencia de dos embriones sin screening genético alguno, con la ventaja de reducir drásticamente el riesgo de embarazo múltiple(52). Sin embargo, aun no está claro si la transferencia de embriones euploides resulta mejor cuando se realiza en ciclos frescos o en ciclos congelados.
Desde el punto de vista práctico, debemos considerar que no todas las clínicas son capaces de obtener los resultados en las 24 horas post biopsia impidiendo así una transferencia en el mismo ciclo. Además, aquellos embriones que requieren una biopsia en día 6 pueden no ser óptimos para una nueva transferencia en fresco debido a una asincronía entre el embrión y el endometrio. Es en este contexto donde la idea del freeze-all adquiere un rol atractivo, ya que nos permite superar las limitaciones del tiempo permitiéndonos biopsiar los embriones en etapas posteriores de desarrollo, vitrificarlos inmediatamente después, enviar las células para ser evaluadas, esperar a que los resultados vuelvan y programar la transferencia de un embrión normal en un ciclo posterior. No hace falta decir que es obligatorio contar con un buen programa de vitrificación y que la logística del laboratorio de FIV se verá afectada no solo por el proceso de biopsia, sino por un aumento significativo en el porcentaje de pacientes que deberán ser vitrificados.
4. La preocupación sobre los resultados perinatales y obstétricos
Cada vez hay más evidencias que ponen de manifiesto las preocupaciones sobre los resultados perinatales y obstétricos tras los tratamientos de reproducción asistida, en particular, tras las transferencias en ciclos frescos.
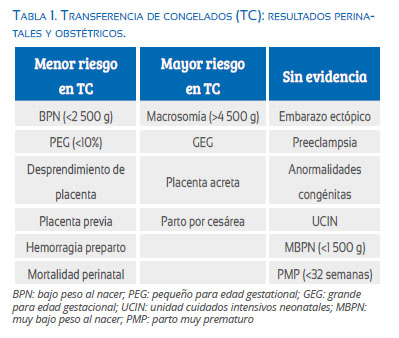
Diferentes estudios han demostrado que los niños nacidos después de las técnicas de reproducción asistida tienen peores resultados en términos de parto prematuro (PP), bajo peso al nacer (BPN), tamaño pequeño para la edad gestacional (PEG) y mortalidad perinatal (MP) en comparación con los recién nacidos de concepciones naturales(53-55). Por otro lado, entre los pacientes que se someten a FIV, los resultados entre las transferencias de embriones frescos y congelados (FET) en términos del resultado perinatal obstétrico aún no están claros(56-58). Los resultados de una revisión sistemática y metaanálisis basados en 11 estudios observacionales concluyeron que los embarazos únicos después de la transferencia de embriones descongelados resultaron en un menor riesgo de hemorragia antes del parto ( (RR = 0,67; IC95%: 0,55 a 0,81), de parto prematuro (RR = 0,84; IC95% 0,78 a 0,90), bebes PEG (RR = 0,45, IC95%: 0,30 a 0,66), BPN (RR = 0,69, IC95%: 0,62 a 0,76) y MP (RR = 0,68; IC95%: 0,48 a 0,96) que con embriones frescos(59). Un estudio escandinavo que incluyó tres países diferentes(57) corroboró algunos de estos hallazgos, pero también observó que los embriones congelados y descongelados tenían un mayor riesgo de nacimiento postérmino (OR 1,40, IC95%: 1,27 a 1,55), bebes grandes para la edad gestacional (GEG) (OR 1,45, IC95%: 1,27 a 1,64), macrosomía (OR 1,58, IC95%: 1,39 a 1,80) y MP (OR 1,49, IC95%: 1,07 a 2,07), lo que concuerda con otros estudios de poblaciones de gran tamaño(60,61). La evidencia más reciente de otro estudio observacional en Australia(62) confirmó que las transferencias de blastocistos desvitrificados producían tasas de recién nacidos vivos equivalentes a las de los blastocistos frescos, pero mejoraban significativamente los resultados neonatales en términos de edad gestacional, con un promedio de 0,3 semanas más y de peso al nacimiento con bebés nacidos, en promedio, 145 g más pesados en comparación con las transferencias en fresco. Sin embargo, podríamos preguntarnos cuál es la relevancia clínica de esto. Finalmente, este año, un informe de un grupo en Bruselas analizó 1 072 recién nacidos vivos de embarazos únicos y gemelares provenientes de embriones vitrificados en día 3 y 5, concluyendo que los parámetros de salud neonatal, incluida la prevalencia de malformaciones congénitas, eran similares o ligeramente mejores que después de la transferencia de embriones frescos(63). Se debe tener en cuenta que la mayoría de estos estudios son observacionales y que los embriones vitrificados son siempre la segunda opción para la transferencia. Podríamos suponer que la transferencia electiva de embriones congelados con embriones de primera opción podría tener mejores resultados, pero estos estudios aún no se han realizado. Por lo tanto, los datos publicados sugieren que aun no está claro si los resultados perinatales y obstétricos son mejores con los FET en comparación con los frescos (tabla 1)
Evidencia en favor del Freeze-all
No existe mucha evidencia que respalde la política del freeze-all. Un metaanálisis reciente(64) concluyó lo siguiente: 'el uso de transferencias de congelados, en comparación con la transferencia de embriones frescos, mejora significativamente las tasas de embarazo clínicas y en curso en pacientes sometidos a reproducción asistida'. Sin embargo, esta conclusión es altamente cuestionable debido a diferentes factores:
Primero, el metaanálisis incluye solo tres pequeños estudios. Un metaanálisis adecuado debe incluir al menos 3 o 4 estudios prospectivos aleatorizados con no menos de 1 000 participantes cada uno(65). Esto no se cumple en esta revisión, ya que el número total de pacientes incluidos fue de solo 633. Además, uno de los estudios(66), de hecho el más grande, se retractó a petición del Editor y del Comité de Publicaciones de la Sociedad Americana de Medicina Reproductiva-ASRM, debido a graves fallas metodológicas, disminuyendo aún más el número total para respaldar tal conclusión.
Segundo, los tres estudios son muy heterogéneos en cuanto a los tipos de pacientes incluidos (normo y altas respondedoras), así como algunos aspectos técnicos. Las normo y altas respondedores representan dos entidades diferentes en términos de enfoque clínico, manejo y resultados de FIV, por no hablar de cuestiones de seguridad, que son muy diferentes de un grupo de pacientes a otro. Además, la técnica de criopreservación y la etapa de desarrollo en la que se criopreservaron los embriones fueron diferentes. Ambos estudios por Shapiro y col(67,68) realizaron una congelación lenta en estadio de pronúcleos (2 PN), mientras que Aflatoonian y col vitrificaron en día dos de desarrollo.
Tercero, el estudio realizado por Shapiro y col(68) que incluía a los normo-respondedores no tenía suficiente poder estadístico (el tamaño muestral requerido fue de 411 pacientes y el estudio asignó al azar solo 67 pacientes para las transferencias en fresco y 70 para el grupo de congelados. Además, incluyó cointervenciones como el dual triggering para la maduración ovocitaria y condujo a tasas de embarazo del 84% en el grupo de congelados que eran muy superiores a las reportadas en los registros europeos o americanos.
Cuarto, ninguno de estos estudios pudo proporcionar datos sobre las tasas de recién nacidos vivos, la rentabilidad y la aceptabilidad del paciente.
En nuestra opinión, no hay duda de que las pacientes con riesgo de OHSS son buenas candidatas para este enfoque. Para este tipo de pacientes, la combinación del protocolo de estimulación correcto más la vitrificación de los ovocitos/embriones ha transformado lo que era una situación de alto riesgo en una simple anécdota(69,70). Según lo descrito por Devroey y col(71), la estrategia para obtener una clínica sin OHSS está estrechamente relacionada con el concepto de segmentación. Más específicamente esto consistiría en: segmento A, estimulación con antagonista de GnRH y desencadenante con agonista de GnRH; segmento B, criopreservación de ovocitos o embriones mediante vitrificación; y el segmento C, transferencia de embriones en un endometrio receptivo no estimulado en un ciclo natural o con preparación endometrial artificial. Con respecto al segmento B, una pregunta común es si deberíamos vitrificar ovocitos o embriones. De acuerdo con una comparación prospectiva de Herrero y col, ambos enfoques son seguros, ya que dan como resultado tasas similares de embarazo en curso y nacidos vivos después de tres transferencias(17). Por lo tanto, la decisión de hacer uno u otro probablemente dependerá de las preferencias del paciente individual, así como de los problemas éticos y culturales y no de los resultados clínicos. Un ensayo con respecto a las expectativas y percepciones de los pacientes con embriones congelados reveló que muchas parejas están preocupadas por la disposición de embriones congelados por razones éticas(72). Ante estas preocupaciones, al final, la vitrificación de ovocitos puede ser una alternativa más atractiva y realista para ciertos grupos de la sociedad(73). Con respecto al segmento C, hay poco consenso sobre el método más eficaz de preparación del endometrio antes de una FET. Una revisión sistemática y un metaanálisis publicados en 2013 compararon las tasas de embarazo clínicas y en curso, así como las tasas de recién nacido vivo en: a) ciclo natural con FET (NC-FET), b) NC-FET modificado con hCG, c) ciclo artificial con FET (AC-FET) y d) ACFET complementado con agonistas de GnRH. El estudio no reveló una ventaja significativa de un enfoque específico para preparar el endometrio en términos de tasas de embarazo clínico o tasas de recién nacidos vivos(74). Los resultados estuvieron en línea con una revisión sistemática previa publicada en 2008(75). De cualquier manera, e independientemente de las características particulares del segmento B y C, no hay duda de que el enfoque de segmentación para pacientes con OHSS funciona(69,70,76,77) y la política de freezeall no tiene controversia en esta situación.
Por otro lado, existe controversia cuando se trata de pacientes normo-respondedoras. Los beneficios de la política freeze-all en pacientes con riesgo de OHSS no se pueden extrapolar a normo-respondedoras. Un estudio reciente de nuestro grupo(78) no reveló diferencias en cuanto a las tasas de embarazos en curso y nacidos vivos entre las pacientes normo-respondedoras que se sometieron a transferencias de embriones frescos y diferidos. Este fue un estudio retrospectivo que incluyó a 882 pacientes de entre 20 y 44 años que experimentaron su primer o segundo ciclo de FIV/ICSI, en el que se obtuvo un rendimiento normal de ovocitos(4-20). Los pacientes fueron divididos en dos grupos: 364 (41,3%) tuvieron transferencia de embriones en fresco y 518 (58,7%) fueron sometidos a congelación, todo según las preferencias del médico. No se observaron diferencias entre ambos grupos de pacientes en términos de características demográficas y parámetros de estimulación ovárica. El análisis en bruto mostró que las tasas de embarazo en curso (36,2% vs. 33,8%, p = 0,51) y de nacidos vivos (33,2% vs. 32,9%, p = 0,94) para ciclos de congelación versus ciclos frescos fueron similares, respectivamente. Cuando se hicieron ajustes teniendo en cuenta la edad del paciente y otras variables que pudieran afectar los resultados, tampoco se vieron evidencias de ningún impacto de la congelación. Todos los pacientes en el estudio fueron considerados normo-respondedoras y, por lo tanto, representativos de una población rutinaria en nuestras clínicas.
Frente a estos resultados, un estudio diferente de Roque col(79) sí encontró mejores tasas de embarazo en curso utilizando la política de freezeall en pacientes con niveles de progesterona ≤1,5 ng/mL el día del desencadenamiento. Sin embargo, el tamaño muestral fue más bajo que nuestro estudio (un total de 530 pacientes: 351 en el grupo fresco y 179 en el grupo congelado). Además, el diseño retrospectivo de este estudio no nos permite diferenciar si se transfirieron en fresco solo las pacientes bajas respondedoras y si se congelaron las normo y altas respondedoras, lo que habría sesgado los resultados.
Debemos entender que una respuesta normal per se no es exclusiva de freeze-all. Sin embargo las pacientes normo-respondedoras pueden enfrentar situaciones en las que esta política es útil como aquellas que se someten a un screening genético, o que presentan altos niveles de progesterona, tienen el endometrio alterado y otros. Pero, fuera de una indicación, la pregunta sobre si esta política beneficia o no a las pacientes aún persiste y más estudios bien diseñados son necesarios para contestarla. Este es el caso de un estudio aleatorio controlado que se encuentra actualmente en curso en el Reino Unido (ensayo E-FREEZE). En este estudio multicéntrico, se aleatorizarán 1 086 mujeres (543 en cada brazo) durante un período de 2 años para mostrar (o no) una diferencia absoluta en el resultado primario de al menos un 9% (con 90% de potencia y 5% de significación estadística). El resultado primario se definió como: un único bebé vivo nacido a término con un peso adecuado para la gestación (AGA). Se ha elegido un resultado primario compuesto para reflejar la seguridad (único, término y AGA) y la efectividad (nacimiento vivo), ya que se entiende que el objetivo de la reproducción asistida moderna es tener un bebé sano y una madre sana (sin OHSS) (http://www.nets.nihr.ac.uk/projects/hta/1311582).
Costos
Independientemente de la evidencia a favor o en contra del freeze-all, un aspecto no menor a considerar es el costo adicional que esta política conlleva. Lamentablemente, no hay estudios que evalúen la relación costo-efectividad de las FET por elección cuando se comparan con transferencias en fresco. Es por ello que es necesario realizar estos estudios para determinar si un cambio en la política (realizar FET electivas en lugar de ET en fresco) es rentable teniendo en cuenta a) los costos de criopreservación, b) los costos asociados con la preparación endometrial, y c) el costo emocional asociado a la angustia que sufren los pacientes que no se someten a una transferencia en fresco.
ConclusIón: ¿congelar todo, congelar nada, o congelar poco?
Un cambio en la práctica habitual debe basarse en buena evidencia y en estudios suficientemente potentes. En la actualidad, los beneficios de la política freeze-all se basan principalmente en los resultados obtenidos en pacientes con alta respuesta y no deben ser extrapolados a la población general de nuestras clínicas. Un artículo interesante publicado el año pasado realizó un análisis FODA (fortalezas, oportunidades, debilidades y amenazas) de la política freeze-all actualizándonos sobre los diferentes aspectos de esta estrategia. Los autores concluyeron que, aunque la principal ventaja o fortaleza de esta estrategia es la posibilidad de eliminar el OHSS, otros factores también respaldan este enfoque como, por ejemplo, una mejor programación de los ciclos y una mejor organización de las clínicas. También se presentaron las amenazas que incluyeron los costos y resultados (bebés grandes para la edad gestacional)(80).
Estamos entrando en la era de los tratamientos individualizados en reproducción asistida, no solo desde el punto de vista clínico, sino también desde las tecnologías y estrategias de laboratorio que ofrecemos a nuestros pacientes. La política del freeze-all no debería estar exenta de esta individualización siempre que esté justificada.
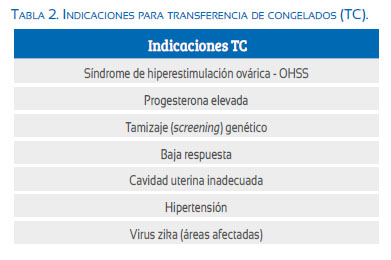
Sin embargo debemos ser claros con las indicaciones (tabla 2). En nuestro centro, las indicaciones para freeze-all no solo están restringidas a las pacientes con riesgo de OHSS, sino también para cualquier tipo de paciente con una indicación clara: pacientes que buscan un examen genético; pacientes con un perfil endocrino y cardiovascular alterado en el momento de la transferencia (progesterona elevada, hipertensión, entre otros); pacientes con cavidad uterina inadecuada para la transferencia de embriones (es decir, fluido en la cavidad), y pacientes de baja respuesta que buscan una estrategia para acumular ovocitos o embriones. Además, en algunas áreas del mundo, especialmente en América Latina, la situación endémica del virus zika está causando que los pacientes pospongan o interrumpan sus tratamientos de FIV para evitar la infección durante el embarazo. Sin embargo, la postergación no es una opción para algunos de nuestros pacientes, ya que ya están luchando con su reloj biológico; por lo tanto, iniciar el tratamiento y congelar todos los embriones representa una solución.
Se debe enfatizar la importancia de un buen laboratorio. La implementación de la política virus zika no funcionará a menos que se garanticen altas tasas de supervivencia tras la vitrificación y desvitrificación de ovocitos y embriones. Este aspecto no es menor y es la esencia para que esta política funcione. Cualquier embriólogo estaría de acuerdo en que la vitrificación es un proceso laborioso que requiere concentración y que está inevitablemente afectado por una larga curva de aprendizaje. En este contexto, tal vez, la introducción de sistemas automáticos pueda ayudar en la estandarización de los resultados y en la implementación de las políticas virus Zica. Finalmente, debemos considerar lo siguiente: Los pacientes ¿aceptarían este cambio? ¿Estamos listos para manejar sus expectativas? Un estudio que evaluó las actitudes de los pacientes hacia la transferencia electiva de embriones únicos (eSET) mostró claramente que aunque los pacientes están lo suficientemente preocupados por los resultados adversos de los embarazos múltiples, se vuelven más permisivos a la transferencia de varios embriones después de haber enfrentado múltiples fallos de FIV y una gran costo económico(72). Entonces la pregunta es: ¿por qué el comportamiento de los pacientes frente a la congelación electiva sería diferente al de la transferencia electiva de embriones individuales?
Todavía nos quedan muchas preguntas por contestar y aún son necesarios más estudios bien diseñados para confirmar si los beneficios clínicos de esta política justifican un cambio en la práctica actual. Por lo tanto, creemos que la política de congelación solo debe implementarse cuando exista una indicación real para ella.
Financiamiento: Autofinanciado
Citar como: Basile N. Freeze-all en reproducción asistida. Rev Peru Ginecol Obstet. 2018;64(2):213-223. DOI: https://doi.org/10.31403/rpgo.v64i2081
Referencias Bibliográficas
1. Lode H, Torres A, Cockle A. What drives our choices? Evidence, guidelines or habit? Int J Antimicrob Agents. 2007;29 Suppl 1:S17-22. [ Links ]
2. Cobo A, de los Santos MJ, Castello D, Gamiz P, Campos P, Remohi J. Outcomes of vitrified early cleavage-stage and blastocyst-stage embryos in a cryopreservation program: evaluation of 3,150 warming cycles. Fertil Steril. 2012;98:1138,46.e1. doi: 10.1016/j.fertnstert.2012.07.1107. [ Links ]
3. Herrero L, Martinez M, Garcia-Velasco JA. Current status of human oocyte and embryo cryopreservation. Curr Opin Obstet Gynecol. 2011;23:245-50. doi: 10.1097/GCO.0b013e32834874e2. [ Links ]
4. Tucker MJ, Wright G, Morton PC, Massey JB. Birth after cryopreservation of immature oocytes with subsequent in vitro maturation. Fertil Steril. 1998;70:578-9. [ Links ]
5. Borini A, Bonu MA, Coticchio G, Bianchi V, Cattoli M, Flamigni C. Pregnancies and births after oocyte cryopreservation. Fertil Steril. 2004;82:601-5. [ Links ]
6. De Santis L, Cino I, Rabellotti E, Papaleo E, Calzi F, Fusi FM, et al. Oocyte cryopreservation: clinical outcome of slow-cooling protocols differing in sucrose concentration. Reprod Biomed Online. 2007;14:57-63. [ Links ]
7. Porcu E, Fabbri R, Seracchioli R, Ciotti PM, Magrini O, Flamigni C. Birth of a healthy female after intracytoplasmic sperm injection of cryopreserved human oocytes. Fertil Steril. 1997;68:724-6. [ Links ]
8. Chia CM, Chan WB, Quah E, Cheng LC. Triploid pregnancy after ICSI of frozen testicular spermatozoa into cryopreserved human oocytes: case report. Hum Reprod. 2000;15:1962-4. [ Links ]
9. Miller KA, Elkind-Hirsch K, Levy B, Graubert MD, Ross SJ, Scott RT Jr. Pregnancy after cryopreservation of donor oocytes and preimplantation genetic diagnosis of embryos in a patient with ovarian failure. Fertil Steril. 2004;82:211-4. [ Links ]
10. Greco E, Iacobelli M, Rienzi L, Fabris GF, Tesorio N, Tesarik J. Birth of a healthy boy after fertilization of cryopreserved oocytes with cryopreserved testicular spermatozoa from a man with nonmosaic Klinefelter syndrome. Fertil Steril. 2008;89:991. [ Links ]e5,991.e7.
11. Gook DA, Edgar DH. Human oocyte cryopreservation. Hum Reprod Update. 2007;13:591-605. [ Links ]
12. Rezazadeh Valojerdi M, Eftekhari-Yazdi P, Karimian L, Hassani F, Movaghar B. Vitrification versus slow freezing gives excellent survival, post warming embryo morphology and pregnancy outcomes for human cleaved embryos. J Assist Reprod Genet. 2009;26:347-54. doi: 10.1007/s10815-009-9318-6. [ Links ]
13. Stehlik E, Stehlik J, Katayama KP, Kuwayama M, Jambor V, Brohammer R, et al. Vitrification demonstrates significant improvement versus slow freezing of human blastocysts. Reprod Biomed Online. 2005;11:53-7. [ Links ]
14. Cobo A, Perez S, De los Santos MJ, Zulategui J, Domingo J, Remohi J. Effect of different cryopreservation protocols on the metaphase II spindle in human oocytes. Reprod Biomed Online. 2008;17:350-9. [ Links ]
15. Cobo A, Garrido N, Crespo J, Jose R, Pellicer A. Accumulation of oocytes: a new strategy for managing low-responder patients. Reprod Biomed Online. 2012;24:42432. doi: 10.1016/j.rbmo.2011.12.012. [ Links ]
16. Milan M, Cobo AC, Rodrigo L, Mateu E, Mercader A, Buendia P, et al. Redefining advanced maternal age as an indication for preimplantation genetic screening. Reprod Biomed Online. 2010;21:649-57. doi: 10.1016/j.rbmo.2010.06.020. [ Links ]
17. Herrero L, Pareja S, Aragones M, Cobo A, Bronet F, Garcia-Velasco JA. Oocyte versus embryo vitrification for delayed embryo transfer: an observational study. Reprod Biomed Online. 2014;29:567-72. doi: 10.1016/j.rbmo.2014.07.016. [ Links ]
18. Herrero L, Pareja S, Losada C, Cobo AC, Pellicer A, Garcia-Velasco JA. Avoiding the use of human chorionic gonadotropin combined with oocyte vitrification and GnRH agonist triggering versus coasting: a new strategy to avoid ovarian hyperstimulation syndrome. Fertil Steril. 2011;95:1137-40. doi: 10.1016/j.fertnstert.2010.09.040. [ Links ]
19. Cobo A, Kuwayama M, Perez S, Ruiz A, Pellicer A, Remohi J. Comparison of concomitant outcome achieved with fresh and cryopreserved donor oocytes vitrified by the Cryotop method. Fertil Steril. 2008;89:1657-64. [ Links ]
20. Li Z, Wang YA, Ledger W, Edgar DH, Sullivan EA. Clinical outcomes following cryopreservation of blastocysts by vitrification or slow freezing: a population-based cohort study. Hum Reprod. 2014;29:2794-801. doi: 10.1093/humrep/deu246 [ Links ]
21. Shapiro BS, Daneshmand ST, Garner FC, Aguirre M, Hudson C, Thomas S. High ongoing pregnancy rates after deferred transfer through bipronuclear oocyte cryopreservation and post-thaw extended culture. Fertil Steril. 2009;92:1594-9. [ Links ]
22. Practice Committee of American Society for Reproductive Medicine. Ovarian hyperstimulation syndrome. Fertil Steril. 2008;90:S188-93. [ Links ]
23. Nastri CO, Ferriani RA, Rocha IA, Martins WP. Ovarian hyperstimulation syndrome: pathophysiology and prevention. J Assist Reprod Genet. 2010;27:121-8. doi: 10.1007/s10815-010-9387-6. [ Links ]
24. Youssef MA, van Wely M, Hassan MA, Al-Inany HG, Mochtar M, Khattab S, et al. Can dopamine agonists reduce the incidence and severity of OHSS in IVF/ICSI treatment cycles? A systematic review and meta-analysis. Hum Reprod Update. 2010;16:459-66. doi: 10.1093/humupd/dmq006. [ Links ]
25. Humaidan P, Quartarolo J, Papanikolaou EG. Preventing ovarian hyperstimulation syndrome: guidance for the clinician. Fertil Steril. 2010;94:389-400. doi: 10.1016/j.fertnstert.2010.03.028. [ Links ]
26. Gomez R, Soares SR, Busso C, Garcia-Velasco JA, Simon C, Pellicer A. Physiology and pathology of ovarian hyperstimulation syndrome. Semin Reprod Med. 2010;28:448-57. doi: 10.1055/s-0030-1265670. [ Links ]
27. Olivennes F, Frydman R. Friendly IVF: the way of the future? Hum Reprod. 1998;13:1121-4. [ Links ]
28. Huirne JA, Homburg R, Lambalk CB. Are GnRH antagonists comparable to agonists for use in IVF? Hum Reprod. 2007;22:2805-13. [ Links ]
29. Borm G, Mannaerts B. Treatment with the gonadotrophin-releasing hormone antagonist ganirelix in women undergoing ovarian stimulation with recombinant follicle stimulating hormone is effective, safe and convenient: results of a controlled, randomized, multicentre trial. The European Orgalutran Study Group. Hum Reprod. 2000;15:1490-8. [ Links ]
30. Fluker M, Grifo J, Leader A, Levy M, Meldrum D, Muasher SJ, et al. Efficacy and safety of ganirelix acetate versus leuprolide acetate in women undergoing controlled ovarian hyperstimulation. Fertil Steril. 2001;75:38-45. [ Links ]
31. Kolibianakis EM, Schultze-Mosgau A, Schroer A, van Steirteghem A, Devroey P, Diedrich K, et al. A lower ongoing pregnancy rate can be expected when GnRH agonist is used for triggering final oocyte maturation instead of HCG in patients undergoing IVF with GnRH antagonists. Hum Reprod. 2005;20:2887-92. [ Links ]
32. Kolibianakis EM, Tarlatzis B, Devroey P. GnRH antagonists in IVF. Reprod Biomed Online. 2005;10:705-12. [ Links ]
33. Griesinger G, Diedrich K, Devroey P, Kolibianakis EM. GnRH agonist for triggering final oocyte maturation in the GnRH antagonist ovarian hyperstimulation protocol: a systematic review and meta-analysis. Hum Reprod Update. 2006;12:159-68. [ Links ]
34. Youssef MA, Van der Veen F, Al-Inany HG, Mochtar MH, Griesinger G, Nagi Mohesen M, et al. Gonadotropin-releasing hormone agonist versus HCG for oocyte triggering in antagonist-assisted reproductive technology. Cochrane Database Syst Rev. 2014;10:CD008046. doi: 10.1002/14651858.CD008046.pub3. [ Links ]
35. Fatemi HM, Popovic-Todorovic B, Humaidan P, Kol S, Banker M, Devroey P, et al. Severe ovarian hyperstimulation syndrome after gonadotropin-releasing hormone (GnRH) agonist trigger and "freeze-all" approach in GnRH antagonist protocol. Fertil Steril. 2014;101:100811. doi: 10.1016/j.fertnstert.2014.01.019. [ Links ]
36. Gurbuz AS, Gode F, Ozcimen N, Isik AZ. Gonadotrophin-releasing hormone agonist trigger and freeze-all strategy does not prevent severe ovarian hyperstimulation syndrome: a report of three cases. Reprod Biomed Online. 2014;29:541-4. doi: 10.1016/j.rbmo.2014.07.022. [ Links ]
37. Santos-Ribeiro S, Polyzos NP, Stouffs K, De Vos M, Seneca S, Tournaye H, et al. Ovarian hyperstimulation syndrome after gonadotropin-releasing hormone agonist triggering and "freeze-all": in-depth analysis of genetic predisposition. J Assist Reprod Genet. 2015;32:1063-8. doi: 10.1007/s10815-015-0498-y. [ Links ]
38. Segal S, Casper RF. Progesterone supplementation increases luteal phase endometrial thickness and oestradiol levels in in-vitro fertilization. Hum Reprod. 1992;7:1210-3. [ Links ]
39. Casper RF. Introduction: Gonadotropin-releasing hormone agonist triggering of final follicular maturation for in vitro fertilization. Fertil Steril. 2015;103:865-6. doi: 10.1016/j.fertnstert.2015.01.012. [ Links ]
40. Kol S, Humaidan P, Alsbjerg B, Engmann L, Benadiva C, Garcia-Velasco JA, et al. The updated Cochrane review 2014 on GnRH agonist trigger: repeating the same errors. Reprod Biomed Online. 2015;30:563-5. doi: 10.1016/j.rbmo.2015.02.009. [ Links ]
41. Hamamah S, Matha V, Berthenet C, Anahory T, Loup V, Dechaud H, et al. Comparative protein expression profiling in human cumulus cells in relation to oocyte fertilization and ovarian stimulation protocol. Reprod Biomed Online. 2006;13:807-14. [ Links ]
42. Huirne JA, Lambalk CB, van Loenen AC, Schats R, Hompes PG, Fauser BC, et al. Contemporary pharmacological manipulation in assisted reproduction. Drugs. 2004;64:297-322. [ Links ]
43. Silber S, Escudero T, Lenahan K, Abdelhadi I, Kilani Z, Munne S. Chromosomal abnormalities in embryos derived from testicular sperm extraction. Fertil Steril. 2003;79:30-8. [ Links ]
44. Platteau P, Staessen C, Michiels A, Tournaye H, Van Steirteghem A, Liebaers I, et al. Comparison of the aneuploidy frequency in embryos derived from testicular sperm extraction in obstructive and non-obstructive azoospermic men. Hum Reprod. 2004;19:1570-4. [ Links ]
45. Munne S, Fischer J, Warner A, Chen S, Zouves C, Cohen J, et al. Preimplantation genetic diagnosis significantly reduces pregnancy loss in infertile couples: a multicenter study. Fertil Steril. 2006;85:326-32. [ Links ]
46. Munne S, Dailey T, Sultan KM, Grifo J, Cohen J. The use of first polar bodies for preimplantation diagnosis of aneuploidy. Hum Reprod. 1995;10:1014-20. [ Links ]
47. Verlinsky Y, Kuliev A. Preimplantation polar body diagnosis. Biochem Mol Med. 1996;58:13-7. [ Links ]
48. Munne S, Chen S, Fischer J, Colls P, Zheng X, Stevens J, et al. Preimplantation genetic diagnosis reduces pregnancy loss in women aged 35 years and older with a history of recurrent miscarriages. Fertil Steril. 2005;84:331-5. [ Links ]
49. Gianaroli L, Magli MC, Ferraretti AP, Munne S. Preimplantation diagnosis for aneuploidies in patients undergoing in vitro fertilization with a poor prognosis: identification of the categories for which it should be proposed. Fertil Steril. 1999;72:837-44. [ Links ]
50. Cohen J, Wells D, Munne S. Removal of 2 cells from cleavage stage embryos is likely to reduce the efficacy of chromosomal tests that are used to enhance implantation rates. Fertil Steril. 2007;87:496-503. [ Links ]
51. McArthur SJ, Leigh D, Marshall JT, de Boer KA, Jansen RP. Pregnancies and live births after trophectoderm biopsy and preimplantation genetic testing of human blastocysts. Fertil Steril. 2005;84:1628-36. [ Links ]
52. Forman EJ, Hong KH, Ferry KM, Tao X, Taylor D, Levy B, et al. In vitro fertilization with single euploid blastocyst transfer: a randomized controlled trial. Fertil Steril. 2013;100:100,7.e1. doi: 10.1016/j.fertnstert.2013.02.056. [ Links ]
53. Helmerhorst FM, Perquin DA, Donker D, Keirse MJ. Perinatal outcome of singletons and twins after assisted conception: a systematic review of controlled studies. BMJ. 2004;328:261. [ Links ]
54. Henningsen AK, Pinborg A, Lidegaard O, Vestergaard C, Forman JL, Andersen AN. Perinatal outcome of singleton siblings born after assisted reproductive technology and spontaneous conception: Danish national sibling-cohort study. Fertil Steril. 2011;95:959-63. doi: 10.1016/j.fertnstert.2010.07.1075. [ Links ]
55. Bloise E, Feuer SK, Rinaudo PF. Comparative intrauterine development and placental function of ART concepti: implications for human reproductive medicine and animal breeding. Hum Reprod Update. 2014;20:82239. doi: 10.1093/humupd/dmu032. [ Links ]
56. Pelkonen S, Koivunen R, Gissler M, Nuojua-Huttunen S, Suikkari AM, Hyden-Granskog C, et al. Perinatal outcome of children born after frozen and fresh embryo transfer: the Finnish cohort study 1995-2006. Hum Reprod. 2010;25:914-23. doi: 10.1093/humrep/dep477. [ Links ]
57. Wennerholm UB, Henningsen AK, Romundstad LB, Bergh C, Pinborg A, Skjaerven R, et al. Perinatal outcomes of children born after frozen-thawed embryo transfer: a Nordic cohort study from the CoNARTaS group. Hum Reprod. 2013;28:2545-53. doi: 10.1093/humrep/det272. [ Links ]
58. Ishihara O, Araki R, Kuwahara A, Itakura A, Saito H, Adamson GD. Impact of frozen-thawed single-blastocyst transfer on maternal and neonatal outcome: an analysis of 277,042 single-embryo transfer cycles from 2008 to 2010 in Japan. Fertil Steril. 2014;101:128-33. doi: 10.1016/j.fertnstert.2013.09.025. [ Links ]
59. Maheshwari A, Pandey S, Shetty A, Hamilton M, Bhattacharya S. Obstetric and perinatal outcomes in singleton pregnancies resulting from the transfer of frozen thawed versus fresh embryos generated through in vitro fertilization treatment: a systematic review and meta-analysis. Fertil Steril. 2012;98:368,77.e1-9. doi: 10.1016/j.fertnstert.2012.05.019. [ Links ]
60. Pinborg A, Loft A, Aaris Henningsen AK, Rasmussen S, Andersen AN. Infant outcome of 957 singletons born after frozen embryo replacement: the Danish National Cohort Study 1995-2006. Fertil Steril. 2010;94:1320-7. doi: 10.1016/j.fertnstert.2009.05.091. [ Links ]
61. Sazonova A, Kallen K, Thurin-Kjellberg A, Wennerholm UB, Bergh C. Obstetric outcome in singletons after in vitro fertilization with cryopreserved/thawed embryos. Hum Reprod. 2012 May;27(5):1343-50. doi: 10.1093/humrep/des036. [ Links ]
62. Roy TK, Bradley CK, Bowman MC, McArthur SJ. Single-embryo transfer of vitrified-warmed blastocysts yields equivalent live-birth rates and improved neonatal outcomes compared with fresh transfers. Fertil Steril. 2014;101:1294-301. doi: 10.1016/j.fertnstert.2014.01.046 [ Links ]
63. Belva F, Bonduelle M, Roelants M, Verheyen G, Van Landuyt L. Neonatal health including congenital malformation risk of 1072 children born after vitrified embryo transfer. Hum Reprod. 2016;31:1610-20. doi: 10.1093/humrep/dew103. [ Links ]
64. Roque M, Lattes K, Serra S, Sola I, Geber S, Carreras R, et al. Fresh embryo transfer versus frozen embryo transfer in in vitro fertilization cycles: a systematic review and meta-analysis. Fertil Steril. 2013;99:156-62. doi: 10.1016/j.fertnstert.2012.09.003. [ Links ]
65. Humaidan P, Polyzos NP. (Meta)analyze this: Systematic reviews might lose credibility. Nat Med. 2012;18:1321. doi: 10.1038/nm0912-1321. [ Links ]
66. Aflatoonian A, Oskouian H, Ahmadi S, Oskouian L. Can fresh embryo transfers be replaced by cryopreserved-thawed embryo transfers in assisted reproductive cycles? A randomized controlled trial. J Assist Reprod Genet. 2010;27:357-63. doi: 10.1007/s10815-010-9412-9. [ Links ]
67. Shapiro BS, Daneshmand ST, Garner FC, Aguirre M, Hudson C, Thomas S. Evidence of impaired endometrial receptivity after ovarian stimulation for in vitro fertilization: a prospective randomized trial comparing fresh and frozen-thawed embryo transfers in high responders. Fertil Steril. 2011;96:516-8. doi: 10.1016/j. fertnstert.2011.05.050. [ Links ]
68. Shapiro BS, Daneshmand ST, Garner FC, Aguirre M, Hudson C, Thomas S. Evidence of impaired endometrial receptivity after ovarian stimulation for in vitro fertilization: a prospective randomized trial comparing fresh and frozen-thawed embryo transfer in normal responders. Fertil Steril. 2011;96:344-8. doi: 10.1016/j. fertnstert.2011.02.059 [ Links ]
69. Griesinger G, Kolibianakis EM, Papanikolaou EG, Diedrich K, Van Steirteghem A, Devroey P, et al. Triggering of final oocyte maturation with gonadotropin-releasing hormone agonist or human chorionic gonadotropin. Live birth after frozen-thawed embryo replacement cycles. Fertil Steril. 2007;88:616-21. [ Links ]
70. Griesinger G, Schultz L, Bauer T, Broessner A, Frambach T, Kissler S. Ovarian hyperstimulation syndrome prevention by gonadotropin-releasing hormone agonist triggering of final oocyte maturation in a gonadotropin-releasing hormone antagonist protocol in combination with a "freeze-all" strategy: a prospective multicentric study. Fertil Steril. 2011;95:2029,33, 2033. e1. doi: 10.1016/j.fertnstert.2011.01.163. [ Links ]
71. Devroey P, Polyzos NP, Blockeel C. An OHSS-Free Clinic by segmentation of IVF treatment. Hum Reprod. 2011;26:2593-7. doi: 10.1093/humrep/der251. [ Links ]
72. Nachtigall RD, Mac Dougall K, Lee M, Harrington J, Becker G. What do patients want? Expectations and perceptions of IVF clinic information and support regarding frozen embryo disposition. Fertil Steril. 2010;94:206972. doi: 10.1016/j.fertnstert.2010.02.023. [ Links ]
73. Heng BC. Oocyte cryopreservation as alternative to embryo cryopreservation some pertinent ethical concerns. Reprod Biomed Online. 2007;14:402-3. [ Links ]
74. Groenewoud ER, Cantineau AE, Kollen BJ, Macklon NS, Cohlen BJ. What is the optimal means of preparing the endometrium in frozen-thawed embryo transfer cycles? A systematic review and meta-analysis. Hum Reprod Update. 2013;19:458-70. doi: 10.1093/humupd/dmt030. [ Links ]
75. Ghobara T, Vandekerckhove P. Cycle regimens for frozen-thawed embryo transfer. Cochrane Database Syst Rev. 2008;(1):CD003414. doi:CD003414. [ Links ]
76. Atkinson P, Koch J, Ledger WL. GnRH agonist trigger and a freeze-all strategy to prevent ovarian hyperstimulation syndrome: a retrospective study of OHSS risk and pregnancy rates. Aust N Z J Obstet Gynaecol. 2014;54:581-5. doi: 10.1111/ajo.12277. [ Links ]
77. Borges E Jr, Braga DP, Setti AS, Vingris LS, Figueira RC, Iaconelli A Jr. Strategies for the management of OHSS: Results from freezing-all cycles. JBRA Assist Reprod. 2016;20:8-12. doi: 10.5935/1518-0557.20160003. [ Links ]
78. Celada P, Bosch E, De los Santos MJ, Giles J, Pellicer A. Elective frozen embryo transfer does not improve reproductive outcome in normo-responder patients. Hum Reprod. 2015; 30 (Suppl 1): i112 [ Links ]
79. Roque M, Valle M, Guimaraes F, Sampaio M, Geber S. Freeze-all policy: fresh vs. frozen-thawed embryo transfer. Fertil Steril. 2015;103:1190-3. doi: 10.1016/j. fertnstert.2015.01.045. [ Links ]
80. Blockeel C, Drakopoulos P, Santos-Ribeiro S, Polyzos NP, Tournaye H. A fresh look at the freeze-all protocol: a SWOT analysis. Hum Reprod 2016;31:491-7. doi: 10.1093/humrep/dev339. [ Links ]
Correspondencia:
Natalia Basile, PhD
Recibido: 12 abril 2018
Aceptado: 16 abril 2018