Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Ginecología y Obstetricia
versión On-line ISSN 2304-5132
Rev. peru. ginecol. obstet. vol.64 no.2 Lima abr./jun. 2018
http://dx.doi.org/https://doi.org/10.31403/rpgo.v64i2082
SIMPOSIO biología en reproducción asistida
Vitrificación de ovocitos y pacientes con cáncer
Oocyte vitrification in female cancer patients
Gabriel Dalvit1
1. Profesor de la Universidad de Buenos Aires; Director Científico de Cryotech Argentina
RESUMEN
El incremento del uso de la criopreservación de ovocitos empieza después de la introducción de la técnica de vitrificación y el nacimiento del primer bebe logrado con este método en 1999. Usando esta poderosa herramienta, los científicos han ayudado a las mujeres a criopreservar sus gametos ya sea a través de la vitrificación de ovocitos o de corteza ovárica. Durante una década, fuertes avances en la tecnología de la vitrificación han mejorado la eficiencia clínica y sus resultados. Con estos avances se ha reducido la dependencia de la habilidad del operador y se ha elevado la tasa de éxito a niveles altos y homogéneos. Como resultado, la vitrificación se ha vuelto confiable y la tendencia actual está mostrando un incremento definitivo en su uso en comparación de la congelación lenta. El nuevo y avanzado método conocido como 'Método Cryotech' asegura que se logre 100% de viabilidad en ovocitos y embriones en cualquier estadio. La técnica se establece para asegurar y definir cambios en la técnica de criopreservación en el mundo entero. Debido al gran efecto emocional que causa el diagnóstico de cáncer y la necesidad de su inmediato tratamiento, los potenciales efectos gonadotóxicos del cáncer o de este tratamiento no son normalmente discutidos a la hora del diagnóstico. La preservación de la fertilidad es un reciente esfuerzo y muchos pacientes con cáncer y trabajadores de salud no están familiarizados con el desarrollo rápido que ha tenido tanto en la parte de investigación como en la implementación en la práctica clínica. Se han establecido algunas técnicas de preservación de fertilidad como la vitrificación de ovocitos y otros como vitrificación de corteza ovárica que ha sido validada en los últimos 5 años con niños saludables nacidos sin tratamiento de fertilidad, incluso cuando aún siguen considerándose casos experimentales. Combinando todos los conocimientos que ahora tenemos sobre vitrificación de ovocitos y corteza ovárica con la estimulación hormonal del ovario incluso en la fase lútea y la efectividad del proceso de la reproducción asistida, podemos afirmar que es posible preservar vidas reproductivas de pacientes con cáncer incluso en pacientes pediátricos.
Palabras clave. Ovocitos, vitrificación; Cáncer en la mujer; Preservación de la fertilidad.
ABSTRACT
The increase in the use of oocyte cryopreservation occurred after the introduction of the vitrification technique and the birth of the first baby with this method in 1999. Using this powerful tool, scientists have helped women to cryopreserve their gametes by oocyte or ovarian cortex vitrification. For a decade, important advances in vitrification technology have improved clinical efficiency and results. This progress has reduced the dependence on the operator skill and has increased the success rate to high and homogeneous levels. As a result, vitrification has become reliable and the current trend shows a definite increase in its use compared to slow freezing. The new and advanced method known as âoeCryotech methodâ ensures achievement of 100% viability in oocytes and embryos at any stage. The technique is set to make definite changes in the procedure of cryopreservation in the whole world. Due to the great emotional effect caused by cancer diagnosis and the need for immediate treatment, the potential gonadotoxic effects of cancer or its treatment are not normally discussed at the time of diagnosis. Fertility preservation is a recent effort, and many cancer patients and health workers are not familiar with its rapid development on research and on implementation in clinical practice. Some techniques of fertility preservation as oocyte or ovarian cortex vitrification have been validated in the past 5 years with healthy children born without fertility treatment, even when these continue to be experimental cases. Combining all the knowledge we now have on oocytes and ovarian cortex vitrification with hormonal stimulation of the ovary even in the luteal phase and the effectiveness of the process of assisted reproduction, we can say that it is possible to preserve reproductive lives of patients with cancer even in pediatric patients.
Keywords: Oocytes, vitrification, criopreservation; Cancer in women; Fertility preservation.
Introducción
El incremento del uso de la criopreservación de ovocitos empieza después de la introducción de la vitrificación y el nacimiento del primer bebe logrado con este método en 1999. El método de vitrificación de ovocitos parece volverse más empleado debido a que en el 2003 los comités de prácticas clínicas de la Sociedad Americana de Medicina Reproductiva (ASRM) y la Sociedad para la Tecnología de Reproducción Asistida removieron su clasificación como un procedimiento experimental(1).
Si miramos desde una perspectiva de tecnología de reproducción asistida, es fácil de ver que el primer gran paso fue la fertilización in vitro, el segundo gran paso fue la inyección Intracitoplasmática del espermatozoide (ICSI), y sin duda el tercero es la vitrificación de ovocitos y embriones, obteniendo tasas de sobrevivencia hasta del 100%.
Al usar esta poderosa herramienta en las últimas décadas, los científicos han ayudado a las mujeres a criopreservar sus gametos a través de vitrificación de ovocitos e incluso de corteza ovárica. La ventaja de esta técnica ofrece una esperanza a las pacientes con cáncer que se ven enfrentadas con el riesgo de la toxicidad iatrogénica a nivel de las gónadas (ovarios) que puede producir el tratamiento contra el cáncer (por ejemplo, la quimioterapia) o a la mujer con predisposición a insuficiencia ovárica primaria.
Este nuevo procedimiento de vitrificación permite a la mujer posponer la maternidad, previniendo la disminución de fertilidad por factores de edad. Hoy en día muchas mujeres sanas están posponiendo el embarazo a una mayor edad y el uso de las técnicas de criopreservación están aumentando para salvaguardar la oportunidad de que puedan tener éxito reproductivo en un futuro(2).
En las técnicas de reproducción asistida es innegable que la criopreservación de embriones y ovocitos humanos ha sido significativamente mejorada por la técnica de vitrificación. El sistema de congelación lenta resulta anticuado debido al hecho que tienen enormes desventajas cuando es comparada con la vitrificación; por ejemplo, el requerimiento de una costosa crio máquina programada que usualmente toma horas para terminar un procedimiento y un costo muy elevado de mantenimiento. Por otro lado, la vitrificación tiene más flexibilidad, puede ser ejecutada en cualquier estadio de desarrollo embrionario, con un pequeño o casi nulo miedo de malos resultados. Esta técnica tiene resultados consistentes y un aproximado de 100% de tasa de sobrevivencia post descongelación. Además, en el sistema de congelación lenta es muy difícil eliminar el daño celular debido a la formación de cristales de hielo, y la viabilidad post descongelación ha sido reportada de estar alrededor de 40 a 60%. Los estudios han documentado la superioridad de la vitrificación sobre la congelación lenta en la consistencia de la expresión genética en ovocitos y embriones de humanos y animales logrados por vitrificación(3-6).
Protocolos de vitrificación
Los protocolos de vitrificación varían ampliamente y su práctica ha sido dependiente de las habilidades del operador, contando con una amplia diferencia en las tasas de éxito entre embriólogos. Ningún protocolo cumple para todas los tipos de especies y la vulnerabilidad de daño criogénico diferente para cada especie sigue siendo un mayor obstáculo. Como resultado, las combinaciones para la fórmula del proceso de vitrificación proliferan ampliamente, algunos basados en investigaciones minuciosas, otros basados en fórmulas caseras. Además, la cantidad de agentes crioprotectores (CPA) para congelar y descongelar tienen ciertos límites de tolerancia y diferentes protocolos requieren ser ejecutados en segundos. En esta fase es muy necesaria una minuciosa atención en los detalles y manos expertas son indispensables; un excelente protocolo puede resultar comprometido en las manos de personal no capacitado. Desde que más clínicas parecen tener pequeñas cantidades de pacientes, la experiencia y pericia para el empleo de estas técnicas tiende a crecer lenta y erráticamente(7). Estas dificultades se han superado con la nueva técnica de vitrificación.
A pesar de estas experiencias -los resultados de vitrificación en términos de sobrevivencia, embarazo y tasa de implantación han sido destacados-, más investigaciones y avances fueron solicitados y logrados rápidamente con tecnología para superar los obstáculos que los embriólogos fueron enfrentando.
Durante una década se han dado severos avances en la tecnología de vitrificación, mejorando la eficiencia clínica y la tasa de éxito; se ha reducido la dependencia de las habilidades del operador y se ha elevado la tasa de éxito a un mayor nivel con resultados más homogéneos. Como resultado, la vitrificación se ha vuelto más confiable y la tendencia muestra un incremento definitivo sobre la congelación lenta.
Incluso para un embriólogo con experiencia, aprender la técnica desde un libro de protocolos no es fácil. Para lograr resultados excelentes, el laboratorio necesita instrucciones sobre puntos críticos durante la vitrificación y entender qué está haciendo en cada paso.
Hay muchos sistemas de vitrificación disponibles, pero solo el método del Dr. Kuwuyama conquistó el mundo. Las razones son múltiples, pero la más importante fue el hecho que la técnica es efectiva, su rendimiento es consistente y sus resultados han sido fácilmente reproducidos en los laboratorios en diferentes países, no solo por nuestra alta experiencia sino también por la habilidad en las manos de cada personal de laboratorio. El nuevo y avanzado 'método Cryotech', el cual asegura un éxito de hasta 100% de viabilidad en ovocitos y embriones en cualquier estadio, ha sido establecido para segura y definitivamente cambiar la técnica de criopreservación en el mundo entero.
El mejor protocolo
Hoy en día hay muchas maneras de llevar a cabo la vitrificación, con diferentes soluciones y resultados variables, algunos de ellos con alta tasa de sobrevivencia. En la literatura cualquiera puede encontrar un método con un rango entre 40% y 90% de sobrevivencia, y para algunos embriólogos tener un 90% de sobrevivencia es suficiente.
Frente a esta realidad es muy interesante señalar cuáles son los ovocitos destinados a morir con un procedimiento que presenta un 90% de sobrevivencia. Definitivamente, la respuesta a esta pregunta es muy simple: serán los más sensibles, los débiles o los frágiles. Así que la pregunta obvia es entonces: ¿qué tipo de ovocitos tiene una paciente con cáncer? Estas pacientes tienen ovocitos sensibles, débiles o frágiles, así que esa tasa de éxito del 90% de sobrevivencia que se muestra en ovocitos normales se reduce cerca al 0% para pacientes con cáncer. Esa es la razón por la cual un protocolo que obtenga 90% de sobrevivencia no es suficiente, necesitamos un 100% para resguardar todos los ovocitos de este tipo de pacientes. Lo mismo aplica para ovocitos de una mujer mayor a 38 años. Esta es la razón por la cual se necesita el mejor protocolo.
El nuevo método de vitrificación alcanza la última meta: 100% de ovocitos vivos y embriones en cualquier estadio de desarrollo así como blastocistos logrados al finalizar el desarrollo embrionario in vitro. Basado en la evidencia de cientos de centros de reproducción asistida en todo el mundo y una garantía de 100% de sobrevivencia, nosotros señalamos que el mejor protocolo de hoy en día es el método Cryotech.
El punto clave de este método de vitrificación es enfocar el tiempo de exposición y la reacción del ovocito o embrión a ser detectado por los ojos del embriólogo, en lugar del tiempo absoluto que toma el proceso.
Como una breve descripción de la técnica, los ovocitos o embriones son equilibrados a temperatura ambiente en la solución que provee el kit; esta solución contiene etilenglicol (EG) y dimetilsulfóxido (DMSO) en medio mínimo esencial (MEM) con hidroxipropilcelulosa (HPC) y sin suplemento proteico. Los ovocitos o embriones se contraen y luego regresan a su morfología normal. Este proceso toma de 7 a 15 minutos, dependiendo de la calidad de cada ovocito o embrión. Luego, los ovocitos o embriones son trasladados a la solución de vitrificación que contiene EG + DMSO y trehalosa en MEM + HPC a temperatura ambiente, hasta que el ovocito o embrión se encoja severamente y se sumerja en el medio de vitrificación. Los ovocitos o embriones son luego cargados individualmente con una pipeta de vidrio en la parte superior de la pajilla con una cantidad mínima de medio del kit y la muestra es rápidamente sumergida en el nitrógeno líquido; posteriormente se cubre una tapa protectora. El tiempo entre la inmersión en la solución de vitrificación y la inmersión en el nitrógeno líquido es de 60 a 90 segundos. Para la desvitrificación, la pajilla es sumergida directamente en la solución de desvitrificación (MEM+ trehalosa + HPC), a 37° grados centígrados por 1 minuto; luego, los ovocitos o embriones son incubados por 3 minutos en la solución diluente del kit (MEM+ trehalosa + HPC) y finalmente lavados dos veces por 5 minutos en solución de lavado (MEM +HPC)(8).
Con este protocolo, el 100 % de éxito en viabilidad después de descongelar es garantizado en ovocitos y en cada estadio de desarrollo del embrión. Sin embargo para lograr tal éxito se requiere un entrenador durante los primeros intentos.
Una potencial alternativa en el manejo de pacientes de baja respuesta, es crear un stock de ovocitos mediante la acumulación de ovocitos vitrificados en metafase 2 durante varios ciclos de estimulación, para luego fertilizarlos todos al mismo tiempo. Teóricamente, esto podría ayudar a incrementar las oportunidades de éxito al conferir a las pacientes un estado similar al de una 'normo respondedora'. El empleo de la acumulación de ovocitos (banking de ovocitos) se ha elevado recientemente gracias a la disponibilidad de las técnicas de vitrificación(9), con tasas de éxito igual a las obtenidas con ovocitos frescos(10). A pesar que los protocolos de congelación lenta han mejorado durante el tiempo, la eficiencia de la vitrificación para la criopreservación de ovocitos ha demostrado ser más alta, como se ha mostrado en recientes metaanálisis(11).
El efecto del tratamiento de cáncer en el ovario
La preservación de la fertilidad puede tener una parte esencial en la medicina reproductiva por 3 razones. Primero, la preservación de la fertilidad es la única opción para pacientes con cáncer que desean conservar su fertilidad. Los avances en los diagnósticos tempranos y sus nuevos tratamientos han disminuido la tasa de muerte de mujeres jóvenes con cáncer (pacientes entre 20 y 39 años). Por ejemplo, la mortalidad por cáncer ha disminuido entre 1 y 8 % por año en hombres y 1 a 4% en mujeres en los Estados Unidos, entre 2006 y 2010(12).
A pesar de los picos en la incidencia del cáncer después de los 50 años, miles de mujeres en edad reproductiva y mujeres en general son diagnosticadas con cáncer cada año. La reducción de mortalidad asociada al cáncer es el objetivo principal de las instituciones médicas, pero la calidad de vida en la creciente población de mujeres jóvenes que han tenido cáncer también merece atención. Debido al incremento en la tasa de sobrevivencia al cáncer, ha crecido el interés en la prevención de la pérdida del estado reproductivo en mujeres jóvenes quienes han tenido cáncer; esta pérdida de fertilidad viene a ser generada por el mismo cáncer o por su tratamiento con drogas gonadotóxicas(13).
Las mujeres que han tenido cáncer tienen incremento de riesgo de padecer menopausia temprana e insuficiencia ovárica primaria como resultado de una reducción de los folículos ováricos, fibrosis del estroma y daño vascular luego de la quimioterapia y radioterapia(14). La menopausia temprana tiene un efecto negativo en la calidad de vida(15) y está asociada a osteoporosis(16), enfermedades cardiovasculares(17) y desórdenes psicosociales como la depresión(18). Incluso las mujeres que sobreviven y mantienen la función ovárica durante el tratamiento contra el cáncer deberán enfrentar un periodo corto de fertilidad(19). El grado de daño al ovario dependerá del tipo y dosis de quimioterapia(20), el esquema de fraccionamiento, el campo de irradiación(21) y la reserva ovárica después del tratamiento.
Preservación de la fertilidad en pacientes con cáncer
Cuando una paciente en edad reproductiva es diagnosticada con cáncer, todos los eventos se van a precipitar, dejando a la paciente sin opciones a tomar. El oncólogo solo le mostrará un papel para firmar el consentimiento para aplicar el tratamiento. En general este tratamiento incluye una parcial o total pérdida de su futuro potencial de fertilidad.
Debido al gran efecto emocional del diagnóstico del cáncer y la inmediata concentración en el tratamiento, el efecto gonadotóxico potencial del cáncer o su tratamiento no son discutidos en el momento del diagnóstico. La preservación de fertilidad es un reciente esfuerzo y muchos pacientes con cáncer y trabajadores al cuidado de la salud no están familiarizados con el desarrollo avanzado de las investigaciones sobre la preservación de fertilidad y su aplicación en la práctica clínica. Algunas técnicas de preservación de fertilidad como la vitrificación de ovocitos ya se han establecido como procedimiento clínico y otros como la vitrificación y posterior trasplante de corteza ovárica han sido validados en los últimos 5 años con niños saludables nacidos sin tratamiento de fertilidad; incluso así estos casos aún son considerados experimentales. Un estimado de 50 a 80% de mujeres jóvenes diagnosticadas con cáncer no se les estaría dando un asesoramiento sobre la preservación de fertilidad antes de empezar el tratamiento del cáncer(22-23).
Dos de cada cincuenta mujeres en edad reproductiva son afortunadamente sobrevivientes del cáncer debido a la alta eficiencia de los oncólogos y el tratamiento oncológico; usualmente, estos oncólogos empiezan el tratamiento lo más pronto posible. Cuando un médico encuentra un exceso de azúcar en sangre, él obliga al paciente a visitar un oftalmólogo porque sus ojos pueden verse comprometidos. De la misma manera, un oncólogo debería obligar al paciente con sospecha oncológica a visitar un centro de reproducción para preservar su fertilidad en ese momento.
¿Qué puede hacer el centro de medicina reproductiva por la preservación de fertilidad solo unos días antes del tratamiento oncológico?
Ellos pueden obtener corteza ovárica y ovocitos para preservar su fertilidad, combinando las técnicas que conocemos:
1. ¿Qué es mejor? 'Vitrificación de corteza ovárica y recuperación de ovocitos' o 'recuperación de ovocitos y vitrificación de corteza ovárica'?
La combinación de la remoción parcial de la corteza ovárica para criopreservación seguido por la estimulación ovárica y criopreservación de ovocitos puede mejorar la eficacia de la preservación de la fertilidad sin generar una demora en el tratamiento oncológico. Empezar con la remoción parcial de la corteza ovárica no afecta sustancialmente el número promedio y la calidad de ovocitos recuperados después de la estimulación ovárica(24). Huober-Zeeb y colaboradores observaron esto en un grupo de 12 pacientes con estimulación ovárica iniciada 1 a 3 días después de la remoción de la corteza comparado con 28 pacientes con estimulación ovárica sin remoción de corteza; no hubo diferencia en el valor de ovocitos aspirados por paciente y tasa de fertilización de estos ovocitos. Ellos obtuvieron una buena calidad de corteza ovárica sin complicaciones y sin efectos secundarios, logrando una doble eficiencia en el programa de preservación de fertilidad.
2. ¿Es eficiente la estimulación ovárica antes de la quimioterapia?
Sí. La estimulación ovárica y criopreservación de ovocitos fertilizados antes de la terapia oncológica es la mejor y más eficiente técnica de preservación de fertilidad y debería ser siempre considerada antes de la quimioterapia. Lawrenz y colaboradores(25) observaron dentro de un corto tiempo que entre 8,6 (18 a 25 años) y 5,1 (36 a 40 años) ovocitos fertilizados pueden ser vitrificados, u ovocitos no fertilizados en el caso de mujeres solteras.
3. ¿se pueden obtener oVocitos en un periodo de dos semanas independientemente del ciclo menstrual?
Sí, se pudo obtener ovocitos con total éxito usando antagonistas de GnRH. La estimulación ovárica para criopreservar ovocitos para pacientes con cáncer puede empezar en la fase luteal, dando el mismo resultado en ovocitos aspirados, ovocitos viables y tasa de fertilización(26).
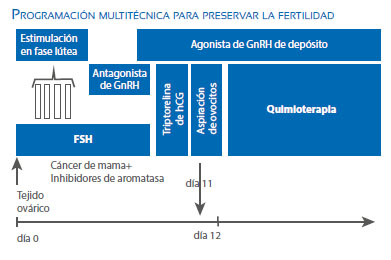
Entonces considerando todos estos conceptos juntos y para estimular la imaginación del lector, solo como un ejemplo, podemos proponer una programación del tratamiento la cual nos dará suficiente tiempo para obtener corteza ovárica y aspirar ovocitos dentro de 11 días, sin ningún riesgo o retraso:
En el día 0, se realiza la laparoscopia para obtener corteza ovárica; luego empieza la estimulación ovárica, incluso si la paciente está en fase lútea, terminando en 11 días con la aspiración de los ovocitos. La quimioterapia puede empezar en el día 12 y nosotros tendríamos corteza ovárica y ovocitos maduros para asegurar su futuro éxito reproductivo.
Se debe notar que en pacientes pediátricos con ausencia de ciclo menstrual, la única forma es la vitrificación de corteza ovárica, y esta es una excelente elección debido a la gran reserva ovárica y óptimo pronóstico para sus vidas reproductivas. Usualmente estos tipos de pacientes son los más descuidados por los oncólogos, sobretodo en temas de reproducción.
Financiamiento: a cargo del autor.
Conflictos de interés: no existen en el presente artículo.
Citar como: Vitrificación de ovocitos y pacientes con cáncer. Rev Peru Ginecol Obstet. 2018;64(2):225-230. DOI: https://doi.org/10.31403/rpgo.v64i2082
Referencias Bibliográficas
1. Practice Committees of American Society for Reproductive Medicine, and the Society for Assisted Reproductive Technology. Mature oocyte cryopreservation: a guideline. Fertil Steril. 2013;99:37-43. doi: 10.1016/j.fertnstert.2012.09.028. [ Links ]
2. Stoop D, Cobo A, Silber S. Fertility preservation for age-related fertility decline. Lancet. 2014; Oct 4;384(9950):1311-9. doi: 10.1016/S01406736(14)61261-7 [ Links ]
3. Monzo C, Haouzi D, Roman K, Assou S, Dechaud H, Hamamah S. Slow freezing and vitrification differentially modify the gene expression profile of human metaphase II oocytes. Hum Reprod. 2012;27:2160-8. doi: 10.1093/humrep/des153 [ Links ]
4. Rao BS, Mahesh YU, Charan KV, Suman K, Sekhar N, Shivaji S. Effect of vitrification on meiotic maturation and expression of genes in immature goat cumulus oocyte complexes. Cryobiology. 2012;64:176-84. doi: 10.1016/j.cryobiol.2012.01.005. [ Links ]
5. Gosden R. Cryopreservation: a cold look at technology for fertility preservation. Fertil Steril. 2011;96:264-8. doi: 10.1016/j.fertnstert.2011.06.029. [ Links ]
6. Gutnisky C, Alvarez G, Cetica P, Dalvit G. Evaluation of the Cryotech vitrification kit for bovine embryos. Cryobiology. 2013;67:391-3. doi: 10.1016/j.cryobiol.2013.08.006. [ Links ]
7. Martino A, Songsasen N, Leibo SP. Development into blastocysts of bovine oocytes cryopreserved by rapid cooling. Biol Reprod. 1996;54:1059-69. [ Links ]
8. Vaita G, Holm P, Kuwayama M. Open pulled straw (OPS) vitrification: a new way to reduce cryo injuries of bovine ova and embryos. Mol Reprod Dev. 1998;51:53-8. [ Links ]
9. Kuwayama M, Vajta G, Kato O, Leibo SP. Highly efficient vitrification method for cryopreservation of human oocytes. Reprod Biomed Online. 2005;11:300-8. [ Links ]
10. Vajta G, Nagy Z. Are programmable freezers still needed in the embryo laboratory? Review on vitrification. Reprod BioMed Online. 2006;12:779-96. [ Links ]
11. Elnahas A, Alcolak E, Marar E, Elnahas T,Elnahas K, Palapelas V. Vitrification of human oocytes and different development stages of embryos: An overview. Middle East Fertility Society J. 2010;15:2-9. [ Links ]
12. Siegel R, Ma J, Zou Z, Jemal A. Cancer statistics, 2014. CA Cancer J Clin. 2014;64:9-29. doi: 10.3322/caac.21220. [ Links ]
13. Forman EJ, Anders CK, Behera MA. A nationwide survey of oncologists regarding treatment-related infertility and fertility preservation in female cancer patients. Fertil Steril. 2010;94:1652-6. doi: 10.1016/j.fertnstert.2009.10.008. [ Links ]
14. Morgan S, Anderson RA, Gourley C, Wallace WH, Spears N. How do chemotherapeutic agents damage the ovary? Hum Reprod Update. 2012;18:525-35. doi: 10.1093/humupd/dms022. [ Links ]
15. Letourneau JM, Ebbel EE, Katz PP, Katz A, Ai WZ, Chien AJ, Melisko ME, Cedars MI, Rosen MP. Pretreatment fertility counseling and fertility preservation improve quality of life in reproductive age women with cancer. Cancer. 2012;118:1710-7. doi: 10.1002/cncr.26459. [ Links ]
16. Bruning PF, Pit MJ, de Jong-Bakker M, van den Ende A, Hart A, van Enk A. Bone mineral density after adjuvant chemotherapy for premenopausal breast cancer. Br J Cancer. 1990;61:308-10. [ Links ]
17. Jeanes H, Newby D, Gray GA. Cardiovascular risk in women: the impact of hormone replacement therapy and prospects for new therapeutic approaches. Expert Opin Pharmacother. 2007;8:279-88. [ Links ]
18. Carter J, Rowland K, Chi D, et al. Gynecologic cancer treatment and the impact of cancer-related infertility. Gynecol Oncol. 2005;97:90-5. [ Links ]
19. Letourneau JM, Ebbel EE, Katz PP. Acute ovarian failure underestimates age-specific reproductive impairment for young women undergoing chemotherapy for cancer. Cancer. 2012;118:1933-9. doi: 10.1002/cncr.26403. [ Links ]
20. Meirow D, Biederman H, Anderson RA, Wallace WHB. Toxicity of chemotherapy and radiation on female reproduction. Clin Obstet Gynecol. 2010;53:727-39. [ Links ]
21. Wallace WH, Thomson AB, Saran F, Kelsey TW. Predicting age of ovarian failure after radiation to a field that includes the ovaries. Int J Radiat Oncol Biol Phys. 2005;62:738-44. [ Links ]
22. Anderson RA, Weddell A, Spoudeas HA. Do doctors discuss fertility issues before they treat young patients with cancer? Hum Reprod. 2008;23:2246-51. [ Links ]
23. Corney RH, Swinglehurst AJ. Young childless women with breast cancer in the UK: a qualitative study of their fertility-related experiences, options, and the information given by health professionals. Psychooncology. 2014;23:20-6. doi: 10.1002/pon.3365. [ Links ]
24. Huober-Zeeb C, Lawrenz B, Popovici RM, Strowitzki T, Gemeyer A, Stute P, von Wolff M. Improving fertility preservation in cancer: ovarian tissue cryobanking followed by ovarian stimulation can be efficiently combined. Fertil Steril. 2011;95:342-4. doi: 10.1016/j.fertnstert.2010.07.1074. [ Links ]
25. Lawrenz B, Jauckus J, Kupka M, Strowitzki T, von Wolff M. Efficacy and safety of ovarian stimulation before chemotherapy in 205 cases. Fertil Steril. 2010;94:28713. doi: 10.1016/j.fertnstert.2010.06.054. [ Links ]
26. VonWolf, Thaler CJ, Frambach MD, Zeeb C, Lawrenz B, Popoivici MD, Strowitzki MD. Ovarian stimulation to cryopreserve fertilized oocyte for cancer patients can be started in the luteal phase. Fertil Steril. 2009;92:13605. doi: 10.1016/j.fertnstert.2008.08.011. [ Links ]
Correspondencia:
Gabriel Dalvit, DVM, PhD
Recibido: 28 abril 2018
Aceptado: 2 mayo 2018