Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Peruana de Ginecología y Obstetricia
versão On-line ISSN 2304-5132
Rev. peru. ginecol. obstet. vol.64 no.3 Lima jul./set. 2018
http://dx.doi.org/https://doi.org/10.31403/rpgo.v64i2094
ARTÍCULO ORIGINAL
Tamizaje de reserva ovárica con hormona antimülleriana
Ovarian reserve screening with antiMüllerian hormone
Iván Reyes-Armas1,2,a,b, Flor Carvallo Ñiquena
1 Servicio de Reproducción Humana, Hospital Nacional Docente San Bartolomé, Lima, Perú
2 Universidad Científica del Sur, Lima, Perú
a Médico Gineco-obstetra, Especialista en Infertilidad
b Máster en Reproducción Humana
ABSTRACT
Currently, ovarian reserve (OR) tests are mainly used in the evaluation of subfertile patients. In this paper, we discuss the use of anti-Müllerian hormone (AMH) levels, which have been associated in some cases with antral follicle count (AFC) and FSH levels in young women, and we propose an algorithm to identify the risk of reduced ovarian reserve. Using her full autonomy and after counseling, the woman would decide whether or not to do the tests, according to her priorities in life. If these tests were altered, the woman could modify her plans in regard to motherhood.
Key words: Anti-Müllerian hormone, Ovarian reserve, Mass screening.
RESUMEN
En la actualidad, las pruebas de reserva ovárica (RO) son usadas principalmente en la evaluación de pacientes subfértiles. En este artículo, se discute el uso del dosaje de hormona antimülleriana (HAM), asociado en algunos casos con el recuento de folículos antrales (RFA) y el dosaje de FSH, en la población general de mujeres jóvenes, postulando un algoritmo de tamizaje para identificar riesgo de reserva ovárica disminuida. Usando su plena autonomía y luego de una consejería, la mujer decidiría hacer o no las pruebas, según sus prioridades en la vida. Si dichos exámenes resultaran alterados, la mujer podría modificar sus planes en lo que se refiere a la maternidad.
Palabras clave. Hormona antimülleriana, Reserva ovárica, Tamizaje masivo.
Introducción
El tamizaje de reserva ovárica (RO) para la población general de mujeres en edad reproductiva es un tema de discusión relativamente nuevo, siendo la introducción de la determinación de hormona antimülleriana (HAM) la prueba de tamizaje para identificar a las mujeres con riesgo de reserva ovárica disminuida (ROD)(1).
La RO es el potencial reproductivo como función del número y calidad de ovocitos restantes(2). Estos están determinados por el resultado neto del tamaño inicial de folículos primordiales, la tasa natural de pérdida atrésica y el impacto de cualquier injuria al ovario que puede adelantar la depleción folicular(1). De esto se puede inferir la gran variabilidad de RO, inclusive a la misma edad, así como la diferente respuesta a la estimulación ovárica y la edad del comienzo de la subfertilidad y de la menopausia. Estudios en sociedades donde no hay anticoncepción sugieren que 11% de las mujeres no tiene hijos más allá de los 35 años, y hay un espacio de 10 años entre la edad de las madres al nacimiento de su último hijo y el inicio de la menopausia. Por lo tanto, en promedio 1 de cada 10 mujeres será estéril involuntariamente a los 35 años(1).
La HAM es una glicoproteína producida por las células de la granulosa y refleja la actividad de los folículos de crecimiento temprano hasta el antral pequeño(3). Se ha encontrado que la HAM es una buena medida de la RO(4), especialmente cuando se usa junto con el recuento de folículos antrales (RFA). Aunque puede haber pequeñas variaciones durante todo el ciclo menstrual(5), es ampliamente aceptado que un nivel de esta hormona es relativamente constante durante el ciclo menstrual de una mujer y se puede medir en cualquier día del ciclo.
La HAM puede verse afectada por el uso de anticonceptivos hormonales, encontrando disminuciones mínimas o hasta de 50% en sus niveles durante su utilización(6-9). La supresión continua o los intervalos cortos libres de anticonceptivos se asocian con disminuciones más significativas en la HAM, dada la mayor inhibición de pequeños folículos antrales(7). Del mismo modo, el embarazo lleva a una disminución transitoria de dicha hormona, con retorno al valor basal después del parto(10,11). También se ha encontrado que fumar afecta negativamente los valores de HAM, mientras que los factores como el consumo de alcohol, el ejercicio y el estatus socioeconómico no se cree que estén asociados con los niveles de HAM(6). El índice de masa corporal (IMC) no se ha correlacionado directamente con la HAM en la población general, pero podría estar asociado con menores niveles de HAM en aquellas con ROD o síndrome de ovario poliquístico(12,13).
Actualmente, el American College of Obstetricians and Gynecologists Committee Opinion reconoce que la HAM es una prueba útil de detección en mujeres con un riesgo alto de ROD y en mujeres sometidas a FIV, pero tiene limitado beneficio en mujeres con riesgo bajo de ROD(14).
Sin embargo, la HAM es un poderoso biomarcador clínico que ayuda a mejorar el tratamiento de la infertilidad, la planificación de futuros embarazos, monitorización de daño ovárico por medicamentos y/o procedimientos (cirugías) y la detección de enfermedades relacionadas con los ovarios como el síndrome de ovario poliquístico (SOP) y la insuficiencia ovárica prematura(15).
La HAM predice con éxito la respuesta pobre y alta en un ciclo de FIV(16). Su medición es cada vez más reconocida como de valor clínico en una variedad de entornos, aparte de los ya mencionados. Así permite la evaluación de la RO tras el tratamiento del cáncer(17); también se ha utilizado como predictor de cuánto tiempo las mujeres pueden retrasar, con relativa seguridad, el embarazo sin afrontar el riesgo de subfertilidad, y para pronosticar la edad de la menopausia(16).
Utilizando los niveles medios de HAM, la literatura parece estar de acuerdo en que los valores declinan anualmente a una tasa bastante consistente después de 25 años de edad hasta por debajo del límite de detección clínica a los 50 años de edad(18-22). Sin embargo, el patrón de aumento antes de los 25 años tiene una representación contradictoria en la literatura, con un estudio que muestra picos y valles(23) y otro que muestra un aumento gradual desde el nacimiento hasta los 15 años de edad y luego declina(24).
Por lo tanto, se debe interpretar con cautela los valores de HAM en suero en mujeres menores de 25 años de edad. Además, hay pocos datos disponibles para determinar si el patrón de disminución de los valores de HAM de una mujer individual coincide con el patrón del promedio de la población(15).
El valor de HAM para predecir la tasa de nacidos vivos o la calidad del ovocito, independiente de la edad, sigue siendo controversial, con algunos estudios que continúan demostrando no haber asociación, como otros que demuestran una asociación pequeña pero útil(25-31). Esta controversia puede deberse en parte a diferencias en la metodología de medición de la HAM y al diseño del estudio, enmascarando la asociación de HAM sérica y la calidad del ovocito. En última instancia, como concluye un metaanálisis reciente, es probable que esta hormona tenga una asociación con la calidad de ovocitos, pero esta es probablemente débil a moderada en el mejor de los casos, independiente de la edad de la mujer(32).
La HAM puede mejorar la predicción de la calidad de los ovocitos cuando se incorpore un enfoque multivariante algorítmico(31). Sin embargo, como sigue habiendo pruebas de que los nacimientos vivos son posibles con niveles de HAM muy bajos, estos valores por sí solos, no deben ser utilizados para hacer un diagnóstico definitivo(33).
Se ha fomentado la posibilidad de utilizar la HAM como prueba de tamizaje en la población en general, sobre todo teniendo en cuenta el aumento de la edad de las mujeres que desean embarazo. La HAM puede probablemente ser útil en la población general para identificar a las mujeres con riesgo de ROD que son asintomáticas. Una vez identificadas, estas mujeres pueden optar por tomar medidas tempranas o por lo menos buscar más información con respecto a su estado de fertilidad(34).
Un análisis reciente sobre tamizaje de RO desde el punto de vista ético y científico sugiere que dicho tamizaje se debe ofrecer a las mujeres y proponer un algoritmo para ello(1).
En un estudio se encontró que 19% de las mujeres asintomáticas estaban en riesgo para ROD(34). Estudios previos han demostrado interés en evaluar la RO. Un estudio entre mujeres estudiantes universitarias con una edad media de 22 años encontró que 79% estaban interesadas en conocer su RO(35). Otros investigadores encuestaron a proveedores de salud masculinos y femeninos, con una mediana de edad de 29 años, con respecto a la prueba de RO para ellos o sus parejas y encontraron interés similar(36). Tomados en conjunto, estos datos apoyan artículos anteriores abogando por ampliar el uso de la prueba de HAM.
De los 10 atributos que una prueba de tamizaje ideal debe cumplir para cribado de la OMS(38), el tamizaje de RO cumple con 9 criterios(1). Es así que:
a. La ROD es un ‘problema de salud importante para el individuo y la comunidad’. La infertilidad en las mujeres ha sido asociada a tasas altas de depresión, pobre imagen de sí mismas, aislamiento social, incluso suicidio(39,40).
b. ‘Habría un tratamiento o intervención útil para pacientes con la enfermedad’. Si se detecta ROD en la mujer menor de 35 años, aún hay buena chance de lograr un embarazo.
c. ‘La historia natural de la enfermedad es adecuadamente entendida’. La RO declina con el avance de la edad, aunque no se conoce la velocidad con la que disminuye.
d. ‘Hay fase latente temprana asintomática’; este criterio se cumple.
e. ‘Hay prueba de tamizaje aceptable’, vendría a ser la HAM.
f. ‘Las facilidades para diagnóstico y tratamiento están disponibles’; se tiene los procedimientos de reproducción asistida
g. ‘Hay una política de consenso para tratar pacientes’. Este criterio es el único que no cumple el tamizaje de RO. Faltan grandes estudios prospectivos que puedan ser usados para desarrollar puntos de corte para HAM y RFA. Actualmente lo recomendable sería que cuando la HAM esté por debajo del percentil 10 para determinada edad se confirme con un control, RFA y FSH en fase folicular temprana. Si todos resultan bajos, es razonable sugerir que probablemente el potencial de fertilidad está comprometido.
h. ‘El tratamiento iniciado más tempranamente sería más beneficioso que iniciado más tardíamente’. Se cumple ese criterio.
i. ‘El costo sería económicamente balanceado en relación a posible gasto en cuidado médico’. En este sentido, es la propia persona la que asume el gasto de esta prueba versus el costo de algún procedimiento de reproducción asistida que requiriera.
j. ‘El hallazgo del caso sería un proceso continuo y no una vez’. Se sugiere que el tamizaje de RO fuera ofrecido a las mujeres alrededor de los 30 años o posiblemente a una edad más temprana si tuviera factor de riesgo para una ROD(1).
Por otro lado, se postula que el envejecimiento ovárico no cumple los criterios para una enfermedad para la cual se puede desarrollar una prueba de detección. Esto es porque ni la historia natural del envejecimiento ovárico ni la tasa de declinación de la HAM se conocen en una mujer en particular. Por lo tanto, la HAM podría ser incapaz de predecir quién experimentará envejecimiento ovárico temprano(16).
Por ello se dice que la HAM no es una prueba de detección para la RO(41), sino una prueba de diagnóstico para la ROD. Desafortunadamente, en el momento en que la ROD es diagnosticada, es demasiado tarde para proporcionar cualquier tratamiento de fertilidad usando sus propios ovocitos.
Los enfoques algorítmicos multivariados permiten optimizar la combinación de variables clínicas para predecir el resultado.
La realidad es que los médicos, si no se les proporciona un algoritmo validado, se ven forzados en la práctica diaria a aunar la HAM con variables como la edad, el IMC, la historia médica, el RFA, la FSH, con lo mejor de su capacidad, pero sin el beneficio de la optimización matemática y las grandes bases de datos(15).
Recientes estudios demuestran el beneficio de combinar la HAM con otras variables para predecir resultados como menopausia, nacidos vivos o respuesta ovárica a la estimulación en alta complejidad(15,31,42), aunque hay otros estudios que no han encontrado beneficios en combinar pruebas múltiples(43).
Cabe señalar que las diferencias en los materiales de ensayo de HAM y el rendimiento del laboratorio hacen que la combinación de diferentes conjuntos de datos de esta hormona sea compleja y probablemente reduciría las asociaciones de HAM con los resultados. Por lo tanto, aunque es probable que un enfoque multivariante mejoraría drásticamente la precisión en la toma de decisiones, se requerirá una minimización de la variabilidad en los ensayos de HAM, rendimiento del laboratorio, definición de población de pacientes y diseño de los estudios(15).
Los desafíos que enfrenta el médico, aplicando los resultados de laboratorio de pruebas de RO tales como HAM, pueden parecer desalentadores, aunque siguiendo algunos pasos prácticos se puede superar estos inconvenientes(15):
A. No mezclar y combinar los valores de HAM de diferentes laboratorios, pero sí identificar una fuente fiable y única de pruebas de esta hormona que calibren sus pruebas a los resultados clínicos de interés y se comprometan a tener al tanto al médico si se producen cambios en la calibración de los resultados.
B. Evitar que se considere solamente la medición de HAM para evaluar la RO, incorporando otros marcadores como el RFA y la FSH en suero de fase folicular temprana.
C. Identificar si el paciente tiene una condición médica, ha tomado medicamentos (por ejemplo, anticonceptivos hormonales o quimioterapia), o ha tenido cirugías ováricas (por ejemplo, de quiste o endometrioma) que afecten los niveles de HAM.
D. Considerar reevaluar si los resultados de HAM son clínicamente inconsistentes, o si, basado en los resultados de la prueba, se deban tomar decisiones que cambiarán la vida.
La interpretación de los niveles de HAM y el asesoramiento en el contexto de las mujeres que actualmente no están embarazadas es crítico, ya que un valor de HAM puede verse afectado por varios factores(15).
El médico debe conocer los valores ‘normales’ para la edad y el historial de la paciente, y para el ensayo HAM específico que se utiliza, para de esta manera ofrecer el asesoramiento apropiado que no conduzca a una ansiedad indebida o falsas garantías(34). En adición, la sangre para la medición de HAM debe ser recolectada y procesada correctamente, ya que condiciones tales como la hemólisis y la temperatura pueden impactar en los resultados(44,45). Como la anticoncepción hormonal puede suprimir los niveles de HAM, esto se convierte en una parte importante de la conversación para las mujeres con valores menores de lo esperado. En los pacientes con HAM bajo, se debe considerar la posibilidad de cambiar a un método anticonceptivo no hormonal y luego repetir el análisis en 2 meses(7,9). En mujeres que completaron un período de 6 a 8 meses de seguimiento de HAM se encontró que la mayoría tenía valores estables, incluyendo aquellos con valores bajos de dicha hormona(34).
Finalmente, frente a los hallazgos que apoyan el uso de HAM como una prueba de detección para la ROD, teniendo en cuenta que los factores de riesgo clínicos solo identificarán aproximadamente el 50% de las mujeres en riesgo de reserva ovárica baja(46) y bajo la evidencia de que las mujeres están interesadas en el tamizaje de su reserva ovárica y que la mayoría de ellas se tranquilizarán al conocer su nivel de HAM, se podrá hallar que después de las pruebas y el asesoramiento el 78% planeó tomar acciones inmediatas y un 17% adicional planea tomar medidas si la HAM disminuye significativamente en el año(1), pudiendo optar por la preservación de su fertilidad o por intentar un embarazo temprano(47). Por todo lo anterior, se plantea el siguiente protocolo de tamizaje.
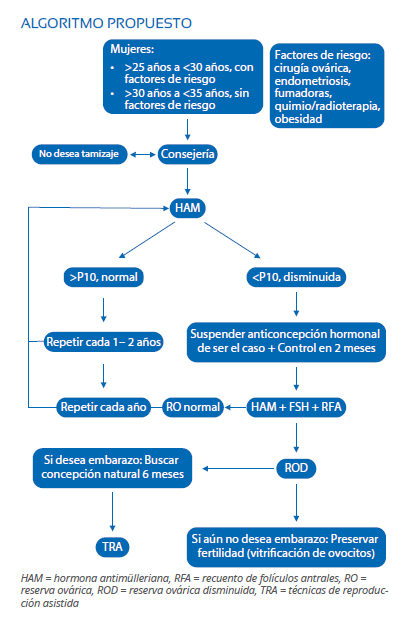
Protocolo de tamizaje propuesto
Las pruebas de RO serían ofrecidas a todas las mujeres de 30 años; si hay factores de riesgo se les ofrecería antes.
El tamizaje es voluntario y con consejería adecuada antes de realizarse la(s) prueba(s)(1).
La HAM es la prueba ideal, tiene menos variabilidad inter-observador y se toma en cualquier día del ciclo. Una HAM sérica debajo del percentil 10 para la edad sugiere ROD. Se recomienda HAM control y FSH entre los día 3 y 5 (sin anticoncepción hormonal en 2 meses), junto con el RFA(1).
Los resultados anormales deben ser conversados con el médico especialista para evaluar los méritos y opciones de tratamiento. Las pacientes con ROD serían orientadas para buscar concepción natural por 6 meses. De no ocurrir, optar por tratamientos de reproducción asistida (TRA) o preservar su fertilidad. Las pacientes con RO borderline pueden elegir seguimiento de tamizaje cada 12 meses y actuar según resultados(1).
Conclusiones
El uso de la HAM como prueba de tamizaje de reserva ovárica en la población general, asociado en ciertos casos con el recuento de folículos antrales y niveles de FSH, es prometedor, ofreciendo la posibilidad de identificar a las mujeres con riesgo de reserva ovárica disminuida que son asintomáticas. Teniendo en cuenta que actualmente muchas mujeres retrasan su maternidad por causas sociales, médicas o simplemente por desinformación, el hallazgo de alguna prueba disminuida les ofrecería la opción oportuna de optar por intentar embarazar activamente, preservar su fertilidad, o por lo menos buscar más información con respecto a su estado de fertilidad.
Fuente de financiamiento: autofinanciado
Conflicto de interés: ninguno
Citar como: Reyes-Armas I, Carvallo Ñiquen F. Tamizaje de reserva ovárica con hormona antimülleriana. Rev Peru Ginecol Obstet. 2018;64(3):337-344
Referencias Bibliográficas
1. Tremellen K, Savulescu J. Ovarian reserve screening: a scientific and ethical analysis. Human Reprod. 2014;29(12):2606– 14. DOI:10.1093/humrep/deu265. [ Links ]
2. American College of Obstetricians and Gynecologists Committee on Gynecologic Practice and Practice Committee, ASRM Practice Committee. Testing and interpreting measures of ovarian reserve: a committee opinion. Fertil Steril. 2015;103:e9–e17. DOI:10.1016/j.fertnstert.2012.09.036. [ Links ]
3. Weenen C, Laven JS, Von Bergh AR, Cranfield M, Groome NP, Visser JA, et al. Anti-Mullerian hormone expression pattern in the human ovary: Potential implications for initial and cyclic follicle recruitment. Mol Hum Reprod. 2004;10:77–83. [ Links ]
4. Van Rooij IA, Broekmans FJ, te Velde ER, Fauser BC, Bancsi LF, de Jong FH, et al. Serum anti-Mullerian hormone levels: A novel measure of ovarian reserve. Hum Reprod. 2002;17:3065–71. [ Links ]
5. Kissell KA, Danaher MR, Schisterman EF, Wactawski-Wende J, Ahrens KA, Schliep K, et al. Biological variability in serum anti-Mullerian hormone throughout the menstrual cycle in ovulatory and sporadic anovulatory cycles in eumenorrheic women. Hum Reprod. 2014;29:1764–72. DOI:10.1093/humrep/deu142. [ Links ]
6. Dolleman M, Verschuren WM, Eijkemans MJ, Dollé ME, Jansen EH, Broekmans FJ, et al. Reproductive and lifestyle determinants of anti-Mullerian hormone in a large population based study. J Clin Endocrinol Metab. 2013;98:2106–15. DOI:10.1210/jc.2012-3995. [ Links ]
7. Kallio S, Puurunen J, Ruokonen A, Vaskivuo T, Piltonen T, Tap anainen JS. Antimullerian hormone levels decrease in women using combined contraception independently of administration route. Fertil Steril. 2013;99:1305–10. DOI:10.1016/j.fertnstert.2012.11.034. [ Links ]
8. Bentzen JG, Forman JL, Pinborg A, Lidegaard Ø, Larsen EC, Friis-Hansen L, et al. Ovarian reserve parameters: A comparison between users and non-users of hormonal contraception. Reprod Biomed Online. 2012;25:612–9. DOI:10.1016/j.rbmo.2012.09.001. [ Links ]
9. Birch Petersen K, Hvidman HW, Forman JL, Pinborg A, Larsen EC, Macklon KTet al. Ovarian reserve assessment in users of oral contraception seeking fertility advice on their reproductive lifespan. Hum Reprod. 2015;30:2364–75. DOI:10.1093/humrep/dev197. [ Links ]
10. Köninger A, Kauth A, Schmidt B, Schmidt M, Yerlikaya G, Kasimir-Bauer S, et al. Anti-Mullerian hormone levels during pregnancy and postpartum. Reprod Biol Endocrinol. 2013;11:60. DOI:10.1186/1477-7827-11-60. [ Links ]
11. Koninger A, Schmidt B, Mach P, Damaske D, Nießen S, Kimmig R, Strowitzki T, Gellhaus A. Anti-Mullerian-Hormone during pregnancy and peripartum using the new Beckman Coulter AMH Gen II assay. Reprod Biol Endocrinol. 2015;13:86. doi: 10.1186/s12958-015-0082-4. [ Links ]
12. Buyuk E, Seifer DB, Illions E, Grazi RV, Lieman H. Elevated body mass index is associated with lower serum anti-mullerian hormone levels in infertile women with diminished ovarian reserve but not with normal ovarian reserve. Fertil Steril. 2011;95:2364–8. doi: 10.1016/j.fertnstert.2011.03.081. [ Links ]
13. Kriseman M, Mills C, Kovanci E, Sangi-Haghpeykar H, Gibbons W. Antimullerian hormone levels are inversely associated with body mass index (BMI) in women with polycystic ovary syndrome. J Assist Reprod Genet. 2015;32:1313–6. doi: 10.1007/s10815-015-0540-0. [ Links ]
14. Committee on Gynecologic Practice. Committee opinion no. 618: Ovarian reserve testing. Obstet Gynecol. 2015;125:268– 73. doi: 10.1097/01.AOG.0000459864.68372.ec. [ Links ]
15. Leader B, Baker VL. Maximizing the clinical utility of antimullerian hormone testing in women’s health. Curr Opin Obstet Gynecol. 2014;26:226–36. doi: 10.1097/GCO.0000000000000087.
16. Loh JS, Maheshwari A. Anti-Mullerian hormone: is it a cristal ball for predicting ovarian ageing?. Human Reprod. 2011;26(11):2925–32. doi: 10.1093/humrep/der271 [ Links ]
17. Nelson SM, Messow MC, McConnachie A, Wallace H, Kelsey T, Fleming R, Anderson RA, Leader B. External validation of normogram for the decline in serum anti-Mullerian hormone in women: a population study of 15 834 infertility patients. Reprod Biomed Online. 2011 Aug;23(2):204-6. doi: 10.1016/j.rbmo.2011.05.006. [ Links ]
18. La Marca A, Spada E, Grisendi V, Argento C, Papaleo E, Milani S, Volpe A. Normal serum anti-mullerian hormone levels in the general female population and the relationship with reproductive history. Eur J Obstet Gynecol Reprod Biol. 2012;163:180–4. doi: 10.1016/j.ejogrb.2012.04.013. [ Links ]
19. Nelson SM, Iliodromiti S, Fleming R, Anderson R, McConnachie A, Messow CM. Reference range for the antimullerian hormone Generation II assay: a population study of 10 984 women, with comparison to the established Diagnostics Systems Laboratory nomogram. Fertil Steril. 2014;101:523–9. doi: 10.1016/j.fertnstert.2013.10.021. [ Links ]
20. Nelson SM, Messow MC, Wallace AM, Fleming R, McConnachie A. Nomogram for the decline in serum antimullerian hormone: a population study of 9601 infertility patients. Fertil Steril. 2011;95:736–41;e1–e3. doi: 10.1016/j.fertnstert.2010.08.022. [ Links ]
21. Leader B, Hegde A, Baca Q, Stone K, Lannon B, Seifer DB, Broekmans F, Baker VL. High frequency of discordance between antimullerian hormone and follicle-stimulating hormone levels in serum from estradiol-confirmed days 2 to 4 of the menstrual cycle from 5354 women in U.S. fertility centers. Fertil Steril. 2012;98:1037–42. doi: 10.1016/j.fertnstert.2012.06.006. [ Links ]
22. Seifer DB, Baker VL, Leader B. Age-specific serum anti-mullerian hormone values for 17 120 women presenting to fertility centers within the United States. Fertil Steril. 2011;95:747– 50. doi: 10.1016/j.fertnstert.2010.10.011. [ Links ]
23. Kelsey TW, Wright P, Nelson SM, Anderson RA, Wallace WH. A validated model of serum anti-mullerian hormone from conception to menopause. PLoS One. 2011;6:e22024. doi: 10.1371/journal.pone.0022024. [ Links ]
24. Lie Fong S, Visser JA, Welt CK, de Rijke YB, Eijkemans MJ, Broekmans FJ, et al. Serum anti-mullerian hormone levels in healthy females: a nomogram ranging from infancy to adulthood. J Clin Endocrinol Metab. 2012;97:4650–5. doi: 10.1210/ jc.2012-1440. [ Links ]
25. Brodin T, Hadziosmanovic N, Berglund L, Olovsson M, Holte J. Antimullerian hormone levels are strongly associated with live-birth rates after assisted reproduction. J Clin Endocrinol Metab. 2013;98:1107–14. doi: 10.1210/jc.2012-3676. [ Links ]
26. Li HW, Lee VC, Lau EY, Yeung WS, Ho PC, Ng EH. Role of baseline antral follicle count and antimullerian hormone in the index stimulation cycle of IVF treatment in predicting outcome of subsequent frozen-thawed embryo transfers. Gynecol Endocrinol. 2014;30:490–3. doi: 10.3109/09513590.2014.899572. [ Links ]
27. Lehmann P, Velez MP, Saumet J, Lapensée L, Jamal W, Bissonnette F, Phillips S, Kadoch IJ. Anti-mullerian hormone (AMH): a reliable biomarker of oocyte quality in IVF. J Assist Reprod Genet. 2014;31:493–8. doi: 10.1007/s10815-014-0193-4. [ Links ]
28. Merhi Z, Zapantis A, Berger DS, Jindal SK. Determining an anti-mullerian hormone cutoff level to predict clinical pregnancy following in vitro fertilization in women with severely diminished ovarian reserve. J Assist Reprod Genet. 2013;30:1361–5. doi: 10.1007/s10815-013-0077-z [ Links ]
29. Lin WQ, Yao LN, Zhang DX, Yang XJ, Yu R. The predictive value of anti-mullerian hormone on embryo quality, blastocyst development, and pregnancy rate following in vitro fertilization-embryo transfer (IVF-ET). J Assist Reprod Genet. 2013;30:649–55. doi: 10.1007/s10815-013-9973-5. [ Links ]
30. Himabindu Y, Gopinathan KK, Pandey AK, Sriharibabu M. Correlation of age and antimullerian hormone in assisted reproductive technology program outcome. Indian J Physiol Pharmacol. 2013;57:9–15. [ Links ]
31. Khader A, Lloyd SM, McConnachie A, Fleming R, Grisendi V, La Marca A, Nelson SM. External validation of antimullerian hormone based prediction of live birth in assisted conception. J Ovarian Res. 2013;6:3. doi: 10.1186/1757-2215-6-3. [ Links ]
32. liodromiti S, Kelsey TW, Wu O, Anderson RA, Nelson SM. The predictive accuracy of antimullerian hormone for live birth after assisted conception: a systematic review and meta-analysis of the literature. Hum Reprod Update. 2014;20:560–70. doi: 10.1093/humupd/dmu003. [ Links ]
33. Kedem A, Haas J, Geva LL, Yerushalmi G, Gilboa Y, Kanety H, Hanochi M, Maman E, Hourvitz A. Ongoing pregnancy rates in women with low and extremely low AMH levels. A multivariate analysis of 769 cycles. PLoS One. 2013;8:e81629. doi: 10.1371/journal.pone.0081629. [ Links ]
34. Grossman LC, Safier LZ, Kline MD, Chan CW, Lobo RA, Sauer MV, Douglas NC. Utility of ovarian reserve screening with anti-mullerian hormone for reproductive age women deferring pregnancy. J Women’s Health (Larchmt). 2017 Apr;26(4):345351. DOI: 10.1089/jwh.2016.5842.
35. Bavan B, Porzig E, Baker VL. An assessment of female university students’ attitudes toward screening technologies for ovarian reserve. Fertil Steril. 2011;96:1195–9. doi: 10.1016/j.fertnstert.2011.08.018.
36. Azhar E, Seifer DB, Melzer K, Ahmed A, Weedon J, Minkoff H. Knowledge of ovarian reserve and reproductive choices. J Assist Reprod Genet. 2015;32:409–15. doi: 10.1007/s10815014-0415-9. [ Links ]
37. Broekmans FJ, Kwee J, Hendriks DJ, Mol BW, Lambalk CB. A systematic review of tests predicting ovarian reserve and IVF outcome. Hum Reprod Update. 2006;12:685–718. [ Links ]
38. Wilson JMG, Jungner G. Principles and Practice of Screening for Disease. Geneva: WHO, 1968. http://www.who.int/bulletin/volumes/86/4/07-050112BP.pdf [ Links ]
39. Wirtberg I, Mo¨ller A, Hogström L, Tronstad SE, Lalos A. Life 20 years after unsuccessful infertility treatment. Hum Reprod. 2007;22:598–604. [ Links ]
40. Schwerdtfeger KL, Shreffler KM. Trauma of pregnancy loss and infertility for mothers and involuntarily childless women in the contemporary United States. J Loss Trauma. 2009;14:211–27. [ Links ]
41. Maheshwari A, Gibreel A, Bhattacharya S. Screening for early ovarian ageing. In: Bewley S, Ledger W, Nikolaou D (eds). Reproductive Ageing. UK: RCOG Press, 2009, Chapter 19. [ Links ]
42. Gleicher N, Kim A, Kushnir V, Weghofer A, Shohat-Tal A, Lazzaroni E, Lee HJ, Barad DH. Clinical relevance of combined FSH and AMH observations in infertile women. J Clin Endocrinol Metab. 2013 May;98(5):2136-45. doi: 10.1210/jc.2013-1051. [ Links ]
43. Broer SL, van Disseldorp J, Broeze KA, Dolleman M, Opmeer BC, Bossuyt P, Eijkemans MJ, et al. Added value of ovarian reserve testing on patient characteristics in the prediction of ovarian response and ongoing pregnancy: an individual patient data approach. Hum Reprod Update. 2013;19:26–36. doi: 10.1093/humupd/dms041. [ Links ]
44. Rustamov O, Smith A, Roberts SA, Yates AP, Fitzgerald C, Krishnan M, Nardo LG, Pemberton PW. Anti-Mullerian hormone: poor assay reproducibility in a large cohort of subjects suggests sample instability. Hum Reprod. 2012;27:3085–91. doi: 10.1093/humrep/des260 [ Links ]
45. Rustamov O, Smith A, Roberts SA, Yates AP, Fitzgerald C, Krishnan M, Nardo LG, Pemberton PW. The measurement of anti-Mullerian hormone: A critical appraisal. J Clin Endocrinol Metab. 2014 Mar;99(3):723-32. doi: 10.1210/jc.2013-3476. [ Links ]
46. Martyn F, O’Brien YM, Wingfield M. Review of clinical indicators, including serum anti-Müllerian hormone levels, for identification of women who should consider egg freezing. J Womens Health (Larchmt). 2017 Apr;26(4):345-51. doi: 10.1089/jwh.2016.5842.
47. Grossman LC, Safier LZ, Kline MD, Chan CW, Lobo RA, Sauer MV, et al. Utility of ovarian reserve screening with anti-müllerian hormone for reproductive age women deferring pregnancy. Gynecol Endocrinol. 2017 Aug;33(8):644-8. doi: 10.1080/09513590.2017.1306848. [ Links ]
Correspondencia:
Dr. Iván Reyes Armas
Recibido:11 junio 2018
Aceptado:31 julio 2018