Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Ginecología y Obstetricia
versión On-line ISSN 2304-5132
Rev. peru. ginecol. obstet. vol.64 no.3 Lima jul./set. 2018
http://dx.doi.org/https://doi.org/10.31403/rpgo.v64i2095
ARTÍCULO ORIGINAL
Interpretación de las pruebas diagnósticas de sífilis en gestantes
Interpretación de las pruebas diagnósticas de sífilis en gestantes Interpretation of diagnostic tests for syphilis in pregnant women
Ricardo Iván Álvarez Carrasco1,2
1 Médico Patólogo Clínico, Instituto Nacional Materno Perinatal, Lima, Perú
2 Asociación Médica Peruana de Patología Clínica
ABSTRACT
In much of the American continent and particularly in Peru, gestational syphilis is a public health problem, which is particularly important because of the risk of infection to the fetus. Because of this, it is essential to use commonly used immunological tests that are vital to define the diagnosis and timely administration of the antibiotic treatment. The objective of this review is to disseminate the general characteristics of these tests, and their correct use and interpretation, according to current protocols.
Key words. Syphilis. pregnancy; Syphilis, laboratory tests.
RESUMEN
En gran parte del continente americano y en el Perú en particular, la sífilis gestacional es un problema de salud pública, que adquiere particular importancia por el riesgo de la infección al feto, por lo que es indispensable la adecuada utilización de las pruebas inmunológicas de uso común, que son vitales para definir el diagnóstico y la administración oportuna del tratamiento antibiótico. El objetivo de esta revisión es difundir las características generales de dichas pruebas y su correcto empleo e interpretación, según los protocolos vigentes.
Palabras clave. Sífilis. gestación; Sífilis, pruebas de laboratorio.
Introducción
La sífilis es una infección sistémica y crónica, exclusiva del ser humano(1), causada por el Treponema pallidum, subespecie pallidum, que generalmente se trasmite por vía sexual y se caracteriza por episodios de enfermedad activa, interrumpidos por episodios de latencia(2), aunque puede manifestarse de numerosas formas, por lo que se le conoce como la gran simuladora(3).
La sífilis gestacional es aquella que se diagnostica durante el embarazo, el postaborto o el puerperio inmediato, en cualquiera de sus fases, aunque es más frecuente en la secundaria indeterminada, adquiriendo mayor importancia por el riesgo de una infección transplacentaria al feto(4-6), en cualquier etapa del embarazo(7), la cual puede ocasionar muerte perinatal, parto prematuro, peso bajo al nacer, anomalías congénitas y sífilis activa en el neonato(8,9).
En América Latina y el Caribe la sífilis gestacional es un problema de salud pública. En el 2012 su prevalencia era muy variable de un país a otro, oscilando entre 0,8 y 7,0%, con una cifra estimada de 63 000 infecciones maternas durante el embarazo, que mereció medidas gubernamentales para reducirla, al punto que en 2016, los casos de sífilis congénita se redujeron en la mayoría de las naciones de la región, incluso Cuba reportó su eliminación(10).
El Treponema pallidum posee características biológicas que le confieren poca afinidad a los colorantes comunes e imposibilitan el cultivo en medios de uso común(1,11,12), lo que dificulta el empleo de métodos microbiológicos y convierten las pruebas inmunológicas en el estándar diagnóstico(8,13), cuya adecuada interpretación es vital en las estrategias para reducir progresivamente esta enfermedad.
En 1907, Wasserman elaboró el primer ensayo para detectar anticuerpos anti treponémicos en el suero de los pacientes, que al año siguiente introdujo en nuestro país el doctor Raúl Rebagliati(14). Sin embargo, numerosos reportes de falsos positivos y negativos comprobaron que tenía una sensibilidad y especificidad relativamente pobre. En 1922, Kahn ideó una prueba de floculación que no requería complemento(3,15), que se utilizó profusamente en los lustros siguientes, ya que mejoró la performance de su antecesor.
En 1941, Pangborn aisló la cardiolipina(16,17), que permitió a Harris desarrollar, en 1946, la venereal desease research laboratory (VDRL)(15), más específica que las precedentes, aunque subsistieron las reacciones inespecíficas. En 1962 se ideó la rapid plasma reagin (RPR)(18) y en 1969 el unheated serum test (USR)(19).
En 1949 apareció el ensayo treponema pallidum inmovilisation (TPI), la primera prueba treponémica(20); en 1957 lo hizo el fluorescent treponemal antibody (FTA)(21,22), el cual se perfeccionó en 1962 convirtiéndose en el fluorescent treponemal antibody absorbed (FTA-Abs)(23); en 1967 se describió la primera prueba de hemaglutinación(24), que en 1969 se modificó bajo la denominación de microhemaglutinación (MHA-TP)(25); en 1975 apareció el enzimo inmuno ensayo (ELISA)(26).
A principios del siglo XXI comenzaron a difundirse, bajo la denominación genérica de pruebas rápidas de sífilis (PRS), una serie de técnicas treponémicas cuyo denominador común era el breve lapso en que se obtenía un resultado cualitativo(27), y que poseían uno o varios antígenos recombinantes de la bacteria(28), lo que permitió la mejora paulatina de su sensibilidad y especificidad, al punto que cada vez más países las utilizan como tamizaje durante la gestación.
Metodología de búsqueda de la información
Se efectuó una prolija y sistemática búsqueda de información relacionada con el tema, que solo tomó en consideración las fuentes impresas y electrónicas provenientes de revistas médicas indexadas en idioma español, inglés y francés, tesis de posgrado de universidades extranjeras, libros, manuales y folletos publicados por entidades gubernamentales y organismos internacionales.
Estadios clínicos de la sífilis
La interpretación de las pruebas inmunológicas requiere de un conocimiento elemental de la clínica de la sífilis, pues su sensibilidad y especificidad varían según la etapa de evolución de la enfermedad(29,30).
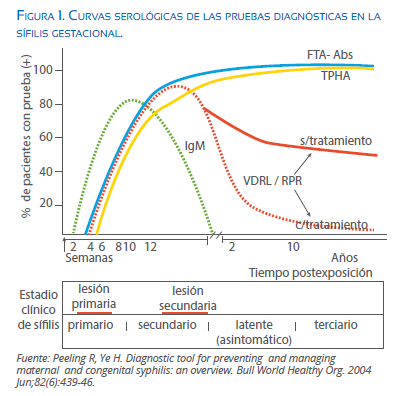
El período de incubación es generalmente de tres semanas(3,31,32), con extremos entre 9 a 90 días(32), luego de lo cual aparece el chancro duro, una lesión rica en treponemas, situada en el lugar de la inoculación(33), generalmente la vagina, el pene o el ano, pero puede ser extragenital(3,32), que desaparece espontáneamente entre 2 y 8 semanas(33). Esa lesión inicia la sífilis primaria, en la que la bacteria se multiplica en los ganglios y se distribuye por vía sanguínea a todos los órganos(29).
Al cabo de 2 a 12 semanas de la infección sobreviene la sífilis secundaria(33), cuya manifestación más común es el exantema, que afecta cualquier superficie corporal y desaparece espontáneamente. Puede reaparecer con menor intensidad por espacio de uno o dos años (fase de latencia precoz), hasta que desaparecen todos los signos y síntomas (fase de latencia tardía). Luego puede presentarse un período terciario con alteraciones mucocutáneas y de los sistemas óseo, cardiovascular y nervioso(29).
Reacción inmunológica ante la infección por el Treponema pallidum
La infección sifilítica induce una respuesta inmune muy compleja. En la etapa primaria se producen anticuerpos IgM (75%) e IgG (25%), luego la segunda permanece más elevada, aunque la IgM persiste después de la resolución del cuadro clínico(34). Tales anticuerpos se dirigen contra dos antígenos diferentes:
-
Los no treponémicos, antiguamente denominados reaginas, lo hacen contra el complejo antigénico cardiolipina-lecitina-colesterol(1,11,13), y son detectados por la RPR, VDRL, ELISA y USR(2,29,35).
Los treponémicos son específicos contra los determinantes antigénicos del Treponema pallidum(10,13,36), se detectan con la FTA-Abs, MHTP, TPI y las pruebas rápidas, cuyo método más común es la inmunocromatografía(15,32).
El período de ventana, que es el lapso que trascurre desde la infección hasta que las pruebas diagnósticas son capaces de detectar los anticuerpos, es variable. En la RPR y VDRL oscila entre 10 a 14 días después de la aparición del chan cro duro(31,37). El ELISA es más precoz, alrededor de 5 días después de la presentación de dicha lesión, la FTA-Abs entre 5 a 7 días, y la MHATP de 7 a 10 días, aunque es difícil corroborarlo en todos los casos(38).
La evolución natural de los títulos de anticuerpos varía según cada prueba (Figura 1). En las no treponémicas describe una curva que llega a su acmé durante el secundarismo, y va disminuyendo en la sífilis latente tardía(15); eso explica los resultados altamente variables, incluso algunos falsos negativos, que pueden ser observados en las fases tardías.
Características generales de las pruebas inmunológicas
Son muy pocos los casos de sífilis gestacional que se diagnostican por las manifestaciones clínicas. La gran mayoría requiere del tamizaje prenatal mediante pruebas inmunológicas, que idealmente debe ser precoz y universal, para instaurar el tratamiento oportuno y eliminar casi por completo sus graves consecuencias(9).
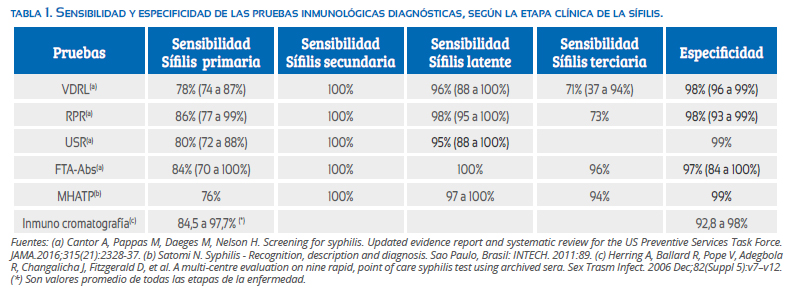
No existen pruebas inmunológicas específicas para la gestación. Los parámetros que se deben considerar para evaluar su idoneidad son la sensibilidad, especificidad, el valor predictivo positivo y negativo(35). Sin embargo, ello varía según el estadio de la enfermedad y la población estudiada (tabla 1). Las pruebas disponibles son de dos tipos(32,39):
-
No treponémicas que se utilizan como tamizaje y la evaluación de la eficacia del tratamiento(33,40). Tienen una baja sensibilidad en la sífilis primaria temprana, y por su inespecificidad pueden presentar resultados falsamente reactivos(29,40). Las más empleadas son la RPR y VDRL, la primera tiene mayor sensibilidad en la etapa primaria y en el resto de la enfermedad es semejante al VDRL(28); la especificidad de ambas es similar (98%)(28,30,41,42). En los últimos años, la RPR ha sido más utilizada por tener una técnica y una lectura más sencillas(43).
La RPR y VDRL pueden presentar el fenómeno de prozona(32,33,44,45), que ocurre entre 1 y 2% de la sífilis secundaria(37,46,47) -aunque puede llegar hasta el 10%(37)como consecuencia que los anticuerpos circulan en exceso, están incompletos o bloquean la reacción antígeno-anticuerpo, reduciendo artificialmente los títulos. En algunos casos incluso pueden dar resultados falsamente negativos(30). Cuando el laboratorio tiene la información adecuada, desarrollará una variante de la técnica para desbloquear dicho fenómeno(41).
Presentan falsos positivos, que se dividen en agudos y crónicos. Los primeros persisten como máximo seis meses, y entre ellos tenemos: hepatitis, mononucleosis infecciosa, neumonía viral, varicela, sarampión, otras infecciones virales, malaria, inmunizaciones, error de laboratorio y embarazo(48); en este último caso puede fluctuar entre 20 y 40%(49). Los crónicos perduran más de seis meses y se asocian a enfermedades del tejido conectivo, anomalías de las inmunoglobulinas, adicciones a narcóticos, lepra, neoplasias malignas y vejez(50). En todos estos casos, los títulos suelen ser iguales o menores a 4 diluciones(11,32,43).
Presentan falsos negativos en el período de ventana, inmunodeficiencias de causas diversas, fenómeno de prozona(51), y en las fases muy tardías de la enfermedad(10).
La seroreversión de las pruebas no treponémicas luego del tratamiento es un proceso lento, que depende de la etapa de la enfermedad en que fue administrado(52,53). En la sífilis primaria se hacen no reactivas entre los 6 y 12 meses después de la aplicación de dicha terapia; en la secundaria, de 12 a 18 meses(15,25,54); en la infección latente temprana se puede observar una reducción significativa de los títulos luego de los 12 meses(42), y en la latente o sintomática tardía la terapia tiene poco efecto en los títulos y no debería emplearse para estimar su eficacia(15,25). Se necesita un cambio de dos diluciones en el título para demostrar una diferencia clínicamente significativa entre dos pruebas consecutivas(32). En los pacientes con historia de sífilis tardía tratada adecuadamente, el aumento de una dilución no tiene significación clínica, pero a partir de dos diluciones debe sospecharse de reinfección o reactivación.
En algunos pacientes tratados en etapas latentes o tardías, los anticuerpos no treponémicos pueden persistir a bajo título durante un largo período, a veces de por vida; esto se conoce como la ‘reacción serofast’(55-58); ello no significa necesariamente un fracaso terapéutico(30). Existen pacientes que no han recibido terapia y pueden hacerse espontáneamente negativos después de varios años(11), debido a la curva descendente que experimentan naturalmente los títulos de anticuerpos en las fases tardías de la enfermedad(15). La interpretación de la serología de la sífilis es idéntica en caso de coinfección con VIH, aunque se puede observar un incremento de los falsos positivos(59) y del fenómeno prozona(37).
En el diagnóstico de la neurosífilis se utiliza como espécimen el líquido céfalo raquídeo (LCR) y la prueba de elección es la VDRL(49,60), que tiene una especificidad excelente, pero una pobre sensibilidad (27 a 52%)(61,62). La RPR no está estandarizada para procesar el LCR(40).
-
Las treponémicas se han empleado tradicionalmente como pruebas confirmatorias, aunque carecen de utilidad para monitorear la eficacia del tratamiento, ya que permanecen positivas en el 85 a 90% de los casos que recibieron tratamiento previamente(40); por tanto, no indican si la enfermedad está activa o curada(13,41) y por esa razón no tiene ningún sentido práctico titularlas. Son más específicas que las no treponémicas, pero no están exentas de reacciones falsas(41).
La FTA-Abs es altamente precoz y sensible en la sífilis primaria(31), las falsas reacciones ocurren en el 1%(37,41,45), y se presentan en el lupus eritematoso sistémico(25), diabetes tipo I, enfermedad de Lyme, infecciones virales como el Herpes simplex y Epstein Barr(37) y otras treponematosis patógenas(51).
La MHA-TP tiene una sensibilidad de 98 a 99%, los falsos positivos son infrecuentes, alrededor de 1%(45), y se observan en la mononucleosis infecciosa, lepra, colagenopatías, borreliosis, otras treponematosis patógenas y en los adictos a drogas por vía parenteral(51).
La TPI es altamente específica, pero al ser muy laboriosa, se realiza en laboratorios de investigación. Por años se le consideró el estándar de oro(2). En el futuro probablemente será reemplazada por la reacción en cadena de la polimerasa (PCR).
Las pruebas rápidas para el diagnóstico de sífilis y las duales (VIH y sífilis) se han empleado más recientemente como ensayos de tamizaje en algunos algoritmos de secuencia inversa(10). En comparación con la MHATP, su sensibilidad oscila entre 85 y 98% y la especificidad de 93 a 98%(32).
Todas las pruebas inmunológicas, sin excepción, deben efectuarse siguiendo estrictamente las indicaciones de cada fabricante, y contar con controles de calidad internos y externos para garantizar la fiabilidad de sus resultados(10).
AlgoritMos para el diagnóstico de sífilis en gestantes
En nuestro país, durante varios lustros, el algoritmo diagnóstico para la sífilis gestacional solo contemplaba el tamizaje mediante una prueba no treponémica, usualmente la RPR y VDRL, que en caso de resultar reactiva requería la confirmación con una prueba treponémica, comúnmente la FTA-Abs y MHATP.
En febrero de 2010 se inició el proyecto ‘Cura inmediata de la sífilis neonatal (CISNE)’, una investigación de la Universidad Peruana Cayetano Heredia, que introdujo un algoritmo inverso, que empleaba como prueba de tamizaje a la PRS por el método de inmunocromatografía. Al cabo de dos años, los resultados demostraron que la tasa de positividad fue mayor que la del protocolo tradicional, siendo capaz de detectar gestantes con sífilis latente no diagnosticadas por su antecesor(44,63), entre otras causas, por la mayor sensibilidad de las pruebas treponémicas respecto a las no treponémicas(64). Sin embargo, ello no es óbice para continuar evaluándolo en relación al diagnóstico definitivo de los casos positivos, pero que no cumplen estrictamente los criterios de actividad de la enfermedad(65).
En diciembre de 2010, el Instituto Nacional Materno Perinatal adoptó la PRS como única prueba de tamizaje en gestantes(65) y, en agosto de 2014, el Ministerio de Salud aprobó la Norma Técnica de Salud N° 108 que incorporó a la PRS y las pruebas duales para VIH y sífilis en dicho tamizaje, aunque mantuvo como alternativa el uso de la RPR(66). Los resultados de las pruebas duales deben interpretarse individualmente, siguiendo las recomendaciones de la normativa nacional e internacional(66,67).
Protocolo que utiliza la rpr como prueba de tamizaje
Cuando la RPR resulta reactiva, es obligatorio que el reporte sea cualitativo y cuantitativo, para definir la línea basal a partir de la cual se observará la evolución de los títulos, según la etapa de la enfermedad en que se administró el tratamiento(11). Dicho resultado será corroborado mediante una prueba treponémica. Si esta resulta positiva quedará confirmado el diagnóstico(66), si es negativa es altamente probable que estemos frente a un falso positivo de la RPR.
Si la RPR es no reactiva, el reporte solo es cualitativo, considerándose que la gestante no está infectada, salvo que existan antecedentes epidemiológicos que obliguen a efectuar su seguimiento(68).
Protocolo que utiliza la prs o la prueba dual VIH-sífilis como prueba de tamizaje
La PRS y la prueba dual VIH-sífilis solo son cualitativas y al igual que las otras treponémicas no disciernen si la infección está activa o es una anteriormente tratada, ya que los anticuerpos persisten por largo tiempo(35). Cuando son positivas es obligatorio realizar la RPR para definir tal situación(67,69):
-
Si la RPR no es reactiva, se sugiere efectuar una prueba treponémica distinta (FTA-Abs o MHA-TP) para darle mayor fiabilidad al diagnóstico(70). Las causas de la discordancia podrían ser una cicatriz inmunológica, periodo de ventana más prolongado que el FTA-Abs, ELISA y MHA-TP(38), error de laboratorio y con menos frecuencia una reacción inespecífica de la prueba rápida.
-
Si la RPR es reactiva con un título menor a 8 diluciones, y más aún si existen antecedentes de diagnóstico y/o tratamiento, es probable que estemos frente a una cicatriz inmunológica, y con menos frecuencia un error de laboratorio.
-
Si la RPR es reactiva con un título igual o mayor a 8 diluciones, es un caso de sífilis activa que debe recibir tratamiento, el cual será monitoreado con la RPR(65), a partir del mes posterior a su administración, siendo repetida a los 3, 6, 12 y 24 meses(9,11). La evolución de los títulos debe seguir los parámetros definidos para cada estadio de la enfermedad(15,25). En caso contrario hay que evaluar esta eventualidad. No se han reportado cepas de Treponema pallidum resistentes a la penicilina(9,42). Por ello no debe considerarse entre las causas de fracaso terapéutico.
En ambos protocolos es indispensable evaluar a la pareja o parejas sexuales de la gestante, con el propósito de cortar el círculo del contagio. Incluso la norma nacional vigente establece que se debe iniciar tratamiento sin necesidad de efectuar las pruebas diagnósticas(66). La sífilis no genera inmunidad duradera, el individuo puede infectarse tantas veces como contactos sexuales tenga con enfermos activos(71), aunque persistan ciertos anticuerpos(38).
También es obligatorio prevenir la sífilis neonatal(42), tomando en cuenta los cuatro escenarios señalados por la norma nacional vigente(66). Existen tres pruebas de laboratorio específicas -FTAAbs IgM, ELISA Captia IgM e Inmunoblot IgM(5,51,60) , considerándose diagnóstico el hallazgo de esta inmunoglobulina, aunque su negatividad no descarta dicha patología, debiendo repetirse mensualmente hasta los tres meses de vida(15).
Conclusiones
1. No existe la prueba diagnóstica ideal para la sífilis gestacional, que en teoría debe ser altamente sensible y específica, adecuada para monitorear la respuesta al tratamiento, ser negativa después de la terapia eficaz y demostrar claramente una reinfección(28). Todas las actuales tienen limitaciones, que hacen necesario su empleo secuencial, en diversos algoritmos.
2. El algoritmo tradicional tamiza a las gestantes con ensayos no treponémicos (VDRL, RPR y USR), cuya reactividad obliga a la titulación y luego a la confirmación mediante las treponémicas (FTA-Abs y MHA-TP). Los algoritmos más recientes emplean una lógica inversa, es decir, utilizan como tamizaje pruebas treponémicas, usualmente por inmunocromatografía, que cuando son positivas obligan a efectuar la RPR, con el fin de establecer la actividad de la enfermedad.
3. La sensibilidad, especificidad y los valores predictivos positivo y negativo de cada tipo de prueba depende de varios factores, entre otros la etapa de la enfermedad, la población estudiada y la idoneidad del laboratorio, lo que puede dificultar su interpretación.
4. El conocimiento de su correcto empleo y adecuada interpretación permitirá el diagnóstico oportuno y el eficaz tratamiento de la sífilis gestacional y subsecuentemente la erradicación de la sífilis congénita(5).
Declaración: Este artículo no ha sido publicado previamente o remitido a otra revista biomédica.
Fuente de financiamiento: El autor ha cubierto íntegramente con su propio peculio los gastos que ha irrogado la elaboración de este artículo.
Conflicto de intereses: El autor declara que no tiene conflicto de intereses al desarrollar el presente artículo.
Citar como: Álvarez Carrasco RA. Interpretación de las pruebas diagnósticas de sífilis en gestantes. Rev Peru Ginecol Obstet. 2018;64(3):345-352
Referencias Bibliográficas
1. Neira F. Sífilis congénita. Sociedad Colombiana de Pediatría. Curso Continuo de Actualización en Pediatría. 2005; 5(1):41-48. [ Links ]
2. Carradas T. Sífilis: actualidad, diagnóstico y tratamiento. Rev Fac Med UNAM. 2003; 46(6):236-42. [ Links ]
3.Smith B. The development of novel antigens for improved syphilis diagnosis (Tesis de Maestría). Victoria-Canadá: Universidad de Victoria. 2012:2pp. [ Links ]
4. Ahumada C, Hanna M, Villadiego M. Sífilis gestacional: enfermedad de interés en salud pública, Córdoba Colombia, 2015. Rev Cuid. 2017;8(1):1449-58. doi: https:// doi.org/10.15649/cuidarte.v8i1.350. [ Links ]
5. Vargas K, Mena C, Toledo M, Valencia A. Sífilis la gran simuladora. Dermatol Rev Mex. 2014; 58:40-47. [ Links ]
6. Zenker P, Rolfs R. Treatment of syphilis. Rev Infect Dis. 1990; 12(Suppl 6):S590-S609. [ Links ]
7. Wicher V, Wicher K. Pathogenesis of maternal-fetal syphilis revisited. Clinical Infectious Diseases. 2001 Ago 1; 33(3):354-363. doi: https://doi.org/10.1086/321904. [ Links ]
8. Emerson C. Syphilis: A review of the diagnosis and treatment. Open Infect Dis J. 2009;3:143-7. [ Links ]
9. Samalvides-Cuba F, Banda-Flores C. Sífilis en la gestación. Rev Per Ginecol Obstet. 2010;56(3):202-8. [ Links ]
10. Organización Panamericana de la Salud, Organización Mundial de la Salud, Centros para el Control y la Prevención de las Enfermedades EE. UU. Prácticas con respecto a las pruebas de diagnóstico de la sífilis en la región de las Américas: resultados en la encuesta realizada en 2014. Washington DC, Estados Unidos de América: Organización Panamericana de la Salud. 2016:8,15,16,26-28. http://iris.paho.org/xmlui/bits tream/handle/123456789/34107/practicas_pruebas_spa.pdf?sequence=1&isAllowed=y. [ Links ]
11. Ratnam S. The laboratory diagnosis of syphilis. Can J Infect Dis Med Microbiol. 2005 Jan;16(1):45-51. [ Links ]
12. García P, Grassi B, Fich F, Salvo A. Diagnóstico de la infección por Treponema pallidum en pacientes con sífilis temprana y neurosífilis mediante reacción de la polimerasa en cadena. Rev Chil Infect. 2011; 28(4):310-315. doi: 10.4067/S0716-10182011000500002. [ Links ]
13. Tran A. Innovative testing strategies for the diagnosis of syphilis (Tesis doctoral en Salud Pública). Berkeley-Estados Unidos de América: Universidad de California. 2013:1,8 pp. [ Links ]
14. Álvarez R. Apuntes para la historia de la Patología Clínica en el Perú 1850-1950. Primera edición. Lima, Perú: Editora impresora Amarilys; 2004:51,232. [ Links ]
15. Sanguineti-Díaz A, Rodríguez J. Actualización en el diagnóstico de la sífilis. Dermatol Perú. 2004; 14(3):192-9. [ Links ]
16. Funes J, Cutler J, Levitan S, Portnoy J, Funes R. Estudios serológicos y clínicos con referencia a la sífilis en Guatemala, Centro América. Bol Oficina Sanit Panam. 1953 Ene;34(1):15-8. [ Links ]
17. Pangborn M. A new serologically active phospholipid from beef heart. Proc Soc Exp Biol Med. 1941;48:484-6. [ Links ]
18. Portnoy J, Brewer J, Harris A. Rapid plasma reagin card test for syphilis and other treponematoses. Public Health Rep. 1962;77:645–52. [ Links ]
19. A history of shypilis and its laboratory diagnosis. IBMS Congress 2007 – History Committee. Disponible: https://www.ibms.org/.../history-of-syphilis/history-of-syphilis.pdf. Acceso: 23 de marzo de 2018. [ Links ]
20. Nelson R, Mayer M. Immobilization of Treponema pallidum in vitro by antibody produced in syphilitic infection. J Exp Med. 1949; 89:369-93. [ Links ]
21. Deacon W, Falcone V, Harris A. A fluorescent test for treponemal antibodies. Proc Soc Exp Biol Med. 1957; 96:477-80. [ Links ]
22. Carpenter C, Boak R, Miller J, Le Clair R. Serologic diagnosis of syphilis. California Medicine. 1965; 102(1):14-6. [ Links ]
23. Deacon W, Hunter E. Treponemal antigens as related to identification and syphilis serology. Proc Soc Exp Biol Med. 1962;110:352-6. [ Links ]
24. Rathlev T. Haemagglutination test utilizing pathogenic Treponema pallidum for the sero-diagnosis of syphilis. Br J Vener Dis. 1967; 43:181-5. [ Links ]
25. Corrales H. Sífilis, algunos aspectos de interés. Eev. Med. Hondue. 1975; 43:49-70. [ Links ]
26. Veldkamp J, Visser A. Application of the enzyme-linked immunosorbent assay (ELISA) in the serodiagnosis of syphilis. Br J Vener Dis. 1975; 51:227-31. [ Links ]
27. Peeling R, Holmes K, Mabey D, Ronald A. Rapid tests for sexually transmitted infections (STIs): the way forward. Sex Transm Infect. 2006 Dec; 82(Suppl 5):v1-6. [ Links ]
28. Satomi N. Syphilis Recognition, Description and Diagnosis. Sao Paulo, Brasil: INTECH. 2011:95,100,101,117. [ Links ]
29. Quattordio L, Milani P, Milani H. Diagnóstico serológico de sífilis. Acta Bioquím Clin Latinoam. 2004; 38(3):301-6. [ Links ]
30. Larsen S, Steiner B, Rudolph A. Laboratory diagnosis and interpretation of tests for syphilis. Clinical Microbiology Reviews. 1995; 8(1):1-21. [ Links ]
31. Gatti J, Cardama J. Manual de Dermatología. Octava edición. Buenos Aires Argentina: Librería editorial El Ateneo. 1980:169-172,190. [ Links ]
32. WHO guidelines treatment Treponema pallidum (syphilis). Ginebra: Servicio de producción documentaria de la Organización Mundial de la Salud. 2016:10,12,13. [ Links ]
33. Contreras E, Zuluaga S, Ocampo V. Sífilis: la gran simuladora. Infectio. 2008;12(2):340-7. [ Links ]
34. Salazar J, Hazlett K, Radolf J. The immune response to infection with Treponema pallidum, the stealth pathogen. Microbes Infect. 2002 Sep;4(11):1133-40. [ Links ]
35 El uso de las pruebas rápidas para sífilis. Programa especial de investigación y enseñanzas sobre Enfermedades Tropicales/Organización Mundial de la Salud. Disponible: whqlibdoc.who.int/hq/2007/TDR_SDI_06.1_spa.pdf?ua=1. Acceso: 08 de abril de 2018. [ Links ]
36. Angel G, Ángel M. Interpretación clínica del laboratorio. Séptima edición. Bogotá, Colombia: Panamericana Formas e Impresos S.A. 2010:79. [ Links ]
37. Chernieski T. An update and review of the diagnosis and management of syphilis. New York, Estados Unidos de América: Department of health and mental higiene – New York City. 2006:14-16,31,32. [ Links ]
38. Farhi D, Dupin N. Diagnostic sérologique de la syphilis. Ann Dermatol Venereol. 2008 May; 135(5):418-25. doi: 10.1016/j.annder.2008.02.007. [ Links ]
39. Bisso A, Candiotti J. Terapéutica Médica. Décima octava edición. Lima: REP SAC. 2018:328. [ Links ]
40. Procedimiento técnico para el diagnóstico serológico de sífilis. Santiago de Chile: Instituto de Salud Pública. 2015:4,5,11,13. [ Links ]
41. Forero N, Peña M. Manifestaciones dermatológicas de la sífilis. Med UIS. 2011;24(2):217-29. [ Links ]
42. Casas R, Rodríguez M, Rivas J. Sífilis y embarazo: ¿Cómo diagnosticar y tratar oportunamente? Rev Colom Obstet Ginecol. 2009;60(1):49-56. [ Links ]
43. Moraes M, Estevan M. Actualización en sífilis congénita temprana. Arch Pediatr Urug. 2011; 83(1):35-9. [ Links ]
44. Mera B, Batthar S, Saxena S, Rawat D, Bhalla P. Evaluation of SD BIOLINE Syphilis 3.0 for Rapid Diagnosis of Syphilis: Report from a Regional Sexually Transmitted Infection Reference Laboratory in North India. J Lab Physicians. 2016 Jan-Jun; 8(1): 36–40. doi: 10.4103/09742727.176239 [ Links ]
45. Manual de procedimientos técnicos para el diagnóstico serológico de sífilis. Instituto Nacional de Salud. Segunda edición. Lima, Perú: Art Lautrec SRL. 1997:19,27,30,32. [ Links ]
46. Spangler A, Jackson J, Fiumara N, Warthin T. Syphilis with a negative blood test reaction. JAMA. 1964;189(2):87–90. [ Links ]
47. Jurado R, Campbell J, Martin P. Prozone Phenomenon in Secondary Syphilis: Has Its Time Arrived? Arch Intern Med. 1993;153(21):2496-98. [ Links ]
48. Grossman I, Peery T. Biologically false-positive serologic tests for syphilis due to smallpox vaccination. Am. J. Clin. Pathol. 1969 Mar;51(3):375-8. [ Links ]
49. Guía diagnóstico y manejo de la sífilis en el embarazo y prevención de la sífilis congénita. Primera edición. Hermosillo: Gobierno del Estado de Sonora. 2012:11-5. [ Links ]
50. Tuffanelli D. Aging and false-positive reactions for syphilis. Br. J. Vener. Dis. 1966 Mar; 42(1):40–1. [ Links ]
51. Diagnóstico situacional de sífilis materna y sífilis congénita. San Salvador: Ministerio de Salud. 2010:21,22. [ Links ]
52. Wicher K, Horowitz HW, Wicher V. Laboratory methods of diagnosis of syphilis for the beginning of the third millennium. Microbes Infect. 1999 Oct;1(12):1035-49. [ Links ]
53. Romanowski B, Sutherland R, Fick G, Mooney D, Love E. Serologic response to treatment of infectious syphilis. Ann Intern Med. 1991 Jun 15;114(12):1005-9. [ Links ]
54. Fröhlich D, Graf N, Lauten S, Weber R, Bosshard P. Serological response to treatment of syphilis according to disease stage and HIV status. Clin Infect Dis. 2012 Dec 15;55(12):1615–22. https://doi.org/10.1093/cid/cis757 [ Links ]
55. Hook E, Marra C. Acquired syphilis in adults. N Engl J Med. 1992 Apr 16;326(16):1060-9. [ Links ]
56. Fiumara N. Serologic responses to treatment of 128 patients with late latent syphilis. Sex Transm Dis. 1979 Oct-Dec;6(4):243-6. [ Links ]
57. Clement M, Okeke N, Hicks C. Treatment of syphilis: a systematic review. JAMA. 2014 Nov 12;312(18):1905-17. doi: 10.1001/jama.2014.13259. [ Links ]
58. Ghanem K, Workowski K. Management of adult syphilis. Clin Infect Dis. 2011 Dec;53(suppl 3):S110-28. doi: 10.1093/cid/cir701. [ Links ]
59. Dupin N. Actualité sur la syphilis. La Lettre de l’Infectiologue. 2013 Mai-Jui;28(3):88-92.
60. Regazzi J, Bottino G. Syphilis: diagnosis, treatment and control. An Bras Dermatol. 2006 Mar-Apr;81(2):111-26. http://dx.doi.org/10.1590/S0365-05962006000200002. [ Links ]
61. Davis LE, Schmitt JW. Clinical significance of cerebrospinal fluid tests for neurosyphilis. Ann Neurol. Jan 1989;25(1):50-5. [ Links ]
62. Marra C, Critchlow C, Hook E, Collier A, Lukehart S. Cerebrospinal fluid treponemal antibodies in untreated early syphilis. Arch Neurol. Jan 1995;52(1):68-72. [ Links ]
63. Nah E, Cho S, Kim S, Cho H, Chai J. Comparison of Traditional and Reverse Syphilis Screening Algorithms in Medical Health Checkups. Ann Lab Med. 2017 Nov;37(6):511-5. doi: 10.3343/alm.2017.37.6.511. [ Links ]
64. Landry M, Peaper D. Syphilis testing using the reverse algorithm: an update. Laboratory updates: Clinical virology and microbiology. Yale New Haven Hospital.Disponible: https://medicine.yale.edu/labmed/sections/virology/Syphilis%20Testing%20Reverse%20Algorithm%20Update_322879_284_36854_v1.pdf. Acceso: 09 de abril de 2018. [ Links ]
65. Guía de práctica clínica y procedimientos en obstetricia y perinatología. Adenda: Guía de práctica clínica: atención de la gestante con sífilis. Lima: Instituto Nacional Materno Perinatal. 2010:4-6,9,10. [ Links ]
66. Norma Técnica N° 108-MINSA/DGSP-V.01. Norma técnica de salud para la prevención de la transmisión madre-niño del VIH y la sífilis. Aprobada por Resolución Ministerial N° 619-2014/MINSA. Lima, 18 de agosto de 2014:18,20-23,40,41. [ Links ]
67. The Global Elimination of Congenital Syphilis: rational and strategy for action. Ginebra, Suiza: World Health Organization. 2007:7-9,27. [ Links ]
68. Pestoni C, Lado F, Cabarcos A, Sánchez D. Sífilis: perspectivas terapéuticas actuales. An Med Interna Madrid. 2002;19(2):89-95. [ Links ]
69. Workowski K, Berman S. Sexually Transmitted Diseases Guidelines, 2010. Morbidity and Mortality Weekly Report. 2010 Dec 11;(59)RR12:26-40. [ Links ]
70. Binnicker M, Jespersen D, Rollins L. Treponema-specific tests for serodiagnosis of syphilis: comparative evaluation of seven assays. J Clin Microbiol. 2011 Apr;49(4):1313-7. doi: 10.1128/JCM.02555-10. [ Links ]
71. Recommendations en santé publique: évaluation a priori du dépistage de la syphilis en France. Synthèse et perspectives. Spectra Biologie. 2007 Dec;163:34-47. [ Links ]
Correspondencia:
Jirón Junín N° 238, departamento 505, Magdalena del Mar.
950 – 830526 / 328 – 2082 / 495 – 8977
Recibido:26 abril 2018
Aceptado:9 junio 2018