Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Ginecología y Obstetricia
versión On-line ISSN 2304-5132
Rev. peru. ginecol. obstet. vol.64 no.3 Lima jul./set. 2018
http://dx.doi.org/https://doi.org/10.31403/rpgo.v64i2096
ARTÍCULO DE REVISIÓN
Restricción de crecimiento fetal y factores angiogénicos: un nuevo horizonte
Fetal growth restriction and angiogenic factors: a new horizon
Rommel Omar Lacunza Paredes1,2,4, Jorge Ávalos Gómez3,4
1 Médico Gineco-Obstetra, Hospital Nacional Daniel Alcides Carrión, Callao, Perú
2 Centro de Medicina Fetal CENMEF, Lima, Perú
3 Médico Gineco-Obstetra, Servicio de Obstetricia de Alto Riesgo, Hospital Guillermo Almenara Irigoyen, Lima, Perú
4 Fetalia, Grupo de Medicina Materno Fetal
ABSTRACT
Fetal growth restriction is intimately linked to the placental function due to its failure of adequately nurture and oxygenate the fetus, with consequences in the short and long term. The search for the best definition and best diagnostic biomarkers has currently led to angiogenic factors closely related to the placenta formation and development. Placenta hypoperfusion has been linked to alterations in the levels of angiogenic factors, and it is proposed that these could help to differentiate the fetuses truly affected by chronic hypoxia even before the late adaptive hemodynamic changes are evident by Doppler ultrasound. This could have implications not only in the definition of growth restriction but also in the potential prediction of the event.
Key words: Intrauterine growth restriction, Angiogenesis, Uteroplacental insufficiency.
RESUMEN
La restricción de crecimiento fetal está íntimamente ligada a la función placentaria por el fracaso de la adecuada nutrición y oxigenación del feto, con múltiples consecuencias a corto y largo plazo. La búsqueda de la mejor definición y de los mejores biomarcadores diagnósticos actualmente se dirige a los factores angiogénicos. Estos factores se relacionan estrechamente con la formación y desarrollo placentario. En la hipoperfusión placentaria se ha hallado alteraciones en los niveles de los factores angiogénicos, por lo que estos factores podrían ayudar a diferenciar a los fetos verdaderamente afectados por hipoxia crónica aún antes que los cambios hemodinámicos adaptativos tardíos sean evidenciables en la ultrasonografía Doppler. Esto podría tener implicancias no solo en la definición de restricción de crecimiento sino también en la potencial predicción del evento.
Palabras clave. Restricción de crecimiento intrauterino, Angiogénesis, Insuficiencia uteroplacentaria.
Introducción
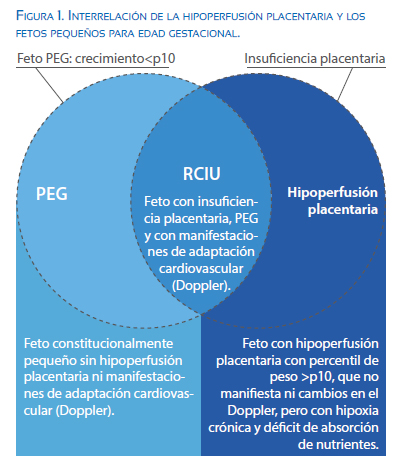
Para entender la compleja relación entre la restricción de crecimiento intrauterino (RCIU) y los factores angiogénicos, se debe primero recordar el concepto de RCIU. Teóricamente, en la RCIU el feto no logra su potencial de crecimiento genético durante la gestación, actualmente operativizado como el ponderado fetal menor al percentil 10 (p10) de crecimiento para la edad gestacional. Ello intenta delimitar la población de fetos con mayor frecuencia de malos resultados perinatales a corto y largo plazo. Sin embargo, al encontrar un grupo de fetos con peso menor a p10 pero con resultado perinatal bueno (pequeños para edad gestacional (PEG)) inicia la controversia sobre la pertinencia de la definición operacional que se debe adoptar(1,2)(figura 1).
En este contexto, surge la necesidad de un biomarcador que ayude a diferenciar los RCIU de los PEG. Actualmente se propugna la utilización de la flujometría Doppler como la mejor opción disponible en la práctica clínica. Esta prueba permite valorar las alteraciones hemodinámicas al medir las resistencias y velocidades en los vasos fetales (fenómenos adaptativos) producto de la hipoxia crónica y la inadecuada nutrición2. La secuencia evolutiva del deterioro en la flujometría Doppler expresa el paulatino aumento de la morbilidad y mortalidad perinatal, conforme progresan los cambios en los diversos vasos fetales1,2. Estas alteraciones de los fenómenos hemodinámicos no ocurren en los fetos PEG constitucionales. De esta forma, al aplicar el Doppler a una población de riesgo (la cual se delimita por el peso menor a p10) optimiza el diagnóstico de RCIU de causa placentaria (figura 1).
La placenta, insuficiencia placentaria y RCIU
Es fundamental entender la insuficiencia placentaria, al ser la etiología principal en la RCIU. Esta se entiende como la incapacidad de la placenta de ofertar los recursos necesarios (nutricionales y oxigenatorios) que demanda el feto para su adecuado desarrollo y crecimiento. Recordar que estas necesidades varían de acuerdo con el momento de la gestación, siendo mayores durante la segunda mitad (específicamente en el último trimestre) donde el desarrollo y madurez fetal son priorizados.
El fenómeno fisiopatológico del fallo placentario en la RCIU está relacionado a la inadecuada invasión de las arterias uterinas por las células del trofoblasto; ellas mantienen su alta resistencia con la consiguiente producción de flujo deficiente, turbulento y de alta velocidad dentro del espacio intervelloso. Esto genera estrés sobre el endotelio de la vellosidad corial y altera la absorción de nutrientes (desnutrición fetal) así como también de oxígeno (hipoxia fetal crónica) (3,4). La hipoxia crónica a su vez genera la inadecuada formación de las vellosidades coriales en estadios tempranos del desarrollo placentario, aumentando la hipoperfusión de oxígeno y generando un ciclo de agravamiento de la hipoxia durante el desarrollo de la placenta a lo largo de la gestación(3,5).
Uno de los fenómenos cruciales para la adecuada implantación placentaria es la angiogénesis. Los factores de crecimiento vascular (angiogénicos) intervienen en la gestación desde la implantación, haciendo posible que el trofoblasto logre una adecuada invasión de las arterias espirales(3). Posteriormente, en el desarrollo de las vellosidades coriales, los factores de crecimiento permiten tanto el aumento del número como la adecuada maduración de las vellosidades(3,5). Este aumento del número de vellosidades coriales se mantiene hasta aproximadamente el segundo trimestre y posteriormente únicamente se produce la maduración de las ya existentes(3,6). La familia de factores de crecimiento endotelial (VEGF por sus siglas en inglés vascular endothelial growth factor) incluye a VEGF-A, PlGF (placental growth factor), VEGF-B, VEGF-C y VEGF-D. Cumplen funciones angiogénicas, induciendo la generación de nuevos vasos, al actuar en sus receptores celulares como el VEGFR-1 (también llamado Flt-1 por sus siglas del inglés fms-like-tyrosine-kinase receptor). La fracción soluble del VEGFR-1 (sFlt-1) antagoniza los efectos del VEGF-A y el PlGF al impedir en el suero la unión al receptor celular, por lo cual su efecto podría denominarse antiangiogénico(7,8). A lo largo de la gestación los niveles de PlGF en suero materno aumentan progresivamente hasta el segundo trimestre de la gestación (pico máximo a las 30 semanas) para luego disminuir progresivamente, estableciendo valores de normalidad para cada edad gestacional(9). La presente revisión se enfocará principalmente en PlGF y sFlT-1 en la gestación.
Del doppler a los factores antiangiogénicos, en el diagnóstico de la RCIU
Una de las grandes preguntas en la RCIU es cómo poder diferenciar a los PEG de los fetos pequeños afectados por insuficiencia placentaria (RCIU). Los parámetros actualmente utilizados de la ultrasonografía Doppler valoran signos de ‘redistribución’ en los flujos sanguíneos fetales de zonas específicas (arteria umbilical, arteria cerebral media (ACM), istmo aórtico, ductus venoso); pero estos parecen ser cambios tardíos en la cascada de deterioro hipóxico, por lo que su capacidad diagnóstica estaría limitada a los casos con hipoxemia marcada. Se debe también considerar que no todos los fetos con RCIU parecen mostrar estos cambios adaptativos hemodinámicos a la hipoxia crónica.
Inicialmente se utilizó la onda de flujo de la arteria umbilical para evidenciar insuficiencia placentaria severa en los RCIU de inicio temprano. Pero actualmente se conoce que se requiere la pérdida de cerca del 30 a 50% del lecho vascular placentario para evidenciar alteraciones en la onda(2). Sin embargo, este fenómeno es poco común al final de la gestación, por lo cual pierde utilidad en los casos de RCIU tardío. Entonces, ahora se entiende que mucho antes de tener un resultado alterado (al Doppler) existe ya compromiso del lecho vascular placentario; sin embargo, la ultrasonografía Doppler de la arteria umbilical aún no lo puede evidenciar. De la misma forma, la vasodilatación de la ACM (disminución de la resistencia IP<p5) en los casos de RCIU es un fenómeno tardío, conociendo que otros vasos y zonas cerebrales muestran vasodilatación mucho antes que la ACM. Entonces, la vasodilatación evidenciable al Doppler de la ACM expresa ya un daño (mínimo) a nivel cerebral, por lo que actualmente no se considera como un fenómeno protector como anteriormente(10). En el caso del ductus venoso, sabemos que es un marcador de falla cardiaca fetal (disfunción diastólica) y expresa un estado hipóxico severo, por lo que su valor está limitado a los estadios finales del deterioro por hipoxia crónica(1,2,11).
Por otro lado, un vaso no fetal como la arteria uterina también tiene importancia en el estudio de la RCIU. Una elevada resistencia al flujo en la arteria uterina teóricamente expresa la insuficiente transformación de los vasos uterinos por el trofoblasto en las primeras etapas de la gestación(1,2). Un índice de pulsatilidad (IP) elevado o la presencia de escotadura proto-diastólica (nocht) establecerían la sospecha de una inadecuada invasión, pudiendo predecir que la placenta sufrirá hipoperfusión crónica y progresivamente no podría satisfacer las necesidades metabólicas del feto (insuficiencia placentaria); sin embargo, estos resultados no se han replicado en todos los casos de RCIU(1). En general se puede observar que la capacidad diagnóstica del Doppler en la insuficiencia placentaria se limita a estadios de hipoxia establecida (dependiendo los vasos que se evalúen).
Este panorama establece la necesidad de biomarcadores que expresen estadios más tempranos de patología hipóxica placentaria, permitiendo identificar poblaciones con alto riesgo y así poder diferenciar a los fetos verdaderamente afectados por insuficiencia placentaria.
La relación entre los hallazgos de la ultrasonografía Doppler y los signos anatomopatológicos de hipoperfusión placentaria fue estudiada por Parra, quien reporta en fetos con peso menor al p10 y con Doppler de arteria umbilical normal (IP ≤p95) que 53,7% tenían signos de hipoperfusión placentaria (definida por anatomopatología). En estos casos, los vasos con alteraciones significativas del Doppler fueron la arteria uterina (IP ≥p95) y la vena umbilical (flujo sanguíneo por la vena umbilical ≤ 82 mL/min/kg). Propone entonces que estas alteraciones al Doppler podrían constituirse como biomarcadores de insuficiencia placentaria al reflejar la hipoperfusión placentaria(12). De la misma forma, otra serie publicada encuentra asociación entre los signos de hipoperfusión placentaria con el mayor riesgo de acidosis metabólica al nacer (33% vs 14,3%) y de cesárea de emergencia por cardiotocografia intraparto alterada (44% vs 21%)(13).
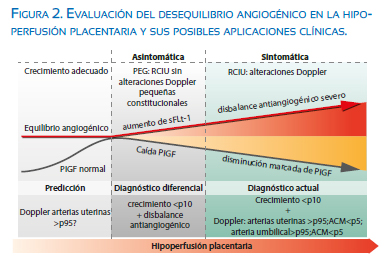
Recientes estudios de factores angiogénicos en gestantes con preeclampsia con y sin RCIU han encontrado valores séricos bajos de PlGF asociados con altos valores de sFlt-1; por ello, recientemente se propone a la relación sFlt-1/PlGF como una prueba diagnóstica y con valor predictivo en la preeclampsia. Adicionalmente, el análisis de los datos pone en evidencia que los casos de preeclampsia muestran valores mucho más altos de sFlt-1 en comparación con los casos de RCIU y por el contrario los casos de RCIU cursan con valores muy bajos de PlGF(14-16). Herraiz reporta valores de PlGF que apoyan esta observación; encontrando niveles de PlGF para RCIU, preeclampsia y RCIU-preeclampsia de 63,4, 92,4 y 57,5 pg/mL, respectivamente, con una relación de sFlt-1/PlGF de 116, 66,5 y 165(16). Basados en estas observaciones iniciales, propone que la caída de factores angiogénicos como el PlFG podría proporcionar un nuevo marcador de insuficiencia placentaria en RCIU (figura 2).
Benton(17) plantea que los valores de PlGF pueden diferenciar a una RCIU (definida como circunferencia abdominal ≤p10) de un feto PEG; en una serie de 16 pacientes encuentra que todos los casos con placentas con signos de hipoperfusión presentaron bajos valores de PlGF: valores en RCIU ≤12 pg/mL y en PEG ≤84 pg/mL. En otra serie Benton(18) nos presenta una serie de 213 fetos con sospecha de RCIU (definido como circunferencia abdominal ≤p10) en los cuales se analizó tanto la anatomía patológica de la placenta como los valores maternos de PlGF; 94 casos (44,1%) tenían PlGF ≤ p5 y 55 casos (58%) signos placentarios de hipoperfusión. El valor de PlGF ≤p5 para edad gestacional como prueba diagnóstica de hipoperfusión placentaria mostró una sensibilidad de 98%, especificidad 75% y 0,96 del área de la curva ROC. Propone entonces que los valores de PlGF pueden diferenciar a los RCIU de origen placentario de los PEG (figura 2).
Por esta misma línea de investigación, Triunfo(15) en una serie de 122 fetos con peso ≤p10 a las 34 semanas de gestación, encuentra que los casos con placentas con signos de hipoperfusión tenían valores significativamente menores de PlGF y también elevación del IP de la arteria uterina. Característicamente, los casos con hipoperfusión placentaria (RCIU) sin preeclampsia tuvieron valores muy bajos de PlGF (0,23 MoM) con elevación moderada de sFlt-1 (3,77 MoM); en comparación, los casos de preeclampsia mostraron un perfil a predominio de elevación del sFlT1 (6,82 MoM) y leve caída de PlGF (0,47 MoM), estableciendo que el descenso de PlGF podría ser un criterio diagnóstico para definir RCIU de inicio tardío (figura 2).
Aplicando los factores antiangiogénicos en la predicción de RCIU
La fisiopatología del RCIU y la preeclampsia de inicio temprano están indudablemente ligadas a la hipoperfusión placentaria. Por ello la predicción de ambas están íntimamente asociadas con la evaluación de marcadores de hipoperfusión. Crispi(19) en una pequeña serie demuestra que los casos que desarrollaron RCIU/preeclampsia de inicio temprano versus los de inicio tardío mostraron a la semana 24 de gestación valores significativamente más bajos de PlGF (92 vs. 260 pg/mL) con elevación de sFlT-1 (1257 vs. 660 pg/ mL) y un mayor IP de la arteria uterina (1,93 vs. 1,58). La combinación del IP de arteria uterina, PlGF y sFlt-1 evidenció el mejor rendimiento predictivo (sensibilidad de 89% y especificidad de 95%); por ello podrían ser utilizados en la predicción de enfermedad placentaria de inicio temprano.
Recientemente Bakalis(20) evalúa la posibilidad de tener un neonato pequeño para edad gestacional (PEG) a través de la evaluación de múltiples biomarcadores en el tercer trimestre (30 a 34 semanas). Encuentra que el mejor rendimiento para predecir el parto de un PEG (≤ p10) en las próximas 5 semanas se dio con la combinación de factores maternos y el valor de PlGF (razón de detección de 85% con 10% de falsos positivos), con un rendimiento que mejora cuanto más pequeño es el recién nacido (≤ p5; razón de detección de 93% con 10% de falsos positivos). Otro modelo propuesto por el mismo autor (en las mismas edades gestacionales) compuesto por factores maternos, ponderado fetal ecográfico, IP arteria uterina, presión arterial media y PlGF, predijo parto antes de las 37 semanas con peso ≤ p10, con una razón de detección de 89% con 10% de falsos positivos(21). Estos modelos predictivos brindarían la oportunidad de identificar poblaciones de alto riesgo afectadas por RCIU y mejorar el control de la gestación minimizando efectos adversos perinatales (figura 2).
Conclusión
El diagnóstico de RCIU aún es controversial. Las múltiples imprecisiones en los límites de la normalidad establecidos por ponderados ecográficos (percentil 10) y la valoración de flujos vasculares fetales al Doppler producen un alto porcentaje de falsos negativos en fetos afectados por insuficiencia placentaria. En general, se puede concluir que el futuro del diagnóstico de la RCIU está en la búsqueda de marcadores más tempranos de insuficiencia placentaria, que permitan diferenciar claramente a los fetos con mayor morbimortalidad aún antes de las alteraciones que pueden evidenciarse en la ultrasonografía Doppler. En este contexto, los factores angiogénicos aparecen como buenos candidatos para mejorar la precisión diagnóstica y la capacidad predictiva, mejorando el seguimiento y manejo de estas gestaciones.
Fuente de financiamento: Autofinanciado
Conflicto de interés: ninguno
Citar como: Lacunza Paredes RO, Ávalos Gómez J. Restricción de crecimiento fetal y factores angiogénicos: un nuevo horizonte. Rev Peru Ginecol Obstet. 2018;64(3):353-358. DOI: https://doi.org/10.31403/rpgo.v64i2096
Referencias Bibliográficas
1. Figueras F, Gratacós E. Update on the diagnosis and classification of fetal growth restriction and proposal of a stage-based management protocol. Fetal Diagn Ther. 2014;36:86–98 DOI: 10.1159/000357592. [ Links ]
2. Seravalli V, Baschat AA. A uniform management approach to optimize outcome in fetal growth restriction. Obstet Gynecol Clin North Am. 2015;42(2):275-88. doi: 10.1016/j.ogc.2015.01.005. [ Links ]
3. Arroyo JA, Winn VD. Vasculogenesis and angiogenesis in the IUGR placenta. Semin Perinatol. 2008;32(3):172-7. doi: 10.1053/j.semperi.2008.02.006. [ Links ]
4. Marconi AM, Paolini CL. Nutrient transport across the intrauterine growth-restricted placenta. Semin Perinatol. 2008;32(3):178-81. doi: 10.1053/j.semperi.2008.02.007. [ Links ]
5. Chaddha V, Viero S, Huppertz B, Kingdom J. Developmental biology of the placenta and the origins of placental insufficiency. Semin Fetal Neonatal Med. 2004;9(5):357-69. Doi: 10.1016/j.siny.2004.03.006. [ Links ]
6. Kingdom J, Huppertz B, Seaward G, Kaufmann P. Development of the placental villous tree and its consequences for fetal growth. Eur J Obstet Gynecol Reprod Biol. 2000;92(1):35-43 doi: 10.1016/s0301-2115(00)00423-1. [ Links ]
7. Andraweera PH, Dekker GA, Roberts CT. The vascular endothelial growth factor family in adverse pregnancy outcomes. Hum Reprod Update. 2012;18(4):436-57. doi: 10.1093/humupd/dms011. [ Links ]
8. Otrock ZK, Makarem JA, Shamseddine Al. Vascular endothelial growth factor family of ligands and receptors: Review. Blood Cells Mol Dis. 2007;38(3):258-68 doi: 10.1016/j.bcmd.2006.12.003. [ Links ]
9. Saffer C, Olson G, Boggess KA, Beyerlein R, Eubank C, Sibai BM. Determination of placental growth factor (PlGF) levels in healthy pregnant women without signs or symptoms of preeclampsia. Pregnancy Hypertens. 2013;3(2):124-32. doi: 10.1016/j.preghy.2013.01.004. [ Links ]
10. Hernandez-Andrade E, Serralde JA, Cruz-Martinez R. Can anomalies of fetal brain circulation be useful in the management of growth restricted fetuses? Prenat Diagn. 2012;32(2):103–12. DOI: 10.1002/pd.2913. [ Links ]
11. Yagel S, Kivilevitch Z, Cohen SM, Valsky DV, Messing B, et al. The fetal venous system, Part II: ultrasound evaluation of the fetus with congenital venous system malformation or developing circulatory compromise. Ultrasound Obstet Gynecol. 2010;36(1):93-111. doi: 10.1002/uog.7622. [ Links ]
12. Parra-Saavedra M, Crovetto F, Triunfo S, Savchev S, Peguero A, et al. Association of Doppler parameters with placental signs of underperfusion in late-onset small-for-gestational-age pregnancies. Ultrasound Obstet Gynecol. 2015;44(3):330-7. doi: 10.1002/uog.13358. [ Links ]
13. Parra-Saavedra M, Simeone S, Triunfo S, Crovetto F, Botet F, et al. Correlation between histological signs of placental underperfusion and perinatal morbidity in late-onset small-for-gestational-age fetuses. Ultrasound Obstet Gynecol 2015;45(2):145-55. doi: 10.1002/uog.13415. [ Links ]
14. Alahakoon TI, Zhang W, Trudinger BJ, Lee VW. Discordant clinical presentations of preeclampsia and intrauterine fetal growth restriction with similar proand anti-angiogenic profiles. J Matern Fetal Neonatal Med. 2014;27(18):1854-9. doi: 10.3109/14767058.2014.880882. [ Links ]
15. Triunfo S, Lobmaier S, Parra-Saavedra M, Crovetto F, Peguero A, et al., Angiogenic factors at diagnosis of late-onset small-for-gestational age and histological placenta underperfusion. Placenta. 2014;35(6):398e-403. doi: 10.1016/j.placenta.2014.03.021. [ Links ]
16. Herraiz I, Dröge LA, Gómez-Montes E, Henrich W, Galindo A, Verlohren S. Characterization of the soluble fms-like tyrosine kinase-1 to placental growth factor ratio in pregnancies complicated by fetal growth restriction. Obstet Gynecol. 2014;124(2 Pt 1):265-73. doi: 10.1097/AOG.0000000000000367. [ Links ]
17. Benton SJ, Hu Y, Xie F, Kupfer K, Lee SW, Magee LA, et al. ¿Can placental growth factor in maternal circulation identify fetuses with placental intrauterine growth restriction? Am J Obstet Gynecol. 2012;206(2):163.e1e7. doi: 10.1016/j.placenta.2016.03.010. [ Links ]
18. Benton SJ, McCowan LM, Heazell AE, Grynspan D, Hutcheon JA, Senger C, et al. Placental growth factor as a marker of fetal growth restriction caused by placental dysfunction. Placenta 2016;42:1-8. doi: 10.1016/j.placenta.2016.03.010. [ Links ]
19. Crispi F, Llurba E, Domínguez C, Martín-Gallán P, Cabero L, Gratacós E. Predictive value of angiogenic factors and uterine artery Doppler for early versus late-onset pre-eclampsia and intrauterine growth restriction. Ultrasound Obstet Gynecol. 2008;31(3):303e9. Doi: 10.1002/uog.5184. [ Links ]
20. Bakalis S, Gallo DM, Mendez O, Poon LC, Nicolaides KH. Prediction of small-for-gestational-age neonates: screening by maternal biochemical markers at 30-34 weeks. Ultrasound Obstet Gynecol. 2015;46(2):208-15. doi: 10.1002/uog.14861. [ Links ]
21. Bakalis S, Peeva G, Gonzalez R, Poon LC, Nicolaides KH. Prediction of small-for-gestational-age neonates: screening by biophysical and biochemical markers at 30-34 weeks. Ultrasound Obstet Gynecol. 2015;46(4):446-51. doi: 10.1002/uog.14863. [ Links ]
Correspondencia:
Dr. Rommel Lacunza Paredes
Av. Guardia Chalaca 2176, Bellavista. Callao
985436784
Recibido:4 enero 2018