Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Peruana de Ginecología y Obstetricia
On-line version ISSN 2304-5132
Rev. peru. ginecol. obstet. vol.64 no.3 Lima July/Set. 2018
http://dx.doi.org/https://doi.org/10.31403/rpgo.v64i2105
SIMPOSIO ENFOQUE PERINATAL DEL PARTO PRETÉRMINO
Manejo actual de la rotura prematura de membranas en embarazos pretérmino
Current management of premature rupture of the membranes in a preterm pregnancy
Miguel Gutiérrez Ramos 1,2,3
1 Médico Ginecólogo Obstetra
2 Director, Pathfinder International
3 Fellow, American College of Obstetricians and Gynecologists
ABSTRACT
The obstetrician and gynecologist must frequently face complicated situations in the practice of obstetrics, one of them is the rupture of the membranes in a preterm pregnancy. While the medical conduct is to preserve both maternal and fetal health, many times the decision may affect fetal health in order to preserve the maternal health. This occurs when the presence of an infection makes it impossible to maintain the normal course of pregnancy and complete gestational age. In many cases the complications that cause prematurity of the newborn will put mother’s life at risk and we must therefore be prepared to minimize the consequences of our decision. In this article we review evidence-based management that the obstetriciangynecologist should consider when this situation occurs.
Key words: Pregnancy, preterm, Delivery, preterm, Premature rupture of membranes, preterm.
RESUMEN
Frecuentemente, el ginecólogo obstetra debe enfrentar situaciones complicadas en la práctica de la obstetricia; una de ellas es la rotura de membranas en un embarazo pretérmino. Si bien la conducta médica que debe tomar está encaminada a preservar la salud tanto materna como fetal, muchas veces, la decisión puede afectar la salud fetal en aras de preservar la salud materna. Esto ocurre cuando la presencia de una infección hace imposible mantener el curso normal de la gestación y la edad gestacional no es de término. En muchos casos, las complicaciones que ocasionará la prematuridad del recién nacido pondrán en riesgo su vida y por lo tanto debemos estar preparados para minimizar las consecuencias de nuestra decisión. En el presente artículo revisamos el manejo basado en evidencias, que el ginecólogo obstetra debería considerar cuando ocurre esta situación.
Palabras clave. Embarazo pretérmino, Parto pretérmino, Rotura prematura de membranas, pretérmino.
Parto pretérmino, rotura prematura de membranas y factores de riesgo
La Federación Internacional de Obstetricia y Ginecología (FIGO) y la Organización Mundial de la Salud (OMS) definen el parto pretérmino o prematuro al que se produce entre las semanas 22 y 36,6 de gestación, es decir, entre 154 y 258 días.
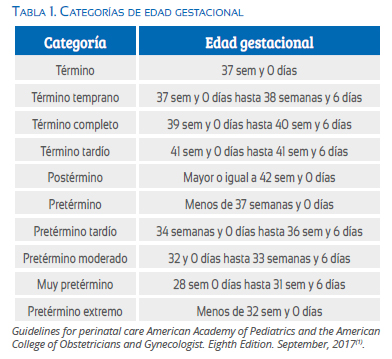
Para poder entender mejor las categorías de la edad gestacional, presentamos la tabla 1 considerada en las Guías para el Cuidado Perinatal de Academia Americana de Pediatría y del Colegio Americano de Obstetricia y Ginecología (septiembre 2017)(1).
La prematuridad es la primera causa de morbilidad perinatal; excluyendo las malformaciones congénitas, el 75% de las muertes perinatales se puede atribuir a ella. Cada año nacen en el mundo 15 millones de recién nacidos prematuros, y más de un millón de niños mueren cada año debido a complicaciones relacionadas a la prematuridad. En el Perú, la tasa de parto prematuro se encuentra alrededor de 7%, y el año 2016 se registraron 30 294 partos prematuros; lo que coloca a esta entidad como uno de los principales problemas de salud pública(2).
Los Estados Unidos reportan una incidencia del 12%(3). En el Instituto Nacional Materno Perinatal, que atiende actualmente un promedio de 19 000 partos anuales, la incidencia de parto pretérmino en los últimos 5 años ha sido 9,7%(4). Aunque las causas que ocasionan que se presente un trabajo de parto prematuro no se comprenden bien, la carga de nacimientos prematuros es clara: los nacimientos prematuros representan aproximadamente el 70% de las muertes neonatales y el 36% de las muertes infantiles, así como 25 a 50% de los casos de deterioro neurológico a largo plazo en niños(5-7).
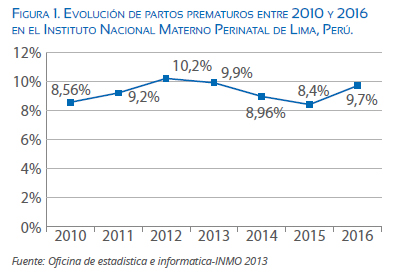
En el Instituto Nacional Materno Perinatal de Lima (INMP), el parto prematuro significa el 9% del total de los partos que ocurren anualmente. Este porcentaje ha variado en los últimos años entre 8,56% a 10,2% entre los años 2010 al 2016 (figura 1).
La prematuridad, evento no infrecuente en la práctica obstétrica y que tiene muchos riesgos para el neonato, se ve complicada mucho más cuando se da la ocurrencia de una rotura prematura de membranas. Le añade un factor de riesgo mayor al parto pretérmino, sobre todo cuando este es muy temprano. El total de partos en el INMP durante el año 2016 fue 21 605. Durante ese año ocurrieron un total de 2 717 casos de rotura prematura de membranas (12,5%) y de ellos 518 (19%) fueron partos prematuros. El año 2017 ocurrieron 19 288 partos; de ellos, 2 697 (13,9%) fueron con rotura prematura de membranas y de ellos, 481 en embarazos pretérmino (17%)(8).
La rotura prematura de membranas que ocurre sobre todo en gestantes que no han llegado al término, constituye una emergencia obstétrica, una emergencia perinatal, ya que se pierde la protección que tiene el feto con el medio externo; es decir, se pierde la barrera natural establecida por la membrana amniótica, se pierde el líquido amniótico que es producido por el feto, y se expone a la gestante y al feto pretérmino a la contaminación con los gérmenes que existen en el cuello uterino y en la vagina, con el grave riesgo de que se produzca una infección materna-fetal.
Se trata de prevenir la rotura prematura de membranas; sin embargo, los mecanismos para la rotura de membranas son múltiples y por eso muchas veces no se consigue su prevención. Dentro de la etiología de la rotura prematura de membranas (RPM) se consideran defectos estructurales de la formación de la membrana amniótica; sobredistensión de las membranas, como ocurre en los casos de polihidramnios o embarazo gemelar; causas infecciosas que pueden ascender desde la vagina y cuello, como es el caso de la vaginosis bacteriana. Sin embargo, muchas veces no se conoce la causa(9,10).
Como hemos mencionado, en el INMP hemos encontrado que 20% de gestantes con rotura prematura de membranas en un embarazo pretérmino terminan teniendo un parto prematuro, con las consecuencias en la salud para el neonato, derivadas de la prematuridad. La literatura nos presenta que es importante conocer el antecedente de haber presentado una rotura de membranas en embarazo anterior, ya que se señala como un factor de riesgo para tener una RPM prematura o trabajo de parto prematuro en un siguiente embarazo(11).
Los factores de riesgo adicionales asociados con la RPM prematura son similares a los asociados con el nacimiento prematuro espontáneo e incluyen una longitud cervical corta, hemorragia en el segundo y tercer trimestre, bajo índice de masa corporal, bajo nivel socioeconómico, tabaquismo y consumo de drogas ilícitas(12).
Factores de riesgo(13,14)
Parto pretérmino previo: 31% a 50%
Embarazo múltiple y complicaciones asociadas: 12% a 28%
Rotura prematura de membranas: 6% a 40%
Trastornos hipertensivos del embarazo: 12%
Restricción del crecimiento intrauterino: 2% a 4%
Hemorragia anteparto: 6 a 9%
Miscelánea (estatus socioeconómico): 8% a 9%
Madre prematura: 41% a 63%(15).
También debemos considerar las infecciones como factor de riesgo tanto para la posibilidad de un parto prematuro como para la de la rotura prematura de membranas. Es así que, en los casos de infecciones urinarias y bacteriuria asintomática, existen evidencias del riesgo significativo de parto pretérmino en el grupo de portadoras de bacteriuria asintomática; se señala hasta un 64%(16). Es importante recordar que cuando tenemos un urocultivo positivo a estreptococo del grupo B, las embarazadas deben ser tratadas e identificadas como portadoras, debiendo recibir profilaxis intraparto (tanto en el pretérmino como en los casos de gestantes a término), para prevención de la sepsis neonatal por este germen(17).
Otra enfermedad frecuente relacionada no solo con parto prematuro sino también con la rotura de membranas, es la vaginosis bacteriana. Una revisión Cochrane demostró que el tamizaje y el tratamiento de todas las embarazadas con vaginosis bacteriana no resultó eficaz para la prevención de un parto prematuro. Sin embargo, dentro del subgrupo de pacientes a quienes se les realizó el cribado y tratamiento antes de las 20 semanas de gestación, se encontró una reducción del mismo(18).
Efectos de la rotura prematura de membranas en la gestante y en el recién nacido
Efectos en la gestante de la RPM
Cuando ocurre una rotura prematura de membranas, en forma independiente al manejo que se le brinde, la literatura nos señala que el parto ocurrirá en 50% de los casos dentro de la primera semana de haber transcurrido la RPM(19).
Un hecho a tener en cuenta es que, cuando ocurre una RPM en embarazos de menor edad gestacional, el parto derivado de esa rotura se demora más en iniciar. Por otro lado, es menor cuando más tiempo de gestación tiene; es decir, la latencia después de la rotura de la membrana se correlaciona inversamente con la edad gestacional (20).
Adicionalmente, con gestaciones muy tempranas en las que ha ocurrido una RPM, puede haber un restablecimiento del volumen del líquido amniótico. En muchos de estos casos, la evolución puede ser favorable y tener un mayor tiempo de espera antes de que se interrumpa la gestación(21).
Entre las mujeres con RPM pretérmino, la infección intraamniótica clínicamente evidente se produce en aproximadamente 15 a 25%(22). La infección posparto se produce en aproximadamente 15 a 20% de los casos; la incidencia de infección es mayor a edades gestacionales más tempranas(23,24). El desprendimiento prematuro de placenta puede complicar 2 a 5% de los embarazos e incluso presentar placenta retenida, con RPM pretérmino(24,25).
Efectos en el feyo de la RPM
Como es de esperarse, los riesgos más significativos para el feto después de la RPM prematura son las complicaciones de la prematuridad, ya que el parto pretérmino se puede producir poco tiempo después de la RPM. Por otro lado, dependiendo del tiempo de la RPM y del uso o no de antibióticos, existe la posibilidad de infección intraútero, la cual de presentarse se puede asociar con un mayor riesgo de deterioro del neurodesarrollo fetal(26,27). Además, la prematuridad en la rotura de la membrana también se ha asociado con un mayor riesgo de daño de la sustancia blanca neonatal(28).
La infección y el accidente del cordón umbilical contribuyen al 1 o 2% de riesgo de muerte fetal prenatal después de una RPM pretérmino(29).
Manejo inicial de la rotura prematura de membranas
En toda gestante que busca una atención por pérdida de líquido amniótico, o porque simplemente se le ‘rompió la fuente’ antes de tiempo, hay 3 acciones que se debe realizar prioritariamente:
-
Elaborar una historia clínica completa, y prioritariamente determinar la edad gestacional, presentación fetal y el estado del bienestar fetal.
-
Inmediatamente después se debe evaluar la existencia de signos de infección intrauterina, riesgo de desprendimiento de placenta y compromiso fetal. En ese sentido, si se considera un manejo expectante, se debe obtener un cultivo para los estreptococos del grupo B (GBS).
-
La monitorización electrónica de la frecuencia cardíaca fetal y monitorización de la actividad uterina ofrece la oportunidad de identificar trazados anormales de la frecuencia cardíaca fetal y evaluar las contracciones(30).
Como nos ha ocurrido a todos los ginecólogos obstetras, la edad gestacional es determinante cuando tenemos que decidir la posibilidad de un manejo expectante, sobre todo cuando es una gestación muy prematura. Sin embargo, debemos tener en consideración que cuando en la evaluación inicial determinamos que existe un mal estado fetal, una corioamnioniotis clínica o un desprendimiento prematuro de placenta, en esos casos no podemos esperar y procederemos al parto inmediato(31).
La edad gestacional óptima para el parto es poco clara y controvertida. Un metaanálisis de siete ensayos controlados aleatorios, que incluyó a 690 mujeres, concluyó que no había pruebas suficientes para guiar la práctica clínica con respecto a los riesgos y beneficios del manejo expectante versus el parto en el contexto de la RPM(32).
Otros dos ensayos controlados aleatorios evaluaron el parto versus el manejo expectante entre las 34 semanas y las 37 semanas de gestación e incluyeron un total de 736 mujeres; combinando datos de los dos estudios, la inducción del trabajo de parto no produjo una reducción estadísticamente significativa en la tasa de sepsis neonatal. Sin embargo, la inducción del parto redujo significativamente el riesgo de corioamnionitis a las 37 semanas de gestación(33).
Sin embargo, la relevancia del parto prematuro tardío en mujeres con RPM no es clara. Hay una tasa más alta de resultados adversos con una espera mayor en comparación con los controles. Además, la corioamnionitis, la rotura prolongada de la membrana y el oligohidramnios son factores de riesgo de resultados neonatales adversos con RPM pretérmino(34,35).
Por ello, a las 34 0/7 semanas de gestación o más, se recomienda el parto a todas las mujeres con rotura de membranas. Si el manejo expectante se prolonga más allá de las 34 0/7 semanas de gestación, el balance entre el beneficio y el riesgo debe considerarse y discutirse cuidadosamente con el paciente, y el manejo expectante no debe extenderse más allá de las 37 0/7 semanas de gestación.
Pero, cuando las gestantes tienen RPM con menos de 34 0/7 semanas de gestación, deben ser tratadas expectantemente si no existen contraindicaciones maternales o fetales(36).
Manejo expectante
Cuando se ha determinado que la gestante con RPM pretérmino tiene condiciones para ser manejada en forma expectante, se debe considerar en primer lugar que esto debe hacerse con hospitalización, enfocando la atención en una evaluación permanente que trate de determinar si existe en algún momento indicios de infección, signos de desprendimiento prematuro de placenta, compresión del cordón umbilical, alteración del bienestar fetal o presencia de signos de trabajo de parto.
Debe indicarse monitoreo de la frecuencia cardíaca fetal y monitorización ecográfica del crecimiento fetal. Se debe actuar manteniendo un alto índice de sospecha de la presencia de una infección precoz, en ausencia de fiebre, considerando criterios clínicos que tienen sensibilidad y especificidad variables para diagnosticarla.
Debemos tener presente, sin embargo, que el monitoreo en serie de los recuentos de leucocitos y otros marcadores inflamatorios no han demostrado ser útiles y son inespecíficos cuando no hay evidencia clínica de infección, especialmente si se han administrado corticosteroides prenatales(37).
Uso de tocolíticos
No hay datos suficientes para apoyar o refutar el uso de la tocólisis profiláctica. La tocólisis profiláctica puede asociarse con una prolongación del embarazo y un mayor riesgo de corioamnionitis sin beneficio significativo materno o neonatal, aunque su uso no se ha evaluado adecuadamente con antibióticos de latencia y corticosteroides(38,39).
En RPM con trabajo de parto activo, no se ha demostrado que la tocólisis terapéutica prolongue la latencia ni mejore los resultados neonatales. Por lo tanto, no se recomienda la tocólisis terapéutica(40).
Uso de corticoides
Hay evidencia muy concreta que el uso de corticosteroides después de RPM pretérmino reduce la mortalidad neonatal, el síndrome de dificultad respiratoria, la hemorragia intraventricular y la enterocolitis necrosante(41-42).
No están asociados con un mayor riesgo de infección materna o neonatal, independientemente de la edad gestacional. Se recomienda un solo ciclo de corticosteroides para mujeres embarazadas entre 24 0/7 semanas y 34 0/7 semanas de gestación, y puede considerarse para mujeres embarazadas a las 23 0/7 semanas de gestación que están en riesgo de parto prematuro dentro de los 7 días siguientes(43,4 4).
Un solo ciclo de corticosteroides prenatales se debe considerar de rutina para todos los partos prematuros(41).
No es concluyente que haya algún beneficio para un segundo ciclo de betametasona en el período pretérmino tardío en estos pacientes. Además no hay datos que respalden el uso de corticosteroides antes de la viabilidad, y actualmente no se recomienda la administración de corticosteroides en este contexto. Por otro lado, la administración semanal de corticosteroides se ha asociado con una reducción en el peso al nacer y la circunferencia de la cabeza y no se recomienda(45,46).
Datos recientes indican que la administración de betametasona en el período pretérmino tardío entre 34 0/7 semanas y 36 6/7 semanas reduce la morbilidad respiratoria en recién nacidos(47).
Uso de sulfato de magnesio
La administración materna de sulfato de magnesio para la neuroprotección fetal cuando se anticipa el nacimiento antes de las 32 0/7 semanas de gestación, reduce el riesgo de parálisis cerebral en los recién nacidos supervivientes (RR 0,71; IC del 95%: 0,55-0,91)(48).
En el más grande de estos ensayos, el 85% de las mujeres inscritas tuvo RPM pretérmino entre las 24 semanas y las 32 semanas de gestación. El régimen de tratamiento óptimo para la neuro- protección fetal sigue sin estar claro, y se usaron diferentes regímenes en diferentes ensayos(49).
Independientemente del régimen de tratamiento utilizado, las mujeres con RPM pretérmino antes de las 32 0/7 semanas de gestación, que se considera que están en riesgo de un parto inminente, deben ser consideradas candidatas para el tratamiento neuroprotector fetal con sulfato de magnesio.
Uso de antibióticos
Sobre todo para los casos donde el manejo será expectante, los antibióticos de amplio espectro prolongan el embarazo, reducen las infecciones maternas y neonatales y reducen la morbilidad gestacional dependiente de la edad gestacional.
Se recomienda un tratamiento de 7 días con una combinación de ampicilina intravenosa (2 g cada 6 horas) y eritromicina (250 mg cada 6 horas) durante 48 horas, seguido de amoxicilina oral (250 mg cada 8 horas) y base de eritromicina (333 mg cada 8 horas en RPM que tienen menos de 34 0/7 semanas de gestación). El uso de amoxicilina-ácido clavulánico se ha asociado con mayores tasas de enterocolitis necrosante y no se recomienda(50-52).
Aunque no existen regímenes alternativos bien estudiados para las mujeres alérgicas a los antibióticos β-lactámicos, puede ser razonable administrar eritromicina sola.
Las mujeres con RPM pretérmino y un feto viable, que son candidatos para la profilaxis del GBS intraparto, deben recibir profilaxis intraparto para prevenir la transmisión vertical, independientemente de los tratamientos anteriores(53).
Es importante tener un esquema general para el manejo del RPM, sobre todo en los casos de embarazos pretérmino:
Cronología del manejo de la rotura prematura de membranas en prematuridad
Término y término temprano (37 semanas 0/7 semanas de gestación o más)
-
Atención del parto
-
Profilaxis contra el estreptococo grupo B (GBS)
Pretérmino tardío (34 0/7 a 36 6/7 semanas de gestación)
-
Similar como con término y término temprano
Pretérmino (24 0/7 a 33 6/7 semanas de gestación)
-
Manejo expectante
-
Se recomienda el uso de antibióticos, en latencia prolongada, si no hay contraindicación
-
Un solo esquema de dosis de corticoides
-
Profilaxis del GBS si estuviera indicado
Menos de 24 semanas de gestación
-
Consejería
-
Manejo expectante o inducción del parto
-
Antibióticos es recomendado tan tempranamente como desde las 20 semanas 0/7 de gestación
-
Profilaxis contra el GBS no es recomendado antes de la viabilidad
-
Corticoides no son recomendados antes de la viabilidad
-
Tocólisis no es recomendada antes de la viabilidad
-
Sulfato de magnesio para neuroprotección. No es recomendado antes de la viabilidad (puede ser recomendado desde las 23 0/7 semanas)
Recomendaciones
En el Boletín de ACOG Número 188, enero 2018(54), que trata sobre la rotura de membranas, se presentan estas recomendaciones.
Recomendaciones de Nivel A:
-
Las pacientes con RPM antes de las 34 0/7 semanas de gestación deben ser manejadas en forma expectante si no existen contraindicaciones maternas o fetales.
-
Para reducir las infecciones maternas y neonatales y la morbilidad dependiente de la edad gestacional, se recomienda un tratamiento de 7 días con una combinación de ampicilina intravenosa y eritromicina seguida de amoxicilina oral y eritromicina durante el tratamiento expectante de mujeres con RPM pretérmino menores de 34 semanas 0/7 semanas de gestación.
-
Las mujeres con RPM pretérmino y un feto viable que son candidatas para la profilaxis de infección con estreptococo del grupo B intraparto (GBS), deben recibir profilaxis de GBS intraparto para prevenir la transmisión vertical, independientemente de los tratamientos anteriores.
-
Se recomienda un ciclo único de corticosteroides para mujeres embarazadas entre 24 0/7 semanas y 34 0/7 semanas de gestación, y puede considerarse para mujeres embarazadas a las 23 0/7 semanas de gestación que están en riesgo de parto prematuro en los siguientes 7 días.
-
Las mujeres con RPM pretérmino antes de las 32 0/7 semanas de gestación que se considera que están en riesgo de un parto inminente deben ser consideradas candidatas para el tratamiento neuroprotector fetal con sulfato de magnesio.
Recomendaciones de Nivel B:
-
Para las mujeres con RPM a las 37 0/7 semanas de gestación o más, si el parto espontáneo no ocurre cerca del momento de la presentación en aquellas que no tienen contraindicaciones para el trabajo de parto, se debe inducir el parto.
-
A las 34 0/7 semanas de gestación o más, se recomienda el parto a todas las mujeres con rotura de membranas.
-
En el contexto de rotura de membranas con trabajo de parto activo, no se ha demostrado que la tocólisis terapéutica prolongue la latencia ni mejore los resultados neonatales. Por lo tanto, no se recomienda la tocólisis terapéutica.
Recomendaciones de Nivel C:
-
El manejo ambulatorio de la RPM prematura con un feto viable no se ha estudiado lo suficiente como para establecer la seguridad y, por lo tanto, no se recomienda.
Financiamiento: propio del autor
Conflicto de intereses: el autor declara no tener conflicto de intereses con el presente artículo
Citar como: Gutiérrez Ramos M. Manejo actual de la rotura prematura de membranas en embarazos pretérmino. Rev Peru Ginecol Obstet. 2018;64(3):405-413. DOI: https://doi.org/10.31403/rpgo.v64i2105
Referencias Bibliográficas
1. Guidelines for perinatal care. American Academy of Pediatrics and the American College of Obstetricians and Gynecologist. Eighth Edition. Appendix F: 619-20. September, 2017. [ Links ]
2. Boletín Estadístico de Nacimientos Perú: 2016 del Sistema de Registro del Certificado de Nacido Vivo en Línea. [ Links ]
3. Mathews TJ, MacDorman MF. Infant mortality statistics from the 2006 period linked birth/infant death data set. Natl Vital Stat Rep. 2010;58:1–31. [ Links ]
4. Tendencia de indicadores de resultados de neonatología. Oficina de Estadística e Informática del INMP, 2016. [ Links ]
5. Volpe JJ. Overview: perinatal and neonatal brain injury. Ment Retard Dev Disabil Res Rev. 1997;3:1–2. (Level III) [ Links ]
6. MacDorman MF, Callaghan WM, Mathews TJ, Hoyert DL, Kochanek KD. Trends in preterm-related infant mortality by race and ethnicity: United States, 1999– 2004. NCHS Health E-Stat. Hyattsville (MD): National Center for Health Statistics; 2007. Available at: http:// www.cdc.gov/nchs/data/hestat/infantmort99-04/in fantmort99-04.htm. Retrieved July 25, 2011. (Level II-3) [ Links ]
7. Informe de la Oficina de Estadística e Informática del INMP, 2017. [ Links ]
8. Mercer BM. Preterm premature rupture of the membranes. Obstet Gynecol. 2003;101:178–93. (Level III) [ Links ]
9. Garite TJ, Freeman RK. Chorioamnionitis in the preterm gestation. Obstet Gynecol. 1982;59:539–45. (Level II-3) [ Links ]
10. Mercer BM, Goldenberg RL, Moawad AH, Meis PJ, Iams JD, Das AF, et al. The preterm prediction study: effect of gestational age and cause of preterm birth on subsequent obstetric outcome. National Institute of Child Health and Human Development Maternal-Fetal Medicine Units Network. Am J Obstet Gynecol 1999;181:1216–21. (Level II-2) [ Links ]
11. Harger JH, Hsing AW, Tuomala RE, Gibbs RS, Mead PB, Eschenbach DA, et al. Risk factors for preterm premature rupture of fetal membranes: a multicenter case-control study. Am J Obstet Gynecol 1990;163:130–7. [ Links ]
12. ACOG Practice Bulletin N° 31: Assessment of risk factors for pre term Birth. Obstet Gynecol. 2001;98(4):709-16. [ Links ]
13. Deker GA, Lee SV, North RA, McCowan LM, Simpson NA, Roberts CT. Risk factors for pre term births in an international prospective cohort of nulliparous women. Plos One. 2012;7(7):e39154. doi: 10.1371/journal.pone.0039154. [ Links ]
14. Boivin A, Luo Z-C, Audibert F, Mâsse B, Lefebvre F, Tessier R, Nuyt AM. Risk for preterm and very preterm delivery in women who were born preterm. Obstet Gynecol. May 2015;125(5):1177–84. doi: 10.1097/ AOG.0000000000000813. [ Links ]
15. Smaill F, Vazquez JC. Antibióticos para la bacteriuria asintomática en el embarazo. La Biblioteca Cochrane Plus, 2008 Numero 4. Oxford: Update Software Ltd. Disponible en: http://www.update-software. (Nivel de Evidencia 1a, Recomendación A) [ Links ]
16. Center for Disease Control and Prevention (CDC). Prevention of perinatal group B streptococcal disease. MMWR. 2002;51:1-18. [ Links ]
17. Allen V, Yudin MH; INFECTIOUS DISEASES COMMITTEE. Management of group B streptococcal bacteriuria in pregnancy. J Obstet Gynaecol Can. 2012;34(5):482–6. doi: 10.1016/S1701-2163(16)35246-X. [ Links ]
18. Biblioteca Cochrane Plus, 2008 Número 4. Oxford: Update Software Ltd. Disponible en: http://www.update-software.com (Traducida de The Cochrane Library, 2008 Issue 3. Chichester, UK: John Wiley & Sons, Ltd. [ Links ]).
19. Garite TJ, Freeman RK. Chorioamnionitis in the preterm gestation. Obstet Gynecol. 1982;59:539–45. (Level II-3) [ Links ]
20. Johnson JW, Egerman RS, Moorhead J. Cases with ruptured membranes that "reseal." Am J Obstet Gynecol. 1990;163:1024–30; discussion 1030–2. (Level II-2) [ Links ]
21. Kenyon S, Boulvain M, Neilson JP. Antibiotics for preterm rupture of membranes. Cochrane Database of Systematic Reviews 2010, Issue 8. Art. No.: CD001058. DOI: 10.1002/14651858.CD001058.pub2. (Meta-analysis) [ Links ]
22. Beydoun SN, Yasin SY. Premature rupture of the membranes before 28 weeks: conservative management. Am J Obstet Gynecol. 1986;155:471–9. [ Links ]
23. Mercer BM, Goldenberg RL, Moawad AH, Meis PJ, Iams JD, Das AF, et al. The preterm prediction study: effect of gestational age and cause of preterm birth on subsequent obstetric outcome. National Institute of Child Health and Human Development Maternal-Fetal Medicine Units Network. Am J Obstet Gynecol. 1999;181:1216–21. (Level II-2) [ Links ]
24. Ananth CV, Oyelese Y, Srinivas N, Yeo L, Vintzileos AM. Preterm premature rupture of membranes, intrauterine infection, and oligohydramnios: risk factors for placental abruption. Obstet Gynecol. 2004;104:71–7. (Level II-3) [ Links ]
25. Schucker JL, Mercer BM. Midtrimester premature rupture of the membranes. Semin Perinatol. 1996;20:389–400. (Level III) [ Links ]
26. Yoon BH, Romero R, Park JS, Kim CJ, Kim SH, Choi JH, et al. Fetal exposure to an intra-amniotic inflammation and the development of cerebral palsy at the age of three years. Am J Obstet Gynecol. 2000;182:675–81. (Level II-2) [ Links ]
27. Locatelli A, Ghidini A, Paterlini G, Patane L, Doria V, Zorloni C, et al. Gestational age at preterm premature rupture of membranes: a risk factor for neonatal white matter damage. Am J Obstet Gynecol. 2005;193:947– 51. (Level II-3) [ Links ]
28. Mercer BM, Arheart KL. Antimicrobial therapy in expectant management of preterm premature rupture of the membranes [published erratum appears in Lancet. 1996;347:410]. Lancet. 1995;346:1271–9. (Meta-analysis) [ Links ]
29. Manuck TA, Eller AG, Esplin MS, Stoddard GJ, Varner MW, Silver RM. Outcomes of expectantly managed preterm premature rupture of membranes occurring before 24 weeks of gestation. Obstet Gynecol. 2009;114:29–37. doi: 10.1097/AOG.0b013e3181ab-6fd3. [ Links ]
30. Verani JR, McGee L, Schrag SJ. Division of Bacterial Diseases, National Center for Immunization and Respiratory Diseases, Centers for Disease Control and Prevention (CDC). Prevention of perinatal group B streptococcal disease––revised guidelines from CDC, 2010. MMWR Recomm Rep. 2010;59(RR-10):1–36. (Level I) [ Links ]
31. Van der Ham DP, van der Heyden JL, Opmeer BC, Mulder AL, Moonen RM, van Beek JH, et al. Management of late-preterm premature rupture of membranes: the PPROMEXIL-2 trial. Am J Obstet Gynecol. 2012;207:276. e1–276.10. doi: 10.1016/j.ajog.2012.07.024. [ Links ]
32. Van der Ham DP, Vijgen SM, Nijhuis JG, van Beek JJ, Opmeer BC, Mulder AL, et al. Induction of labor versus expectant management in women with preterm prelabor rupture of membranes between 34 and 37 weeks: a randomized controlled trial. PPROMEXIL trial group. PLoS Med. 2012;9:e1001208. doi: 10.1371/journal.pmed.1001208. [ Links ]
33. Naef RW 3rd, Allbert JR, Ross EL, Weber BM, Martin RW, Morrison JC. Premature rupture of membranes at 34 to 37 weeks’ gestation: aggressive versus conservative management. Am J Obstet Gynecol. 1998;178:126–30. (Level I)
34. Ramsey PS, Lieman JM, Brumfield CG, Carlo W. Chorioamnionitis increases neonatal morbidity in pregnancies complicated by preterm premature rupture of membranes. Am J Obstet Gynecol. 2005;192:1162–6. [ Links ]
35. Tita AT, Andrews WW. Diagnosis and management of clinical chorioamnionitis. Clin Perinatol. 2010;37:339– 54. doi: 10.1016/j.clp.2010.02.003. (Level III) [ Links ]
36. Teune MJ, Bakhuizen S, Gyamfi Bannerman C, Opmeer BC, van Kaam AH, van Wassenaer AG, et al. A systematic review of severe morbidity in infants born late preterm. Am J Obstet Gynecol. 2011;205:374.e1–9. doi: 10.1016/j.ajog.2011.07.015 (Meta-analysis) [ Links ]
37. Fox NS, Gelber SE, Kalish RB, Chasen ST. Contemporary practice patterns and beliefs regarding tocolysis among U.S. maternal-fetal medicine specialists. Obstet Gynecol. 2008;112:42–7. doi: 10.1097/AOG.0b013e318176158e. (Level III) [ Links ]
38. Ehsanipoor RM, Shrivastava VK, Lee RM, Chan K, Galyean AM, Garite TJ, et al. A randomized, double-masked trial of prophylactic indomethacin tocolysis versus placebo in women with premature rupture of membranes. Am J Perinatol. 2011;28:473–8. doi: 10.1055/s0030-1270118. [ Links ]
39. Mackeen AD, Seibel-Seamon J, Grimes-Dennis J, Baxter JK, Berghella V. Tocolytics for preterm premature rupture of membranes. Cochrane Database of Systematic Reviews 2011, Issue 10. Art. No.: CD007062. DOI: 10.1002/14651858.CD007062.pub2. (Meta-analysis) [ Links ]
40. Roberts D, Dalziel SR. Antenatal corticosteroids for accelerating fetal lung maturation for women at risk of preterm birth. Cochrane Database of Systematic Reviews 2006, Issue 3. Art. No.: CD004454. DOI: 10.1002/14651858.CD004454.pub2. (Meta-analysis) [ Links ]
41. Vidaeff AC, Ramin SM. Antenatal corticosteroids after preterm premature rupture of membranes. Clin Obstet Gynecol. 2011;54:337–43. doi: 10.1097/ GRF.0b013e318217d85b. (Level III) [ Links ]
42. Periviable Birth. Obstetric Care Consensus No. 6. American College of Obstetricians and Gynecologists. Obstet Gynecol. 2017;130:e187–99. doi: 10.1097/ AOG.0000000000002352. [ Links ]
43. Antenatal corticosteroids revisited: repeat courses. NIH Consensus Statement. 2000;17(2):1–18. (Level III) [ Links ]
44. Gyamfi-Bannerman C, Thom EA, Blackwell SC, Tita AT, Reddy UM, Saade GR, et al. Antenatal betamethasone for women at risk for late preterm delivery. NICHD Maternal–Fetal Medicine Units Network. N Engl J Med. 2016;374:1311–20. doi: 10.1056/NEJMoa1516783. [ Links ]
45. Bloom SL, Sheffield JS, McIntire DD, Leveno KJ. Antenatal dexamethasone and decreased birth weight. Obstet Gynecol. 2001;97:485–90. (Level II-3) [ Links ]
46. Thorp JA, Jones PG, Knox E, Clark RH. Does antenatal corticosteroid therapy affect birth weight and head circumference? Obstet Gynecol. 2002;99:101–8. (Level II-3) [ Links ]
47. Wapner RJ, Sorokin Y, Thom EA, Johnson F, Dudley DJ, Spong CY, et al. Single versus weekly courses of antenatal corticosteroids: evaluation of safety and efficacy. National Institute of Child Health and Human Development Maternal Fetal Medicine Units Network. Am J Obstet Gynecol. 2006;195:633–42. (Level I) [ Links ]
48. Rouse DJ, Hirtz DG, Thom E, Varner MW, Spong CY, Mercer BM, et al. A randomized, controlled trial of magnesium sulfate for the prevention of cerebral palsy. Eunice Kennedy Shriver NICHD Maternal–Fetal Medicine Units Network. N Engl J Med. 2008;359:895–905. (Level I) [ Links ]
49. Marret S, Marpeau L, Zupan-Simunek V, Eurin D, Leveque C, Hellot MF, et al. Magnesium sulphate given before very-preterm birth to protect infant brain: the randomised controlled PREMAG trial. PREMAG trial group. BJOG. 2007;114:310–8. (Level I) [ Links ]
50. Beydoun SN, Yasin SY. Premature rupture of the membranes before 28 weeks: conservative management. Am J Obstet Gynecol. 1986;155:471–9. (Level III) [ Links ]
51. Mercer BM, Miodovnik M, Thurnau GR, Goldenberg RL, Das AF, Ramsey RD, et al. Antibiotic therapy for reduction of infant morbidity after preterm premature rupture of the membranes. A randomized controlled trial. National Institute of Child Health and Human Development Maternal–Fetal Medicine Units Network. JAMA. 1997;278:989–95. [ Links ]
52. Prevention of early-onset group B streptococcal disease in newborns. Committee Opinion No. 485. American College of Obstetricians and Gynecologists. Obstet Gynecol. 2011;117:1019–27. doi: 10.1097/AOG.0000000000002466. (Level III) [ Links ]
53. Use of prophylactic antibiotics in labor and delivery. Practice Bulletin No. 120. American College of Obstetricians and Gynecologists. Obstet Gynecol. 2011;117:1472–83. (Level III) doi: 10.1097/AOG.0b013e3182238c31. [ Links ]
54. Clinical Management Guidelines for Ob/Gyn. ACOG Practice Bulletin N°188 Vol 131, N°1 e4 e8, January 2018. [ Links ]
Correspondencia:
Recibido:18 setiembre 2018
Aceptado:22 setiembre 2018