Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Ginecología y Obstetricia
versión On-line ISSN 2304-5132
Rev. peru. ginecol. obstet. vol.64 no.4 Lima oct./dic. 2018
http://dx.doi.org/10.31403/rpgo.v64i2125
ARTÍCULO DE REVISIÓN
Hipertiroidismo en el embarazo
Hyperthyroidism in pregnancy
Daniela Franco-Herrera1,2,a, Daniela Córdoba Díaz1,2,a, Daniela González Ocampo1,2,a, Juan José Ospina1,2,b, Sandra Ximena Olaya Garay1,2,c, David Ricardo Murillo García1,2,a
1. Programa de Medicina, Facultad de Ciencias de la Salud, Universidad Tecnológica de Pereira, Colombia
2. Grupo de investigación MEOCRI (Medicina Obstétrica y cuidado intensivo).
a. Estudiante de medicina
b. Médico docente, epidemiólogo clínico, gerente de calidad y auditoría en salud, maestría en gerencia de calidad, doctorante en ciencias de la educación
c. Médico Ginecoobstetra intensivista, doctorante en ciencias de la educación
ABSTRACT
The association of hyperthyroidism and pregnancy is rare. Its importance resides in the prognosis of mother and fetus. The recognition of thyroid alterations during pregnancy differs from the general population; in this special group, it is necessary to correlate diagnostic tests and normal physiological changes. The main cause of hyperthyroidism is Graves disease, with its autoimmune component. Transient gestational thyrotoxicosis becomes important during pregnancy and is critical in the differential diagnosis, especially during the first trimester. Management of hyperthyroidism during pregnancy has special implications; first-line therapies are contraindicated, and antithyroid drugs become relevant. No therapy is completely safe during pregnancy; possible adverse effects and mother and fetus implications must be evaluated. In this review, we want to consider the physiological changes in thyroid function during pregnancy. Also, we want to point out the best actions for the proper recognition, diagnosis and management of hyperthyroidism during pregnancy, in order to reduce maternal and fetal morbidity and mortality. A review of the literature was performed in PubMed and Science Direct using MeSH words and connectors. We included the most relevant articles published by scientific societies in the last 20 years on the diagnosis and management of hyperthyroidism during pregnancy.
Key words: Hyperthyroidism, Pregnancy, Thyrotoxicosis, Graves disease, Thyroid crisis, Antithyroid agents.
RESUMEN
La relación hipertiroidismo y embarazo es poco común. Su importancia recae en el pronóstico de la madre y el feto. El reconocimiento de las alteraciones tiroideas durante el embarazo difiere de la población general. En este grupo poblacional es necesario correlacionar las pruebas diagnósticas con los cambios fisiológicos durante este periodo. La principal causa de hipertiroidismo es la enfermedad de Graves, con su componente autoinmune. La tirotoxicosis gestacional transitoria toma relevancia durante el embarazo y es un diagnóstico diferencial importante durante el primer trimestre. El manejo del hipertiroidismo durante el embarazo tiene implicaciones especiales. Las terapias de primera línea convencionales están contraindicadas, y toman relevancia los medicamentos antitiroideos. Ninguna terapia es totalmente segura durante el embarazo y se deben evaluar los posibles efectos adversos e implicaciones para la madre y el feto. En esta revisión queremos dar a conocer los cambios en la función tiroidea durante la gestación; además, las pautas necesarias para el adecuado reconocimiento, diagnóstico y manejo del hipertiroidismo durante el embarazo, con el fin de disminuir la morbilidad y mortalidad materno-fetal. Se realizó una revisión de la literatura en PubMed y Science Direct utilizando palabras MeSH y conectores. Se incluyeron artículos especiales más relevantes publicados por las sociedades internacionales en los últimos 20 años sobre el diagnóstico y manejo del hipertiroidismo durante el embarazo
Palabras clave. Hipertiroidismo, Embarazo, Tirotoxicosis, Enfermedad de Graves, Crisis tiroidea, Agentes antitiroideos.
Introducción
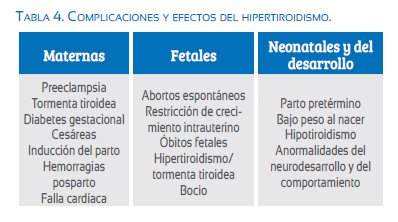
Durante el embarazo ocurren numerosos cambios hormonales; la función tiroidea sufre modificaciones complejas que toman relevancia en el desarrollo fetal y en diferentes procesos fisiopatológicos(1). Las enfermedades tiroideas afectan hasta el 4% de los embarazos, siendo la segunda causa más común de enfermedad endocrina que afecta a la mujer en edad reproductiva (2,3). Este grupo de enfermedades tienen repercusiones importantes durante la gestación; la deficiencia o exceso de hormonas tiroideas pueden resultar en morbilidad significativa en ausencia de un manejo adecuado. Posibles efectos adversos dependientes son el aumento en la prevalencia de abortos, hemorragia posparto, desprendimiento prematuro de la placenta, hipertensión gestacional, parto pretérmino, lesión cerebral en el neonato y alteraciones en el neurodesarrollo(2-4).
Es de especial relevancia la presencia de hipertiroidismo durante el embarazo. Esta patología puede producir desenlaces desfavorables para la madre y el feto, siendo además un desafío para el médico. En esta revisión se muestran los cambios en la función tiroidea durante la gestación, además de las características, tamizaje, diagnóstico, manejo y consecuencias del hipertiroidismo durante el embarazo.
Metodología
Se realizó una búsqueda de la literatura en diferentes bases de datos, las cuales contenían datos en diferentes idiomas según la búsqueda, como PUBMED, ClinicalKey, SciELO, ScienceDirect y Google Académico.
La búsqueda se realizó usando palabras claves como: hipertiroidismo, embarazo, enfermedad de Graves, enfermedad tiroidea, terapia antitiroidea, tirotoxicosis, tormenta tiroidea, complicaciones.
Posteriormente, se filtraron las categorías del MeSH, según el idioma (inglés y español), revistas indexadas de alto impacto, artículos de revisión, guías de manejo y artículos originales, permitiendo que la búsqueda tuviera un tiempo máximo de 20 años desde su publicación; sin embargo, se buscó utilizar las referencias más actualizadas según el tema que se estuviera desarrollando. Se usaron conectores en la búsqueda, como AND y OR, logrando depurar los mejores artículos relacionados con el tema.
Desarrollo del tema
Fisiología tiroidea en el embarazo
La función tiroidea materna cambia significativamente durante la gestación. Estos cambios son esenciales para el crecimiento y desarrollo cerebral del feto y neonato, además de otros aspectos del embarazo(5,6).
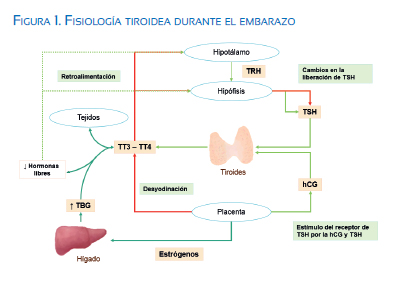
Las modificaciones son el resultado de diferentes procesos que inician tempranamente con el estímulo de la gonadotropina coriónica humana (hCG) a los receptores tiroideos para la hormona tirotrópica (TSH)(7). También aumentan las globulinas fijadoras de tiroxina (TBG) debido al incremento de estrógenos(6), y hay modificaciones en el metabolismo periférico de las hormonas tiroideas maternas y cambios en las reservas materna de yodo(4) (figura 1).
Estimulación de los receptores de TSH por la gonadotropina coriónica Humana (Hcg)
La hCG es una glicoproteína secretada por el sincitotrofoblasto, que cuenta con una estructura similar a la TSH, teniendo la capacidad de unirse y estimular los receptores de TSH en la glándula tiroidea(8). Durante las primeras semanas de gestación, la glándula tiroidea materna es estimulada directamente por la hCG, logrando el pico de concentración en las primeras 8 a 11 semanas(9). La acción tirotrópica de la hCG es la responsable del aumento brusco en la producción de tiroxina (T4)(4,10) y de la disminución de las concentraciones séricas de TSH (20%) durante el primer trimestre(10-12). Este proceso puede causar hipertiroidismo transitorio en algunas mujeres(6).
Aumento en los niveles de séricos de globulinas Fijadoras de tiroxina (tbg)
El aumento en los niveles de estrógeno es determinante en la elevación de las TBG(7). Tiene inicio aproximadamente entre las 6 y 8 semanas, alcanza una meseta alrededor de la semana 16 de gestación y se mantiene posteriormente(13). Los mecanismos de este aumento están relacionados tanto a la mayor síntesis hepática de TBG como a la reducción en la eliminación de esta proteína(4). Produce reducción de hormonas libres (T4 y T3 libres), con mayor afinidad por T4 que por T3(10). Por medio de mecanismos de retroalimentación, hay mayor liberación de TSH y aumento en los niveles circulantes de T3 y T4 total, buscando lograr el equilibrio y homeostasis hormonal durante el embarazo(4,5).
Cambios en las reservas de yodo
La disminución en las reservas de yodo antes de la semana 20 se debe a: 1) aumento en la síntesis de T4, la cual puede llegar a exceder hasta el 50% de la producción normal; 2) aumento en la eliminación renal, secundario al incremento fisiológico del flujo sanguíneo renal y tasa de filtración glomerular; y, 3) a la transferencia de la madre al feto(4,10,11,14). Después de este periodo, el aumento de las necesidades de yodo se debe a la producción fetal de hormonas tiroideas(15).
La presentación de enfermedades tiroideas se ha asociado con la cantidad de yodo disponible, presentando variaciones entre grupos poblacionales; tanto el exceso como el déficit de yodo aumentan la incidencia de enfermedades tiroideas autoinmunes(16).
Modificaciones en el metabolismo periférico
Los cambios en el metabolismo periférico de las hormonas tiroideas se deben a la elevada actividad de desyonidación placentaria(10). Las yodotironinas desyodinasas expresadas por la placenta son de tipo 2 (D2) y tipo 3 (D3). El tipo de desyodinasa predominante en la placenta es la forma D3, la cual se caracteriza por tener un nivel de actividad 200 veces mayor que la forma D2(17), aunque su actividad disminuye a medida que progresa la gestación(4,10). Su función es limitar la transferencia de hormonas tiroideas al feto, catalizan la desyonidación de T4 a T3 y esta a su forma inactiva; y regulan los niveles de T3 fetal, evitando la presentación de tirotoxicosis fetal(18). En general, el aumento en la degradación de las hormonas tiroideas por las desyodinasas placentarias contribuye al aumento en la demanda hormonal(10).
Evaluación de la función tiroidea durante el embarazo
Los cambios fisiológicos influyen en los exámenes de función tiroidea en la paciente embarazada(19). Igualmente, los rangos de referencia pueden cambiar significativamente entre grupos poblacionales(19), debido a la diferencia de etnias, tamaño corporal, así como la disponibilidad de yodo en la dieta(20). Actualmente, los niveles de TSH y T4 libre (FT4) son los indicadores más comúnmente utilizados en el diagnóstico de las alteraciones tiroideas durante el embarazo(21).
TSH
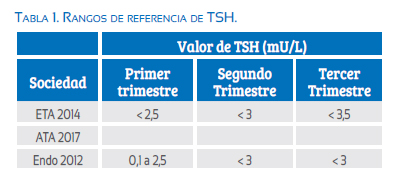
Los cambios en la TSH dependen de las variaciones de hCG, entre otros factores, por lo que su concentración es diferente en cada trimestre(22). Consecuentemente, las diferentes sociedades científicas han buscado establecer rangos de referencia específicos para cada trimestre (tabla 1). La recomendación actual es la de utilizar, siempre que sea posible, los rangos de referencia de TSH sérico específicos para la población y trimestre(19,23-25).
Hormonas tiroidEas
Los niveles de T3 y T4 circulantes mantienen un equilibrio tanto de sus formas libres como de las unidas a proteínas (>99%); estas últimas aumentan hasta 50% en relación con la elevación de las TBG(8,26). Si bien se presenta en menor concentración, su forma libre (FT4) es la biológicamente activa(26). La medición de FT4 se realiza por técnica de inmunoensayo, siendo un método indirecto influenciado por las proteínas transportadoras y por lo tanto menos confiable(27). Su interpretación requiere valores de referencia dependientes de la edad gestacional(28), a diferencia de técnicas más precisas como la ultrafiltración o equilibrium dialysis(19,27).
Debido a la incertidumbre con las técnicas de medición de FT4, se ha sugerido estrategias alternativas. La primera, la concentración de T4 total (TT4) aumenta gradualmente y de forma predecible de la semana 7 a 16 para mantenerse elevada(29), calculándose 50% el valor superior normal; este cálculo se utiliza a partir de la semana 16. Los valores de TT4 antes de este tiempo pueden calcularse aumentando 5% por semana a partir de la semana 7(19). La segunda técnica es el índice FT4; ha sido considerado un indicador confiable durante el embarazo, aunque su cálculo parte de variables inexactas (captación de T3 por resina y la estimación de TT4 por inmunoensayo); no hay rangos de referencia trimestrales y es raramente disponible(23).
Anticuerpos
Los receptores de TSH, tiroglobulina y la peroxidasa tiroidea (TPO) son blancos inmunes de las células T y anticuerpos autorreactivos en las enfermedades tiroideas autoinmunes(30). Mientras los anticuerpos anti TPO y tiroglobulina pueden detectarse también en sujeto sanos, los anticuerpos antirreceptor TSH (TRAbs) solo pueden encontrarse en pacientes con enfermedad de Graves y en 10% a 15% de pacientes con tiroiditis de Hashimoto(31).
Las concentraciones de TRAbs tienden a disminuir durante la gestación y aumentar durante el posparto; sin embargo, en ocasiones se pueden mantener elevados durante el embarazo(32). Los TRAbs cruzan la placenta libremente desde las primeras semanas de gestación y la tiroides fetal es funcional desde la semana 16 a 20 de gestación; por lo tanto, puede verse afectada por los anticuerpos alrededor de esta época; esta situación aumenta el riesgo de que se presenten hipertiroidismo/tirotoxicosis y bocio(31-33).
Los TRAbs, aparte de su importancia clínica en el diagnóstico de hipertiroidismo materno, tiene implicaciones en la función tiroidea fetal y neonatal(31). Por ende, se debe determinar el riesgo fetal con la medición de estos anticuerpos. En pacientes con antecedentes de hipertiroidismo se deben medir al inicio de la gestación y, en caso se estar elevados, repetir a la semana 18 a 20 (19).
Los niveles que excedan tres veces el límite superior normal son predictores de hipertiroidismo fetal y neonatal, por lo que requerirán vigilancia fetal estricta(19,34).
HIpertiroidisMo
La frecuencia de hipertiroidismo es de 0,75% en Europa(35) y 1,3% en Estados Unidos. Su etiología principal es la enfermedad de Graves, responsable de 85 a 90% de los casos(36). Su incidencia aumenta con la edad y es más frecuente en mujeres en edad reproductiva(37). Está presente en 55 a 80 y 35 a 50 casos por 100 000 personas/año en mujeres mayores de 30 y entre 20 a 29 años, respectivamente; en mujeres menores de 20 años, el riesgo es mucho menor(38). El riesgo teórico de desarrollar hipertiroidismo durante el embarazo es aproximadamente 0,5%; pese a esto, las enfermedades tiroideas autoinmunes tienden a mejorar durante la gestación. No obstante, hay mayor probabilidad de detección de hipertiroidismo no diagnosticado debido a que la estimulación por la hCG puede hacerlo clínicamente manifiesto(38).
El hipertiroidismo durante el embarazo se puede presentar de diferentes maneras y sus manifestaciones clínicas pueden ser enmascaradas por cambios normales de la gestación(36). Las pacientes pueden manifestar los signos y síntomas clásicos, tales como taquicardia (que no mejora con la maniobra de Valsalva), diaforesis excesiva, hipertensión, palpitaciones, disnea, nerviosismo, insomnio, aumento de frecuencia de defecación, intolerancia al calor, bocio, temblor de extremidades, pérdida de peso o ganancia inadecuada, polidipsia(7,36). La tirotoxicosis es un síndrome clínico caracterizado por un estado hipermetabólico e hiperactivo que resulta cuando una persona es expuesta a cantidades suprafisiológicas de hormonas tiroideas(19). En su forma más severa puede presentarse con tormenta tiroidea y falla cardiaca tirotóxica(7,36,37).
Durante la valoración de la función tiroidea, si se detectan concentraciones de TSH anormales, debe evaluarse los niveles de TT4 (o FT4) y T3(19). Inicialmente, el diagnóstico por bioquímica es directo; los niveles de TSH por debajo del rango de referencia con valores séricos de TT4/FT4 y/o T3 elevados, caracteriza el hipertiroidismo franco; mientras que su forma subclínica se presenta con disminución de los valores de TSH pero T3 y T4 en rangos normales(39).
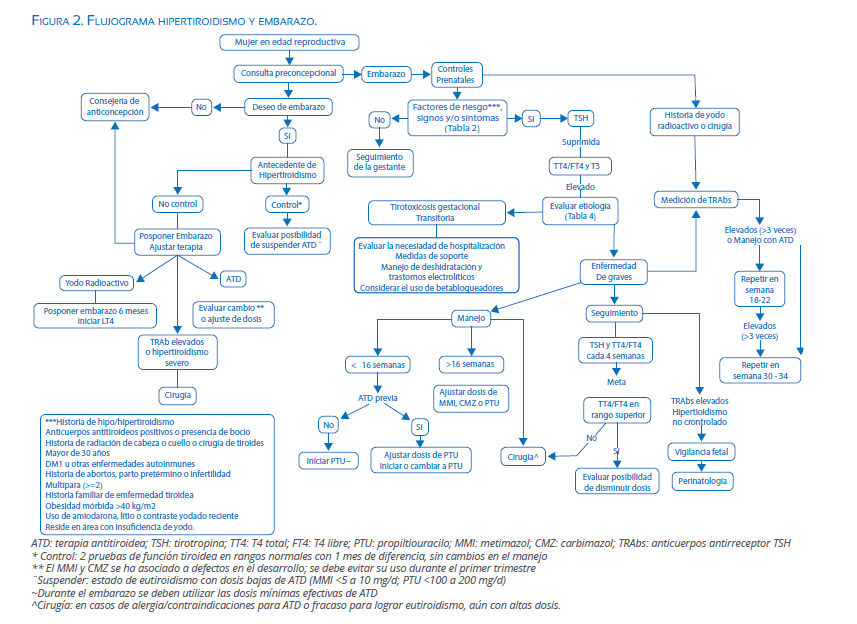
Durante el abordaje de la paciente con exceso de hormonas tiroideas, se debe tratar de diferenciar los cambios fisiológicos, cambios fisiológicos del hipertiroidismo y la tirotoxicosis gestacional transitoria; esta diferenciación tiene implicaciones en los efectos adversos y manejo(24) (figura 2).
Etiología del Hipertiroidismo
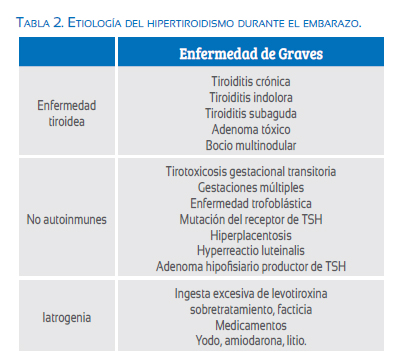
La causa más común de tirotoxicosis es la hiperfunción tiroidea (hipertiroidismo), y la causa más frecuente de hipertiroidismo en la mujer en edad reproductiva es la enfermedad de Graves autoinmune(37,40). Otras causas menos comunes incluyen el bocio tóxico multinodular, el adenoma tóxico, tiroiditis subaguda, adenoma pituitario, metástasis tiroideas funcionales o mutaciones de la línea germinal del receptor de TSH(7,41) (tabla2).
Tirotoxicosis gestacional transitoria
Es definida como tirotoxicosis en mujeres con un embarazo aparentemente normal y se produce por la estimulación excesiva inducida por la elevación de la hCG(42,43). Ocurre alrededor de 2% a 3% de todos los embarazos, especialmente durante el pico de la hCG(36). Se ha asociado con enfermedad trofoblástica y embarazos múltiples, debido principalmente por los altos niveles de hCG encontrados en estos tipos de embarazos(44-48).
Los niveles de FT4 y TT4 están aumentados y la TSH sérica se encuentra en niveles indetectables o suprimidos; sin embargo, los valores de TT3 y FT3 están aumentados en solo 30% a 40% de las mujeres afectadas(41). Se diferencia de la enfermedad de Graves por la ausencia de TRAbs, bocio, anormalidades al ultrasonido o la presencia de oftalmopatía(49) (tabla 3).
Los signos y síntomas hipermetabólicos característicos de hipertiroidismo están ausentes o son leves. La severidad de presentación puede variar desde náuseas matutinas hasta hiperémesis gravídica(41). Los altos niveles de hCG se correlacionan con la presentación de hiperémesis gravídica(50), definida como náuseas y vómito severo que lleva a la pérdida del 5% del peso corporal, deshidratación, cetonuria, pruebas de función hepática alterada(36). Generalmente, se resuelve en el segundo trimestre, no conlleva a desenlaces adversos importantes y no requiere tratamiento(36,50,51).
El manejo de la tirotoxicosis gestacional transitoria depende de la severidad de los síntomas; cuando sea necesario, se pueden utilizar bajas dosis de betabloqueadores y generalmente no se requiere terapia antitiroidea(19). En hiperémesis gravídica, el tratamiento debe estar enfocado en el manejo del vómito, deshidratación y anormalidades electrolíticas; necesitando en algunos casos manejo intrahospitalario(19,43).
Enfermedad de graves
La enfermedad de Graves es la causa más frecuente de hipertiroidismo, con una prevalencia aproximada de 0,5%(49). Su incidencia fluctúa a lo largo de la gestación; frecuentemente se exacerba durante el primer trimestre debido a los efectos adicionales de la estimulación por la hCG al receptor de TSH(52,53). Mejora en la segunda mitad del embarazo por la remisión inmunológica y se exacerba en el posparto, como consecuencia de la reactivación(53,54).
La fisiopatología consiste en la presencia de anticuerpos que se unen y activan el receptor para la TSH, produciendo una liberación anormal de hormonas tiroideas(39). Ya que los anticuerpos maternos circulantes pueden cruzar la placenta y causar hipertiroidismo fetal, estos deben ser medidos al inicio de la gestación, a la semana 18 a 22 y en la semana 30 o 34, según sea el caso(49,55). Si los anticuerpos están elevados, el feto requerirá valoración para disfunción tiroidea, con ultrasonidos seriados para evaluar crecimiento fetal y detectar signos de hipertiroidismo(55).
Los signos y síntomas son similares a los de la paciente no gestante(40). El diagnóstico de enfermedad de Graves se debe sospechar en la mujer embarazada que: 1) haya presentado síntomas previos al embarazo, 2) tenga diagnóstico previo de hipertiroidismo, o 3) haya tenido un hijo previo con disfunción tiroidea(56).
Complicaciones
El hipertiroidismo durante el embarazo tiene consideraciones especiales, además de implicaciones importantes en la sobrevida y morbilidad materno-fetal (tabla 4). En retrospectiva, las complicaciones han disminuido por el uso de medicamentos antitiroideos como propiltiouracilo y metimazol(49).
Tratamiento
Medicamentos antitiroidEos
Antes de iniciar un manejo específico, es primordial realizar una consejería apropiada, teniendo en cuenta los efectos adversos que los medicamentos pueden producir(57). Los medicamentos antitiroideos (ATD) son la base en el manejo; el yodo radiactivo está contraindicado durante el embarazo y la tiroidectomía solo se recomienda en casos específicos(58).
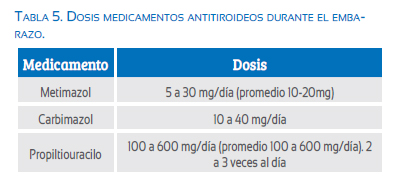
Los ATD son tioamidas que disminuyen la organificación del yodo y su unión a monoyodotirosina y diyodotirosina, con consecuente inhibición de la síntesis de las hormonas tiroideas(59). Esta inhibición no es completa y su efecto es gradual hasta llegar a la normalización en algunas semanas(19). Los medicamentos disponibles de este grupo incluyen el metimazol (MMI), carbimazol (CMZ) y propiltiouracilo (PTU); todos estos fármacos cruzan la placenta y son igualmente efectivos en el manejo del hipertiroidismo durante el embarazo(19,58,59). La dosis inicial depende de la severidad de los síntomas y el grado de hipertiroxinemia(19) (tabla 5).
La terapia antitiroidea se relaciona a potenciales efectos adversos, particularmente cuando se utilizan durante etapas tempranas del embarazo(58). El uso de MMI o CMZ se ha asociado con casos de agranulocitosis y un riesgo aumentado de defectos del desarrollo, como atresia de coanas o esofágica, defectos oculares aplasia cutis y onfalocele. El PTU se ha asociado a defectos del desarrollo, como quistes faciales e hidronefrosis; frecuentemente son defectos menores y menos severos; otros efectos de este medicamento incluyen agranulocitosis, hepatoxicidad y vasculitis(58-63).
Las recomendaciones actuales consisten en evaluar la necesidad de continuar la terapia antitiroidea o la posibilidad de suspenderla(19,23,24). Si la paciente se encuentra eutiroidea con dosis bajas de MMI o PTU, se puede considerar suspender la ATD y continuar con seguimiento materno-fetal(19). En gestantes con alto riesgo de desarrollar tirotoxicosis (fuera de metas o altas dosis de ATD), se recomienda continuar la ATD con PTU de primera línea durante el primer trimestre(19,24).
Hay discusión sobre la continuación de la terapia después del primer trimestre, pudiendo ser razonable continuar con el PTU instaurado en el primer trimestre evaluando la función hepática materna; o cambiar a MMI, disminuyendo el riesgo de hepatotoxicidad(59,60). La decisión debe ser individualizada, ya que existe la posibilidad de producirse un periodo de menor control tiroideo, lo cual tiene consecuencias para la madre y el feto(19,24,59,60).
La meta del tratamiento es mantener los niveles de hormonas tiroideas lo más cercano a rangos normales, utilizando las dosis más bajas posibles; en la mayoría de los casos, la dosis se puede disminuir después del primer trimestre(19,49). El seguimiento de la función tiroidea es importante; las recaídas pueden presentarse aproximadamente en 30% a 50%; se debe evaluar con frecuencia, cada 2 a 4 semanas desde el inicio de la terapia y cada 4 a 6 semanas al alcanzar las metas(19,61). El exceso de tratamiento (sobretratamiento) puede inducir hipotiroidismo y bocio fetal(19,59,60).
Los betabloqueadores, como el propanolol (10 a 40 mg cada 6 a 8 horas), pueden ser utilizados para controlar los síntomas; la dosis debe ser reducida según la respuesta, ya que su uso a largo plazo se ha relacionado con restricción del crecimiento intrauterino (RCIU), bradicardia fetal e hipoglicemia neonatal(19).
Manejo quirúrgico
La tiroidectomía debe ser considerada en caso de reacciones adversas severas a los medicamentos antitiroideos; en la paciente en quien no se logra el eutiroidismo a pesar de las dosis elevadas; o en caso de no adherencia con hipertiroidismo no controlado(24,64). Si está indicada, se considera que el momento óptimo de realizar la cirugía es el segundo trimestre, aunque el riesgo de pérdida fetal persiste(19,24,40). Posterior a la tiroidectomía, se produce una disminución gradual de los anticuerpos y es necesario continuar la terapia antitiroidea; su suspensión puede resultar en hipertiroidismo fetal, lo que hace necesario un control fetal a pesar de la adecuada respuesta materna(19).
Tormenta tiroidea
La tormenta tiroidea es el estado de mayor descompensación del hipertiroidismo. Generalmente se presenta en pacientes pobremente o no controlados y se asocia a mayor mortalidad materna y fetal(7). Puede ser desencadenada por infecciones, preeclampsia, parto o cesárea, entre otras situaciones(65). Clínicamente, los pacientes presentan fiebre, alteración del estado mental, taquicardia severa o taquiarritmias, intolerancia al frío, náuseas y vómito, y diarrea severa(38). Estos síntomas son la manifestación del inicio abrupto de un estado hipermetabólico que puede resultar en algunos casos en insuficiencia cardiaca y falla orgánica múltiple. Aunque el diagnóstico es clínico, debe haber evidencia en las pruebas de función tiroidea de hipertiroidismo(7,38,66).
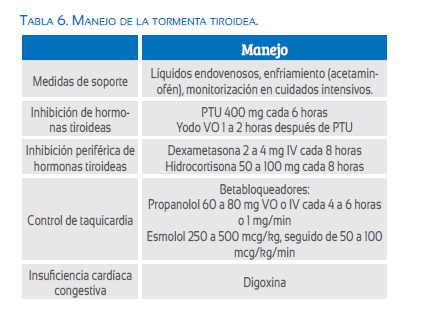
Es necesario el ingreso a la unidad de cuidados intensivos, contando con monitorización continua y medidas de soporte (líquidos endovenosos, oxígeno, medidas de enfriamiento, corrección de anormalidades electrolíticas)(38). La fiebre debe ser manejada con acetaminofén; se debe evitar la aspirina, ya que puede aumentar las hormonas tiroideas libres(38,67). Las taquiarritmias o síntomas hiperadrenérgicos son manejados con betabloqueadores, como propanolol o esmolol; en caso de insuficiencia cardiaca, se indica la digoxina(38,66,67).
La terapia antitiroidea a dosis altas debe iniciarse tan pronto como sea posible, siendo preferible el uso de PTU por su capacidad de bloquear la conversión de T4 a T3(65,67). Una hora después del inicio de la ATD, debe adicionarse alguna forma de yodo por vía oral, para bloquear la liberación hormonal desde la glándula tiroidea; se debe iniciar el yodo solo una vez que se haya empezado la ATD; de lo contrario puede empeorar la tirotoxicosis(38,65). Los glucocorticoides (hidrocortisona o dexametasona) pueden ser útiles en el bloqueo periférico de las hormonas tiroideas(65). El factor desencadenante debe ser detectado y tratado siempre que sea posible. El parto y la cesárea deben ser postergados hasta que la condición materna se estabilice, porque pueden exacerbar la tormenta tiroidea(66,67). En general, la tormenta tiroidea es una condición que amenaza la vida, requiere una detección temprana y un manejo en unidades de cuidado intensivo y monitoreo materno-fetal continuo(7,38,66,67) (tabla 6).
Conclusiones
Las alteraciones tiroideas se presentan con relativa frecuencia en mujeres en edad reproductiva, lo que hace importante su reconocimiento durante el embarazo(2-4). Según estudios internacionales de prevalencia e incidencia, la presentación de hipertiroidismo depende del grupo poblacional al cual pertenezca(35,53). A nivel nacional y regional, no se cuenta con estrategias de notificación obligatoria que permitan evaluar el comportamiento de esta patología en nuestra población, especialmente en la población embarazada.
Durante la evaluación de la función tiroidea en la gestante se deben tener en cuenta los cambios fisiológicos(5,6,19). Diversas sociedades han tratado de establecer rangos de referencias que se ajusten a todas las poblaciones, aunque preferiblemente se debe contar con valores propios(19,23,24). A nivel mundial ya se cuenta con estudios de esta clase(20,22,25,28). En nuestro país, es necesario incitar este tipo de investigaciones para lograr estrategias de detección precisa y apropiada para las características propias de nuestra población.
Agradecimientos
A nuestros maestros.
Este trabajo no ha sido publicado o remitido a otra revista biomédica.
Conflicto en interés: Los autores declaran no tener conflictos de interés
Financiación: Autofinanciado
Citar como: Franco-Herrera D, Córdoba Díaz D, González Ocampo D, Ospina JJ, Olaya Garay SX, Murillo García DR. Hipertiroidismo en el embarazo. Rev Peru Ginecol Obstet.2018;64(4):569-579 DOI: https://doi.org/10.31403/rpgo.v64i2125
Referencias Bibliográficas
1. Krassas G, Karras SN, Pontikides N. Thyroid diseases during pregnancy: a number of important issues. Hormones (Athens, Greece). 2015;14(1):59-69. DOI: 10.14310/horm.2002.1574. [ Links ]
2. Carney LA, Quinlan JD, West JM. Thyroid disease in pregnancy. Am Fam Phys. 2014;89(4):273-8. [ Links ]
3. Mannisto T, Mendola P, Grewal J, Xie Y, Chen Z, Laughon SK. Thyroid diseases and adverse pregnancy outcomes in a contemporary US cohort. J Clin Endocrinol Metab. 2013;98(7):2725-33. DOI: 10.1210/jc.2012-4233. [ Links ]
4. Giacobbe AM, Grasso R, Triolo O, Tonni G, Granese R. Thyroid diseases in pregnancy: a current and controversial topic on diagnosis and treatment over the past 20 years. Arch Gynecol Obstet. 2015;292(5):995-1002. DOI: 10.1007/s00404-015-3741-y. [ Links ]
5. Pearce EN. Thyroid disorders during pregnancy and postpartum. Best practice & research Clin Obstet Gynaecol. 2015;29(5):700-6. DOI: 10.1016/j.bpobgyn.2015.04.007. [ Links ]
6. Alemu A, Terefe B, Abebe M, Biadgo B. Thyroid hormone dysfunction during pregnancy: A review. Int J Reprod Biomed (Yazd, Iran). 2016;14(11):677-86. DOI: 10.29252/ijrm.14.11.677. [ Links ]
7. King JR, Lachica R, Lee RH, Montoro M, Mestman J. Diagnosis and management of hyperthyroidism in pregnancy: a review. Obstet Gynecol Survey. 2016;71(11):67585. DOI: 10.1097/ogx.0000000000000367. [ Links ]
8. Leung AM. Thyroid function in pregnancy. J Trace Elem Med Biol. 2012;26(2-3):137-40. DOI: 10.1016/j.jtemb.2012.03.004. [ Links ]
9. Feldt-Rasmussen U, Mathiesen ER. Endocrine disorders in pregnancy: physiological and hormonal aspects of pregnancy. Best Pract Res Clin Endocrinol Metab. 2011;25(6):875-84. DOI: 10.1016/j.beem.2011.07.004. [ Links ]
10. Moleti M, Trimarchi F, Vermiglio F. Thyroid physiology in pregnancy. Endoc Prac. 2014;20(6):589-96. DOI: 10.4158/ep13341.ra. [ Links ]
11. Yalamanchi S, Cooper DS. Thyroid disorders in pregnancy. Curr Op Obstet Gynecol. 2015;27(6):406-15. DOI: 10.1097/gco.0000000000000226. [ Links ]
12. Korevaar TI, de Rijke YB, Chaker L, Medici M, Jaddoe VW, Steegers EA, et al. Stimulation of thyroid function by human chorionic gonadotropin during pregnancy: a risk factor for thyroid disease and a mechanism for known risk factors. Thyroid. 2017;27(3):440-50. DOI: 10.1089/thy.2016.0527. [ Links ]
13. Tingi E, Syed AA, Kyriacou A, Mastorakos G, Kyriacou A. Benign thyroid disease in pregnancy: A state of the art review. J Clin Translat Endocrinol. 2016;6:37-49. DOI: 10.1016/j.jcte.2016.11.001. [ Links ]
14. Zimmermann MB. The effects of iodine deficiency in pregnancy and infancy. Paed Perinat Epidemiol. 2012;26 Suppl 1:108-17. DOI: 10.1111/j.13653016.2012.01275.x. [ Links ]
15. Amouzegar A, Khazan M, Hedayati M, Azizi F. An assessment of the iodine status and the correlation between iodine nutrition and thyroid function during pregnancy in an iodine sufficient area. Eur J Clin Nutr. 2014;68(3):397-400. DOI: 10.1038/ejcn.2013.273. [ Links ]
16. Laurberg P, Cerqueira C, Ovesen L, Rasmussen LB, Perrild H, Andersen S, et al. Iodine intake as a determinant of thyroid disorders in populations. Best Pract Res Clin Endocrinol Metab. 2010;24(1):13-27. DOI: 10.1016/j.beem.2009.08.013. [ Links ]
17. Chan SY, Vasilopoulou E, Kilby MD. The role of the placenta in thyroid hormone delivery to the fetus. Nature Clin Pract Endocrinol Metab. 2009;5:45. DOI: 10.1038/ncpendmet1026. [ Links ]
18. Santini F, Chiovato L, Ghirri P, Lapi P, Mammoli C, Montanelli L, et al. Serum iodothyronines in the human fe tus and the newborn: evidence for an important role of placenta in fetal thyroid hormone homeostasis. J Clin Endocrinol Metab. 1999;84(2):493-8. DOI: 10.1210/jcem.84.2.5439. [ Links ]
19. Alexander EK, Pearce EN, Brent GA, Brown RS, Chen H, Dosiou C, et al. 2017 Guidelines of the American Thyroid Association for the Diagnosis and Management of Thyroid Disease During Pregnancy and the Postpartum. Thyroid. 2017;27(3):315-89. DOI: 10.1089/thy.2016.0457. [ Links ]
20. Kim HJ, Cho YY, Kim SW, Kim TH, Jang HW, Lee S-Y, Choi S-J, Roh C-R, Kim J-H, Chung JH, Oh SY. Reference intervals of thyroid hormones during pregnancy in Korea, an iodine-replete area Korean J Intern Med. 2017;0(0):0. DOI: 10.3904/kjim.2016.051. [ Links ]
21. Practice Bulletin No. 148: Thyroid disease in pregnancy. Obstet Gynecol. 2015;125(4):996-1005. DOI: 10.1097/01.aog.0000462945.27539.93. [ Links ]
22. Xing J, Yuan E, Li J, Zhang Y, Meng X, Zhang X, et al. Trimesterand assay-specific thyroid reference intervals for pregnant women in China. Int J Endocrinol. 2016;2016:3754213. DOI: 10.1155/2016/3754213. [ Links ]
23. Lazarus J, Brown RS, Daumerie C, Hubalewska-Dydejczyk A, Negro R, Vaidya B. 2014 European Thyroid Association Guidelines for the Management of Subclinical Hypothyroidism in Pregnancy and in Children. Eur Thyroid J. 2014;3(2):76-94. DOI: 10.1159/000362597. [ Links ]
24. De Groot L, Abalovich M, Alexander EK, Amino N, Barbour L, Cobin RH, et al. Management of thyroid dysfunction during pregnancy and postpartum: an Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2012;97(8):2543-65. DOI: 10.1210/jc.2011-2803. [ Links ]
25. Ortega Carpio A, Vazquez Rico I, Castano Lopez MA, Duarte Gonzalez L, Montilla Alvaro M, Ruiz Reina A. [Thyrotropin reference ranges during pregnancy in the province of Huelva, Spain]. Semergen. 2017. DOI: 10.1016/j.semerg.2017.08.008. [ Links ]
26. Lazarus JH. Thyroid function in pregnancy. British Medical Bulletin. 2011;97(1):137-48. DOI: 10.1093/bmb/ldq039. [ Links ]
27. Gargallo Fernandez M. Hyperthyroidism and pregnancy. Endocrinol Nutr. 2013;60(9):535-43. DOI: 10.1016/j.endonu.2012.11.006. [ Links ]
28. Kostecka-Matyja M, Fedorowicz A, Bar-Andziak E, Bednarczuk T, Buziak-Bereza M, Dumnicka P, et al. Reference values for TSH and free thyroid hormones in healthy pregnant women in Poland: A prospective, multicenter study. Eur Thyroid J. 2017;6(2):82-8. DOI: 10.1159/000453061. [ Links ]
29. Wilson KL, Casey BM, McIntire DD, Cunningham FG. Is total thyroxine better than free thyroxine during pregnancy? Am J Obstet Gynecol. 2014;211(2):132.e1.e6. DOI: 10.1016/j.ajog.2014.02.029. [ Links ]
30. Kotwal A, Stan M. Thyrotropin receptor antibodies-an overview. Ophth Plastic Reconstr Surg. 2018. DOI: 10.1097/iop.0000000000001052. [ Links ]
31. Bucci I, Giuliani C, Napolitano G. Thyroid-stimulating hormone receptor antibodies in pregnancy: clinical relevance. Front Endocrinol. 2017;8:137. DOI: 10.3389/fendo.2017.00137. [ Links ]
32. De Leo S, Pearce EN. Autoimmune thyroid disease during pregnancy. Lancet Diab Endocrinol. 2017. DOI: 10.1016/s2213-8587(17)30402-3. [ Links ]
33. van Dijk MM, Smits IH, Fliers E, Bisschop PH. Maternal thyrotropin receptor antibody concentration and the risk of fetal and neonatal thyrotoxicosis: a systematic review. Thyroid. 2018;28(2):257-64. DOI: 10.1089/thy.2017.0413. [ Links ]
34. Abeillon-du Payrat J, Chikh K, Bossard N, Bretones P, Gaucherand P, Claris O, et al. Predictive value of maternal second-generation thyroid-binding inhibitory immunoglobulin assay for neonatal autoimmune hyperthyroidism. Eur J Endocrinol. 2014;171(4):451-60. DOI: 10.1530/eje-14-0254. [ Links ]
35. Garmendia Madariaga A, Santos Palacios S, Guillen-Grima F, Galofre JC. The incidence and prevalence of thyroid dysfunction in Europe: a meta-analysis. J Clin Endocrinol Metab. 2014;99(3):923-31. DOI: 10.1210/jc.2013-2409. [ Links ]
36. Galofre JC, Davies TF. Autoimmune thyroid disease in pregnancy: a review. J Women’s Health. 2009;18(11):1847-56. DOI: 10.1089/jwh.2008.1234.
37. De Leo S, Lee SY, Braverman LE. Hyperthyroidism. Lancet. 2016;388(10047):906-18. DOI: 10.1016/s01406736(16)00278-6. [ Links ]
38. Cooper DS, Laurberg P. Hyperthyroidism in pregnancy. Lancet Diab Endocrinol. 2013;1(3):238-49. DOI: 10.1016/s2213-8587(13)70086-x. [ Links ]
39. Laurberg P, Andersen SL. Endocrinology in pregnancy: Pregnancy and the incidence, diagnosing and therapy of Graves’ disease. Eur J Endocrinol. 2016;175(5):R219-30. DOI: 10.1530/eje-16-0410.
40. Franklyn JA, Boelaert K. Thyrotoxicosis. Lancet. 2012;379(9821):1155-66. DOI: 10.1016/s01406736(11)60782-4. [ Links ]
41. Mestman JH. Hyperthyroidism in pregnancy. Curr Op Endocrinol Diab Obes. 2012;19(5):394-401. DOI: 10.1097/MED.0b013e328357f3d5. [ Links ]
42. Diez JJ, Iglesias P, Donnay S. [Thyroid dysfunction during pregnancy]. Med Clin (Barc). 2015;145(8):344-9. DOI: 10.1016/j.medcli.2014.08.007. [ Links ]
43. Kopp P. Thyrotoxicosis of other etiologies. Endotext. South Dartmouth (MA): MDText.com, Inc.; 2000. [ Links ]
44. Virmani S, Srinivas SB, Bhat R, Rao R, Kudva R. Transient thyrotoxicosis in molar pregnancy. J Clin Diagn Res. 2017;11(7):Qd01-qd2. DOI: 10.7860/jcdr/2017/28561.10133. [ Links ]
45. Moskovitz JB, Bond MC. Molar pregnancy-induced thyroid storm. J Emerg Med. 2010;38(5):e71-6. DOI: 10.1016/j.jemermed.2009.08.053. [ Links ]
46. Suksai M, Suwanrath C, Kor-Anantakul O, Geater A, Hanprasertpong T, Atjimakul T, et al. Complete hydatidiform mole with co-existing fetus: Predictors of live birth. Eur J Obstet Gynecol Reprod Biol. 2017;212:1-8. DOI: 10.1016/j.ejogrb.2017.03.013. [ Links ]
47. Higuchi R, Minami S, Yagi S, Otani T, Kioka N, Hiramatsu C, et al. Gestational thyrotoxicosis during a triplet pregnancy. J Obstet Gynaecol. 2008;28(4):444-5. DOI: 10.1080/01443610802164318. [ Links ]
48. Chiniwala NU, Woolf PD, Bruno CP, Kaur S, Spector H, Yacono K. Thyroid storm caused by a partial hydatidiform mole. Thyroid. 2008;18(4):479-81. DOI: 10.1089/thy.2007.0212. [ Links ]
49. Negro R, Stagnaro-Green A. Clinical aspects of hyperthyroidism, hypothyroidism, and thyroid screening in pregnancy. Endocr Pract. 2014;20(6):597-607. DOI: 10.4158/ep13350.ra. [ Links ]
50. Sun S, Qiu X, Zhou J. Clinical analysis of 65 cases of hyperemesis gravidarum with gestational transient thyrotoxicosis. J Obstet Gynaecol Res. 2014;40(6):1567-72. DOI: 10.1111/jog.12372. [ Links ]
51. Kinomoto-Kondo S, Umehara N, Sato S, Ogawa K, Fujiwara T, Arata N, et al. The effects of gestational transient thyrotoxicosis on the perinatal outcomes: a case-control study. Arch Gynecol Obstet. 2017;295(1):87-93. DOI: 10.1007/s00404-016-4219-2. [ Links ]
52. Stagnaro-Green A. Overt hyperthyroidism and hypothyroidism during pregnancy. Clin Obstet Gynecol. 2011;54(3):478-87. DOI: 10.1097/GRF.0b013e3182272f32. [ Links ]
53. Andersen SL, Olsen J, Carle A, Laurberg P. Hyperthyroidism incidence fluctuates widely in and around pregnancy and is at variance with some other autoimmune diseases: a Danish population-based study. J Clin Endocrinol Metab. 2015;100(3):1164-71. DOI: 10.1210/jc.2014-3588. [ Links ]
54. Ide A, Amino N, Kudo T, Yoshioka W, Hisakado M, Nishihara E, et al. Comparative frequency of four different types of pregnancy-associated thyrotoxicosis in a single thyroid centre. Thyroid Res. 2017;10:4. DOI: 10.1186/s13044-017-0039-0. [ Links ]
55. Smith A, Eccles-Smith J, D’Emden M, Lust K. Thyroid disorders in pregnancy and postpartum. Australian Prescriber. 2017;40(6):214-9. DOI: 10.18773/austprescr.2017.075.
56. Nguyen CT, Sasso EB, Barton L, Mestman JH. Graves’ hyperthyroidism in pregnancy: a clinical review. Clin Diab Endocrinol. 2018;4:4. DOI: 10.1186/s40842-0180054-7.
57. Lazarus JH. Management of hyperthyroidism in pregnancy. Endocrine. 2014;45(2):190-4. DOI: 10.1007/s12020-013-0086-9. [ Links ]
58. Andersen SL. Risk of embryopathies with use of antithyroidal medications. Curr Op Endocrinol Diab Obes. 2017;24(5):364-71. DOI: 10.1097/med.0000000000000353. [ Links ]
59. Matteo C, Marta D, Elena DG, Maurizio C. Pharmacologic treatment of hyperthyroidism during pregnancy. Birth Defects Research Part A. Clin Mol Teratol. 2012;94(8):612-9. DOI: doi:10.1002/bdra.23012. [ Links ]
60. Taylor PN, Vaidya B. Side effects of anti-thyroid drugs and their impact on the choice of treatment for thyrotoxicosis in pregnancy. Eur Thyroid J. 2012;1(3):176-85. DOI: 10.1159/000342920. [ Links ]
61. Korevaar TIM, Medici M, Visser TJ, Peeters RP. Thyroid disease in pregnancy: new insights in diagnosis and clinical management. Nature Rev Endocrinol. 2017;13(10):610-22. DOI: 10.1038/nrendo.2017.93. [ Links ]
62. Song R, Lin H, Chen Y, Zhang X, Feng W. Effects of methimazole and propylthiouracil exposure during pregnancy on the risk of neonatal congenital malformations: A meta-analysis. PLoS One. 2017;12(7):e0180108. DOI: 10.1371/journal.pone.0180108. [ Links ]
63. Akmal A, Kung J. Propylthiouracil, and methimazole, and carbimazole-related hepatotoxicity. Expert Op Drug Safety. 2014;13(10):1397-406. DOI: 10.1517/14740338.2014.953796. [ Links ]
64. Piantanida E. Preoperative management in patients with Graves’ disease. Gland Surg. 2017;6(5):476-81. DOI: 10.21037/gs.2017.05.09.
65. Chan GW, Mandel SJ. Therapy insight: management of Graves’ disease during pregnancy. Nat Clin Pract Endocrinol Metab. 2007;3(6):470-8. DOI: 10.1038/ncpendmet0508.
66. Fitzpatrick DL, Russell MA. Diagnosis and management of thyroid disease in pregnancy. Obstet Gynecol Clin N Am. 2010;37(2):173-93. DOI: 10.1016/j.ogc.2010.02.007. [ Links ]
67. Khoo CM, Lee KO. Endocrine emergencies in pregnancy. Best Pract Res Clin Obstet Gynaecol. 2013;27(6):885-91. DOI: 10.1016/j.bpobgyn.2013.08.005. [ Links ]
68. Andersen SL, Andersen S, Vestergaard P, Olsen J. Maternal thyroid function in early pregnancy and child neurodevelopmental disorders: A Danish nationwide case-cohort study. Thyroid. 2018;28(4):537-46. DOI: 10.1089/thy.2017.0425. [ Links ]
69. Sheehan PM, Nankervis A, Araujo Junior E, Da Silva Costa F. Maternal thyroid disease and preterm birth: systematic review and meta-analysis. J Clin Endocrinol Metab. 2015;100(11):4325-31. DOI: 10.1210/jc.2015-3074. [ Links ]
70. Phoojaroenchanachai M, Sriussadaporn S, Peerapatdit T, Vannasaeng S, Nitiyanant W, Boonnamsiri V, et al. Effect of maternal hyperthyroidism during late pregnancy on the risk of neonatal low birth weight. Clin Endocrinol. 2001;54(3):365-70. DOI: 10.1046/j.13652265.2001.01224.x. [ Links ]
71. Korevaar TIM, Tiemeier H, Peeters RP. Clinical associations of maternal thyroid function with fetal brain development:Epidemiological interpretation and overview of available evidence. Clin Endocrinol. 2018. DOI: 10.1111/cen.13724. [ Links ]
72. Aggarawal N, Suri V, Singla R, Chopra S, Sikka P, Shah VN, et al. Pregnancy outcome in hyperthyroidism: a case control study. Gynecol Obstet Invest. 2014;77(2):94-9. DOI: 10.1159/000357615. [ Links ]
73. Azizi F, Mehran L, Hosseinpanah F, Delshad H, Amouzegar A. Secondary and tertiary preventions of thyroid disease. Endoc Res. 2018;43(2):124-40. DOI: 10.1080/07435800.2018.1424720. [ Links ]
74. Sheffield JS, Cunningham FG. Thyrotoxicosis and heart failure that complicate pregnancy. American journal of obstetrics and gynecology. 2004;190(1):211-7. DOI: 10.1016/s0002-9378(03)00944-x.re that complicate pregnancy. Am J Obstet Gynecol. 2004;190(1):211-7. [ Links ]
Correspondencia:
Juan José Ospina
Facultad Ciencias de la Salud, Programa de Medicina, Universidad Tecnológica de Pereira, Área Materno infantil. Carrera 27 No. 10-02 Barrio Los Álamos, Risaralda, Colombia – A.A 97 – Código postal: 66003
juanjoospina@utp.edu.co
Recibido: 28 julio 2018
Aceptado: 10 setiembre 2018