Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Ginecología y Obstetricia
versión On-line ISSN 2304-5132
Rev. peru. ginecol. obstet. vol.64 no.4 Lima oct./dic. 2018
http://dx.doi.org/10.31403/rpgo.v64i2132
SIMPOSIO CIRUGÍA FETAL EN AMÉRICA LATINA
Cirugía fetal en teratoma sacrococcígeo
Fetal surgery in sacroccygeal teratoma
Nelson Leonel Ortega, MSc1 ORCID ID: https://orcid.org/0000-0003-1046-7715.
1. 1. Médico Subespecialista en Medicina Materno Fetal, Complejo Hospitalario Metropolitano A.A.M, Caja de Seguro Social, Panamá, Ciudad de Panamá
ABSTRACT
Sacrococcygeal teratoma is the most common neonatal tumor. In a large number of cases, fetuses are born at term and the teratoma can be resected without complications. However, in another group, prematurity, hydrops and cardiac failure do not allow pregnancy interruption without consequences for the fetus. Here is where fetal surgery has a place. We conducted a search of the literature related to sacrococcygeal teratoma and case reports where surgery was performed, including those with details on the patient’s preparation, surgery, and the postoperative period. The average gestational age of presentation in ultrasound is 23 weeks. There is more literature on open surgery, and the main indication is hydrops or imminent cardiac failure. The reported cases with minimally invasive therapy are the least, with controversial results. Sacrococcygeal teratoma in the newborn is an entity with very good prognosis depending on the case, time of diagnosis, type of tumor, and malignancy potential. However, those of prenatal diagnosis are at high risk of complications and death. There are several reports of open surgery and EXIT procedure (special delivery technique where the sacrococcygeal teratoma is exposed through a limited incision in the uterus) with good surgical results but with high maternal and fetal comorbidity. Therefore, minimally invasive techniques have emerged to reduce the potential risks of open surgery; nevertheless, there are contradictory results.
Key words: Teratoma, sacrococcygeal, Fetal surgery, Prenatal diagnosis, EXIT procedure, Hydrops, Minimally invasive surgery.
RESUMEN
El teratoma sacrococcígeo es el tumor neonatal más común. En un gran número de los casos los fetos llegan al término y pueden ser resecados sin complicaciones. Sin embargo, en otro grupo de pacientes, su prematuridad, el hidrops y la falla cardiaca no permiten interrumpir el embarazo sin consecuencias para el feto. Aquí es donde la cirugía fetal tiene cabida. Se realizó una búsqueda de la literatura relacionada al teratoma sacrococcígeo y reportes de casos donde se practicó cirugía. Se incluyeron también aquellos en donde se detallaba la preparación de la paciente, el transoperatorio y postoperatorio. La edad gestacional de la presentación usualmente fue durante la ecografía estructural, con una media de las 23 semanas. Se encuentra más literatura acerca de cirugías abiertas y la principal indicación es el hidrops y/o la falla cardiaca inminente. Los casos reportados realizados con mínima invasión son los menos, con resultados controversiales. El teratoma sacrococcígeo en el recién nacido es una entidad con muy buen pronóstico dependiendo del caso, tiempo del diagnóstico, tipo del tumor y potencial de malignidad del mismo. Sin embargo, el diagnosticado prenatalmente, cursa con alto riesgo de complicaciones y muerte. Hay varios casos reportados de cirugía abierta y procedimiento EXIT (técnica especial en la que el tumor es expuesto a través de una pequeña incisión) con buenos resultados quirúrgicos, pero con alta comorbilidad materna y fetal. Por ende, han surgido técnicas mínimamente invasivas para disminuir los riesgos potenciales de la cirugía abierta; a pesar de esto hay resultados contradictorios.
Palabras clave. Teratoma sacrococcígeo, Cirugía fetal, Diagnóstico prenatal, procedimiento EXIT, Hidrops, Cirugía mínimamente invasiva.
Introducción
El teratoma sacrococcígeo (TSC) es el tumor congénito más común, con una incidencia de 1 en 35 000 nacimientos vivos y de predominancia en el sexo femenino (3 a 4:1)(1). El origen embriológico de este tumor surge a partir de células pluripotenciales del nódulo de Hensen de la línea primitiva localizada en el coxis, el cual se diferenciará en teratoma embrionario (maduro e inmaduro) o extra-embrionario (coriocarcinomas y teratomas del saco vitelino)(2,3). Los teratomas maduros son los benignos y los más comunes(3). La mayoría de los TSCs son diagnosticados prenatalmente, al extender el uso de manera rutinaria del ultrasonido obstétrico(2). Con las mejoras en los equipos de diagnóstico prenatal, el diagnóstico de TSC es posible, usualmente, usando el ultrasonido en el segundo y tercer trimestre (22 y 34 semanas) hasta en 50% de los casos(4,5) y es una anomalía aislada con bajo riesgo de anormalidades cromosómicas u otras estructurales(1-6,7).
Los teratomas predominan en la línea media, siendo la localización sacrococcígea la más común (60%). Otras localizaciones menos frecuentes son las gónadas (20%), el cuello, mediastino anterior, retroperitoneo, cerebro, corazón, faringe, pleura(8).
Los pacientes en donde el diagnóstico es posnatal, usualmente cursan con un postoperatorio sin complicaciones al realizar una resección temprana del mismo, siendo la causa más común de mortalidad en estos pacientes (y muy raro) la malignidad. Sin embargo, una proporción importante de los niños con TSC mueren antes o después del nacimiento por complicaciones intrauterinas o posnatales. La mortalidad perinatal asociada al diagnóstico prenatal, excluyendo los casos de terminación del embarazo, varía en varias series entre 18 y 63%, y se atribuye a falla cardiaca, sangrado del tumor o ambos(9-12). Por esto, varias estrategias para el control de la hemorragia han sido investigadas, incluyendo intervenciones intrauterinas y ligadura de la arteria sacra media antes de resecar el tumor(10).
El gran rango de presentación de esta patología ha llamado la atención de varios centros de cirugía fetal, con el fin de identificar datos ultrasonográficos para predecir aquellos fetos con TSC que se beneficiarían de una intervención intrauterina. La clave para mejorar la sobrevida de estos fetos es intervenir antes del desarrollo de falla cardiaca, hidrops y síndrome del espejo en la madre. Identificando los fetos con riesgo de hidrops y muerte intraútero, podríamos revertir la fisiopatología y salvarlos(11).
Metodología de la obtención de datos
Para esta revisión, se buscó en Pubmed y Medline los términos, ‘teratoma sacrococcígeo’, ‘teratoma sacrococcígeo cirugía’, ‘teratoma sacrococcígeo complicaciones’. Se revisaron reportes de casos, revisiones de la literatura, descripciones de nuevas técnicas quirúrgicas, en inglés y español, en animales y en seres humanos. Se encontraron alrededor de 45 artículos, entre los cuales algunos sobrepasan los 15 años y que involucran los primeros casos, pioneros en cirugía fetal para TSC.
Fisiopatología
La historia natural y fisiopatología de los TSC fetales son diferentes a los casos diagnosticados posnatalmente. La sobrevida de fetos con TSC depende de la anticipación y reconocimiento de los eventos fisiopatológicos y el manejo obstétrico y quirúrgico óptimo(13). El suministro vascular del TSC usualmente surge de la arteria sacra media, la cual puede aumentar de tamaño similar a la de la arteria iliaca común y causar un síndrome de secuestro vascular. Estos tumores muy vascularizados y de gran tamaño pueden llevar a una falla cardiaca hiperdinámica debido a las comunicaciones arteriovenosas a través del tumor, resultando en placentomegalia, hidrops y por último muerte fetal(14).
La presencia de polihidramnios es muy común, debido al incremento en el gasto cardiaco fetal, que en muchos casos lleva a parto pretérmino y rotura prematura de membranas(15). Sin embargo, puede ocurrir oligohidramnios, si la porción intrapélvica del tumor causa una obstrucción importante de la vía urinaria(3).
La placentomegalia ha sido descrita como una manifestación temprana de la falla cardiaca hiperdinámica. Cuando está presente, el TSC puede inducir un síndrome complejo materno caracterizado por edema e hipertensión, usualmente referido como ‘síndrome del espejo’. La madre desarrolla síntomas muy similares a los de preeclampsia severa, como hipertensión, vómitos, edema periférico, edema pulmonar y proteinuria(5). La cirugía fetal está contraindicada luego que el síndrome del espejo se ha instaurado. Se ha descrito indicadores pronósticos para identificar los pacientes antes de la progresión a fase terminal de la enfermedad. Aquellas madres que han desarrollado el síndrome, necesitan ser monitorizadas y requerirán la interrupción del embarazo o terminación del mismo por su seguridad.
Clasificación
En la extensión del tumor se basa el AAPSS (American Academy of Pediatrics Surgical Section) para su clasificación(16):
-
Tipo I: Principalmente externo, con un componente intrapélvico mínimo.
-
Tipo II: De predominio externo, pero con un
componente intrapélvico significativo.
-
Tipo III: De predomino intrapélvico con extensión abdominal, con un componente mínimo externo.
-
Tipo IV: Interno, totalmente entre la pelvis y el abdomen.
Los tumores del tipo I, de componente de predominio externo, son fácilmente diagnosticados prenatalmente y muy bien manejados con resección del mismo. Los tipo IV pueden ser difíciles de diagnosticar y muy difíciles de resecar, siendo frecuentemente malignos al diagnóstico, por lo tarde del mismo(2,17). La clasificación de la AAPSS describe la anatomía quirúrgica e identifica los tumores con posibilidades de resección; sin embargo, no provee información del pronóstico(3) basado en su curso prenatal ni identifica los fetos que se beneficiarían de una intervención fetal.
Intervención
Los fetos con TSC, son considerados para resección fetal o intervención, solo en casos extremos.
Los tumores pequeños pobremente vascularizados (<7 cm) son menos propensos a afectar al feto de manera significativa(3). Usualmente no desarrollan falla cardiaca hiperdinámica o hidropesía, pudiendo ser monitorizados durante el embarazo hasta el término con ultrasonidos seriados. Deberían nacer en un lugar en donde puedan ser estabilizados y operados por un equipo experimentado.
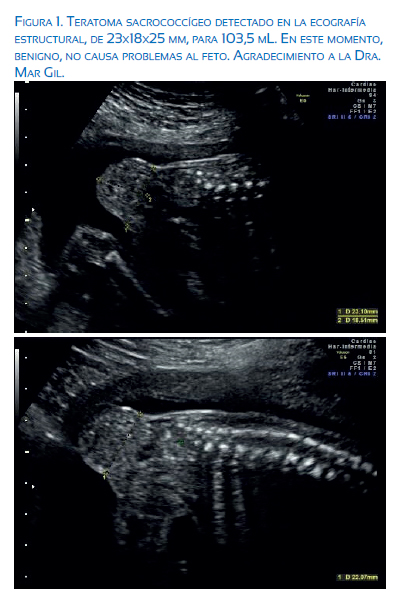
Los tumores de mayor tamaño o muy vascularizados, deben ser vigilados con mucho cuidado, debiéndose incluir medidas del tamaño del tumor y tasa de crecimiento, vascularidad, líquido amniótico y función cardiaca (figura 1). El método de interrupción debe ser alterado en el caso de riesgo a trauma directo al TSC o distocia(3).
No existe un criterio de selección para la intervención; sin embargo, se puede considerar el hidrops, rápido crecimiento, falla cardiaca y polihidramnios extremo. Aquellos con signos de placentomegalia e hidrops luego de madurez pulmonar, deben ser interrumpidos de urgencia. Aquellos fetos aún inmaduros, con signos de pronta evolución a hidrops y tumores accesibles quirúrgicamente son los considerados para intervención fetal(7,17).
Para un feto con alguna malformación que ponga en riesgo su vida, el riesgo del procedimiento es pequeño en comparación del beneficio de salvarlo. Como todo procedimiento invasivo, los riesgos y beneficios de una intervención deben ser considerados en cada paciente. La seguridad de la madre es primordial. Antes de que se considere alguna intervención fetal, un equipo multidisciplinario debe asesorar y evaluar cada familia. La evaluación debe de incluir(17):
-
Ultrasonido detallado para confirmar el diagnóstico y detectar otras anormalidades anatómicas.
-
Resonancia magnética nuclear fetal para agregar información anatómica.
-
Ecocardiografía fetal para descartar cardiopatías congénitas y determinar función cardiaca fetal
-
Amniocentesis o cordocentesis para determinar cariotipo.
Wilson y colaboradores del Children’s Hospital de Filadelfia, propusieron los criterios para la resección prenatal del teratoma sacrococcígeo(18):
-
Sin contraindicaciones maternas para la cirugía (médicas o quirúrgicas, riesgos de la anestesia, otros)
-
Edad gestacional entre 20 y 30 semanas
-
Un estadio favorable según la clasificación de AAPSS (tipo I) y ninguna otra anomalía
-
Hidrops inminente (temprano)
-
Cariotipo normal
-
Compromiso fetal fisiológico con un gasto cardiaco mayor de 600 a 900 mL/kg/min (ajustado a la edad gestacional)
-
Consentimiento materno.
Contraindicaciones
Las contraindicaciones para intervención incluyen(18):
-
Placentomegalia significativa (engrosamiento placentario en el sitio de inserción del cordón >35 a 45 mm a una EG <30 semanas)
-
Sindrome del espejo
-
Gestación múltiple
-
Anormalidad cromosómica
-
Otras anormalidades anatómicas fetales.
Resultados
El curso prenatal de la mayoría de los fetos con TSC cursa sin complicaciones. Solo algunos desarrollarán complicaciones fetales y obstétricas. Varios centros han reportado resultados, con o sin intervención fetal para TSC diagnosticados prenatalmente(19-21). De aquellos pacientes con un diagnóstico prenatal de TSC, 41% requieren intervención(19).
A la mayoría de los recién nacidos con TSC les va muy bien con una cirugía justo después de su nacimiento. La mortalidad debida a TSC se atribuye principalmente a la morfología del tumor; los pequeños TSC quísticos inusualmente causan problemas intraútero. Los tumores de crecimiento rápido pueden ocasionar más complicaciones, pues incrementan las demandas metabólicas, así como el volumen circulante y la anemia resultante por hematopoyesis extramedular(3). El crecimiento rápido de tumores muy vascularizados, puede provocar rotura y causar hemorragia durante el parto, con un desenlace fatal(17).
Los TSC pueden causar distocia, debido a su tamaño y/o configuración. El parto vía vaginal puede ocasionar hemorragia traumática, la cual puede ser letal si no se provee o no se maneja de forma expedita. Por ende, el modo de la interrupción de estos niños con TSC dependerá del tamaño del tumor, con un límite no mayor a 5 cm o un volumen de 750 mL de diámetro. En aquellos en donde no se cumpla con estos requisitos, la cesárea electiva estará indicada(22).
Un 40 a 50% de los sobrevivientes con diagnóstico prenatal cursan con morbilidad a largo plazo, que puede incluir uropatía obstructiva, incontinencia urinaria o fecal por daño a los nervios sacros debido al tumor o durante la resección de este, además de poca satisfacción cosmética poscirugía(4,23).
Indicadores pronósticos
Varios parámetros han sido sugeridos como posibles indicadores prenatales de pobre pronóstico. Entre estos están el tamaño del tumor, composición, tasa de crecimiento, grado de vascularidad, signos de alteración de la función cardiaca, parámetros obstétricos como el desarrollo y tiempo de presentación de polihidramnios, y la aparición de complicaciones maternas(3).
La placentomegalia y el hidrops son precursores de la muerte fetal en el TSC y coinciden con su presentación antes de las 30 semanas(6). Se ha informado sobre la correlación entre la tasa de crecimiento del tumor y los resultados perinatales. Un rápido crecimiento (>150 mL/semana) se asocia a un incremento en la mortalidad perinatal (60%)(12).
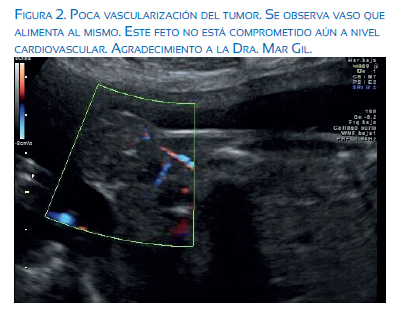
Un estudio retrospectivo en fetos con diagnóstico prenatal de TSC, tratados en la Universidad de California, San Francisco (UCSF), evaluó factores asociados al hidrops(24). Es lógico pensar que el tamaño del tumor se relaciona con el riesgo de falla cardiaca. Se observó que hay un riesgo mayor de muerte fetal en tumores más vascularizados, sin importar su tamaño. Adicionalmente, aquellos fetos que desarrollan hidrops son diagnosticados a una edad gestacional más temprana (19 versus 25 semanas) y también son interrumpidos tempranamente (28 versus 38 semanas) (figura 2).
En estas series, 12 fetos desarrollaron hidrops, cuatro de los cuales sobrevivieron(24). De los cuatro, a tres de se les realizó cirugía, ya que desarrollaron hidrops antes de la viabilidad: el otro lo desarrolló a las 32 semanas y se interrumpió de inmediato. Todos los fetos que no desarrollaron hidrops sobrevivieron.
Este estudio mostró que tumores sólidos y altamente vascularizados tienen un muy alto riesgo de desarrollar hidrops. Estos pacientes ameritan un seguimiento estricto durante el resto del embarazo por medio de ultrasonografía y ecocardiografía, a la vez que deben ser considerados candidatos a intervención si hay signos de incipientes de hidrops.
En cambio, son de buen pronóstico los tumores pequeños y menos vascularizados(19).
Antes del procedimiento
Luego de la evaluación en el centro donde se realizará es procedimiento, la familia debe disponer de un equipo multidisciplinario que resuelva sus dudas. Entre los especialistas debe estar un cirujano pediatra/fetal, obstetras, perinatólogos, anestesiólogos, trabajadora social y coordinación de enfermería, para discutir los riesgo y beneficios de la intervención. Los riesgos potenciales de la intervención incluyen(17):
-
Parto pretérmino
-
Rotura uterina
-
Rotura de membranas
-
Corioamnionitis
-
Efectos adversos de los tocolíticos
-
Edema pulmonar (materno)
-
Muerte fetal.
Otros incluyen sangrado, necesidad de transfusiones e infección de la herida.
El equipo debe disponer de derivados sanguíneos para una transfusión potencial. Estos pacientes que necesitan intervención, usualmente tienen tumores sólidos, muy vascularizados, los cuales muy probablemente requieran transfusiones(25).
Equipo
Cirugía abierta y procedimiento EXIT (técnica especial en la que el tumor es expuesto a través de una pequeña incisión):
-
Ultrasonido transoperatorio
-
Grapas uterinas
-
Separador grande en anillo
-
Oxímetro estéril neonatal y vía IV
-
Calentador de fluidos
-
Laringoscopio estéril neonatal y tubo endotraqueal (procedimiento EXIT).
Técnicas mínimamente invasivas
-
Ultrasonido transoperatorio
-
Aguja de radiofrecuencia
-
Fetoscopio para ablación por láser
-
Fibra de neodimio Neodymium-doped yttrium-aluminum-garnet (Nd:YAG) 0,4 mm para ablación con láser.
Preparación del paciente
Debemos admitir a la paciente a la sala de hospitalización la noche anterior a la cirugía. Antes de la cirugía debe monitorizarse al producto y administrarse tocólisis con indometacina(17), previniendo contracciones uterinas durante el procedimiento y antibióticos.
Manejo transoperatorio
La anestesia para la cirugía abierta incluye epidural y anestesia general. Esto provee anestesia para ambos madre y feto, y asegura una relajación uterina durante el procedimiento. La paciente se coloca en posición supina con toallas ubicadas sobre su lado izquierdo, para alejar el útero de la vena cava superior y evitar compromiso del retorno venoso. La anestesia epidural también disminuye contracciones durante el periodo de recuperación postoperatorio(17).
Para las técnicas mínimamente invasivas, la anestesia puede administrarse de manera intramuscular mediante una combinación de fentanilo y pancuronio bajo guía por ultrasonido(26).
Técnicas
La cirugía fetal para el TSC es aún muy exigente; solo debe considerarse en aquellos fetos en un inminente hidrops, y realizada en centros experimentados en cirugía abierta fetal y manejo de complicaciones relacionadas, como salida de líquido amniótico, separación de membranas y parto pretérmino(21). El propósito de la intervención es retirar el tumor, entendiendo que la resección oncológica formal deberá realizarse de manera posnatal. Siendo la mortalidad muy cerca del 100%, cuando los TSC se asocian a falla cardíaca e hidrops, es racional intervenir ya sea en una cirugía abierta o mínimamente invasiva. La finalidad de ambas intervenciones es disminuir el impacto de la masa en el sistema cardiovascular fetal, permitiendo la recuperación del feto intraútero, similar a lo que sucede en la ablación láser de comunicaciones en un síndrome de transfusión feto fetal, reducción selectiva de feto acardio o vasos que alimentan a un coriangioma(27).
Cirugía Fetal abierta
La exposición fetal para la resección del TSC es similar a lo ya reportado en otras cirugías fetales abiertas(17).
El útero es expuesto a través de una incisión transversa baja. Si la placenta se localiza posteriormente, se debe realizar una incisión en la línea media en la fascia, para exponer el útero para una muy conveniente histerotomía anterior, manteniendo el útero en el abdomen.
Sin embargo, si la placenta se localiza anteriormente, los músculos rectos deben ser separados para prevenir compresión de los vasos uterinos cuando el útero es extraído fuera del abdomen para una histerotomía posterior.
Se utiliza un retractor en forma de anillo de gran tamaño para mantener la exposición.
Se realiza ultrasonografía transoperatoria estéril para determinar la posición del feto y la placenta. El reborde placentario es marcado utilizando el electrocauterio. La posición y orientación de la histerotomía se realiza paralela y por lo menos 6 cm lejos del reborde placentario, permitiendo exposición de la parte del feto a operar. Se puede requerir la versión manual del feto en algunos casos, para mejorar la posición durante la cirugía(17).
Si existe polihidramnios o placentomegalia, el borde de la placenta puede no establecerse correctamente por ultrasonido y la histerotomía debe realizarse mas allá de este borde.
La histerotomía se realiza colocando dos suturas PDS 0 bajo control ultrasonográfico, paralelo al sitio donde se pretende realizar la incisión y a través del grosor de la pared uterina. Se realiza una pequeña histerotomía, extendiéndose con la ayuda de grapas absorbibles. Estas grapas se utilizan para mantener las membranas adosadas a la pared del útero, manteniendo la hemostasia. El feto se acomoda de manera que el tumor es expuesto a través de la histerotomía.
Se realiza ecocardiografía fetal continua, monitorizando la frecuencia cardiaca fetal y la función ventricular. Se coloca un oxímetro de pulso en el feto (palma o pie), para monitorización. El feto se mantiene inmerso y caliente en el útero, en una infusión continua de solución lactato de Ringer, entre 38 y 40° Celsius. Un acceso venoso, para la administración de fluidos, sangre o medicación, es parte del protocolo. El uso de esta estrategia de monitarización durante la cirugía abierta permite la administración de fluidos en respuesta a los cambios de precarga durante la resección y mejora la sobrevida(17).
Luego que el TSC es resecado, se practica una sutura en 2 capas ininterrumpida en el útero. Antes del cierre por completo, se irriga dentro del útero con 400 mL de solución Ringer precalentada con 500 mg de oxacilina, hasta que por ultrasonido se demuestre un volumen de líquido amniótico normal(17).
Un flap de omento puede cubrir la histerotomía, y se cierra la fascia, tejido subcutáneo y piel.
Tratamiento ex-útero Intraparto (exit)
El procedimiento EXIT (ex utero intrapartum treatment) se basa en mantener la circulación feto-placentaria hasta que la vía aérea del feto esté segura(28). Para fetos de alto riesgo con tumores de gran tamaño, el momento de la intervención tiene un papel importante en la sobrevida. En aquellos pacientes con contraindicaciones para la cirugía (tipo III y IV, placentomegalia severa, acortamiento del cérvix y condiciones médicas maternas), que desarrollan hidrops u otras complicaciones antes de las 27 semanas, no existe una medida terapéutica efectiva.
Sin embargo, otro grupo de pacientes manifestarán signos de descompensación fetal, materna o ambas entre las 27-32 semanas. Estos son los casos, donde el parto pretérmino es precipitado por polihidramnios y/o crecimiento acelerado del tumor sin hidrops. La interrupción vía cesárea o EXIT puede ser una opción de sobrevida y resultados favorables29.
Cuando está presente el hidrops avanzado o un desangramiento ocurre justo antes del parto, la sobrevida es rara, sin importar la modalidad de la interrupción. El procedimiento EXIT evita los eventos adversos potenciales que pueden ocurrir entre el parto por cesárea y la resección del tumor. Originalmente desarrollado para establecer una vía aérea en un feto con un compromiso de vías aéreas, mientras está aún conectado a la circulación placentaria para la oxigenación, ha sido adaptado para la resucitación de fetos con otras anomalías que pueden presentar inestabilidad durante el nacimiento(29). Para fetos con TSC, este procedimiento permite resecar gran parte del tumor y detener el fenómeno de ‘robo vascular’, minimizando la manipulación y trauma al tumor(29). El neonato puede entonces ser estabilizado para la resección oncológica definitiva a posteriori.
El procedimiento EXIT es realizado con la madre bajo anestesia general, una secuencia de inducción rápida e intubación. Esto maximiza la relajación uterina y el flujo uteroplacentario. La histerotomía, monitoreo fetal y acceso intravenoso se realiza al igual que cualquier cirugía fetal abierta(28).
El cierre de la histerotomía, fascia y piel se realiza de la misma forma que la cirugía abierta para la resección del TSC.
Roybal y col(29) reportaron un caso de un tumor tipo I de rápido crecimiento que produjo un polihidramnios severo, aumento del gasto cardiaco y dilatación del diámetro de la vena cava inferior, sugiriendo un inminente hidrops y síndrome del espejo materno. Un litro de líquido amniótico sanguinolento fue removido el día de la cirugía, evidenciándose rotura del tumor transoperatoriamente. Luego de remover gran cantidad del tumor, el paciente fue entubado, se administró surfactante y se cortó el cordón. Posteriormente, cursó con complicaciones neurológicas por invasión del tumor en la médula espinal.
Ablación con radio FrecuencIa (arF)
A principios del año 2000, para el tratamiento del TSC solo se contaba con la cirugía abierta y la ablación endoscópica con láser. La cirugía abierta se asociaba a cifras importantes de morbilidad materna y mortalidad fetal; la ablación con láser produjo una penetración limitada y no se lograba penetrar al vaso principal que alimentaba el tumor. Con el fin de evitar el trabajo de parto pretérmino y disminuir la morbilidad materna asociada con la intervención, se comenzaron a realizar técnicas mínimamente invasivas, como el uso de radiofrecuencia.
La ARF puede ser realizada de forma percutánea bajo guía del ultrasonido. Mediante una aguja calibre 15, se introduce una sonda con una configuración muy parecida a la de un paraguas, con un diámetro de 20 a 35 mm. Puede liberar 100 w de energía distribuyéndola de forma esférica para causar necrosis del tejido tumoral(30).
Los riesgos potenciales del procedimiento incluyen embolia gaseosa debido a las microburbujas generadas, hiperkalemia por la necrosis tumor, con el consiguiente tromboembolismo o hemorragia e hipertermia con hemólisis(30).
Paek y col(30) describieron cuatro casos a los cuales se les realizó ablación con radiofrecuencia, en fetos con TSC. La mortalidad fue en 50% y en aquellos que sobrevivieron se necesitó cirugía reconstructiva por lesión a tejidos adyacentes.
De forma experimental, la ARF ha sido utilizada para salvar fetos que hubieran muerto sin tratamiento; sin embargo, la mayoría nació con complicaciones. La clave para el tratamiento exitoso con esta técnica sería limitar la extensión de la coagulación. No es necesario una ablación extensa, solo reducir los vasos que ocasionan el síndrome de robo vascular y así revertir la falla cardiaca que es fatal para el feto.
Se han realizado avances utilizando sondas mas pequeñas, lo que resultaría en menor lesión a los tejidos aledaños y rotura prematura de membranas.
La ARF, como modalidad de tratamiento para TSC, aún es limitada; son necesarios más estudios para determinar cuándo y cómo esta técnica ha de ser utilizada.
Ablación con láser
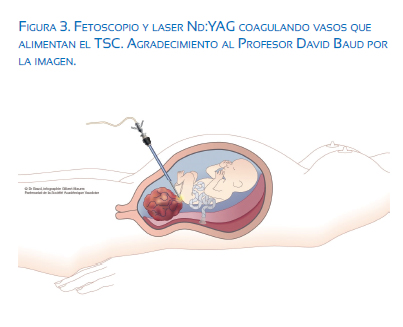
En esta técnica, se infiltra anestesia local en la piel y tejido subcutáneo. Posteriormente, anestesia de forma intramuscular al feto. Bajo guía por ultrasonido, un fetoscopio es introducido en la cavidad amniótica percutáneamente, y con una fibra láser de neodimio (Nd:YAG) se coagulan los vasos(31).
Ruano y col(15) comunican un caso donde el feto cursó con hidrops y falla cardiaca. Se realizó ablación percutánea a las 24 semanas y se diagnosticó anemia severa durante el procedimiento. El feto falleció 2 días después. La evaluación por patología reveló necrosis tumoral local y hemorragia dentro de la masa.
Ding y col(32) informaron sobre un caso en un feto extremadamente prematuro. Bajo guía por ultrasonido, insertaron una aguja calibre 18 directamente al tumor y los vasos que lo alimentaban. Usando una fibra de 600 micrómetros (Nd:YAG), se coagularon los vasos. La paciente fue readmitida en varias ocasiones y a las 29,3 semanas se practicó cesárea por una hemorragia anteparto debida a placenta previa previamente diagnosticada. El feto nació en buenas condiciones, sin necrosis en piel, movimientos normales en piernas y se logró una resección sin complicaciones posteriormente.
La ablación laser para TSC, al igual que la ARF, representa el movimiento de la cirugía fetal hacia técnicas mínimamente invasivas. Sin embargo, los resultados varían y la experiencia actual es muy limitada para determinar si la ablación láser será efectiva en reducir la mortalidad en fetos con TSC (figura 3).
Postoperatorio
Una buena relajación uterina durante la cirugía se logra con la inhalación profunda de los gases anestésicos y es facilitada en el postoperatorio por analgesia vía el catéter epidural. Una infusión de sulfato de magnesio se mantiene por 18 a 24 horas del postoperatorio, monitorizando sus niveles y observando signos clínicos de toxicidad. Se instaura un régimen tocolítico, con supositorios rectales de indometacina cada 6 horas por 48 horas. Y al segundo día se cambia a nifedipino oral. Dependiendo del resultado postoperatorio, las pacientes podrían ser dadas de alta a la semana de la cirugía; sin embargo, debe estar cerca del centro de cirugía fetal. La actividad se modifica gradualmente si hay irritabilidad uterina mínima. Se realizará ultrasonido control dos veces por semana para evaluar tanto al feto como la madre. Por la localización de la histerotomía (no en el segmento inferior), la madre requerirá interrupción vía cesárea en posteriores embarazos y así evitar roturas uterinas en embarazos subsiguientes(17).
Conclusión
El teratoma sacrococcígeo es una anomalía congénita asociada a una alta mortalidad perinatal. El diagnóstico prenatal del TSC requiere una referencia y evaluación detallada por un especialista en medicina fetal, con el fin de evaluar la anatomía del tumor y vascularidad, además de otras anomalías asociadas. Con esta información podremos predecir aquellos casos en los que ocurrirán complicaciones, identificar el hidrops y/o falla cardiaca inminente e indicar la cirugía menos iatrogénica para la madre y el feto.
Agradecimientos
Al Profesor David Baud, Jefe del Servicio de Obstetricia del Lausanne University Hospital. A la Dra. Mar Gil, Especialista en Medicina Fetal y Obstetricia en el Hospital Universitario de Torrejón, Madrid. Ambos por las imágenes y dibujos descriptivos. Al Dr. Paulino Vigil De Gracia, Médico Funcionario del Complejo Hospitalario Metropolitano, por su asesoría en la elaboración de este articulo de revisión.
Conflicto de interés: No hay conflictos de interés
Financiamiento: No hay
Citar como: Leonel Ortega N. Cirugía fetal en teratoma sacrococcígeo. Rev Peru Ginecol Obstet. 2018;64(4):621-630 DOI: https://doi.org/10.31403/rpgo.v64i2132
Referencias Bibliográficas
1. Johnson MP, Mann S. Fetal tumors. In Fetal Medicine: basic science and clinical practice (2nd ed), Rodeck CH and Whittle MJ (eds). [ Links ] UK: Churchill Livingstone. 2009;532–5.
2. Harrison MR. The Unborn Patient: The Art and Science of Fetal Therapy. 3rd ed. Philadelphia: WB Saunders; 2001. [ Links ]
3. Gucciardo L, Uyttebroek A, De Wever I, Renard M, Claus F, Devlieger R, et al. Prenatal assessment and management of sacrococcygeal teratoma. Prenat Diagn. 2011 Jul;31(7):678-88. doi:10.1002/pd.2781. [ Links ]
4. Swamy R, Embleton N, Hale J. Sacrococcygeal teratoma over two decades: birth prevalence, prenatal diagnosis and clinical outcomes. Prenat Diagn. 2008;28:1048– 105. doi: 10.1002/pd.2122. [ Links ]
5. Graf JL, Albanese CT. Fetal sacrococcygeal teratoma. World J Surg. 2003;27:84–6. doi: 10.1007/s00268-0026741-6. [ Links ]
6. Flake AW, Harrison MR, Adzick NS, Laberge JM, Warsof SL. Fetal sacrococcygeal teratoma. J Pediatr Surg. 1986;21(7):563–6. [ Links ]
7. Bond SJ, Harrison MR, Schmidt KG, Silverman NH, Flake AW, Stotnick RN, et al. Death due to high output cardiac failure in fetal sacrococcygeal teratoma. J Pediatr Surg. 1990;25(12):2187–1297. [ Links ]
8. Beghetti M, Prieditis M, Rebeyka IM, Mawson J. Images in cardiovascular medicine. Intrapericardial teratoma. Circulation. 1998;97:1523–4. [ Links ]
9. Usui N, Kitano Y, Sago H, Kanamori Y, Yoneda A, Nakamura T, Nosaka S, Saito M, Taguchi T. Outcomes of prenatally diagnosed sacrococcygeal teratomas: the results of a Japanese nationwide survey. J Pediatr Surg. 2012;47(3):441–7. doi:10.1016/j.jpedsurg.2011.08.020. [ Links ]
10. Kaneyama K, Yamataka A, Kobayashi H, Lane GJ, Itoh S, Kinoshita K, Miyano T. Giant, highly vascular sacrococcygeal teratoma: report of its excision using the ligasure vessel sealing system. J Pediatr Surg. 2004;39(12):1791–3. https://doi.org/10.1016/j.jpedsurg.2004.08.031. [ Links ]
11. Westerburg B, Feldstein VA, Sandberg PL, Lopoo JB, Harrison MR, Albanese CT. Sonographic prognostic factors in fetuses with sacrococcygeal teratoma. J Pediatr Surg. 2000 Feb;35(2):322-5; discussion 325-6. https://doi.org/10.1016/S0022-3468(00)90032-0. [ Links ]
12. Benachi A, Durin L, Vasseur Maurer S, Aubry MC, Parat S, Herlicoviez M, et al. Prenatally diagnosed sacrococcygeal teratoma: a prognostic classification. J Pediatr Surg 2006;41(9):1517–21. doi:10.1016/j.jpedsurg.2006.05.009. [ Links ]
13. Flake AW. Fetal sacrococcygeal teratoma. Semin Pediatr Surg. 1993;2:113-20. [ Links ]
14. Milner R, Adzick NS. Perinatal management of fetal malformations amenable to surgical correction. Curr Opin Obstet Gynecol. 1999 Apr;11(2):177-83. DOI: 10.1097/00001703-199904000-00010. [ Links ]
15. Ruano R, Duarte S, Zugaib M. Percutaneous laser ablation of sacrococcygeal teratoma in a hydropic fetus with severe heart failure–too late for a surgical procedure? Fetal Diagn Ther. 2009;25:26–30. https://doi.org/10.1159/000188663. [ Links ]
16. Altman RP, Randolph JG, Lilly JR. Sacrococcygeal teratoma: American Academy of Pediatrics Surgical Section Survey-1973. J Pediatr Surg. 1974 Jun;9(3):389-98. [ Links ]
17. Adzick NS. Open fetal surgery for life-threatening fetal anomalies. Semin Fetal Neonatal Med. 2010 Feb;15(1):1-8. doi:10.1016/j.siny.2009.05.003. doi: 10.1016/j.siny.2009.05.003. [ Links ]
18. Wilson RD, Hedrick H, Flake AW, Johnson MP, Bebbington MW, Mann S, et al. Sacrococcygeal teratomas: prenatal surveillance, growth and pregnancy outcome. Fetal Diagn Ther. 2009;25(1):15-20. doi: 10.1159/000188056. [ Links ]
19. Makin EC, Hyett J, Ade-Ajayi N, Patel S, Nicolaides K, Davenport M. Outcome of antenatally diagnosed sacrococcygeal teratomas: single-center experience (1993-2004). J Pediatr Surg. 2006 Feb;41(2):388-93. doi:10.1016/j.jpedsurg.2005.11.017. [ Links ]
20. Adzick NS, Crombleholme TM, Morgan MA, Quinnm TM. A rapidly growing fetal teratoma. Lancet 1997;349(9051):538. DOI: 10.1016/S01406736(97)80088-8. [ Links ]
21. Lee MY, Won HS, Hyun MK, Lee HY, Shim JY, Lee PR, et al. Perinatal outcome of sacrococcygeal teratoma. Prenat Diagn. 2011 Dec;31(13):1217-21. doi:10.1002/pd.2865. [ Links ]
22. Westerburg B, Feldstein VA, Sandberg PL, Lopoo JB, Harrison MR, Albanese CT. Sonographic prognostic factors in fetuses with sacrococcygeal teratoma. J Pediatr Surg. 2000 Feb;35(2):322-5; discussion 325-6. DOI: https://doi.org/10.1016/S0022-3468(00)90032-0. [ Links ]
23. Hedrick HL, Flake AW, Crombleholme TM, Howell LJ, Johnson MP, Wilson RD, et al. Sacrococcygeal teratoma: prenatal assessment, fetal intervention, and outcome. J Pediatr Surg. 2004 Mar;39(3):430-8; discussion 430-8. https://doi.org/10.1016/j.jpedsurg.2003.11.005. [ Links ]
24. Rodriguez MA, Cass DL, Lazar DA, Cassady CI, Moise KJ, Johnson A, Mushin OP, et al. Tumor volume to fetal weight ration as an early prognostic classification for fetal sacrococcygeal teratoma. J Pediatr Surg. 2011;46:1182–5. doi: 10.1016/j.jpedsurg.2011.03.051. [ Links ]
25. Isserman RS, Nelson O, Tran KM, Cai L, Polansky M, Rosenbloom JM, et al. Risk factors for perioperative mortality and transfusion in sacrococcygeal teratoma resections. Paediatr Anaesth. 2017 Jul;27(7):726-32. DOI: 10.1111/pan.13143. [ Links ]
26. Sananes N, Javadian P, Schwach Werneck Britto I, Meyer N, Koch A, Gaudineau A, et al. Technical aspects and effectiveness of percutaneous fetal therapies for large sacrococcygeal teratomas: cohort study and literature review. Ultrasound Obstet Gynecol. 2016 Jun;47(6):712-9.v. https://doi.org/10.1002/uog.14935.
27. Van Mieghem T, Al-Ibrahim A, Deprest J, Lewi L, Langer JC, Baud D, et al. Minimally invasive therapy for fetal sacrococcygeal teratoma: case series and systematic review of the literature. Ultrasound Obstet Gynecol. 2014 Jun;43 (6):611-9. https://doi.org/10.1002/uog.13315. [ Links ]
28. Mychaliska GB, Bealer JF, Graf JL, Rosen MA, Adzick NS, Harrison MR. Operating on placental support: the ex utero intrapartum treatment procedure. J Pediatr Surg. 1997 Feb;32(2):227-30; discussion 230-1. doi:10.1016/s0022-3468(97)90184-6. [ Links ]
29. Roybal JL, Moldenhauer JS, Khalek N, Bebbington MW, Johnson MP, Hedrick HL. Early delivery as an alternative management strategy for selected high-risk fetal sacrococcygeal teratomas. J Pediatr Surg. 2011 Jul;46(7):1325-32. doi: 10.1016/j.jpedsurg.2010.10.020. [ Links ]
30. Paek BW, Jennings RW, Harrison MR, Filly RA, Tacy TA, Farmer DL. Radiofrequency ablation of human fetal sacrococcygeal teratoma. Am J Obstet Gynecol. 2001 Feb;184(3):503-7. https://doi.org/10.1067/mob.2001.110446. [ Links ]
31. Hecher K, Hackelöer BJ. Intrauterine endoscopic laser surgery for fetal sacrococcygeal teratoma. Lancet. 1996 Feb 17;347(8999):470. DOI:https://doi. org/10.5555/uri:pii:S0140673696900458. [ Links ]
32. Ding J, Chen Q, Stone P. Percutaneous laser photocoagulation of tumour vessels for the treatment of a rapidly growing sacrococcygeal teratoma in an extremely premature fetus. J Matern Fetal Neonatal Med. 2010 Dec;23(12):1516–8. doi:10.3109/14767051003678085. [ Links ]
Correspondencia:
Nelson Leonel Ortega
nelsonlortega@hotmail.com
Recibido: 9 octubre 2018
Aceptado: 14 octubre 2018