Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Ginecología y Obstetricia
versión On-line ISSN 2304-5132
Rev. peru. ginecol. obstet. vol.64 no.4 Lima oct./dic. 2018
http://dx.doi.org/10.31403/rpgo.v64i2135
SIMPOSIO CIRUGÍA FETAL EN AMÉRICA LATINA
Cirugía fetal en tumores pulmonares mediante escleroterapia
Fetal sclerotherapy for lung tumors
Ramiro Jesús Diaz Primera1https://orcid.org/0000-0002-4020-5794 , Enrique Damián Gil Guevara2 https://orcid.org/0000-0001-6515-2599, Raúl Sánchez Jiménez3 https://orcid.org/0000-0001-6934-1127, Carlos Bermúdez González4
1. Director de Proyecto Fundación Dominican Fetal Center; Centro de Diagnóstico y de Especialidades Naco CEDEN. Santo Domingo, República Dominicana;
2. Director Médico del Instituto Peruano de Medicina y Cirugía Fetal, Lima, Perú;
3. Coordinador Académico Dominican Fetal Center; Director Médico Centro de Diagnóstico y de Especialidades Naco CEDEN, Santo Domingo, República Dominicana;
4. Presidente Fundación Fetosur; Director del programa de Cirugía Fetal Centro Médico Docente La Trinidad. Caracas, Venezuela
ABSTRACT
Microcystic fetal lung tumors or masses such as the congenital cystic adenomatoid malformation (CCAM) and bronchopulmonary sequestration (SBP) are rare congenital pathologies, diagnosed by ultrasound during prenatal assessment, with a high mortality rate of 95% as a consequence of prenatal complications due to hydrops and postnatal death from pulmonary hypoplasia. Minimally invasive therapies using sclerosing agents are positioned among the low cost and highly effective techniques for such pathologies. Methodology: We conducted a prospective, randomized, blind clinical study in 17 pregnant women with diagnosis of fetal microcystic CCAM or hybrid lesion (CCAM + SBP), who were treated with betamethasone or polidocanol. Alternative therapy was employed in case of failure of the initial procedure. Results: In four (44.4%) of the nine cases treated with betamethasone, the alternative therapy of sclerosis with polidocanol was required for treatment due to fetal compromise. Involution of the lung lesion and the hydropic condition was faster and progressive with percutaneous sclerotherapy compared to the maternal steroid effect. Perinatal results were also more satisfactory in the group with polidocanol (91.7%) than in the group with the steroid (60%). Conclusions: Percutaneous sclerotherapy with polidocanol was found efficacious for CCAM and hybrid lesion treatment, with faster and more efficient resolution of the pathology in cases resistant to previously administered steroid therapy.
Key words: Congenital cystic adenomatoid malformation CCAM, Bronchopulmonary sequestration, Sclerotherapy, Betamethasone, Steroids.
RESUMEN
Las tumoraciones o masas pulmonares fetales microquísticas, tales como la malformación adenomatoidea quística congénita (CCAM, por sus siglas en inglés) y el secuestro bronco pulmonar (SBP), representan patologías congénitas poco frecuentes, diagnosticadas por ultrasonido durante la evaluación prenatal, con un alto índice de mortalidad de 95% como consecuencia de las complicaciones prenatales por hidropesía y fallecimiento posnatal debido a hipoplasia pulmonar. Las terapias de mínima invasión usando agentes esclerosantes han tomado posicionamiento entre las técnicas de bajo costo y alta efectividad para dichas patologías. Metodología. Se realizó un estudio clínico prospectivo, aleatorio, ciego, en 17 embarazadas con diagnóstico de CCAM microquística o de lesión híbrida (CCAM +SBP) tratadas con betametasona o con polidocanol, optando por la terapia alternativa en caso de fallar la técnica inicial. Resultados. En 4/9 (44,4%) de los 9 casos tratados con betametasona se requirió la terapia alternativa de esclerosis con polidocanol para la resolución del cuadro, que comprometía el estado fetal. La involución de la lesión pulmonar y del cuadro hidrópico fue más rápida y progresiva con la escleroterapia percutánea en comparación con el efecto esteroideo materno. Los resultados perinatales fueron asimismo más satisfactorios en el grupo con polidocanol (91,7%) que en el grupo con el esteroide (60%). Conclusiones. Se comprobó la eficacia de la escleroterapia percutánea con polidocanol para el tratamiento de la CCAM y de lesión híbrida, con resolución más rápida y eficaz de la patología en los casos donde existía resistencia a la terapia esteroidea previamente administrada.
Palabras clave: Malformación adenomatoidea quística congénita CCAM, Secuestro bronco pulmonar, Escleroterapia, Betametasona, Esteroides.
Introducción
Las tumoraciones fetales representan una variante en el normal desarrollo del feto durante la gestación, trayendo consigo consecuencias letales si no se recibe tratamiento prenatal oportuno. Estas tumoraciones han sido motivo de estudio por distintas unidades de cirugía fetal en el mundo, en especial los tumores pulmonares fetales representados por el secuestro broncopulmonar (SBP) y la malformación adenomatoidea quística congénita (CCAM). El diagnóstico prenatal de estas alteraciones ayuda a definir la historia natural de dichas lesiones, determinar las características fisiopatológicas que influyen en los resultados clínicos finales y formular tratamientos en función del pronóstico(1).
Las masas en el tórax fetal rara vez son de naturaleza maligna, al contrario de lo que ocurre en los adultos. En el feto, la masa torácica resulta peligrosa debido a las alteraciones fisiológicas y anatómicas que provoca. La hipoplasia pulmonar, como una de las secuelas más importantes, el polihidramnios, el desplazamiento cardíaco y del mediastino, la hidropesía fetal, son evidencias de importantes alteraciones fisiológicas, que pueden ser observadas en la ecografía. La hidropesía fetal es un hallazgo especialmente relevante, que produce descompensación fetal y que se asocia con una tasa de mortalidad perinatal cercana al 100%(2).
La CCAM es una patología poco común que involucra la proliferación de los bronquiolos respiratorios terminales, resultando en la formación de quistes de tamaños variables. Diagnosticado por primera vez por Chin y Tang, en 1947, generalmente se encuentra restringido a una parte de un pulmón, pero puede también ser bilateral(1).
La CCAM es clasificada actualmente como microquística en aquellos casos donde la lesión pulmonar presenta quistes menores de 5 mm, o macroquística en presencia de quiste único o múltiples mayores de 5 mm. La historia natural de las CCAM involucra crecimiento hasta las 28 semanas de gestación, momento en el cual las mesetas de crecimiento o incluso involución de la masa se manifiestan marcadamente(2).
Las causas y los mecanismos de la CCAM son desconocidos y por el momento se la considera una malformación esporádica. La teoría más aceptada supone un error en la maduración de las estructuras bronquiolares que ocurre hacia la semana quinta o sexta de gestación, durante la fase pseudoglandular del desarrollo pulmonar. Estas malformaciones pulmonares presentan una proliferación celular aumentada al doble con controles de la misma edad gestacional y tienen además un índice apoptótico celular cinco veces más bajo que los controles(3).
En el periodo prenatal, la CCAM puede generar hidropesía fetal o polihidramnios, desencadenando parto pretérmino. Por otra parte, la CCAM podría regresionar espontáneamente, aunque su completa desaparición es infrecuente. Después del nacimiento, el recién nacido puede cursar con insuficiencia respiratoria severa. El peor pronóstico se observa en lesiones bilaterales o cuando existe hidropesía fetal(1).
Sin tratamiento antenatal, la CCAM y secuestro pulmonar se han asociado a muerte fetal en 95%, principalmente en casos asociados a hidropesía fetal(4).
Los estudios experimentales animales han puesto de manifiesto las consecuencias fisiopatológicas del efecto de masa que produce esta patología. La compresión extrínseca del pulmón sano por una lesión torácica ocupante de espacio durante la fase de formación alveolar (semana 22 a 28) puede originar hipoplasia pulmonar, con la subsecuente muerte al nacer debido a insuficiencia respiratoria en los fetos de corderos(1). Asimismo, la desviación mediastinal, la compresión cardiaca y de los grandes vasos y el aumento de la presión intratorácica que originan estas lesiones, disminuye el retorno venoso e inducen insuficiencia cardiaca y muerte fetal intrauterina.
Múltiples opciones de tratamiento han sido planteadas mediante diferentes grupos de trabajo. entre ellas lobectomía parcial mediante cirugía fetal abierta, terapia de administración de esteroides maternos (betametasona), escleroterapia percutánea mediante el uso de polidocanol, así como la ablación láser del vaso nutricio de la masa. Este último aspecto, toma relevancia en las técnicas mínimamente invasivas en estudio y con resultados cada día más alentadores. Entendiendo la fisiopatología de la enfermedad, debemos considerar el hecho de que en ambas masas pulmonares existe un componente sanguíneo nutricio que contribuye al crecimiento de las mismas. A diferencia de SBP, que recibe su suministro de sangre de la aorta, la CCAM tiene un suministro de sangre de la arteria pulmonar. Sin embargo, una proporción de lesiones pulmonares quísticas tienen un suministro sanguíneo sistémico aberrante de la aorta y han sido definidas como ‘lesiones híbridas’, que representan una combinación de CCAM y SBP(4).
En búsqueda de técnicas mínimamente invasivas replicables en los diferentes medios hospitalarios, con disminución del grado de complejidad quirúrgica así como optimización de los resultados, en el presente estudio realizamos un enfoque comparativo de la eficacia de dos técnicas de bajo costo y alta eficacia, como lo son la escleroterapia percutánea con polidocanol versus betametasona de administración materna (esquema único) en patología microquística pulmonar fetal, enfocados en el CCAM.
Metodología
Se estudió la población conformada por todas aquellas pacientes que acudieron al Servicio de Ginecología y Obstetricia del Centro Médico Docente la Trinidad (Caracas, Venezuela) a la división de Cirugía Fetal Fundación Fetosur, referidas con diagnóstico de CCAM, en el período comprendido entre enero del 2013 y enero del 2015. Se tomó en cuenta como criterios de inclusión para el estudio los pacientes con diagnóstico de CCAM y/o lesión híbrida que cursasen entre 18 y 28 semanas de gestación, cuyas madres estuviesen de acuerdo en la participación del estudio y los procedimientos que involucraba, con previa firma del consentimiento informado. De igual manera debía evidenciarse la presencia de un cuadro de hidropesía fetal definida como líquido en 2 o más cavidades, así como la ausencia de malformaciones mayores asociadas. Se excluyeron las gestaciones gemelares.
De acuerdo con los objetivos específicos propuestos para la investigación, se consideraron como variables de estudio la terapia aplicada, la evolución de las lesiones y los resultados perinatales, comparando los resultados obtenidos con cada técnica utilizada.
En el procedimiento clínico, se realizó evaluación ecográfica del paciente para el diagnóstico de CCAM entre la semana 18 y 28 de gestación, con la debida medición de dos diferentes índices pronósticos en las patologías pulmonares: índice pulmón/cabeza (lung to head ratio, LHR), índice cuantitativo del pulmón (quantitive lung index, QLI). Se determinó los casos con presencia de líquido en dos o más cavidades fetales (hidropesía fetal). Se planteó a la paciente las posibilidades terapéuticas basadas en ambas vertientes -uso de esteroides a nivel materno y escleroterapia percutánea-, y se entregaron los consentimientos informados previamente aprobados por el Comité de Bioética del Centro Médico Docente la Trinidad. De manera aleatoria se asignó la técnica o terapia a utilizar, con la debida aceptación del paciente y firma del consentimiento informado al haber aceptado la participación en el estudio.
Esquema terapéutico 1:
-
En los casos que se inició tratamiento con terapia esteroidea:
-
Se realizó evaluación ecográfica del paciente para establecer el diagnóstico y la debida medición de los diferentes índices pronósticos en las patologías pulmonares: índice pulmón/cabeza, índice cuantitativo del pulmón. Se documentó en tabla anexa los valores de los índices, así como el índice de líquido amniótico (ILA).
-
Administración materna de esteroides (betametasona 12 mg) vía intramuscular profunda, orden día por dos dosis, entre la semana 18 y 28 de gestación (esquema simple).
-
Se realizó evaluaciones ecográficas seriadas con la documentación de los índices de pulmón fetal y pronóstico (QLI y LHR) en los días 3, 7, 14, 21 y 28 posterior a la administración del tratamiento. Se utilizó un ecosonograma obstétrico con transductor Convex de 7.5 MHZ, en equipo de ultrasonido Voluson E8 y Phillips HD 11.
Esquema terapéutico 2:
-
En los casos que se inició tratamiento con escleroterapia percutánea
-
Se realizó evaluación ecográfica del paciente para la debida medición de los diferentes índices pronósticos en las patologías pulmonares: el índice pulmón/cabeza y el índice cuantitativo del pulmón (QLI). Se documentó en tabla anexa los valores de los índices, así como las medidas del índice de líquido amniótico (ILA).
-
Se precisó ecográficamente la posición fetal, área de inserción placentaria, lugar de abordaje del procedimiento invasivo, así como distancia desde el punto de entrada al pulmón fetal comprometido, en cuanto al alcance de la aguja se refiere.
-
Antisepsia del área abdominal materna, con alcohol en primera asepsia y luego solución iodada Betadine® (previa consulta de alergias al iodo por parte de la paciente).
-
Cubriendo el transductor ecográfico Convex con protector estéril para guía ecográfica, se procedió a realizar punción con aguja espinal de 22 Gauge, llevando la punta de la aguja al área central de la masa correspondiente a la CPAM pulmonar, para luego retirar guiador de la misma y a través de esta inyectar 1 mL de polidocanol al 3%; posteriormente se retiró la aguja con antisepsia del área de abordaje.
-
Se registró la frecuencia cardíaca fetal durante 15 minutos continuos, considerando el efecto bradicárdico descrito en estudios previos de la técnica.
-
Se realizó reevaluaciones ecográficas seriadas posteriores, con la documentación anteriormente descrita, en cuanto índices de pulmón fetal sano se refiere, en los días 3, 7, 14, 21 y 28 posterior al tratamiento (figura 1).
-
Tterapia alternativa
En los casos de falla terapéutica, definiendo esto último como persistencia del cuadro del hidrops fetal, no disminución del tamaño de la masa anómala, así como sin evidencia de mejoría en los índices pronósticos QLI y LHR del pulmón fetal sano al realizar la evaluación ecográfica del día 28 posterior a la administración del tratamiento, la conducta a seguida fue la siguiente: aplicación de la terapia alternativa descrita en el estudio. Haciendo nuevamente el seguimiento según el cronograma de días e índices descritos anteriormente.
Así, a aquella paciente que inicialmente estuvo en el grupo de tratamiento con betametasona y no logró mejoría a los 28 días, se le ofreció la opción terapéutica de escleroterapia percutánea con polidocanol. Mientras que aquellas pacientes que estuvieron en el grupo de escleroterapia percutánea y no lograron mejoría, a los 28 días se les ofreció la administración de betametasona.
Resultados
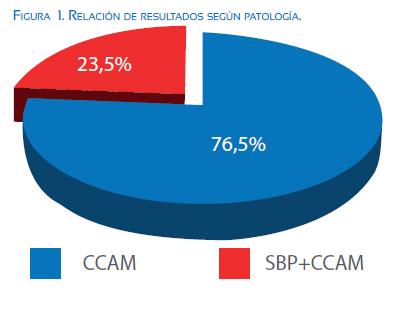
Durante nuestro estudio hubo un total de 17 pacientes que fueron tratadas prenatalmente, en el período comprendido entre enero de 2013 y enero de 2015, de estas, 13 (76,5%) de ellas con diagnóstico de CCAM microquística y 4 pacientes (23,5%) con diagnóstico de lesión híbrida secuestro broncopulmonar + CCAM (figura 1), con un promedio de diagnóstico en la semana 22 de gestación.
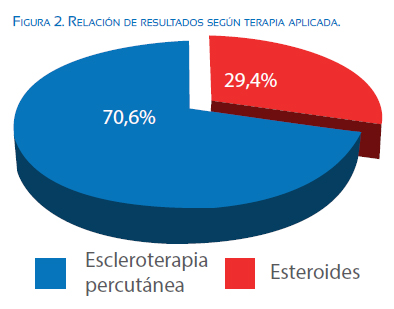
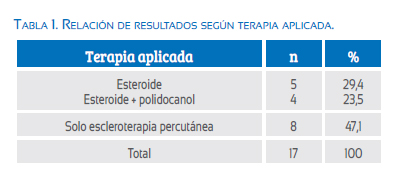
La comparación de la aplicación de ambas técnicas, nos demuestra que 9 (52,9%) de los casos fueron tratados inicialmente con esteroide y 8 (47,1%) con polidocanol. En 5/9 (55,6%) de los casos tratados con esteroides se logró la involución del hidrops y la patología satisfactoriamente. En los 4/9 (44,4%) de los casos restantes hubo que optar por la utilización de la escleroterapia como coadyuvante al tratamiento esteroideo (tabla 1). En ninguno de los casos donde el tratamiento de inicio fue la escleroterapia ameritó tratamiento coadyuvante con esteroides, durante la valoración de seguimiento de 28 días. En 12 (70,6%) de los 17 casos estudiados se usó el polidocanol sea de forma inicial o como tratamiento alternativo complementario (figura 2).
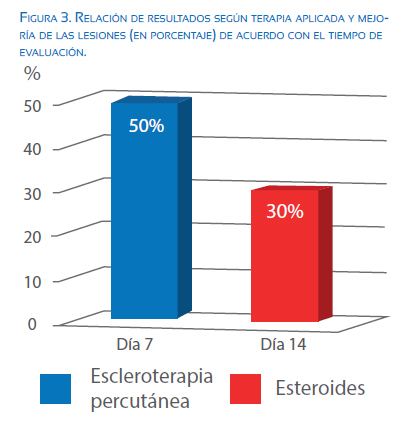
La involución del cuadro patológico pulmonar, así como la resolución del hidrops fetal se logró de manera más rápida y progresiva al usar la técnica de escleroterapia percutánea, con disminución hasta del 50% de las medidas de la masa en un lapso de 7 días, en comparación con la reducción por el efecto esteroideo, donde posterior a 14 días el compromiso pulmonar disminuyó 30% (figura 3).
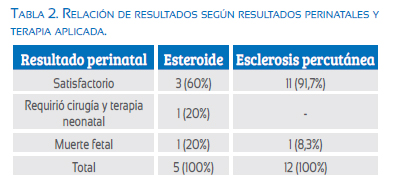
En el grupo tratado con escleroterapia percutánea los resultados perinatales fueron satisfactorios en 11 (91,7%) de 12 casos, mientras que fueron satisfactorios en 3 (60%) de los 5 casos tratados con esteroides maternos (tabla 2).
De igual manera, cuando comparamos el número de casos donde los resultados perinatales fueron adversos, observamos que no hubo diferencia estadísticamente significativa. Ocurrió un episodio de muerte neonatal temprana para cada técnica en los que, producto de roturas prematuras de membranas en ambos casos, la complicación fetal fue dada por la prematurez. Cabe destacar que solo un recién nacido ameritó tratamiento quirúrgico posnatal por el equipo de cirugía pediátrica, debido a la persistencia de parte de la lesión pulmonar; en dicho caso, el tratamiento recibido fue la terapia esteroidea (tabla 2).
Discusión
La CCAM es una anomalía en el desarrollo del pulmón fetal resultante de la proliferación bronquial terminal y el desarrollo alveolar anormal. Aunque la CCAM suele estar restringida a un lóbulo del pulmón, la lesión puede afectar a más de un lóbulo, a todo el pulmón o puede ser más raramente bilateral(5,6).
Presenta una evolución hacia el crecimiento con compresión mediastínica significativa y desarrollo de hidrops fetal. Estos casos se asocian casi de forma invariable a muerte fetal(3). El diagnóstico de CCAM puede tener implicaciones para la salud de la madre; la gravedad del hidrops en estos casos es marcada, y se han descrito casos de mirror syndrome (síndrome materno en espejo) con edema y cuadro pseudoeclámptico en la madre asociado a hidrops fetal(3).
Sin tratamiento antenatal, la CCAM y el secuestro broncopulmonar se han asociado a muerte fetal en 95% de los casos. De igual manera, los recién nacidos sobrevivientes a dichas patologías padecen de hipoplasia pulmonar, la cual se manifiesta inmediatamente después del nacimiento como un síndrome de dificultad respiratoria grave que puede llevar a la muerte neonatal(4).
El tratamiento mediante terapia prenatal en casos de hidrops asociados a CPAM ha ido evolucionando desde la cirugía fetal abierta, donde la lobectomía parcial hoy día representa una técnica en desuso por sus resultados pocos alentadores, además de las complicaciones maternas y fetales que involucra la misma. Es por ello que la búsqueda de nuevas técnicas invasivas y su precisión de efectividad han tomado un auge importante en los objetivos de estudio de la medicina fetal desde hace una década, en la cual los resultados de grandes series se han visto limitados debido a la baja frecuencia de las patologías(7).
La técnica basada en la terapia de administración esteroidea materna con betametasona ha sido descrita y utilizada por diferentes grupos, con resultados que cada día parecen más alentadores. El uso de betametasona 12 mg intramuscular profunda orden día distribuidos en dos dosis representa el esquema simple que actualmente se utiliza, dejando en desuso el esquema de múltiples dosis con repeticiones. Morris LM, en Cincinnati, EE. UU. (2008), estudió 44 fetos identificados con CCAM; 15 de los pacientes recibieron terapia con al menos un ciclo de esteroides, 13 de ellos en condición de hidropesía y 2 no hidrópicos. Siete de los 13 fetos hidrópicos (54%) mostraron una respuesta inicial a la administración de esteroides, mientras que los 2 fetos de alto riesgo no hidrópicos progresaron al nacimiento sin desarrollar hidrops. Siete de los 15 pacientes, sin embargo, dieron como resultado la muerte fetal o la muerte posnatal temprana, lo que representa una tasa de supervivencia del 53%(7).
Loh KC, en 2011, hizo un estudio comparativo en 24 pacientes con diagnóstico de CCAM y la presencia de hidrops fetal tratados con esteroides o cirugía fetal abierta. Trece pacientes fueron tratados con esteroides y 11 pacientes se sometieron a cirugía fetal abierta. En el grupo de esteroides, 12 (92%) de 13 fetos sobrevivieron hasta el parto versus 9 (82%) de 11 en el grupo de cirugía fetal abierta. Sin embargo, solo 5 (56%) de 9 de los pacientes del grupo de cirugía fetal abierta sobrevivió al alta neonatal, en comparación con 10 (83%) de 12 en el grupo de esteroides. Se demostró entonces que la técnica de la cirugía fetal abierta era sustituida en orden de elección como terapia prenatal por el uso de esteroides maternos(8).
Con el progreso de los resultados en la terapia esteroidea, aún quedaba la disyuntiva si el uso de terapias múltiples o la repetición con los mismos representaría un beneficio, interrogante que buscaron solución Perantehau WH y col, en el año 2016, con su estudio en 43 pacientes tratados con esteroides prenatales (28 esquema simple, 15 esquema múltiple). Los fetos receptores de un solo curso demostraron una reducción en el tamaño de la lesión y la resolución de hidropesía en 82% y el 88% de los pacientes, respectivamente, en comparación con 47% y 56% en los receptores de múltiples ciclos de esteroides. La tasa de sobrevida del grupo de terapia múltiple de esteroides fue 86% comparada con los pacientes de esquema simple 93%. Sin embargo, aquellos fetos que recibieron esquema múltiple de esteroide demostraron una mayor necesidad de cirugía fetal abierta y cirugía posnatal a una edad más temprana(2).
Ello sugiere que aquellos fetos que, pese a recibir tratamiento de terapia esteroidea materna no presentan respuesta, ameritaban una medida alternativa. Es donde la descripción de la técnica de la escleroterapia percutánea basada en el uso de polidocanol como solución esclerosante abría un campo de posibilidad terapéutica en aquellos casos donde la terapia esteroidea no ofrecía los resultados esperados. El polidocanol es un esclerosante tensoactivo no iónico, daña el endotelio de los vasos sanguíneos. In vitro tiene un efecto anticoagulante basado en la desnaturalización de proteínas. La inyección produce una disociación del tejido endotelial y parcial desaparición de la capa basal, agregando consecutivamente presencia de fibrina en la íntima y aparición de un trombo hialino adherido al endotelio, ocluyendo el vaso. Bermúdez C, en el año 2007, basado en el conocimiento de las propiedades del fármaco, inició el tratamiento esclerosante en 3 fetos con diagnóstico de SBP intralobar, con resultados exitosos en la disminución de la masa y la desaparición de los cuadros de ascitis, al inyectar 1 mL de polidocanol en el vaso nutricio de la masa(9). Para el año 2008, el mismo grupo de trabajo inició el uso de la técnica esta vez en 3 casos de fetos con diagnósticos de CCAM, obteniendo resolución de los signos de hidropesía, así como la involución de la masa y normal posicionamiento del corazón fetal que previamente se presentaba en dextrocardia(1).
La técnica fue replicada por Lee FL, en 3 casos de CCAM, con resultados similares a los obtenidos por Bermúdez previamente, evidenciándose mejoría de la hidropesía y la disminución del volumen del CCAM(10).
En nuestro estudio con un total de 17 pacientes, pudimos comparar la aplicación de ambas técnicas, demostrándonos que en un total de 44,9% (4/9) de los casos que iniciaron tratamiento con terapia esteroidea hubo que optar por la utilización de la escleroterapia como coadyuvante al tratamiento esteroideo, posterior a 28 días de vigilancia, con una respuesta satisfactoria al segundo tratamiento. De igual manera, la involución de la masa tumoral demuestra una velocidad de resolución más temprana en los casos donde la terapia inicial fue el uso del polidocanol, logrando la resolución del 50% de la misma para el día 7 de evaluación posterior al tratamiento, y desaparición del 100% para el día 21 de evaluación postratamiento.
Esto orienta a la sugerencia del tratamiento esclerosante como una excelente técnica terapéutica. No obstante, no podemos subestimar el hecho que la terapia esclerosante representa un procedimiento invasivo, que a pesar de que la técnica se incluye dentro de la gama de terapia fetal de baja complejidad, debemos tomar en cuenta que involucra todos los factores de riesgo de un procedimiento invasivo de amniocentesis. De igual manera, el debido cuidado del abordaje pulmonar fetal al momento de administración del polidocanol al igual que su dosis de 1 mL deben ser cuidadosamente tomados por el equipo de medicina materno fetal y cirugía fetal a tratar los casos de CCAM. Ya que durante la administración del polidocanol se ha descrito la afectación del tejido pulmonar sano o de órganos vecinos por la inyección de la sustancia esclerosante fuera de la masa, caso reportado por H Chon A en 2017 en un feto de 24 semanas de gestación con diagnóstico de CCAM microquístico; se trató mediante escleroterapia percutánea usando oleato de etanolamina (EO).
La EO inadvertidamente ingresó a la aurícula y ventrículo izquierdo, con posterior bradicardia fetal y fallecimiento. La autopsia reveló necrosis del miocardio(11). En nuestra serie no hubo casos de óbito fetal por administración del esclerosante fuera de la masa pulmonar.
De igual manera, debemos conocer que durante el primer minuto de administración del polidocanol el feto puede presentar bradicardia transitoria de un minuto de duración, la cual solo debe evaluarse mientras sobrepasa la misma(9). Es por lo cual, en nuestro estudio posterior al tratamiento con polidocanol vigilamos la frecuencia cardíaca fetal por un lapso de 15 minutos, asegurando que el ritmo sea estable.
Los costos de ambas técnicas son muy similares, y la reproducibilidad de ambas facilita una opción terapéutica de alcance en los países en desarrollo, donde en muchas oportunidades se cuenta con unidades de medicina materno fetal, pero no con un equipo médico entrenado en procedimientos de alta complejidad en cirugía fetal. Es por ello que las técnicas mínimamente invasivas de ablación láser del vaso nutricio de la masa pulmonar, que día a día presentan grandes avances y resultados, toman en nuestro logaritmo de tratamiento el tercer puesto terapéutico, según la disposición de la unidad de terapia fetal en el área de evaluación y tratamiento. Sin olvidar que 15% de las CCAM pueden desaparecer espontáneamente.
Conclusiones
Hoy por hoy contamos con técnicas invasivas innovadoras que con resultados de 100% de sobrevida, como lo representa la escleroterapia percutánea, en todos se ha logrado alcanzar el término de la gestación. Ello ha permitido instaurar de manera formal una opción de tratamiento para las patologías pulmonares fetales, como el CCAM resistente al tratamiento de esteroides maternos.
Basados en esta experiencia, y con el debido conocimiento de las diferentes técnicas de tratamiento prenatal para la CCAM, sugerimos la estandarización de un protocolo de tratamiento para dichas patologías consistente en dos fases:
Primera fase: denominada conservadora, en la cual se le otorga al feto como paciente el uso de esteroides administrados vía materna, betametasona 12 mg intramuscular profunda, orden día, por 2 dosis; hacer seguimiento del mismo mediante los índices de valoración de pulmón sano (QLI o LHR), donde posterior a ello, de no lograr resultados favorables, cambiar a esa segunda fase definitiva, la cual tendrá dos vertientes, dependiendo de si se cuenta en el país con el recurso de una unidad de terapia fetal.
Segunda fase:
-
Si no se cuenta con unidad de terapia fetal, realizar escleroterapia percutánea con polidocanol al 3% en la unidad de medicina materno fetal.
-
Si se cuenta con unidad de cirugía fetal, realizar ablación láser del vaso nutricio de la masa pulmonar.
De esta forma, se logra la unificación de conductas, estandarizándose un protocolo de fácil manejo y aplicación, reproducible como pauta a nivel mundial para el manejo de dichas patologías.
Conflictos de intereses: Ninguno
Financiamiento: Autofinanciado
Citar como: Diaz Primera RJ, Gil Guevara ED, Sánchez Jiménez R, Bermúdez González C. Cirugía fetal en tumores pulmonares mediante escleroterapia. Rev Peru Ginecol Obstet. 2018;64(4):647-654 DOI: https://doi.org/10.31403/rpgo.v64i2135
Referencias Bibliográficas
1. Bermúdez C, Pérez-Wulff J, Arcadipane M, Bufalino G, Gómez L, Flores L, Sosa C, Bornick PW, Kontopoulos E, Quintero RA. Percutaneous fetal sclerotherapy for congenital cystic adenomatoid malformation of the lung. Fetal Diagn Ther. 2008;24(3):237-40. doi: 10.1159/000151345. [ Links ]
2. Peranteau WH, Boelig MM, Khalek N, Moldenhauer JS, Martinez-Poyer J, Hedrick HL, Flake AW, Johnson MP, Adzick NS. Effect of single and multiple courses of maternal betamethasone on prenatal congenital lung lesion growth and fetal survival. J Pediatr Surg. 2016 Jan;51(1):28-32. doi: 10.1016/j.jpedsurg.2015.10.018. [ Links ]
3. Gratacos, E. Gómez, R. Evaluación de la Patologías Torácicas. Enfermedad Adnomatoidea Quística Pulmonar. Secuestro Bronco Pulmonar Medicina Fetal. Capítulo 31. Editorial Panamericana, 2009:231 pags. [ Links ]
4. Cruz-Martinez R, Martínez-Rodríguez M, Bermúdez-Rojas M, Magaña-Abarca C, Narvaez-Dominguez V, Rojas-Macedo A, Bautista-García N, Alcocer-Alcocer M. Fetal laser ablation of feeding artery of cystic lung lesions with systemic arterial blood supply. Ultrasound Obstet Gynecol. 2017 Jun;49(6):744-50. doi: 10.1002/uog.16011. [ Links ]
5. Derderian SC, Coleman AM, Jeanty C, Lim FY, Shaaban AM, Farrell JA, Hirose S, MacKenzie TC, Lee H. Favorable outcomes in high-risk congenital pulmonary airway malformations treated with multiple courses of maternal betamethasone. J Pediatr Surg. 2015 Apr;50(4):5158. doi: 10.1016/j.jpedsurg.2014.08.019. [ Links ]
6. Nyberg D, McGahan J, Pretorius D, Pilu G. Anomalías del toráx fetal. Ecografía en el diagnóstico de malformaciones fetales. Capítulo 9. Editorial Marbán. 2009. [ Links ]
7. Morris LM, Lim FY, Livingston JC, Polzin WJ, Crombleholme TM. High-risk fetal congenital pulmonary airway malformations have a variable response to steroids. Pediatr Surg. 2009 Jan;44(1):60-5. doi: 10.1016/j.jpedsurg.2008.10.012. [ Links ]
8. Loh KC, Jelin E, Hirose S, Feldstein V, Goldstein R, Lee H. Microcystic congenital pulmonary airway malformation with hydrops fetalis: steroids vs open fetal resection. J Pediatr Surg. 2012 Jan;47(1):36-9. doi:10.1016/j.jpedsurg.2011.10.015. [ Links ]
9. Bermúdez C, Pérez-Wulff J, Bufalino G, Sosa C, Gómez L, Quintero RA. Percutaneous ultrasound-guided sclerotherapy for complicated fetal intralobar bronchopulmonary sequestration. Ultrasound Obstet Gynecol. 2007 May;29(5):586-9. [ Links ]
10. Lee FL, Said N, Grikscheit TC, Shin CE, Llanes A, Chmait RH. Treatment of congenital pulmonary airway malformation induced hydrops fetalis via percutaneous sclerotherapy. Fetal Diagn Ther. 2012;31(4):264-8. doi: 10.1159/000336226. [ Links ]
11. H Chon A, Takeda MR, Felix JC, Chmait RH. A complication of percutaneous sclerotherapy for congenital pulmonary airway malformation: Intravascular injection and cardiac necrosis. Fetal Pediatr Pathol. 2017 Dec;36(6):437-444. doi: 10.1080/15513815.2017.1346017. [ Links ]
Correspondencia:
Dr. Rogelio Cruz-Martínez, MD, PhD
Calle Juan Paradas Bonilla 8-B, Ensanche Naco, Santo Domingo, República Dominicana
+18093905850
dr.ramirodiaz@gmail.com
Recibido: 1 octubre 2018
Aceptado: 3 octubre 2018