Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Ginecología y Obstetricia
versión On-line ISSN 2304-5132
Rev. peru. ginecol. obstet. vol.64 no.4 Lima oct./dic. 2018
http://dx.doi.org/10.31403/rpgo.v64i2141
SIMPOSIO CIRUGÍA FETAL EN AMÉRICA LATINA
Cirugía fetal para hernia diafragmática congénita en América Latina
Fetal surgery for congenital diaphragmatic hernia in Latin America
Rogelio Cruz-Martínez1,2 ORCID: https://orcid.org/0000-0001-5999-866X
1. Departamento de Cirugía Fetal, Hospital de Especialidades del Niño y la Mujer, Querétaro, México
2. Director, Medicina Fetal México/ Investigación
ABSTRACT
Congenital diaphragmatic hernia is an anomaly in the formation of the diaphragm, which is associated with high neonatal mortality secondary to pulmonary hypoplasia and neonatal pulmonary arterial hypertension. Diagnosis is made by ultrasound, usually in the 20th week of gestation, and it is mandatory to request genetic studies (karyotype and microarrays) due to the high risk of chromosomal and monogenic anomalies. In isolated cases, the estimation of lung size in combination with the identification of liver herniation is the best predictive parameter of neonatal survival. In cases with serious pulmonary hypoplasia, fetoscopic tracheal occlusion has improved the survival rate in 30%. In this article, indications, selection criteria, technique and results of fetoscopic tracheal occlusion are reviewed, and differences in neonatal survival rate in Latin America are highlighted.
Key words: Congenital diaphragmatic hernia, Tracheal occlusion, Fetoscopy, Lungto-head ratio.
RESUMEN
La hernia diafragmática congénita es una anomalía en la formación del diafragma, asociada a elevada mortalidad neonatal secundaria a hipoplasia pulmonar e hipertensión arterial pulmonar neonatal. El diagnóstico se realiza por ultrasonido, generalmente en la semana 20 de gestación, y es mandatorio solicitar estudios genéticos (cariotipo y microarreglos) debido al alto riesgo de asociación con anomalías cromosómicas y monogénicas. En casos aislados, la estimación del tamaño pulmonar en combinación con la identificación de herniación hepática es el mejor parámetro predictivo de supervivencia neonatal. En los casos con hipoplasia pulmonar grave, la oclusión traqueal fetoscópica ha demostrado una mejoría en la tasa de supervivencia en 30% con respecto a la probabilidad basal. En este artículo, se resume las indicaciones, criterios de selección, técnica y resultados de la oclusión traqueal fetoscópica, destacando las diferencias de tasa de supervivencia neonatal que existen en América Latina.
Palabras clave. Hernia diafragmática congénita, Oclusión traqueal, Fetoscopia, Índice pulmón-cabeza.
Introducción
La hernia diafragmática congénita (HDC) aislada ocurre en aproximadamente 1 de cada 4 000 embarazos, unos 800/año en México. La característica principal es la hipoplasia pulmonar que afecta tanto al árbol traqueo-bronquial como al vascular. El término de HDC agrupa desórdenes de etiología genética diversa y la hipoplasia es secundaria a una compresión visceral y, en muchos casos, secundaria probablemente a anomalías primarias del desarrollo pulmonar en grado variable(1). Esto explica las diferencias en el resultado perinatal y en la respuesta a terapia prenatal en casos aparentemente similares. En la mayor serie colaborativa publicada, con más de 200 casos, la HDC aislada diagnosticada in útero se asocia a una mortalidad perinatal de alrededor de 50%(2). La cifra no ha cambiado en más de 20 años, como demuestran estudios poblacionales, a pesar de una percepción subjetiva de mejoría de la supervivencia, en realidad sesgada por la interrupción legal del embarazo y los nacidos en hospitales periféricos que no sobreviven al transporte(3-5). La mortalidad neonatal varía entre los diferentes centros del mundo, probablemente en relación a diferencias en la estandarización de las mediciones prenatales, manejo neonatal subóptimo; pero, también existe una mortalidad subestimada asociada a la interrupción legal del embarazo. En un estudio multicéntrico reciente realizado en seis países de América Latina (México, Argentina, Colombia, Perú, Ecuador y Costa Rica), donde no se permite la interrupción legal del embarazo y existe manejo posnatal subóptimo por la falta de ECMO (extracorporeal membrane oxygenation), la supervivencia global reportada fue de solo 30%(6).
Clasificación de severidad
La hernia diafragmática congénita está asociada a un alto riesgo de mortalidad y morbilidad neonatal secundario a la hipoplasia pulmonar que afecta tanto al árbol traqueo-bronquial como el vascular(7). En general, las hernias bilaterales son prácticamente incompatibles con la vida, y las hernias derechas son más graves que las izquierdas, mostrando supervivencias globales menores al 20%. En la hernia diafragmática izquierda, la presencia de herniación hepática intratorácica es también un factor de mal pronóstico, presentando una supervivencia de 43% en comparación con las hernias izquierdas, que presentan el hígado totalmente intraabdominal y supervivencia de 93%(8).
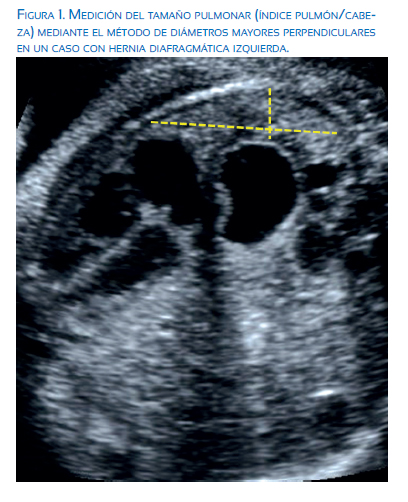
Desde su descripción en 1996, la medición del índice pulmón-cabeza (lung-to-head ratio), obtenido al dividir el área pulmonar (diámetro mayor longitudinal por diámetro mayor transversal) entre el perímetro cefálico, es el parámetro ecográfico que, en combinación con la presencia o ausencia de herniación hepática, ha demostrado ser el mejor método clínico que permite estimar de forma más reproducible la probabilidad de supervivencia neonatal(2,9). La medición se realiza en un corte transversal del tórax fetal, al nivel del corte de 4 cámaras cardíaco y se mide los diámetros del pulmón contralateral al lado de la hernia (figura 1).
En la actualidad se utiliza la relación entre LHR observado y el esperado (O/E) para la edad gestacional, que da un porcentaje que no varía con edad gestacional(9). Para los casos de HDC izquierda, el grado de hipoplasia pulmonar se clasifica en leve -para aquellos casos que presentan un LHR O/E >35% (supervivencia esperada de 80 a 90%)-, moderado para los casos con un LHR O/E de 26 a 35% (supervivencia estimada del 30 a 60%), severo para aquellos fetos con LHR O/E <26% (supervivencia de 15 a 20%) y extremadamente severos, cuando el LHR O/E es menor a 15% (supervivencia menor a 5%)(10). Sin embargo, estas probabilidades de supervivencia han sido publicadas en centros de referencia de países desarrollados, donde se permite la interrupción legal del embarazo. En un estudio reciente, que incluyó 380 casos consecutivos de hernia diafragmática congénita reclutados por nuestro grupo Latin American CDH Group en 6 países de América Latina (México, Argentina, Colombia, Perú, Ecuador, Costa Rica), donde no se permite la interrupción legal del embarazo y el manejo posnatal es subóptimo, las tasas de supervivencia de acuerdo a la medición del tamaño pulmonar fueron significativamente menores que los reportados en el grupo europeo. Así, mientras que en Europa los casos graves con LHR O/E <26% tienen supervivencia de 15 a 20%, en América Latina la supervivencia en este subgrupo es de 0%. De forma similar, los casos ‘moderados’ en Europa (LHR O/E 26 a 45%) presentan 50% de supervivencia, mientras que en América Latina es 10%, y los casos ‘leves’ en Europa (LHR O/E >45%) presentan supervivencia de 90% y en América Latina 60%. Por esta razón, es muy recomendable ajustar la probabilidad de supervivencia de acuerdo a la población evaluada. De acuerdo a este estudio, la hipoplasia pulmonar severa en América Latina sería definida como aquellos casos con un LHR O/E menor de 35%, ya que presentan una tasa de supervivencia menor al 5%.
Debemos reconocer que la medición del LHR es relativamente difícil y se requiere experiencia para su adecuada realización. En un estudio prospectivo, demostramos que es necesario realizar en promedio 70 evaluaciones consecutivas en fetos con HDC para completar la curva de aprendizaje(11). Los centros con menor experiencia suelen sobreestimar el tamaño pulmonar y no identifican adecuadamente la presencia de herniación hepática, explicando así la discrepancia que existe entre la evaluación inicial y la realizada en los centros de referencia con mayor experiencia(12,13). Por este motivo, es una recomendación el referir los casos a centros de concentración donde haya suficiente número de casos para mantener la precisión en la medición del LHR, la identificación de la herniación hepática y, así, optimizar la predicción de supervivencia neonatal.
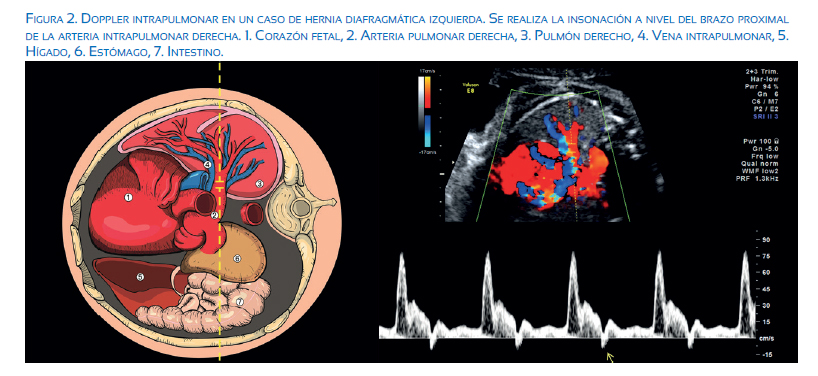
La HDC está también asociada a hipertensión pulmonar severa secundaria a cambios internos en los vasos sanguíneos intrapulmonares(14). Estudios de anatomía patológica han mostrado que los casos de HDC presentan un menor número de vasos sanguíneos intrapulmonares y un mayor grosor en su pared muscular(15,16). Estos cambios intrínsecos pueden ser evaluados clínicamente por ecografía Doppler del brazo proximal de la arteria intrapulmonar (figura 2). Nuestros estudios más recientes sugieren que la evaluación del Doppler intrapulmonar mejora notablemente la predicción del grado de hipoplasia pulmonar y la probabilidad de supervivencia neonatal(17). Así, los casos con Doppler intrapulmonar patológico (flujo diastólico ausente o reverso) presentan una probabilidad de supervivencia neonatal de 30% comparada con 84% en aquellos casos con Doppler intrapulmonar normal, ausencia de herniación hepática y tamaño pulmonar mayor de 26%.
Oclusión traqueal fetoscópica
En casos con hernia diafragmática aislada y cariotipo normal con un mal pronóstico de supervivencia, es decir, aquellos con hipoplasia pulmonar grave (O/E LHR <27%), la oclusión traqueal fetoscópica con balón es la estrategia actual para mejorar el pronóstico(18,19). Esta oclusión traqueal(20) impide la salida del fluido traqueo-bronquial e induce un crecimiento acelerado pulmonar mediante estímulo directo mecánico y secreción de factores de crecimiento(21). El balón se coloca entre las 24 y 32 semanas de gestación según el grado de hipoplasia pulmonar(22) y se retira ya sea en una segunda fetoscopia, punción guiada por ecografía, o por técnica EXIT, a las 34 o 35 semanas.
Los criterios de selección para oclusión traqueal fetoscópica son los siguientes:
-
Presencia de hipoplasia pulmonar severa
-
Ausencia de anomalías estructurales adicionales
-
Ecocardiografía fetal normal
-
Cariotipo y microarreglos normales
-
Longitud cervical mayor de 25 mm
-
Edad gestacional menor de 30 semanas
-
Ausencia de placenta previa
-
Posibilidad de estancia en el centro de cirugía fetal hasta el retiro del balón.
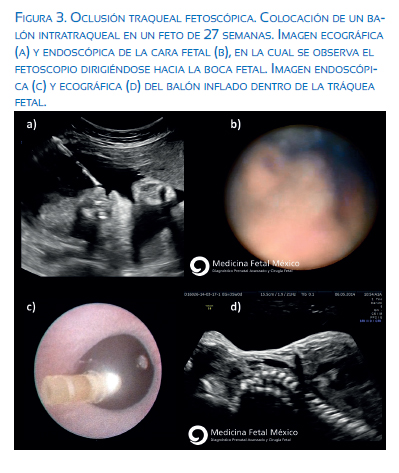
En manos expertas, esta intervención de mínima invasión puede ser realizada en un tiempo mínimo de 3 minutos y un tiempo promedio de 10 minutos. La intervención se realiza con anestesia local o peridural materna y anestesia intramuscular fetal. En ocasiones, es necesario realizar una versión externa para lograr la posición fetal óptima (situación longitudinal con dorso posterior). Guiado por ecografía Doppler para evitar vasos uterinos, se introduce un trocar de 10F hasta el interior de la cavidad amniótica, a través de un puerto de entrada por el abdomen materno y por vía percutánea. El sitio de entrada es elegido de acuerdo a la posición fetal para dirigir el trocar hacia la boca fetal. Se introduce entonces un fetoscopio de 1,2 mm de diámetro dentro de una vaina curva 11540KE (marca Storz), hasta localizar la boca fetal para introducirse en su interior y pasar las cuerdas vocales hasta el interior de la tráquea fetal, donde se avanza el balón con un microcatéter y se infla y libera el balón inmediatamente posterior a las cuerdas vocales (figura 3).
En el estudio europeo, que incluye el mayor número de casos publicados (n=210), describimos que la oclusión traqueal fetoscópica mejoraría en 30 a 40% las probabilidades de supervivencia respecto al pronóstico inicial(23). Un estudio preliminar realizado en el Centro de Cirugía Fetal de Querétaro en México demostró también beneficio, a pesar de no contar con ECMO dentro del protocolo de manejo neonatal(24). Un estudio aleatorizado en Brasil confirmó dicho beneficio al demostrar una supervivencia significativamente mayor en el grupo con oclusión traqueal fetal endoscópica en comparación con aquellos manejados en forma expectante durante el periodo prenatal (54% vs. 5%)(25). Aunque es considerado aún un procedimiento en proceso de investigación, existen centros emergentes que realizan esta intervención bajo un proyecto de investigación en diferentes centros de América Latina (Querétaro, México; Buenos Aires, Argentina; Bogotá, Colombia; y Sao Paulo, Brasil) y los resultados de nuestro grupo Latin American FETO Group están ya en proceso de publicación.
Al igual que la mayoría de los procedimientos invasivos de cirugía fetal, la principal complicación de la oclusión traqueal fetoscópica es la rotura prematura de membranas, la cual ocurre hasta en 30% de los casos. Sin embargo, es posible disminuir su incidencia realizándola en centros donde se cuente con especialistas entrenados en esta intervención, para ofrecer así el menor tiempo intrauterino posible(26).
A pesar de estos resultados, la supervivencia máxima es de 50%, por lo que las actuales investigaciones se enfocan a predecir qué casos van a responder a la intervención para refinar la selección de casos para oclusión traqueal fetoscópica. Nuestros estudios preliminares han demostrado que fetos con hipertensión pulmonar primaria fetal (Doppler fetal intrapulmonar patológico) no responden al tratamiento de oclusión traqueal(27). Sin embargo, la evaluación de Doppler intrapulmonar requiere una elevada experiencia y una curva de aprendizaje para dar resultados fiables y reproducibles(28), por lo que es muy recomendable que estos casos sean evaluados en centros de cirugía fetal con experiencia en hernia diafragmática congénita, para determinar si es un caso candidato o no a beneficiarse de dicha intervención.
Conclusión
En resumen, la hernia diafragmática congénita es un padecimiento raro, que puede presentarse en cualquier embarazo sin factores de riesgo y que puede ser identificado sistemáticamente durante la ecografía estructural a las 20 semanas de gestación. Una vez identificado el padecimiento, es sumamente recomendable referir los casos a centros de experiencia donde se realice la medición del tamaño pulmonar y se determine si existe o no herniación hepática para estimar así un adecuado pronóstico. En presencia de hipoplasia pulmonar severa con herniación hepática y, por lo tanto, altas probabilidades de muerte neonatal, la oclusión traqueal fetoscópica puede ser de beneficio en casos bien seleccionados. El nacimiento de todos los casos de hernia diafragmática con o sin oclusión traqueal debería ser programado en centros de tercer nivel con especialistas en neonatología y cirugía pediátrica, con los recursos necesarios para mantener un adecuado manejo ventilatorio (ventilación de alta frecuencia, ECMO) y manejo médico de la hipertensión pulmonar (óxido nítrico), y evitar así el traslado de recién nacidos graves con mínimas probabilidades de supervivencia. Los centros que ofrecen la oclusión traqueal fetoscópica deben recibir un entrenamiento especializado y completar su curva de aprendizaje en la medición del LHR, en la correcta clasificación de severidad y en los aspectos técnicos de esta intervención, para ofrecer así los mismos resultados que han mostrado los centros de cirugía fetal actuales y disminuir la incidencia de complicaciones ya observadas en los centros pioneros en esta intervención.
Agradecimientos
El Dr. Rogelio Cruz desea agradecer a la Fundación Kristen y a la Fundación de Medicina Fetal México por el apoyo al programa nacional de Cirugía Fetal en Querétaro, México.
Conflictos de interés: No hay conflictos de interés
Financiamiento: No existió para el presente artículo
Citar como: Cruz-Martínez R. Cirugía fetal para hernia diafragmática congénita en América Latina. Rev Peru Ginecol Obstet. 2018;64(4):655-660 DOI: https://doi.org/10.31403/rpgo.v64i2141
Referencias Bibliográficas
1. Ackerman KG, Pober BR. Congenital diaphragmatic hernia and pulmonary hypoplasia: new insights from developmental biology and genetics. Am J Med Genet C Semin Med Genet. 2007;145C:105-8. [ Links ]
2. Jani J, Keller RL, Benachi A, Nicolaides KH, Favre R, Gratacos E, Laudy J, Eisenberg V, Eggink A, Vaast P, Deprest J; Antenatal-CDH-Registry Group. Prenatal prediction of survival in isolated left-sided diaphragmatic hernia. Ultrasound Obstet Gynecol. 2006;27:18-22. [ Links ]
3. Ontario Congenital Anomalies Study Group. Apparent truth about congenital diaphragmatic hernia: a population-based database is needed to establish benchmarking for clinical outcomes for CDH. J Pediatr Surg. 2004;39:661-5. [ Links ]
4. Colvin J, Bower C, Dickinson JE, Sokol J. Outcomes of congenital diaphragmatic hernia: a population-based study in Western Australia. Pediatrics. 2005;116:e35663. [ Links ]
5. Stege G, Fenton A, Jaffray B. Nihilism in the 1990s: the true mortality of congenital diaphragmatic hernia. Pediatrics. 2003;112:532-5. [ Links ]
6. Cruz-Martinez R, Etchegaray A, Molina-Giraldo S, et al. Survival outcomes according to lung-to-head-area ratio in fetuses with congenital diaphragmatic hernia: True mortality in Latin America. Prenat Diagn. Submitted. [ Links ]
7. Gratacós E. Congenital diaphragmatic hernia: one name for various diseases. Fetal Diagn Ther. 2011;29(1):5. doi: 10.1159/000322107. [ Links ]
8. Albanese CT, Lopoo J, Goldstein RB, Filly RA, Feldstein VA, Calen PW, Jennings RW, Farrell JA, Harrison MR Fetal liver position and perinatal outcome for congenital diaphragmatic hernia. Prenat Diagn. 1998;18:1138-42. [ Links ]
9. Jani JC, Peralta CF, Ruano R, Benachi A, Done E, Nicolaides KH, Deprest JA. Comparison of fetal lung area to head circumference ratio with lung volume in the prediction of postnatal outcome in diaphragmatic hernia. Ultrasound Obstet Gynecol. 2007;30(6):850-4. [ Links ]
10. Jani J, Nicolaides KH, Keller RL, Benachi A, Peralta CF, Favre R, Moreno O, Tibboel D, Lipitz S, Eggink A, Vaast P, Allegaert K, Harrison M, Deprest J; Antenatal-CDH-Registry Group. Observed to expected lung area to head circumference ratio in the prediction of survival in fetuses with isolated diaphragmatic hernia. Ultrasound Obstet Gynecol. 2007;30(1):67-71. [ Links ]
11. Cruz-Martinez R, Figueras F, Moreno-Alvarez O, Martinez JM, Gomez O, Hernandez-Andrade E, Gratacós E. Learning curve for lung area to head circumference ratio measurement in fetuses with congenital diaphragmatic hernia. Ultrasound Obstet Gynecol. 2010;36(1):32-6. doi: 10.1002/uog.7577. [ Links ]
12. Done E, Gucciardo L, Van Mieghem T, Devriendt K, Allegaert K, Brady P, Devlieger R, De Catte L, Lewi L, Deprest J. Clinically relevant discordances identified after tertiary reassessment of fetuses with isolated congenital diaphragmatic hernia. Prenat Diagn. 2017 Sep;37(9):883-8. doi: 10.1002/pd.5060. [ Links ]
13. Senat MV, Bouchghoul H, Stirnemann J, Vaast P, Boubnova J, Begue L, Carricaburu E, Sartor A, Jani J, Benachi A, Bouyer J; Center for Rare Diseases: Congenital Diaphragmatic Hernia. Prognosis of isolated congenital diaphragmatic hernia using lung-area-to-head-circumference ratio: variability across centers in a national perinatal network. Ultrasound Obstet Gynecol. 2018;51:208-13. doi: 10.1002/uog.17463. [ Links ]
14. Nobuhara KK, Wilson JM. The effect of mechanical forces on in utero lung growth in congenital diaphragmatic hernia. Clin Perinatol. 1996;23:741-52. [ Links ]
15. Laudy JA, Wladimiroff JW. The fetal lung. 2: Pulmonary hypoplasia. Ultrasound Obstet Gynecol. 2000;16:48294. [ Links ]
16. Roubliova X, Verbeken E, Wu J, Yamamoto H, Lerut T, Tibboel D, Deprest J. Pulmonary vascular morphology in a fetal rabbit model for congenital diaphragmatic hernia. J Pediatr Surg. 2004;39(7):1066-72. [ Links ]
17. Cruz Martinez R, Martinez-Rodriguez M, Nieto-Castro B, Gámez-Varela A, Ahumada-Angulo E, Luna-García J, Pineda-Pérez MJ, Rebolledo-Fernández C. Longitudinal changes in lung size and intrapulmonary artery Doppler during the second half of pregnancy in fetuses with congenital diaphragmatic hernia. Prenat Diagn. 2018;44(3):166-72. doi: 10.1159/000481170. [ Links ]
18. Deprest JA, Nicolaides K, Gratacós E. Fetal surgery for congenital diaphragmatic hernia is back from never gone. Fetal Diagn Ther. 2011;29:6-17. doi: 10.1159/000322844. [ Links ]
19. Deprest JA, Hyett JA, Flake AW, Nicolaides K, Gratacós E. Current controversies in prenatal diagnosis 4: Should fetal surgery be done in all cases of severe diaphragmatic hernia? Prenat Diagn. 2009;29:15-9. doi: 10.1002/pd.2108. [ Links ]
20. Deprest J, Gratacós E, Nicolaides KH. Fetoscopic tracheal occlusion (FETO) for severe congenital diaphragmatic hernia: evolution of a technique and preliminary results. Ultrasound Obstet Gynecol. 2004;24:121-6. [ Links ]
21. tracheal occlusion are dependent on gestational age in a rabbit model of diaphragmatic hernia. J Pediatr Surg. 2002;37:11-7. [ Links ]
22. Deprest J, Nicolaides K, Done’ E, Lewi P, Barki G, Largen E, DeKoninck P, Sandaite I, Ville Y, Benachi A, Jani J, Amat-Roldan I, Gratacós E. Technical aspects of fetal endoscopic tracheal occlusion for congenital diaphragmatic hernia. J Pediatr Surg. 2011 Jan;46(1):22-32. doi: 10.1016/j.jpedsurg.2010.10.008.
23. Jani JC, Nicolaides KH, Gratacós E, Valencia CM, Doné E, Martinez JM, Gucciardo L, Cruz R, Deprest JA. Severe diaphragmatic hernia treated by fetal endoscopic tracheal occlusion. Ultrasound Obstet Gynecol. 2009 Sep;34(3):304-10. doi: 10.1002/uog.6450. [ Links ]
24. Cruz-Martinez R, Mendez A, Moreno-Alvarez O, et al. OP34.10 Impact of fetal endoscopic tracheal occlusion for severe congenital diaphragmatic hernia in a developing country. Ultrasound Obstet Gynecol. 2014;44:175. [ Links ]
25. Ruano R, Yoshisaki CT, da Silva MM, Ceccon ME, Grasi MS, Tannuri U, Zugaib M. A randomized controlled trial of fetal endoscopic tracheal occlusion versus postnatal management of severe isolated congenital diaphragmatic hernia. Ultrasound Obstet Gynecol. 2012;39:207. doi: 10.1002/uog.10142. [ Links ]
26. Gratacós E. Fetoscopy and risk of iatrogenic preterm premature rupture of membranes: not as high as it may seem (in experienced hands). Fetal Diagn Ther. 2012;31(1):10-1. doi: 10.1159/000335420. [ Links ]
27. Cruz-Martinez R, Moreno-Alvarez O, Hernandez-Andrade E, Castañon M, Done E, Martinez JM, Puerto B, Deprest J, Gratacos E. Contribution of intrapulmonary artery Doppler to improve prediction of survival in fetuses with congenital diaphragmatic hernia treated with fetal endoscopic tracheal occlusion. Ultrasound Obstet Gynecol. 2010 May;35(5):572-7. doi: 10.1002/uog.7593. [ Links ]
28. Cruz-Martinez R, Cruz-Lemini M, Mendez A, Illa M, García-Baeza V, Martinez JM, Gratacós E. Learning curve for intrapulmonary artery Doppler in fetuses with congenital diaphragmatic hernia. Fetal Diagn Ther. 2016;39(4):256-60. doi: 10.1159/000441026. [ Links ]
Correspondencia:
Dr. Rogelio Cruz-Martínez, MD, PhD
rcruz@medicinafetalmexico.com
Recibido: 31 octubre 2018
Aceptado: 3 noviembre 2018