Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Ginecología y Obstetricia
versión On-line ISSN 2304-5132
Rev. peru. ginecol. obstet. vol.65 no.2 Lima abr./jun: 2019
http://dx.doi.org/10.31403/rpgo.v65i2172
SIMPOSIO AVANCES EN BIOLOGÍA EN REPRODUCCIÓN ASISTIDA
La importancia del asesoramiento genético para el diagnóstico genético preimplantacional de aneuploidías (PGT-A)
Importance of genetic counseling in preimplantation genetic testing for aneuploidies (PGT-A)
Silvana Sessarego Tabja1,2,3
1 Máster en Asesoramiento Genético de la Universidad Pompeu Fabra (Barcelona, España)
2 Asesora Genética en Clínica de Fertilidad INMATER
3 Miembro de la Sociedad Española de Asesoramiento Genético
ABSTRACT
The development of new genomic technologies has strengthened the influence of genetics in all medical specialties; reproductive medicine is no exception. The introduction of new genetic tests to daily clinical practice, together with the complexity of genetic information and its potential psychological burden, make specialized genetic counseling essential. Preimplantation genetic testing for aneuploidies (PGT-A) has become an almost routine procedure in assisted reproduction treatments. Nevertheless, in Peru, patients usually receive none or inadequate corresponding genetic counseling, which hinders informed decision-making.
Key words: Prenatal genetic counseling; Preimplantation genetic diagnosis; Reproductive medicine, Assisted reproduction, Mosaicism.
RESUMEN
El desarrollo de las nuevas tecnologías genómicas ha potenciado la influencia de la genética en todos los campos de la medicina, en donde la medicina reproductiva no es la excepción. La frecuente introducción de nuevas pruebas genéticas en la práctica clínica diaria, junto con la complejidad de la información genética y su potencial carga psicológica, hacen indispensable el asesoramiento genético especializado. En este contexto, el diagnóstico genético preimplantacional para aneuploidías (PGT-A) se ha convertido en un procedimiento casi de rutina en los tratamientos de reproducción asistida. Sin embargo, en el Perú, en la gran mayoría de casos los pacientes no reciben el asesoramiento genético correspondiente o este no es el adecuado, que no permite una toma de decisiones informada.
Palabras clave. Asesoramiento genético prenatal, Diagnóstico genético preimplantacional PGT-A, Secuenciación de nueva generación NGS, Medicina reproductiva, Reproducción asistida, Mosaicismo.
Introducción
El campo de la genética ha tenido un desarrollo exponencial en los últimos 60 años. Los avances tecnológicos junto con el aumento del conocimiento del genoma humano, sus variaciones y las asociaciones con diferentes enfermedades, están transformando la medicina actual.
El Proyecto del Genoma Humano fue un esfuerzo internacional que tuvo como objetivo secuenciar por completo el genoma de un ser humano. Conseguir este objetivo tomó 13 años y tuvo un costo de 2,7 billones de dólares. Hoy en día, tras la aparición de las técnicas de secuenciación masiva, podemos secuenciar un genoma completo en 24 horas y con un costo de alrededor de 1 000 dólares(1). Esta drástica reducción en tiempo y costos en la secuenciación del ADN, ha hecho que la tecnología, antes solo disponible en laboratorios de investigación, pueda ser hoy asequible para la mayoría de pacientes. Ha potenciado su aplicación en la práctica clínica de rutina, mejorando los procesos diagnósticos y desarrollando nuevos tratamientos, y han dado lugar a la llamada medicina genómica, personalizada o de precisión(2). La influencia de la nueva corriente se puede observar en todas las especialidades médicas, incluyendo la medicina reproductiva.
Las técnicas de secuenciación masiva han proporcionado grandes beneficios, pero también múltiples retos. Quizás el principal sea la enorme cantidad de información genética que podemos obtener por la capacidad de análisis, interpretación, manejo y almacenamiento de información médica confidencial, con potenciales problemas ético-legales.
La información genética no solo es compleja, sino que para el paciente puede llegar a ser estresante y angustiante. Esto se debe a que las enfermedades o condiciones genéticas, por el momento no tienen cura e incluso en algunos casos no cuentan con un tratamiento efectivo. Adicionalmente, la información genética podría no solo tener implicancias directas para el paciente sino también para sus familiares. Y, por último, en algunos casos se hallará condiciones genéticas que se desarrollarán en un futuro, sin nada que pueda hacerse para evitarlo. Es indispensable tener en cuenta este aspecto, ya que la carga psicológica puede dificultar aún más la comprensión de la información por parte del paciente.
Por estos motivos, se necesitan profesionales que no solo sepan interpretar y manejar todos los aspectos de la información genética, sino que sepan comunicarla de manera adecuada a los pacientes. Si bien existe desde los años 40, es precisamente ahora cuando la labor del asesor genético ha cobrado vital importancia.
En el Perú, al igual que en la gran mayoría de países de América Latina, el asesoramiento genético aún no es reconocido como una profesión independiente. Es considerado una competencia médica, porque el servicio es, en teoría, proporcionado por los médicos especialistas(3). Sin embargo, a excepción de quizás los pocos médicos especialistas en genética, la asesoría genética que se proporciona dista mucho del proceso minucioso, metódico y altamente especializado que es.
¿Qué es el asesoramiento genético?
El asesoramiento genético es un proceso de comunicación especializado en el cual no solo se proporciona información, sino también apoyo emocional y ayuda para la toma de decisiones a personas y familiares que estén en riesgo de desarrollar y/o heredar una condición genética(4). Este proceso es llevado a cabo por profesionales capacitados en genética clínica y counseling, que es una técnica psicológica de asesoramiento y ayuda interpersonal.
Este proceso se caracteriza principalmente por ser no directivo y altamente personalizado. La no directividad nos obliga a abandonar la postura paternalista por una en la cual se busca empoderar al paciente para aumentar su control personal y disminuir el estrés psicológico, fomentando de esta manera una toma de decisiones informada y de acuerdo con sus valores e intereses. Por otro lado, la personalización del proceso se basa en las diferentes características del paciente que deben ser tenidas en cuenta durante la asesoría: nivel educativo, aspectos socioculturales, creencias religiosas, entre otros. Ningún proceso de asesoramiento genético es igual a otro, incluso cuando el motivo de consulta sea el mismo.
La consulta de asesoramiento genético
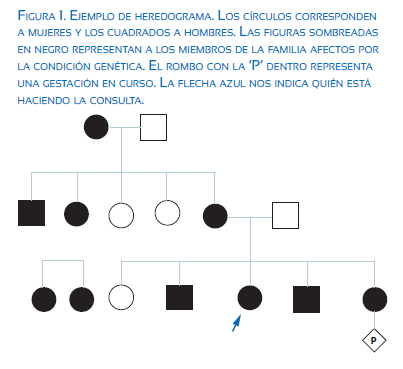
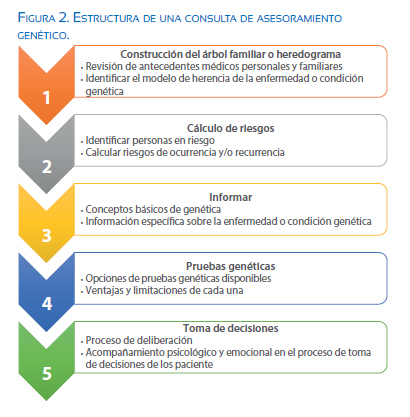
Una consulta de asesoramiento genético normalmente consta de varias partes. La primera y más importante es la construcción del árbol familiar o heredograma (figura 1) y la recolección de los antecedentes médicos personales y familiares. El análisis/evaluación de la historia familiar nos permitirá realizar la segunda parte de la consulta, que es la identificación y cálculo de riesgos.
En esta parte se busca identificar el modelo de herencia de la condición genética para identificar a las personas en riesgo y poder calcular los riesgos de ocurrencia y/o recurrencia. La tercera etapa consiste en proporcionar a los pacientes información sobre genética en general y específica de la condición o enfermedad por la cual se está consultando; y, por último, se dará información y se conversará sobre opciones de pruebas genéticas para cada caso, los pros y contras de hacerlas o no y los posibles resultados. Por otro lado, de manera simultánea y durante todo el proceso, el asesor debe proporcionar también acompañamiento emocional para el paciente(5) (figura 2).
Medicina reproductiva y genética preimplantacional
La medicina reproductiva es quizás, dentro de las especialidades médicas, la más influenciada por la genética, y es porque cuando se habla de reproducción, inherentemente se conversa de herencia; y si se conversa de herencia, necesariamente se habla de genética.
Los tratamientos y terapias que se desarrollan en el campo de la medicina reproductiva están dirigidas a aumentar las tasas de embarazo, disminuir la incidencia de abortos y complicaciones obstétricas e incrementar la tasa de nacidos vivos sanos(6). En la actualidad, muchos de estos tratamientos y terapias se basan en resultados de pruebas genéticas.
El diagnóstico genético preimplantacional fue desarrollado originalmente para ser utilizado exclusivamente en casos en los que los pacientes estaban en riesgo de heredarle una enfermedad genética a sus hijos. El proceso de análisis de los embriones antes de ser transferidos para determinar si presentaban las mutaciones genéticas específicas causantes de la enfermedad, recibió el nombre de diagnóstico genético preimplantacional (PGD).
Sin embargo, al ser las aneuploidías (la presencia de un número de cromosomas diferente a 46) la principal causa de fallos de implantación, abortos espontáneos y malformaciones congénitas, y al conocerse que la tasa de embriones aneuploides aumenta con la edad materna, esta técnica empezó a utilizarse para evaluar la ploidía (el número de cromosomas) de los embriones, proceso que recibió el nombre de tamizaje genético preimplantacional (PGS)(7,8). La hipótesis era que, si los embriones eran analizados para aneuploidías antes de la transferencia, el seleccionar solo embriones con el número correcto de cromosomas para transferir aumentaría las tasas de implantación y embarazo y disminuiría la tasa de abortos espontáneos. Adicionalmente, este procedimiento sería particularmente beneficioso para pacientes de edad materna avanzada, pacientes con falla de implantación repetitivos y pacientes con abortos recurrentes(9). La nueva nomenclatura para referirse a esta prueba es diagnóstico genético preimplantacional para aneuploidías o PGT-A, por sus siglas en inglés(10).
La implementación de la tecnología de secuenciación de nueva generación (NGS) en el PGT-A ha conllevado un aumento considerable en la resolución y precisión de la técnica, la cual ha probado incrementar las tasas de embarazo por transferencia en diversos metaanálisis, ensayos aleatorios controlados y estudios prospectivos caso-control.
Esto ha hecho que el PGT-A, a pesar de también tener muchos detractores, evolucione hasta convertirse en un procedimiento casi de rutina dentro de los tratamientos de reproducción asistida(11). Sin embargo, se debe tener mucho cuidado con la rutinización de pruebas genéticas, ya que esto puede llevar a que se le reste importancia al proceso de informar adecuadamente a los pacientes sobre los alcances y limitaciones de la prueba, para que puedan tomar una decisión informada. En la mayoría de los casos, los pacientes optan por realizar la prueba de acuerdo a la recomendación médica, sin tener claro realmente en qué consiste ni cuál es su utilidad. Por este motivo, el asesoramiento genético debería ser indispensable para todos aquellos pacientes que estén considerando realizar un PGT-A como parte de su tratamiento.
AsesoramIento genético para PGT-A
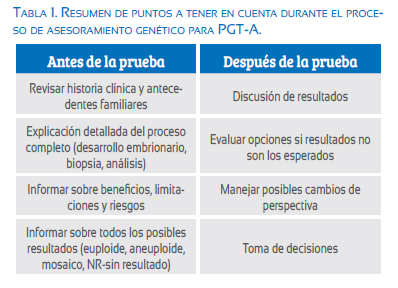
El asesoramiento genético para PGT-A, así como para cualquier otra prueba genética, debería constar de por lo menos dos sesiones: una antes de la prueba y otra después de la prueba (tabla 1).
En la sesión antes de la prueba se deberá empezar por revisar la historia familiar y los antecedentes médicos, mientras se construye el heredograma. De esta manera evaluaremos si existe algún factor no contemplado anteriormente que podría representar la necesidad de un cambio en el tratamiento o la realización de una prueba genética diferente a la indicada. Luego, se debe explicar paso a paso el proceso e informar no solo los beneficios sino también las limitaciones y posibles riesgos de la prueba. Por último, se deberá mencionar y discutir cada uno de los posibles resultados que, en el caso del PGT-A, son la posibilidad de tener embriones clasificados como euploides, aneuploides, mosaico o que el análisis no nos pueda proporcionar un resultado (NR).
La sesión antes de la prueba es la parte crucial del proceso de asesoría genética para PGT-A, debido a que los pacientes pueden tener diversas expectativas o ideas con respecto a la información que la prueba les puede proporcionar. Es importante ajustar estas expectativas a la realidad y recordarles también que la prueba es de carácter no obligatorio. La decisión de realizarla o no debe ser exclusivamente de los pacientes y ellos deben sentirse con la libertad y seguridad necesaria para tomar una decisión informada.
La sesión de asesoramiento después de la prueba consiste básicamente en la discusión de los resultados de la prueba y el proceso de toma de decisiones de los pacientes en base a ellos. Si es que los resultados no fueran los esperados, se deberá evaluar junto con los pacientes las opciones disponibles y, por último, manejar los posibles cambios de perspectivas de los pacientes como consecuencia de los resultados obtenidos(12,13).
PGT-A, mosaicismo y asesoramiento genético
El uso de la tecnología NGS para el PGT-A permite la identificación de embriones mosaico, algo que no era posible con técnicas anteriores. Los embriones mosaico son embriones que poseen dos o más líneas celulares con carga genética distinta. Estudios recientes han comunicado tasas de implantación significativamente menores y mayores tasas de aborto para estos embriones, pero también un número de nacidos vivos sanos luego de la transferencia de embriones mosaico. La significancia clínica del mosaicismo cromosómico diagnosticado por PGT-A aún no está bien definida. En teoría, cualquier aneuploidía podría ser viable en presencia de una línea celular euploide, y se ha descrito diversos síndromes genéticos por mosaicismo cromosómico(14-18). Actualmente no existe forma de predecir el resultado de las transferencias de estos embriones ni evidencia suficiente para asegurar que los resultados que podemos esperar son los de no implantación, aborto espontáneo temprano o nacimiento de un bebé sano(19).
La posibilidad de identificar embriones mosaico supone un reto para el proceso de asesoramiento genético, debido a los altos niveles de incertidumbre alrededor de este tema y a que, si los pacientes consideran como posibilidad la transferencia de estos embriones, se debe realizar un asesoramiento específico en cada caso, dependiendo de las características del mosaico identificado; siempre siendo cautelosos de dar toda la información de manera objetiva y evitando, sobretodo, crear falsas expectativas en los pacientes(20-22).
Conclusión
Si bien el asesoramiento genético existe desde los años 40, es recién ahora, a la luz de las nuevas tecnologías genómicas aplicadas a la práctica clínica de rutina, que ha adquirido un protagonismo sin precedentes y se ha convertido en una necesidad. Sin embargo, su aplicación aún está muy lejos de ser la adecuada, ya que la mayoría de personas no está al tanto de la existencia de esta especialidad. Es de suma importancia no solo la difusión de la profesión sino también la implementación de servicios de asesoría genética que estén a cargo de profesionales especializados, para poder poner esta herramienta al alcance de los pacientes que lo necesiten.
Financiamiento: propio de la autora
Conflictos de interés: ninguno
Citar como: Sessarego Tabja S. La importancia del asesoramiento genético para el diagnóstico genético preimplantacional de aneuploidías (PGT-A). Rev Peru Ginecol Obstet. 2019;65(2):183-188. DOI: https://doi.org/10.31403/rpgo.v65i2172
Referencias Bibliográficas
1. Wetterstrand KA. DNA sequencing costs: Data from the NHGRI Genome Sequencing Program (GSP). www. genome.gov/sequencingcostsdata. Acceso 10 enero 2019. [ Links ]
2. Brittain HK, Scott R, Thomas E. The rise of the genome and personalised medicine. Clin Med J R Coll Physicians London. 2017;17(6):545–51. DOI: 10.7861/clinmedicine.17-6-545 [ Links ]
3. Abacan MA, Alsubaie L, Barlow-Stewart K, Caanen B, Cordier C, Courtney E, et al. The global state of the genetic counseling profession. Eur J Hum Genet. 2018;183–97. DOI: 10.1038/s41431-018-0252-x [ Links ]
4. Yang M, Kim JW. Principles of genetic counseling in the era of next-generation sequencing. Ann Lab Med. 2018;38(4):291–5. DOI: 10.3343/alm.2018.38.4.291 [ Links ]
5. Harper P. Practical Genetic Counselling. 7th ed. Boca Raton, FL: Taylor & Francis, 2010:3-20. [ Links ]
6. Brezina PR, Kearns WG. The evolving role of genetics in reproductive medicine. Obstet Gynecol Clin North Am. 2014;41(1):41–55. DOI: 10.1016/j.ogc.2013.10.006 [ Links ]
7. Practice Committee of Society for Assisted Reproductive Technology; Practice Committee of American Society for Reproductive Medicine. Preimplantation genetic testing: A Practice Committee opinion. Fertil Steril. 2008 Nov;90(5 Suppl):S136-43. doi: 10.1016/j.fertnstert.2008.08.062. [ Links ]
8. ACOG Committee Opinion No. 430. Preimplantation genetic screening for aneuploidy. Obstet Gynecol. 2009;113(3):766–7. DOI: 10.1097/AOG.0b013e31819e9f05 [ Links ]
9. Romana Grati F, Gallazzi G, Branca L, Maggi F, Simoni G, Yaron Y. An evidence-based scoring system for prioritizing mosaic aneuploid embryos following preimplantation genetic screening. Obstet Gynecol Surv. 2018;73(7):409–10. DOI: 10.1016/j.rbmo.2018.01.005 [ Links ]
10. Zegers-Hochschild F, Adamson GD, Dyer S, Racowsky C, De Mouzon J, Sokol R, et al. The international glossary on infertility and fertility care, 2017. Hum Reprod. 2017;32(9):1786–801. DOI: 10.1093/humrep/dex234 [ Links ]
11. Munné S, Grifo J, Wells D. Mosaicism: "survival of the fittest" versus "no embryo left behind." Fertil Steril. 2016;105(5):1146–9. DOI: 10.1016/j.fertnstert.2016.01.016 [ Links ]
12. Besser AG, Mounts EL. Counselling considerations for chromosomal mosaicism detected by preimplantation genetic screening. Reprod Biomed Online. 2017;34(4):369–74. DOI: 10.1016/j.rbmo.2017.01.003 [ Links ]
13. The American College of Obstetricians and Gynecologists Committee on Genetics. Counseling about genetic testing and communication of genetic test results. Obstet Gynecol. 2017;129(4):e96–101. DOI: 10.1097/AOG.0000000000002011 [ Links ]
14. Greco E, Minasi MG, Fiorentino F. Healthy babies after intrauterine transfer of mosaic aneuploid blastocysts. N Engl J Med. 2015;373(21), 2089–2090. DOI: 10.1056/nejmc1500421 [ Links ]
15. Munné S, Wells D. Detection of mosaicism at blastocyst stage with the use of high-resolution next-generation sequencing. Fertil Steril. 2017;107(5):1085–91. DOI: 10.1016/j.fertnstert.2017.03.024 [ Links ]
16. Spinella F, Fiorentino F, Biricik A, Bono S, Ruberti A, Cotroneo E, et al. Extent of chromosomal mosaicism influences the clinical outcome of in vitro fertilization treatments. Fertil Steril. 2018;109(1):77–83. DOI: 10.1016/j.fertnstert.2017.09.025 [ Links ]
17. Fragouli E, Alfarawati S, Spath K, Babariya D, Tarozzi N, Borini A, et al. Analysis of implantation and ongoing pregnancy rates following the transfer of mosaic diploid–aneuploid blastocysts. Hum Genet. 2017;136(7):805–19. DOI: 10.1007/s00439-017-1797-4 [ Links ]
18. Munné S. Origins of mosaicism and criteria for the transfer of mosaic embryos. Reprod Biomed Online. 2018;36(4):369–70. DOI: 10.1016/j.rbmo.2018.02.002 [ Links ]
19. Munné S, Blazek J, Large M, Martinez-Ortiz PA, Nisson H, Liu E, et al. Detailed investigation into the cytogenetic constitution and pregnancy outcome of replacing mosaic blastocysts detected with the use of high-resolution next-generation sequencing. Fertil Steril. 2017;108(1):62–71.e8. DOI: 10.1016/j.fertnstert.2017.05.002 [ Links ]
20. Scott RT, Galliano D. The challenge of embryonic mosaicism in preimplantation genetic screening. Fertil Steril. 2016;105(5):1150–2. DOI: 10.1016/j.fertnstert.2016.01.007 [ Links ]
21. Goldberg-Strassler D, Armenti E, Cabey R, Gay J, Jordan Efficacy of genetic counseling in the preimplantation genetic diagnosis (PGD) setting: patient opinions and perspectives. Fertil Steril. 2017;107(3):e42–3. DOI: https://doi.org/10.1016/j.fertnstert.2017.02.081 [ Links ]
22. Sachdev NM, Maxwell SM, Besser AG, Grifo JA. Diagnosis and clinical management of embryonic mosaicism. Fertil Steril. 2017;107(1):6-11. DOI: 10.1016/j.fertnstert.2016.10.006 [ Links ]
Correspondencia:
Silvana Sessarego Tabja
silvana.sessarego@inmater.pe
Recibido: 10 enero 2019
Aceptado: 17 enero 2019
Publicado online: 8 mayo 2019