Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Peruana de Ginecología y Obstetricia
On-line version ISSN 2304-5132
Rev. peru. ginecol. obstet. vol.65 no.4 Lima Oct./Dic. 2019
http://dx.doi.org/10.31403/rpgo.v65i2210
SIMPOSIO ANEMIA EN LA GESTACIÓN
Fisiopatología de la anemia durante el embarazo: ¿anemia o hemodilución?
Pathophysiology of anemia in pregnancy: anemia or hemodilution?
Gustavo F. Gonzales1 , Paola Olavegoya1
1. Instituto de Investigaciones de la Altura y Departamento de Ciencias Biológicas y Fisiológicas, Facultad de Ciencias y Filosofía, Universidad Peruana Cayetano Heredia.
ABSTRACT
Iron is essential for health; its deficiency and excess are harmful. Our bodies have a high capacity to store and reuse iron so that its requirement is small (1-2 mg absorbed/day). Hepcidin, a hormone produced in the liver, has an important role in this element’s homeostasis by blocking its transport protein, inhibiting its absorption in the duodenum and its release from the iron stores. During pregnancy, there is a new iron requirement for the placenta and fetus. This causes an increase in erythropoiesis; however, hemoglobin concentration decreases due to the greater vascular expansion. This results in hemodilution, which is evident starting the second trimester and returns to pre-gestational values at the end of the third trimester. Maternal iron deficiency anemia becomes a public health problem when it is moderate (7-<9 g/dL) or severe (Hb<7 g/dL), at which point the risk of maternal and neonatal morbidity and mortality increases. On the other hand, higher hemoglobin values (>14,5 g/dL) during pregnancy adversely affect the mother and neonate. For this reason, it is important to confirm if a pregnant woman with low hemoglobin levels is anemic or if it is due to hemodilution, a physiological process during pregnancy that does not require treatment. This review presents evidence to distinguish anemia from physiological hemodilution.
Key words: Hematological pregnancy complications, Erythrocytosis, Hepcidin, Hemodilution.
RESUMEN
El hierro es un micronutriente fundamental para la salud; su deficiencia o su exceso son dañinos. Por ello, el organismo regula el requerimiento de hierro en base a su alta capacidad para almacenar y reciclar el hierro corporal de tal manera que su requerimiento es mínimo (1 a 2 mg absorbido/día). Esto se regula a través de la hepcidina, una hormona hepática que inhibe a la proteína transportadora de hierro (ferroportina) y con ello disminuye la absorción de hierro, o su liberación en los tejidos donde se almacenan. Durante la gestación hay una mayor necesidad de hierro para la placenta y el feto, y ello se evidencia en un aumento de la eritropoyesis; sin embargo, la concentración de la hemoglobina disminuye por efecto de una mayor expansión vascular. Esto determina una hemodilución que se evidencia a partir del segundo trimestre, y luego se va normalizando al final del tercer trimestre. La anemia materna por deficiencia de hierro se constituye en un problema de salud pública cuando es de magnitud moderada (7 a <9 g/dL) y severa (Hb <7 g/dL), incrementando el riesgo de morbi-mortalidad materna y del neonato. Igualmente se ha demostrado que niveles altos de hemoglobina (>14,5 g/dL) en la gestante afecta a la madre y al neonato. Por ello es importante determinar si una gestante con hemoglobina baja es realmente anémica o tiene una hemodilución, que es un proceso fisiológico que no requiere de tratamiento. Esta revisión presenta las evidencias para poder discriminar entre una anemia verdadera gestacional de una hemodilución fisiológica.
Palabras clave. Anemia materna, Eritrocitosis materna, Hepcidina, Embarazo, hemodilución.
Introducción
La anemia es considerada, según las estadísticas oficiales de la OMS, uno de los problemas públicos de mayor severidad en el mundo entero. Se estima que 1 620 millones de personas la padecen, de las cuales las poblaciones más vulnerables son las gestantes y los niños entre 6 y 59 meses de edad. De acuerdo con la OMS, la deficiencia de hierro sería la principal causa de la anemia, particularmente en países de desarrollo económico mediano y bajo.
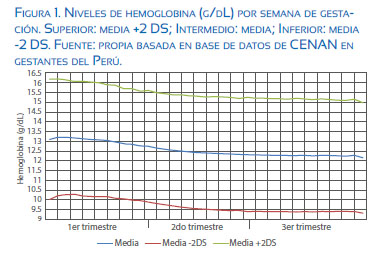
La gestación es un estado de mayor requerimiento de hierro por la necesidad de este para la placenta y el feto. Se estima que por esta mayor necesidad se debe cubrir un gramo adicional de hierro. Sin embargo, fisiológicamente durante el embarazo ocurre mas bien una disminución en la concentración de la hemoglobina (Hb), que se hace evidente a partir del segundo trimestre de gestación (figura 1). Esto ocurre como resultado de una mayor expansión vascular respecto al aumento de la eritropoyesis necesaria para aumentar la disponibilidad de hierro(1).
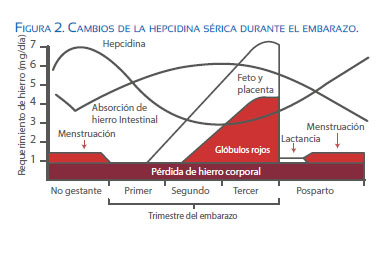
Sobre esta base, la OMS recomienda reducir el punto de corte de corte para definir anemia en la gestación a una Hb de 11 g/dL cuando en la no gestante es de 12 g/dL. Estos cambios en las concentraciones de hemoglobina en el segundo y tercer trimestre determinan que la prevalencia de anemia sea más alta en el segundo trimestre y disminuya al final del tercer trimestre(2). Esto podría indicar que la reducción a 11 g/dL como punto de corte de la Hb podría no ser suficiente. LA CDC de Atlanta utiliza como punto de corte en el segundo trimestre un nivel de Hb de 10,5 g/ dL. En algunos estudios de investigación en países desarrollados se define anemia como <11,0 g/dL en el primer y tercer trimestre y Hb < 10,5 g/dL en el segundo trimestre. A la eritrocitosis o hemoconcentración la definen como Hb > 13,0 g/L en el segundo y tercer trimestres de gestación(3). Esto podría indicar que la reducción a 11 g/dL como punto de corte de la Hb podría no ser suficiente. LA CDC de Atlanta utiliza como punto de corte en el segundo trimestre un nivel de Hb de 10,5 g/dL. En algunos estudios de investigación en países desarrollados se define anemia como <11,0 g/dL en el primer y tercer trimestre y Hb < 10,5 g/dL en el segundo trimestre. A la eritrocitosis o hemoconcentración la definen como Hb > 13,0 g/L en el segundo y tercer trimestres de gestación(4). Sin embargo, la concentración de Hb se mantiene normal con ingestas de hierro de 80% de la dosis recomendada en la primera mitad de la gestación y de 41% en la segunda mitad(5). Esto se debe a que, a partir del segundo trimestre, los niveles de hepcidina, la hormona encargada de regular la homeostasis de hierro, disminuyen significativamente y con ello aumenta de manera importante la absorción de hierro en el duodeno (figura 2). Esto quiere decir que no regula el ingreso de hierro al organismo la mayor ingesta, sino la necesidad de hierro y su regulación a través de la hepcidina circulante.
Las evidencias demuestran que la disminución de la concentración de hemoglobina en un embarazo normal no necesariamente significa una deficiencia de hierro en la dieta, sino que ocurre como fenómeno universal de un proceso de hemodilución sanguínea por expansión vascular, que favorece el flujo arterial uteroplacentario y con ello el adecuado crecimiento del feto.
Si bien la necesidad de hierro en la gestación aumenta debido a las necesidades del feto (300 mg durante el embarazo), el incremento de la hemoglobina materna (500 mg durante el embarazo) y para reponer la pérdida de sangre durante el parto(6), debemos tener en cuenta que la disminución de la concentración de la Hb en la gestación normal es un proceso fisiológico. Entonces, de no detectarse una anemia verdadera, no sería necesario suplir con hierro para incrementar los niveles de Hb en sangre.
Antes del año 2000, era claro que como la gestante normal requería absorber por el duodeno tres veces más de hierro que una no gestante, su ingesta de hierro debería triplicarse. A partir del 2000, cuando se descubre la hepcidina, se sabe que una gestante con suficiencia de hierro antes del embarazo no requiere aumentar el consumo, pues por la disminución fisiológica de la hepcidina con el embarazo aumenta la absorción de hierro. Así, por ejemplo, si una mujer no gestante recibe 10 mg de hierro y se absorbe el 10% (1 mg/día), si consume en el embarazo 10 mg de hierro puede llegar a absorberse hasta 60 o 70% (6 a 7 mg/día), sin necesidad de aumentar la cantidad de hierro en la dieta.
El hierro, ¿bueno o malo para la salud?
El hierro es el cuarto mineral más abundante en la naturaleza; sin embargo, su disponibilidad para los organismos vivientes, en particular en humanos, debe ser regulado de manera milimétrica debido a su gran capacidad de oxidarse, generando estrés oxidativo y daño al organismo. Es probable por ello que los organismos vivos estén diseñados bajo un sistema de mantener el hierro corporal favoreciendo su reciclamiento y evitando su excreción, de tal manera que las necesidades de ingesta sean mínimas (1 a 2 mg absorbidos/día).
Un varón adulto posee en el organismo 4 gramos de hierro (2,5 gramos se encuentran en la hemoglobina, 1 gramo en los hepatocitos y en los macrófagos esplénicos y hepáticos, y el resto en la mioglobina, citocromos y ferroproteínas(7). De uno a dos mg de hierro o <0,05% es perdido del organismo por día debido a descamación de células y pérdidas sanguíneas menores(7); por ello, se requiere tan solo 1 a 2 mg/día de hierro absorbido para reponer estas mermas(8).
En la gestante, dada su mayor necesidad de hierro debido a la presencia del feto, se sugiere un requerimiento de 2 a 4,8 mg de hierro absorbido por día(9). A raíz de esto, se asume que una mujer debería consumir entre 20 y 48 mg de hierro en la dieta para absorber esta cantidad diaria, sobre la hipótesis que, del consumo de alimentos, solo el 10% del hierro contenido se absorbe en los enterocitos(9). La mayoría de los trabajos de este tipo obvian el rol de la hepcidina y particularmente que la reducción de esta hormona puede aumentar la absorción de hierro en el intestino hasta 20 veces cuando la circunstancia lo amerita, reduciendo por tanto los requerimientos absolutos de hierro en la dieta(7).
En base a las publicaciones recientes sobre hepcidina, se está logrando entender mejor la homeostasis del hierro. Así, por ejemplo, durante el embarazo la hepcidina materna tiene rol en regular la captación de hierro por la placenta que procede del hierro heme o no heme de la dieta materna(6). En el embarazo hay un incremento en la absorción intestinal de hierro, de dos a tres veces a lo que se observa en la etapa pregestacional, lo que permitiría mantener los mayores requerimientos de hierro en el organismo, sin necesidad de aumentar el hierro de la dieta que la mujer tenía antes de la gestación.
En embarazos normales, la hepcidina aumenta en el primer trimestre, comparado con las no gestantes, pero luego disminuye en el segundo trimestre, a pesar de que las concentraciones de hierro son estables, sugiriendo una activa supresión de hepcidina, posiblemente por señales aún no descubiertas de la placenta y el feto, presumiblemente para mejorar la disponibilidad de hierro a medida que aumenta la demanda de hierro(10)(figura 2).
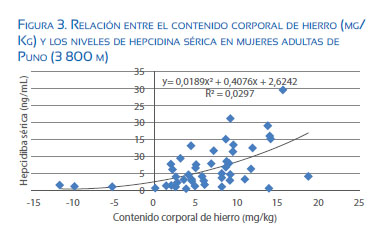
En mujeres con aborto espontáneo durante el primer trimestre, se observa que los niveles de hepcidina, hierro sérico y ferritina están incrementados comparados a los encontrados en embarazos normales en el primer trimestre. Estos resultados demuestran que señales fetoplacentarias pueden modular la homeostasis de hierro materno(10). Se sabe que el hierro es tóxico para la organogénesis y ello explica por qué aumenta la hepcidina, en la necesidad de tener menor disponibilidad de hierro durante este periodo sensible en el embrión(11)(tabla 1). Un aumento del hierro en la primera fase del embarazo va a producir daño en la organogénesis, que puede terminar en aborto; pero a su vez va a promover el aumento de hepcidina, con la finalidad de evitar un mayor ingreso de hierro a la circulación materna. En la figura 3 se puede apreciar cómo a medida que aumenta el contenido corporal de hierro, aumenta la concentración sérica de hepcidina.
Si hay exceso de hierro, se reduce su utilización y ello conduce a la generación de especies reactivas de oxígeno a nivel intracelular, que a su vez producen daño celular; por ello es importante mantener un balance adecuado de hierro en el organismo. La suplementación innecesaria con hierro también acelera la producción de hepcidina y, a través de su efecto sobre la ferroportina 1 (FP-1; transportador de hierro), evita que el hierro intracelular sea transportado fuera, aún si la reserva de hierro fuera el adecuado; también, disminuye la absorción intestinal de hierro.
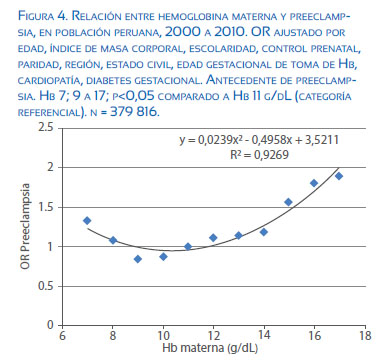
En mujeres preeclámpticas se ha observado mayor nivel de hierro como consecuencia de bajos niveles de hepcidina(12). Teniendo en cuenta que el embarazo en respuesta a señales feto-placentarias disminuyen los niveles de hepcidina, es posible que un exceso de hierro en la dieta o en base a suplementos pueden aumentar la disponibilidad de hierro más allá de lo necesario y con ello producir, entre otras patologÃas, a la preeclampsia. Niveles altos en la concentración de la hemoglobina materna se asocia a un mayor OR para preeclampsia (figura 4).
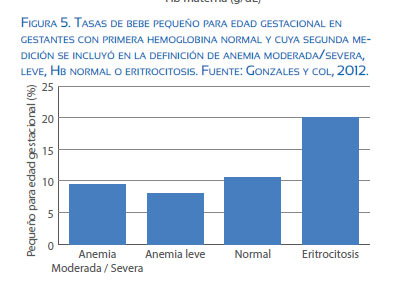
Las gestantes con niveles normales de Hb en la primera toma y que aumentan a >14,5 g/dL en la segunda muestra duplican el riesgo de que nazcan niños pequeños para edad gestacional(13) (figura 5).
En la actualidad, hay literatura abundante donde se describe que tanto la deficiencia de hierro como la sobrecarga de hierro se asocian a efectos indeseados sobre la salud. En Alemania, por ejemplo, como en otros países desarrollados, los suplementos de hierro solo se recomiendan para mujeres gestantes con diagnóstico de deficiencia de hierro/anemia por deficiencia de hierro(14). Esto contrasta con las normas en Perú, donde el Ministerio de Salud ordena el cumplimiento obligatorio de suplementar con hierro a las gestantes, sean o no anémicas.
A pesar de estas consideraciones, se sugiere en países en vías de desarrollo que el suplemento con micronutrientes es más costo-efectivo(15). Esto ciertamente debe ser investigado para determinar cuál es la situación en países como el nuestro donde se observa grandes brechas, con poblaciones que se enmarcan entre los que tienen más y menos salud y acceso a los servicios de salud. Varios micronutrientes apoyan la función del hierro en la eritropoyesis, como la vitamina A, cobre, manganeso y zinc. Sin embargo, aún se desconoce cómo estos nutrientes interactúan(11).
Marcador del nivel de hierro
Por su simplicidad y bajo costo, se prefiere el uso de la concentración de hemoglobina como marcador del nivel de hierro. Sin embargo, la concentración de hemoglobina puede ser afectada por factores adicionales al estatus de hierro, tales como la malaria, parasitosis (de alta prevalencia en zonas selváticas)(16), infecciones sistémicas, hemoglobinopatías, consumo de café(16), otras deficiencias nutricionales, menometrorragias, insuficiencia renal crónica, la hipoxia de altura, o la hipoxemia producida por fumar o por cocinar con combustibles de biomasa (tabla 2).
Se ha definido diferentes marcadores para evaluar el contenido de hierro, como los niveles de ferritina sérica (FS), la concentración del receptor de transferrina soluble (sTfR) y el índice del receptor de transferrina (sTfR/log FS). Se diagnostica anemia ferropénica en la gestación cuando los niveles de ferritina sérica son <30 ng/mL(17).
El mejor marcador del contenido de hierro es la razón entre receptor de transferrina sérico y ferritina (sTfR/log. ferritina), diseñado para evaluar cambios en el hierro funcional y de reserva, resultando más útil que medir solo sTfR o ferritina sérica, dado que se afecta menos ante la inflamación.
La supresión de hepcidina en el segundo trimestre sugiere una ventana para la intervención con suplemento de hierro. La hepcidina resulta ser un mejor marcador de la homeostasis de hierro que la medición de hemoglobina que, per se, no es capaz de identificar la deficiencia de hierro durante el embarazo(18). Su aplicación en el país para la rutina diaria en el manejo de la anemia llevará aún un tiempo, pues se requiere estandarizar los ensayos de laboratorio para establecer valores normales de referencia. Sin embargo, en la actualidad, la medición de hepcidina está siendo útil para la investigación científica.
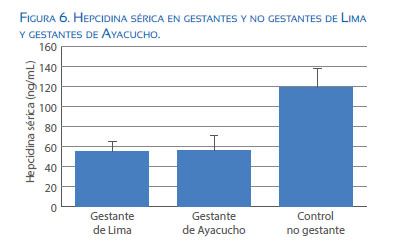
En la figura 6 se aprecia que los niveles de hepcidina son menores en gestantes que en no gestantes, pero no hay diferencias entre los valores de hepcidina séricas en gestantes residentes a baja altitud que aquellas residentes de la altura.
Cambios de parámetros hematológicos con el embarazo
La anemia es un estado final de la deficiencia de hierro. Los pasos iniciales de la deficiencia de hierro resultan en disminución de los niveles de ferritina sérica y aumento en los niveles del receptor soluble de transferrina (RsTf). Cuando la deficiencia de hierro persiste, se afecta la eritropoyesis.
Se ha demostrado que los estados iniciales de la alteración en la eritropoyesis se traducen en cambios detectables de la hemoglobina corpuscular media (MCH), la concentración de la hemoglobina corpuscular media (MCHC) y el volumen corpuscular medio (MCV) (19). Una alta sensibilidad (>70%) con una especificidad mayor de 40% en la predicción de la deficiencia de hierro se ha obtenido con puntos de corte de hemoglobina de 12,2 g/dL, MCV de 83,2 fl, MCH de 26,9 pg y MCHC de 33,2 g/dL(19). Estos valores deben ser confirmados para cada país y cada región dentro de un país. El hallazgo en una cantidad de estudios de que la anemia leve no afecta negativamente la salud materna ni del neonato(20) sugiere que la deficiencia de hierro sin anemia no estaría produciendo daño a la madre ni al feto o que tal vez los valores referenciales que se tienen en la actualidad no son los adecuados.
La anisocitosis se presenta como condición fisiológica en las gestantes(21). Se cuantifica por el cociente entre el coeficiente de variación de la distribución de los volúmenes de los eritrocitos (RDW) dividido por el volumen corpuscular medio (VCM), expresado en tanto por ciento.
El coeficiente de variación del ancho de la distribución de glóbulos rojos aumenta conforme avanza la gestación en un estudio(22), mientras en otro estudio en 220 gestantes no se observa esta diferencia(23). El ancho de distribución del eritrocito (RDW) es más alto en gestantes con preeclampsia que en normales, y es mayor en la preeclampsia severa que en la preeclampsia leve(24). El uso de RDW junto con VCM puede ser de mucha utilidad para el diagnóstico discriminatorio de los tipos de anemia.
La trombocitopenia o disminución en el número de plaquetas (< 150 × 109/L) es detectada en cerca de 10% de los embarazos. Se observa particularmente en el tercer trimestre(25). Esta trombocitopenia se denomina trombocitopenia gestacional (TG), siendo leve, y no necesita de un manejo activo ni introduce riesgo alguno de sangrado materno o fetal. Aunque la TG es común, no se conoce con certeza el mecanismo responsable de su presentación. Ahora se sabe que la disminución de las plaquetas con el embarazo es un patrón universal y se sugiere que la TG ocurre en aquellas gestantes cuyos valores basales de plaquetas se encuentran en el rango normal bajo(26).
Anemia o hemodilución
Las mujeres durante el embarazo sufren una serie de adaptaciones en muchos de los sistemas del organismo. Algunos de estos cambios son secundarios a modificaciones hormonales producto del embarazo, mientras que otros ocurren con la finalidad de apoyar a la mujer gestante y al feto en desarrollo. Algunos de los cambios en la fisiología materna durante el embarazo incluyen aumento en la grasa y en el agua total corporal, disminución en la concentración de proteínas -especialmente albúmina-, un aumento en el volumen sanguíneo materno, gasto cardiaco, flujo sanguíneo a los riñones y a la unidad uteroplacentaria, y disminución en la presión arterial.
La expansión del volumen sanguíneo materno ocurre en mayor proporción que el aumento en la masa eritrocitaria, resultando en ‘anemia por hemodilución’. Otros cambios fisiológicos incluyen el aumento del volumen corriente o tidal, una alcalosis respiratoria parcialmente compensada, retardo en el vaciamiento gástrico y movilidad gastrointestinal, y actividad alterada de las enzimas hepáticas que metabolizan drogas.
Durante el embarazo, ocurren cambios fisiológicos que resultan en ligera disminución en el conteo de plaquetas, disminución en la concentración de hemoglobina y del hematocrito conforme el volumen sanguíneo se expande en 40%(27).
La hemoglobina se reduce de manera fisiológica entre el segundo y tercer trimestres y luego recupera sus valores pregestacionales al final del tercer trimestre o al final del embarazo. Dada esta situación, se han establecido puntos de referencia de Hb para definir anemia en la gestante, que es diferente a la no gestante (Hb=12 g/dL). La OMS establece que, para diagnosticar anemia en gestantes en el segundo y tercer trimestres, los valores de Hb deben estar por debajo de 11 g/dL. LA CDC establece un valor de 10,5 g/dL en el segundo trimestre y 11 g/dL en el tercer trimestre.
La hemodilución fisiológica y un incremento de la hipercoagulabilidad se acompañan de alta agregación y rigidez de los glóbulos rojos durante el segundo trimestre, mientras que la viscosidad del plasma permanece sin afectarse durante el embarazo normal(28).
En la segunda mitad del embarazo se desarrolla una hipercoagulabilidad fisiológica, con aumento en la actividad de los factores de coagulación, agregación plaquetaria, y actividad disminuida y menores niveles sanguíneos de anticoagulantes fisiológicos, con la finalidad de implementar una adecuada homeostasis durante el trabajo de parto. Bajo estas condiciones, la hemodilución moderada es un mecanismo efectivo para prevenir el desarrollo de coagulación intravascular diseminada severa durante el trabajo de parto o durante una cirugía(29). Las interacciones entre las plaquetas y el factor de von Willebrand disminuyen en gestantes sanas en el tercer trimestre respecto a sus controles, un efecto que parece consecuencia de la hemodilución(30).
En diversos trabajos se ha demostrado que los valores de Hb en el segundo y tercer trimestres calificados como de anemia leve se asocian a los mejores resultados del embarazo(20). A las 32 a 34 semanas de gestación se ha observado 19,3% de casos de anemia leve y, de estos, el 65,3% tiene anemia normocrómica normocítica(2). Es probable que estos casos se refieran más a hemodilución que a una verdadera anemia.
La menor incidencia de peso bajo al nacer (<2,5 kg) y de parto pretérmino (<37 semanas de edad gestacional) ocurre en asociación con un nivel de hemoglobina de 95 a 105 g/L. Este rango considerado como anémico se puede estimar como óptimo cuando se asocian a valores de volumen corpuscular medio >84 fL(31).
Se ha postulado que la hemodilución facilita la perfusión placentaria debido a una reducida viscosidad. Esta hemodilución a su vez resulta en concentraciones más bajas de hemoglobina. La anemia por definición implica menor capacidad de transporte de oxígeno en la sangre, resultando en hipoxemia y más aún en hipoxia, que es un factor común de inducción de la formación de nuevos vasos sanguíneos. Es posible, que los bajos niveles de Hb en el rango de anemia leve durante el embarazo pueda promover la expresión de receptores de factores de crecimiento vascular como VEGFR-1 (Flt-1) y VEGFR-2 (FLK-1/ KDR). Consecuentemente, la mayor vasculogénesis y angiogénesis feto-placentaria produce mayor expansión de la red vascular, mayor perfusión placentaria, y por lo tanto ni la madre ni el feto se afectan negativamente(32).
En términos de intervención y tratamiento, es importante determinar cuándo se está frente a un verdadero cuadro de anemia y no de disminución de hemoglobina por hemodilución. Es probable que una gestante verdaderamente anémica trae el problema desde antes del embarazo, y que durante el mismo esta anemia se mantiene o puede agravarse. Se ha demostrado que la anemia, pero no los niveles altos de hemoglobina, antes del embarazo se asocia con un riesgo elevado de partos pretérmino, peso bajo al nacer y pequeño para edad gestacional, y este riesgo aumenta con la severidad de la anemia(33). Igualmente, la muerte fetal tardía es más baja cuando la concentración de hemoglobina se encuentra en el rango de anemia leve(29). Lamentablemente, no es posible tener los valores de hemoglobina pregestacional en la mayoría de las mujeres.
Aunque no ha sido demostrado, es probable que la anemia desde el primer trimestre de la gestación pueda reflejar un estatus persistente de una anemia pregestacional. La anemia (Hb<11 g/ dL) que se observa a partir de segundo y tercer trimestres puede más bien deberse a casos de hemodilución y debería acompañarse con valores normales de volumen corpuscular medio (VCM). Sin embargo, ello no descarta que también se presenten anemias verdaderas en el segundo y tercer trimestre. Por ello, la necesidad de contar con marcadores que permitan discriminar una anemia verdadera de una anemia por hemodilución fisiológica.
La anemia materna observada en el primer trimestre aumenta el riesgo de parto pretérmino; esta relación no es significativa en el segundo y tercer trimestres, indicando la importancia de la detección temprana de anemia, antes que estos casos se mezclen con los casos de hemoglobina baja (<11 g/dL) debido a hemodilución(34). Otro estudio muestra que la Hb alta en el primer trimestre se asocia a diabetes gestacional y a preeclampsia, en tanto que la Hb baja en el primer trimestre se asocia a parto pretérmino(35).
Obesidad y anemia
La obesidad es considerada una afección proinflamatoria caracterizada por la presencia de inflamación sistémica crónica de grado bajo(36). La inflamación relacionada con la obesidad puede conducir a un defecto de la disponibilidad del hierro similar a la anemia por inflamación infecciosa, donde la hepcidina se ha propuesto como mediador clave(37). Previamente, se ha demostrado que esta hormona se sobreexpresa en la obesidad y se correlaciona con un nivel bajo de hierro en personas obesas(36).
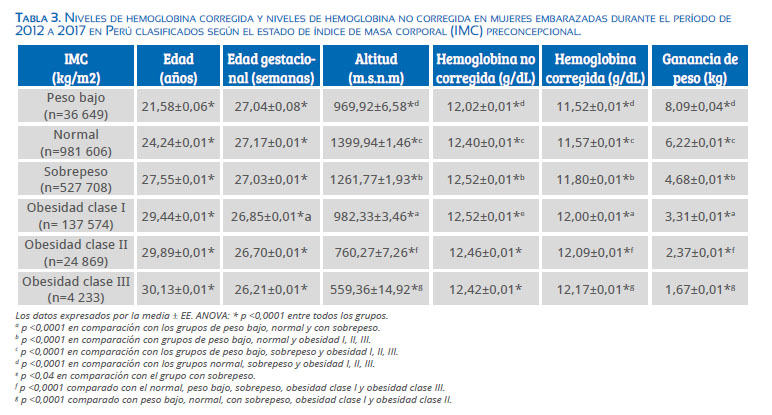
Las mujeres embarazadas obesas tienen menos probabilidades de tener anemia, pero sí mayor probabilidad de tener hemoconcentración(3). En nuestros hallazgos en Perú, las mujeres embarazadas con sobrepeso y obesidad tienden a aumentar los niveles de hemoglobina en comparación con las mujeres embarazadas de peso normal y peso bajo(38) (tabla 3). El mayor peso en la gestación, lejos de ser positivo para la gestante, es considerado un factor de riesgo, ya que se ha demostrado que, si se tiene un IMC elevado, hay riesgo elevado de sufrir anemia posparto(39).
En la tabla 3 se aprecia que los niveles de hemoglobina corregidos por la altura (altitud, metros sobre el nivel del mar m.s.n.m.) y la Hb no corregida en mujeres con obesidad son mayores que el de las mujeres con peso normal y bajo peso.
La mayoría de las poblaciones que viven a gran altitud han mostrado un aumento en la concentración de hemoglobina como resultado del aumento de la actividad eritropoyética como mecanismo para compensar la hipoxia tisular, consecuencia de la baja presión barométrica a la cual están sometidas(40,41). Sin embargo, también hay reducción del volumen plasmático(42,43), algo muy parecido a lo que sucede en mujeres embarazadas obesas (hemoconcentración).
A gran altura, la obesidad tendría un doble impacto en el aumento de la concentración de Hb, lo cual lleva a la gestante a una serie de complicaciones, y asimismo repercute sobre la salud del recién nacido. Este tópico de combinar obesidad y vida en las grandes alturas en la gestación ha sido poco estudiado y merece ser un tema donde se deban profundizar las futuras investigaciones.
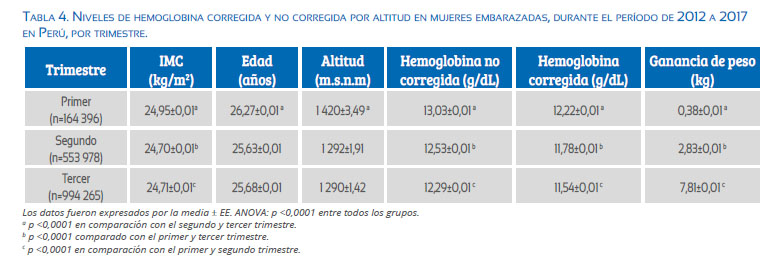
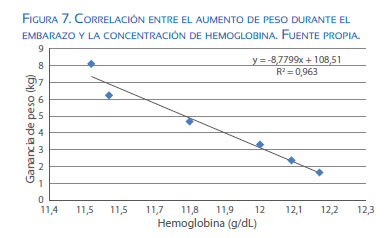
Respecto a la ganancia de peso durante el embarazo, se ha descrito que las gestantes obesas están asociadas a una menor ganancia de peso(44), ya que está relacionado con la disminución en el volumen sanguíneo, lo cual llevaría a producir hemoconcentración. Esta ha sido asociada a aumento en el riesgo de preeclampsia y de nacimiento de pequeños para edad gestacional(45), y un riesgo elevado de mortalidad materna y perinatal. En la tabla 4 se observa que las gestantes obesas aumentan solo la mitad del incremento de peso observado en las mujeres con IMC normal.
Asimismo, se ha visto que la ganancia de peso está correlacionada con disminución en los niveles de hemoglobina (figura 7).
Anemia Inflamatoria
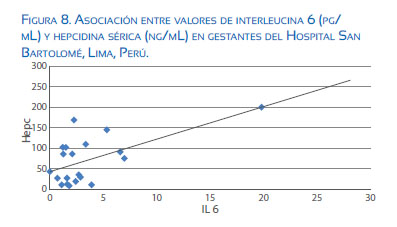
Estados inflamatorios, como en la preeclampsia, infección con malaria y obesidad, están asociados con niveles elevados de hepcidina en el embarazo, comparado con lo observado en gestantes sanas. Esto sugiere que la biodisponibilidad de hierro se encuentra comprometida en la inflamación(46,47). En la inflamación hay un aumento de la interleucina 6 (IL6), y esta es responsable de incrementar los niveles de hepcidina sérica (figura 8); con ello se internaliza la ferroportina que, al degradarse, no permite exportar el hierro de los enterocitos o de las zonas de reserva a la circulación, con lo cual disminuye la biodisponibilidad de hierro.
Los depósitos bajos en hierro pueden proteger de la infección con malaria. Por lo tanto, el mejorar los depósitos de hierro en el embarazo temprano puede aumentar la susceptibilidad a la malaria. En primigrávidas, la medición de la hemoglobina en el embarazo temprano no es un buen indicador del requerimiento de hierro, que más bien podría ser dañino dada la asociación entre mejor estatus de hierro con mayor infección por malaria(48).
La malaria en el embarazo se asocia con aumento en los niveles de citoquinas y quimiocinas proinflamatorias en la placenta y en la sangre periférica materna. Las respuestas inflamatorias sistémicas a la malaria durante el embarazo predicen un mayor riesgo de pérdidas en el embarazo y en parto pretérminos(49).
La hepcidina, mejor que el RsTf, identifica a la mujer embarazada con anemia inflamatoria. La anemia materna por deficiencia de hierro, pero no la anemia inflamatoria, se asocia con menores reservas de hierro en el neonato(50).
La relación neutrófilos/linfocitos (NLR) y plaquetas/linfocitos (PLR) son, ambas, marcadores inflamatorios fácilmente analizados a partir de un conteo de parámetros globulares en el hemograma. Estos marcadores ya son usados como factores pronósticos en varias disciplinas médicas. Se ha sugerido que pueden ser útiles para el caso de gestantes(51).
Otras causas de anemia
Según la OMS, este grupo heterogéneo de causas de anemia contribuye con aproximadamente 8% al total de anemias. Se encuentra anemia en deficiencias de micronutrientes, enfermedades trasmitidas hereditariamente y el cáncer.
Tenemos entre otras causas de anemia a los desórdenes hereditarios como, por ejemplo, las talasemias -que se caracterizan por reducción o supresión de la síntesis de algún tipo de las cadenas de globina (alfa o beta) de la hemoglobina(52)-, y el rasgo que produce anemia por hemólisis intravascular, que a su vez genera sobrecarga de hierro y estrés oxidativo(53).
Las deficiencias de ácido fólico y vitamina B12 (cobalamina) son causas de anemia (anemia megaloblástica). En una época donde la obesidad está incrementando, así como las tasas de cirugías bariátricas para reducir de peso, la deficiencia de cobalamina en el embarazo está aumentando. Esta deficiencia de cobalamina se debe a la reducción por acción de la cirugía bariátrica en el nivel de factor intrínseco que se produce en el estómago. Los bajos niveles maternos de cobalamina se asocian a restricción del crecimiento fetal, resistencia fetal a la insulina y exceso de adiposidad(54,55).
El folato (vitamina B9) tiene funciones importantes en los procesos celulares, como la biosíntesis de ácidos nucleicos, biogénesis de los grupos metilos y metabolismo de los aminoácidos. La detección y corrección de la deficiencia de folato previene la anemia megaloblástica y reduce el riesgo de defectos del tubo neural(56). La deficiencia de ácido fólico se asocia a defecto del tubo neural. Todo ello evidencia la importancia de detectar estos casos para lograr un embarazo con un producto, ambos normales(54). Para evitar los defectos del tubo neural se recomienda el tratamiento con ácido fólico previo al embarazo.
En el embarazo, el crecimiento fetal causa un aumento en el número total de células que rápidamente se están dividiendo, lo que lleva al incremento en los requerimientos de folato (vitamina B9). La falta de folato en la dieta conduciría a disminución en la concentración de folato en el eritrocito, elevación en la concentración de homocisteína, y cambios megaloblásticos en la médula ósea y otros tejidos con células en rápido crecimiento. A pesar de lo mencionado, un estudio sistemático no muestra evidencia concluyente de un beneficio de la suplementación con ácido fólico durante el embarazo sobre el resultado del mismo(57).
Otro estudio reciente de la base de datos Cochrane muestra un impacto positivo en la suplementación en el embarazo con multi micronutrientes con hierro y ácido fólico, reduciendo los partos de pequeños para edad gestacional y pretérminos en países de ingresos bajo y medio. No se observan efectos en países desarrollados(58). Es necesario resaltar que el exceso de folato también es dañino para la salud(56).
Niveles inadecuados de vitamina A (VA) durante la gestación también han sido asociados como causa de anemia y con el peso bajo al nacer(59).
Hemoglobina materna y resultado adverso materno y perinatal
Durante el embarazo existe una expansión del lecho vascular y con ello se produce hemodi lución y disminución en la concentración de la hemoglobina, particularmente en el segundo e inicios del tercer trimestre. Al final del embarazo se restituye el valor pregestacional y la concentración de hemoglobina se normaliza. Esta disminución de la concentración de hemoglobina genera menor viscosidad sanguínea por un lado y, por otro, mayor disponibilidad de óxido nítrico, lo que favorece el flujo uteroplacentario. Esto es importante para el crecimiento fetal.
En poblaciones a nivel del mar, la ausencia de esta disminución en la concentración de la hemoglobina en el embarazo temprano se asocia con resultados adversos, con aumento en la incidencia de preeclampsia, restricción en el crecimiento intrauterino, parto pretérmino y muerte fetal tardía(60-62).
Niveles altos de Hb a nivel del mar (>14,5 g/dL) en el primer trimestre se encuentran asociados con preeclampsia y diabetes mellitus gestacional(63). En otros estudios consideran como eritrocitosis a valores de Hb mayor de 13 g/dL. En los casos de preeclampsia se observa igual reducción en el flujo sanguíneo periférico(64). Si se asocia eritrocitosis con menor flujo útero placentario, se explicaría la restricción en el crecimiento que ocurre en la preeclampsia.
El aumento en el hierro sérico en mujeres preeclámpticas parece deberse a niveles bajos de hepcidina(12). La pregunta que se genera de este resultado es cuál es la señal para que la hepcidina baje más de lo usual durante un embarazo normal.
Un estudio longitudinal ha mostrado que reservas elevadas de hierro están involucradas en el desarrollo de la diabetes mellitus gestacional, aún tan temprano como el primer trimestre. Esto pone en cuestionamiento la recomendación de dar hierro de manera rutinaria a toda gestante, particularmente en aquellas que no son deficientes de hierro(65).
Estudios de metaanálisis sugieren que los niveles circulantes y los biomarcadores de hierro de la dieta en mujeres gestantes se asocian a diabetes mellitus gestacional. Como todo análisis sistemático y debido a la heterogeneidad en los análisis, se recomienda cautela en la interpretación de los datos, y más bien obliga al desarrollo de ensayos clínicos aleatorizados para investigar los beneficios de la reducción de hierro en mujeres con riesgo alto de diabetes mellitus gestacional(66).
En el caso de la anemia existe mucha discusión sobre si todos los casos de anemia materna, según la clasificación vigente (leve, moderada y severa), tienen impacto negativo en la madre o en el recién nacido y si todos deben ser tratados. Estudios llevados a cabo en Inglaterra han demostrado que la mínima incidencia de peso bajo al nacer (<2,5 kg) y de parto pretérmino (<37 semanas completas) ocurre en asociación con una concentración de hemoglobina de 9,5 a 10,5 g/ dL(31). Estos valores están en la categoría de anemia leve, por lo que pone en duda la necesidad de dar tratamiento con suplemento de hierro a las gestantes dentro de esta categoría de anemia.
Un análisis sistemático de 12 estudios que evalúan la asociación entre anemia materna y riesgo de pequeño para edad gestacional muestra que la anemia materna moderada y la severa, pero no la leve, se asocian con aumento en el riesgo de nacer pequeño para edad gestacional(20). En tanto, la anemia severa, pero no la moderada ni leve, fue factor de riesgo para morbilidad y mortalidad materna y neonatal(67,68).
Cuando se trata mujeres sin anemia o con anemia leve con suplementos conteniendo hierro, no se modifica la concentración de la hemoglobina en las mujeres posparto ni en sus infantes a los 6 o 12 meses de edad(69). Esta es una evidencia adicional de que la anemia leve no es patológica para la gestante, y ello se evidencia en la falta de respuesta a la intervención, indicando que los niveles de hepcidina se mantienen y con ello evitan el aumento de la absorción intestinal de hierro.
Igualmente, el estrés oxidativo aumenta significativamente por la administración diaria con hierro (60 a 120 mg) y produce un incremento excesivo de la concentración de hemoglobina en gestantes no anémicas(70), que podría deberse a falta de respuesta a la hepcidina o a que, durante el proceso de disminución de la hepcidina por efecto de la gestación, pueda ingresar más hierro de lo requerido. Esto debe ser estudiado con más profundidad.
En un estudio de intervención en gestantes no anémicas, la suplementación con hierro antes de las 16 semanas de gestación se asoció significativamente con un mayor riesgo de desarrollar hipertensión de novo, después de la semana 20 de gestación(71). Todo lo anterior sería evidencia de que la universalización del suplemento de hierro a toda gestante es innecesaria y puede exponer a riesgo a algunas de las gestantes, sobre todo si no son deficientes de hierro.
Un reciente estudio muestra que las gestantes con anemia severa y con anemia leve/moderada (HR ajustada 1,55; 1,05 a 2,31, y HR ajustada 1,13; 1,06 a 1,20; entre anemia severa y anemia leve/moderada vs. no anemia, respectivamente) presentan una asociación significativa con el porcentaje de hostilizaciones de sus hijos hasta los 18 años por enfermedades neurológicas(72). En la forma como se ha presentado el artículo en referencia no es posible discriminar el efecto diferenciado de la anemia moderada respecto de la anemia leve, dado que ambas han sido evaluadas como un solo grupo.
En otro artículo, estos mismos autores muestran una asociación entre fumar durante la gestación y morbilidad neurológica futura del hijo(73). En el Perú, la población de gestantes que fuman es bastante bajo, por lo que es posible no tenga un rol en la morbilidad neurológica. Sin embargo, dadas las características conductuales de la gestante peruana con las de otras partes del mundo, sugiere la necesidad de realizar un estudio similar para confirmar el rol de la anemia y su magnitud sobre la morbilidad neurológica futura de los hijos de gestantes anémicas.
En conclusión, se ha demostrado que el uso de la medición de la concentración de la hemoglobina como marcador para determinar anemia, a pesar de que es el más común, no es el más exacto y eficaz al momento de dar un correcto diagnóstico, por lo cual es importante evaluar otros marcadores del estatus del hierro, los cuales nos darán un diagnóstico correcto. Así mismo, es necesario tomar en cuenta la fisiología del embarazo para aprender a diagnosticar correctamente anemia en las gestantes. Medir el volumen plasmático de las gestantes ayudará a evitar malinterpretaciones en relación con la concentración de hemoglobina en gestantes con obesidad y sobrepeso, y de aquellas donde la concentración de la hemoglobina es baja por hemodilución, pues sus valores de VCM son normales.
Diferenciar el tipo de anemia, ya sea por deficiencia de hierro o por inflamación, es uno de los nuevos retos. El uso de marcadores inflamatorios basado en los parámetros medidos en los hemogramas por método automatizado es una excelente oportunidad para un diagnóstico más costo-efectivo y que permita identificar la inflamación. La hepcidina es el biomarcador para determinar la homeostasis del hierro y también de la inflamación; de esta manera, y en base a sus valores, se podría tener un uso controlado del consumo de hierro. Finalmente, es importante realizar mayor investigación para esclarecer y encontrar nuevos métodos que nos ayuden a un diagnóstico más eficaz de anemia durante la gestación.
Financiamiento: autofinanciado.
Conflicto de interés: Los autores señalan no tener ningún conflicto de intereses.
Citar como: Gonzales GF, Olavegoya P. Fisiopatología de la anemia durante el embarazo: ¿anemia o hemodilución? Rev Peru Ginecol Obstet. 2019;65(4):489-502. DOI: https://doi.org/10.31403/rpgo.v65i2210
Referencias Bibliográficas
1. Picciano M. Pregnancy and lactation: Physiological adjustments, nutritional requirements and the role of dietary supplements. J Nutr. 2003;133:1997S-2002S. DOI: 10.1093/jn/133.6.1997S. [ Links ]
2. Tunkyi K, Moodley J. Anemia and pregnancy outcomes: a longitudinal study. J Matern Fetal Neonatal Med. 2018;31(19):2594-8. DOI: 10.1080/14767058.2017.1349746. [ Links ]
3. Ribot B, Ruiz-Díez F, Abajo S, March G, Fargas F, Arija V. Prevalence of anaemia, risk of haemoconcentration and risk factors during the three trimesters of pregnancy. Nutr Hosp. 2018;35(1):123-30. DOI: 10.20960/nh.1045. [ Links ]
4. Chelchowska M, Laskowska-Klita T, Leibschang J. Concentration of ferritin, transferrin and iron as a markers of iron deficiency in healthy women in reproductive age. Pol Merkur Lekarski. 2007;22:25-7. [ Links ]
5. Kubik P, Leibschang J, Kowalska B, Laskowska-Klita T, Stanisławska A, Chełchowska M, Maciejewski T. Evaluation of iron balance in healthy pregnant women and their newborns. [Article in Polish] Ginekol Pol. 2010;81:358-63. PMID: 17477085.
6. Fisher AL, Nemeth E. Iron homeostasis during pregnancy. Am J Clin Nutr. 2017;106(6):1567S-74S. doi: 10.3945/ajcn.117.155812. [ Links ]
7. Ganz T, Nemeth E. Interactions with normal and disordered erythropoiesis. Cold Spring Harb Perspect Med. 2012;2:a011668. doi: 10.1101/cshperspect.a011668. [ Links ]
8. Fleming R, Ponka P. Iron overload in human disease. New Eng J Med. 2012;366:348-59. doi: 10.1056/NEJMra1004967. [ Links ]
9. Mukherji J. Iron deficiency anemia in pregnancy. Rational Drug Bull. 2002;12:2–5. [ Links ]
10. Guo Y, Zhang N, Zhang D, Ren Q, Ganz T, Liu S, Nemeth E. Iron homeostasis in pregnancy and spontaneous abortion. Am J Hematol. 2019;94(2):184-8. doi: 10.1002/ajh.25341. [ Links ]
11. Wessling-Resnick M. Excess iron: considerations related to development and early growth. Am J Clin Nutr. 2017;106(6):1600S-5S. doi: 10.3945/ajcn.117.155879. [ Links ]
12. Brunacci F, Rocha VS, De Carli E, Espósito BP, Ruano R, Colli C. Increased serum iron in preeclamptic women is likely due to low hepcidin levels. Nutr Res. 2018;53:32-9. doi: 10.1016/j.nutres.2018.03.005. [ Links ]
13. Gonzales GF, Tapia V, Fort AL. Maternal and perinatal outcomes in second hemoglobin measurement in nonanemic women at first booking: effect of altitude of residence in Peru. ISRN Obstet Gynecol. 2012;2012:368571. [ Links ]
14. Demuth IR, Martin A, Weissenborn A. Iron supplementation during pregnancy a cross-sectional study undertaken in four German states. BMC Pregnancy Childbirth. 2018;18(1):491. doi: 10.1186/s12884-018-2130-5. [ Links ]
15. Parisi F, di Bartolo I, Savasi VM, Cetin I. Micronutrient supplementation in pregnancy: Who, what and how much? Obstet Med. 2019; 12(1):5-13. doi: 10.1177/1753495X18769213. [ Links ]
16. Kumera G, Haile K, Abebe N, Marie T, Eshete T. Anemia and its association with coffee consumption and hookworm infection among pregnant women attending antenatal care at Debre Markos Referral Hospital, Northwest Ethiopia. PLoS One. 2018;13(11):e0206880. doi: 10.1371/journal.pone.0206880. [ Links ]
17. Breymann C, Honegger C, Hösli I, Surbek D. Diagnosis and treatment of iron-deficiency anaemia in pregnancy and postpartum. Arch Gynecol Obstet. 2017;296(6):1229-34. doi: 10.1007/s00404-017-4526-2. [ Links ]
18. Bah A, Pasricha SR, Jallow MW, Sise EA, Wegmuller R, Armitage AE, Drakesmith H, Moore SE, Prentice AM. Serum hepcidin concentrations decline during pregnancy and may identify iron deficiency: Analysis of a longitudinal pregnancy cohort in the Gambia. J Nutr. 2017;147(6):1131-7. doi: 10.3945/jn.116.245373. [ Links ]
19. Rabindrakumar M, Pujitha Wickramasinghe V, Gooneratne L, Arambepola C, Senanayake H, Thoradeniya T. The role of haematological indices in predicting early iron deficiency among pregnant women in an urban area of Sri Lanka. BMC Hematol. 2018;18:37. doi: 10.1186/s12878-018-0131-2. [ Links ]
20. Kozuki N, Lee AC, Katz J; Child Health Epidemiology Reference Group. Moderate to severe, but not mild, maternal anemia is associated with increased risk of small-for-gestational-age outcomes. J Nutr. 2012;142(2):358-62. doi: 10.3945/jn.111.149237. [ Links ]
21. Paliogiannis P, Zinellu A, Mangoni AA, Capobianco G, Dessole S, Cherchi PL, Carru C. Red blood cell distribution width in pregnancy: a systematic review. Biochem Med (Zagreb). 2018;28(3):030502. doi: 10.11613/BM.2018.030502. [ Links ]
22 2Li A, Yang S, Zhang J, Qiao R. Establishment of reference intervals for complete blood count parameters during normal pregnancy in Beijing. J Clin Lab Anal. 2017;31(6). doi: 10.1002/jcla.22150. [ Links ]
23. Amah-Tariah F, Ojeka S, Dapper D. Haematological values in pregnant women in Port Harcourt, Nigeria II: Serum iron and transferrin, total and unsaturated iron binding capacity and some red cell and platelet indices. Niger J Physiol Sci. 2011;26(2):173-8. PMID: 22547187. [ Links ]
24. Yılmaz Z, Yılmaz E, Küçüközkan T. Red blood cell distribution width: A simple parameter in preeclampsia. Pregn Hypertens. 2016;6(4):285-7. doi: 10.1016/j.preghy.2016.05.001.
25. Gebreweld A, Bekele D, Tsegaye A. Hematological profile of pregnant women at St. Paul's Hospital Millennium Medical College, Addis Ababa, Ethiopia. BMC Hematol. 2018;18:15. doi: 10.1186/s12878-018-0111-6. [ Links ]
26. Fogerty A. Thrombocytopenia in pregnancy: Mechanisms and management. Transfus Med Rev. 2018;32(4):225-9. doi: 10.1016/j.tmrv.2018.08.004. [ Links ]
Uchikova EH, Ledjev IL. Changes in haemostasis during normal pregnancy. Eur J Obstet Gynecol Reprod Biol. 2005;119:185–8. doi: 10.1016/j.ejogrb.2004.06.038.
27. Tsikouras P, Niesigk B, von Tempelhoff GF, Rath W, Schelkunov O, Daragó P, Csorba R. Blood rheology during normal pregnancy. Clin Hemorheol Microcirc. 2018;69(1-2):101-14. doi: 10.3233/CH-189104. [ Links ]
28. Buzyan L. Mild anemia as a protective factor against pregnancy loss. Int J Risk Saf Med. 2015;27 Suppl 1:S7-8. doi: 10.3233/JRS-150668. [ Links ]
29. Cowman J, Müllers S, Dunne E, Ralph A, Ricco AJ, Malone FD, Kenny D. Platelet behaviour on von Willebrand Factor changes in pregnancy: Consequences of haemodilution and intrinsic changes in platelet function. Sci Rep. 2017;7(1):6354. doi: 10.1038/s41598-017-06959-6. [ Links ]
30. Steer P. Maternal hemoglobin concentration and birth weight. Am J Clin Nutr. 2000;71(5):1285S-7S. doi: 10.1093/ajcn/71.5.1285s. [ Links ]
31. Stangret A, Skoda M, Wnuk A, Pyzlak M, Szukiewicz D. Mild anemia during pregnancy upregulates placental vascularity development. Med Hypotheses. 2017;102:37-40. doi: 10.1016/j.mehy.2017.03.007. [ Links ]
32. Yi SW, Han YJ, Ohrr H. Anemia before pregnancy and risk of preterm birth, low birth weight and small-for-gestational-age birth in Korean women. Eur J Clin Nutr. 2013;67(4):337-42. doi: 10.1038/ejcn.2013.12. [ Links ]
33. Rahmati S, MiladAzami, Parizad N, Sayehmiri K. The relationship between maternal anemia during pregnancy with preterm birth: a systematic review and meta-analysis. J Matern Fetal Neonatal Med. 2019 Apr 9:1-11. doi: 10.1080/14767058.2018.1555811. [ Links ]
34. Wang C, Lin L, Su R, Zhu W, Wei Y, Yan J, Feng H, Li B, Li S, Yang H. Hemoglobin levels during the first trimester of pregnancy are associated with the risk of gestational diabetes mellitus, pre-eclampsia and preterm birth in Chinese women: a retrospective study. BMC Pregn Childbirth. 2018;18(1):263. doi: 10.1186/s12884-018-1800-7. [ Links ]
35. Yanoff L, Menzie C, Denkinger B, Sebring N, McHugh T, Remaley A, et al. Inflammation and iron deficiency in the hypoferremia of obesity. Int J Obes (Lond). 2007;31(9):1412–9. doi: 10.1038/sj.ijo.0803625. [ Links ]
36. Villarroel P, Arredondo M, Olivares M. Anemia de las enfermedades crónicas asociada a obesidad: papel de la hepcidina como mediador central. Rev Med Chile. 2013;141:887-94. doi: 10.4067/S0034-98872013000700008. [ Links ]
37. Olavegoya P, Gonzales GF. Obesidad y anemia en mujeres embarazadas a baja y gran altitud. Rev Peru Investig Mat Perinat. 2018;7(1):18-23. doi: 10.33421/inmp.2018105. [ Links ]
38. Bodnar L, SIega-Riz A, Gogswell M. High prepregnancy BMI increases the risk of postpartum anemia.Obes Res. 2004;12:941–8. doi: 10.1038/oby.2004.115. [ Links ]
39. Gonzales GF. Hemoglobin and testosterone: importance on high altitude acclimatization and adaptation. Rev Peru Med Exp Salud Publica. 2011;28:92–100. doi: 10.1590/S1726-46342011000100015. [ Links ]
40. Gonzales GF, Tapia V, Gasco M. Correcting haemoglobin cut offs to define anaemia in high‐altitude pregnant women in Peru reduces adverse perinatal outcomes. Arch Gynecol Obstet. 2014;290(1):65–74. doi: 10.1007/s00404-014-3182-z. [ Links ]
41. Sanchez C, Merino C, Figallo M. Simultaneous measurement of plasma volume and cell mass in polycythemia of high altitude. J Appl Physiol. 1970.28:775–8. doi: 10.1152/jappl.1970.28.6.775. [ Links ]
42. Gonzales GF, Fano D, Vásquez-Velásquez C. Necesidades de investigación para el diagnóstico de anemia en poblaciones de altura. Rev Peru Med Exp Salud Publica. 2017;34(4):699708. doi: 10.17843/rpmesp.2017.344.3208. [ Links ]
43. Vricella L, Louis J, Chien E, Mercer B. Blood volume determination in obese and normal weight gravidas: The hydroxyethyl starch method. Am J Obstet Gynecol. 2015;213(3):408. e1-6. doi: 10.1016/j.ajog.2015.05.021. [ Links ]
44. Khoigani M, Goli S, Hasanzadeh A. The relationship of hemoglobin and hematocrit in the first and second half of pregnancy with pregnancy outcome. Iran J Nurs Midwifery Res. 2012;17(1):S165-70. PubMed PMID: 23833600; PubMed Central PMCID: PMC3696966.
45. Koenig M, Tussing-Humphreys L, Day J, Cadwell B, Nemeth E. Hepcidin and iron homeostasis during pregnancy. Nutrients. 2014;6(8):3062-83. doi: 10.3390/nu6083062. [ Links ]
46. Flores-Quijano M, Vega-Sánchez R, Tolentino-Dolores M, López-Alarcón M, Flores-Urrutia M, López-Olvera A, Talavera J. Obesity is associated with changes in iron nutrition status and its homeostatic regulation in pregnancy. Nutrients. 2019;11(3). pii: E693. doi: 10.3390/nu11030693.
47. Diallo S, Roberts SA, Gies S, Rouamba T, Swinkels DW, Geurts-Moespot AJ, Ouedraogo S, Ouedraogo GA, Tinto H, Brabin BJ. Malaria early in the first pregnancy: Potential impact of iron status. Clin Nutr. 2019 Jan 26. pii: S0261-5614(19)300342. doi: 10.1016/j.clnu.2019.01.016.
48. Fried M, Kurtis JD, Swihart B, Pond-Tor S, Barry A, Sidibe Y, Gaoussou S, Traore M, Keita S, Mahamar A, Attaher O, Dembele AB, Cisse KB, Diarra BS, Kanoute MB, Dicko A, Duffy PE. Systemic inflammatory response to malaria during pregnancy is associated with pregnancy loss and preterm delivery. Clin Infect Dis. 2017;65(10):1729-35. doi: 10.1093/cid/cix623. [ Links ]
49. Abioye A, Park S, Ripp K, McDonald E, Kurtis J, Wu H, PondTor S, Sharma S, Ernerudh J, Baltazar P, Acosta L, Olveda R, Tallo V, Friedman J. Anemia of inflammation during human pregnancy does not affect newborn iron endowment. J Nutr. 2018;148(3):427-36. doi: 10.1093/jn/nxx052. [ Links ]
50. Hershko Klement A, Hadi E, Asali A, Shavit T, Wiser A, Haikin E, Barkan Y, Biron-Shental T, Zer A, Gadot Y. Neutrophils to lymphocytes ratio and platelets to lymphocytes ratio in pregnancy: A population study. PLoS One. 2018;13(5):e0196706. doi: 10.1371/journal.pone.0196706. [ Links ]
51. Origa R, Comitini F. Pregnancy in Thalassemia. Mediterr J Hematol Infect Dis. 2019;11(1):e2019019. doi: 10.4084/MJHID.2019.019. [ Links ]
52. Aroke D, Tchouakam DN, Kadia BM, Choukem SP. Iron supplementation in pregnant sicklers: an opinion. BMC Pregnancy Childbirth. 2018;18(1):256. doi: 10.1186/s12884-018-1894-y. [ Links ]
53. Achebe MM, Gafter-Gvili A. How I treat anemia in pregnancy: iron, cobalamin, and folate. Blood. 2017;129(8):940-9. doi: 10.1182/blood-2016-08-672246. [ Links ]
54. Favre L, Ferrario C, Mantziari S, Suter M. Recommendations for monitoring nutritional deficiencies after bariatric surgery. Rev Med Suisse. 2019;15(643):626-30. PMID: 30892841. [ Links ]
55. Sobczyńska-Malefora A, Harrington DJ. Laboratory assessment of folate (vitamin B9) status. J Clin Pathol. 2018;71(11):949-56. doi: 10.1136/jclinpath-2018-205048.
56. Lassi ZS, Salam RA, Haider BA, Bhutta ZA. Folic acid supplementation during pregnancy for maternal health and pregnancy outcomes. Cochrane Database Syst Rev. 2013. doi: 10.1002/14651858.CD006896.pub2. [ Links ]
57. Keats E, Haider B, Tam E, Bhutta Z. Multiple-micronutrient supplementation for women during pregnancy. Cochrane Database Syst Rev. 2019; 3:CD004905. doi: 10.1002/14651858. CD004905.pub6. [ Links ]
58. Neves P, Castro M, Oliveira C, Malta M, Lourenço B, Cardoso M; MINA-Brazil Study Group. Effect of vitamin A status during pregnancy on maternal anemia and newborn birth weight: results from a cohort study in the Western Brazilian Amazon. Eur J Nutr. 2018. doi: 10.1007/s00394-018-1880-1. [ Links ]
59. Huisman A, Aarnoudse J. Increased 2nd trimester hemoglobin concentration in pregnancies later complicated by hypertension and growth retardation. Early evidence of a reduced plasma volume. Acta Obstet Gynecol Scand. 1986;65:605-8. doi: 10.3109/00016348609158396. [ Links ]
60. Murphy JF, O’Riordan J, Newcombe RG, Coles EC, Pearson JF. Relation of haemoglobin levels in first and second trimesters to outcome of pregnancy. Lancet.1986;i:992-5. doi: 10.1016/s0140-6736(86)91269-9.
61. Stephansson O, Dickman P, Johansson A, Cnattingius S. Maternal hemoglobin concentration during pregnancy and risk of stillbirth. JAMA. 2000;284:2611-7. doi: 10.1001/jama.284.20.2611. [ Links ]
62. Gonzales GF, Steenland K, Tapia V. Maternal hemoglobin level and fetal outcome at low and high altitudes. Am J Physiol Regul Integr Comp Physiol. 2009;297(5):R1477-85. doi: 10.1152/ajpregu.00275.2009. [ Links ]
63. Phaloprakarn C, Tangjitgamol S. Impact of high maternal hemoglobin at first antenatal visit on pregnancy outcomes: a cohort study. J Perinat Med 2008;36:115-9. doi:10.1515/JPM.2008.018. [ Links ]
64. Rawal S, Hinkle SN, Bao W, Zhu Y, Grewal J, Albert PS, Weir NL, Tsai MY, Zhang C. A longitudinal study of iron status during pregnancy and the risk of gestational diabetes: findings from a prospective, multiracial cohort. Diabetologia. 2017;60(2):249-57. doi: 10.1007/s00125-016-4149-3. [ Links ]
65. Kataria Y, Wu Y, Horskjær P, Mandrup-Poulsen T, Ellervik C. Iron status and gestational diabetes-A meta-analysis. Nutrients. 2018;10(5). pii: E621. doi: 10.3390/nu10050621.
66. Wylie B. Severe maternal anaemia, a missed opportunity for prevention. BJOG. 2019. doi: 10.1111/1471-0528.15613. [ Links ]
67. Parks S, Hoffman MK, Goudar SS, Patel A, Saleem S, Ali SA, Goldenberg RL, Hibberd PL, Moore J, Wallace D, McClure EM, Derman RJ. Maternal anaemia and maternal, fetal, and neonatal outcomes in a prospective cohort study in India and Pakistan. BJOG. 2018. doi: 10.1111/1471-0528.15585. [ Links ]
68. Serdula M, Zhou Y, Li H, Liu J, Mei Z. Prenatal iron containing supplements provided to Chinese women with no or mild anemia had no effect on hemoglobin concentration in post-partum women or their infants at 6 and 12 months of age. Eur J Clin Nutr. 2018. doi: 10.1038/s41430-018-0365-x. [ Links ]
69. Viteri F, Casanueva E, Tolentino MC, Díaz-Francés J, Erazo AB. Antenatal iron supplements consumed daily produce oxidative stress in contrast to weekly supplementation in Mexican non-anemic women. Reprod Toxicol. 2012;34:125-32. doi: 10.1016/j.reprotox.2012.03.010. [ Links ]
70. Jirakittidul P, Sirichotiyakul S, Ruengorn C, Techatraisak K, Wiriyasirivaj B. Effect of iron supplementation during early pregnancy on the development of gestational hypertension and pre-eclampsia. Arch Gynecol Obstet. 2018;298(3):54550. doi: 10.1007/s00404-018-4821-6. [ Links ]
71. Wainstock T, Walfisch A, Sergienko R, Sheiner E. Maternal anemia and pediatric neurological morbidity in the offspring Results from a population based cohort study. Early Hum Dev. 2019;128:15-20. doi: 10.1016/j.earlhumdev.2018.11.002. [ Links ]
72. Gutvirtz G, Wainstock T, Landau D, Sheiner E. Maternal smoking during pregnancy and long-term neurological morbidity of the offspring. Addict Behav. 2019;88:86-91. doi: 10.1016/j.addbeh.2018.08.013. [ Links ]
Correspondencia:
Dr. Gustavo F. Gonzales
Universidad Peruana Cayetano Heredia.
Av. Honorio Delgado 430. Lima 31, Perú
3190000 anexo 2535
Recibido: 4 mayo 2019
Aceptado: 15 mayo 2019
Publicación online: 14 noviembre 2019