Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Ginecología y Obstetricia
versión On-line ISSN 2304-5132
Rev. peru. ginecol. obstet. vol.65 no.4 Lima oct./dic. 2019
http://dx.doi.org/10.31403/rpgo.v65i2211
SIMPOSIO ANEMIA EN LA GESTACIÓN
Anemia fetal, diagnóstico y manejo actual
Fetal anemia, current diagnosis and management
Erasmo Huertas Tacchino1
1. Médico Cirujano, Especialista en Gineco-Obstetricia, Docente Universidad Nacional Mayor de San Marcos, Lima, Perú
ABSTRACT
Fetal anemia is a rare condition that can be potentially lethal to the fetus, unless timely diagnosis and management take place. Etiology varies from autoimmune (Rh isoimmunization) to infectious (parvovirus B19) disorders, hemoglobinopathies, fetal-maternal hemorrhage and complications of monochorionic pregnancies. Diagnosis may be by invasive (cordocentesis) or non-invasive (medial cerebral artery peak systolic velocity – MCA-PSV) methods, although the latter is preferred. Treatment consisting in intrauterine transfusion achieves a survival of up to 90% without neurological sequelae. This article reviews the definition, classification, etiology, diagnosis and updated management of fetal anemia.
Key words: Fetal anemia, Ultrasonography, Doppler.
RESUMEN
La anemia fetal es una condición poco frecuente en nuestro medio, pero potencialmente letal para el feto, si no se diagnostica y maneja oportunamente. Las causas son diversas, desde autoinmunes (isoinmunización Rh) a infecciosas (parvovirus B19), hemogobinopatías, hemorragia feto materna y complicaciones del embarazo monocoriónico. El diagnóstico puede ser por métodos invasivos (cordocentesis) o no invasivos (pico de velocidad sistólica de la arteria cerebral media – PVS-ACM), aunque se prefiere los últimos. El tratamiento consiste en la transfusión intrauterina, la cual permite sobrevida hasta en 90% de casos, sin secuelas neurológicas. El presente artículo revisa aspectos acerca de la definición, clasificación, causas, diagnóstico y manejo actualizado de la anemia fetal.
Palabras clave. Anemia fetal, Ultrasonografía, Doppler.
Introducción
La anemia fetal es una causa importante de morbimortalidad fetal y neonatal. Puede pasar desapercibida al examen ecográfico si es leve o moderada, a menos que existan criterios de sospecha por los antecedentes maternos (factor Rh negativo, hemoglobinopatías). En la actualidad, el diagnóstico y manejo de esta patología ha revolucionado el pronóstico perinatal alcanzando tasas de sobrevida de hasta 90%.
Definición
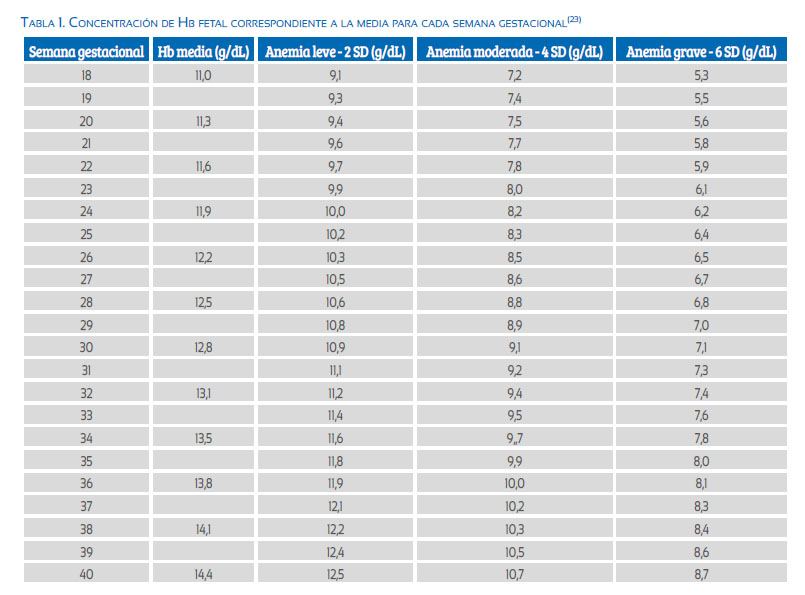
En la actualidad existen hasta 3 definiciones de anemia fetal. Una es la propuesta por Mari, en base a los múltiplos de la mediana (MoM): disminución de la concentración de hemoglobina <0,84 MoM con respecto a la media poblacional(1). Otra es en base a las desviaciones estándar (DE) de la hemoglobina del promedio esperado para la edad gestacional; según esta definición, disminuciones mayores o iguales a -2 DE hacen el diagnóstico(2). La tercera fue propuesta por Nicolaides en 1998(3), que la define como disminuciones mayores o iguales a 2,0 g/dL respecto al promedio para la edad gestacional.
La diferencia entre la primera y la segunda definición es de aproximadamente 0,5 g/dL, siendo los valores menores cuando usamos DE.
Si no se puede medir la hemoglobina, podemos utilizar el hematocrito; valores <30% indican anemia(4).
La concentración de hemoglobina (Hb) en el feto normalmente aumenta con el embarazo (tabla 1), de 11 g/dL a las 11 semanas a 14 g/dL a las 40 semanas.
Clasificación
La anemia fetal se puede clasificar de acuerdo al grado de desviaciones estándar de la media para la edad gestacional:
-
Anemia leve: -2 a –3,9 DE
-
Anemia moderada: -4 a –5,9 DE
-
Anemia severa: -6 o más DE
Causas de anemia fetal
Existen dos causas de anemia fetal:
-
Causa inmune: isoinmunización Rh
-
Causa no inmune, con diversas etiologías:
-
Infecciosa: parvovirus B-19
-
Anemias hereditarias: talasemia alfa
-
Desórdenes de la médula ósea: anemia de Fanconi
-
Malignidades hematopoyéticas: leucemia congénita
-
Patología placentaria: corioangioma, displasia mesenquimal placentaria
-
Hemorragia fetomaterna: desprendimiento prematuro de la placenta, traumatismo
-
Desórdenes genéticos raros: mucopolisacaridosis
-
Complicaciones del embarazo monocorial: secuencia anemia policitemia
-
Tumores fetales: teratoma sacrococcígeo, hemangioma hepático,
-
En Perú, según los trabajos publicados, la incidencia de factor Rh negativo es 0,68% en la población general(5) y 0,21% en gestantes que acuden al Instituto Nacional Materno Perinatal(6). Por esta razón, la anemia fetal de causa autoinmune no es la más frecuente en nuestro medio; sin embargo, no debemos descartarla. Tampoco existen, hasta la fecha, reportes nacionales de prevalencia de las diversas causas autoinmunes de anemia fetal; pero, teniendo en cuenta la diversidad de las mismas, consideramos que agregadas constituyen la causa más frecuente.
Diagnóstico de anemia fetal
El diagnóstico de anemia fetal debe iniciarse como una sospecha en pacientes de riesgo de desarrollarla, como son las mujeres Rh negativas, con hemoglobinopatías o desórdenes genéticos conocidos. Asimismo, el hallazgo ultrasonográfico de anomalías placentarias o la presencia de tumores fetales o embarazo múltiple de tipo monocoriónico es otro de los criterios de sospecha que amerita la referencia de esta gestante a un tercer nivel de atención que cuente con especialistas en diagnóstico y terapia prenatal.
La ecografía en modo B nos permite evaluar la existencia de hepato/esplenomegalia, como uno de los primeros hallazgos ecográficos en fetos anémicos. En 1989, Roberts(7) concluye que la longitud del hígado fetal >p90 se correlaciona con la anemia fetal y, posteriormente, Oepkes(8) encuentra la misma asociación con la esplenomegalia (perímetro del bazo >2 DE). Un signo más avanzado es la presencia de ascitis, derrame pericárdico, hidrotórax y/o edema del tejido celular subcutáneo, que finalmente lleva a hidropesía fetal, lo cual nos indica niveles de hemoglobina fetal por debajo de 5 g/dL(9). El edema placentario, el polihidramnios y el aumento del diámetro de la vena umbilical son también hallazgos ecográficos asociados al diagnóstico de anemia fetal, aunque no tienen valor pronóstico.
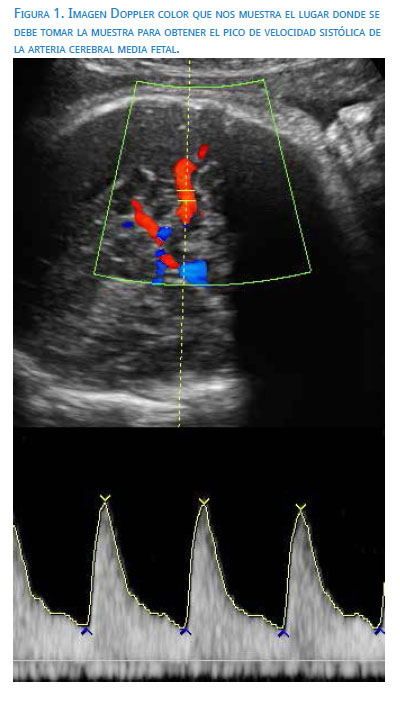
La ecografía Doppler de la arteria cerebral media (ACM) fue la que revolucionó el diagnóstico y manejo de la anemia fetal. Mari y colaboradores(1) demostraron que el pico de velocidad sistólica (PVS) de la ACM >1,50 MoM detectaba a 100% de los casos de anemia fetal moderada a severa, con una tasa de falsos positivos de 12%. Esta metodología demostró ser superior al espectro fotometría y determinación del ΔDO450 en el líquido amniótico, por lo que la amniocentesis para el tamizaje de anemia fetal ha quedado en desuso(10).
La metodología para la obtención del PVS-ACM requiere el cumplimiento de algunos aspectos técnicos que aseguren la calidad del registro; estos son(11)(figura 1):
-
El feto necesita estar en periodo de reposo (sin respirar ni moviéndose)
-
Cabeza fetal en plano transverso (DBP)
-
Se identifica el polígono de Willis con Doppler color
-
Se hace un aumento del área de la ACM, de modo que ocupe más del 50% de la pantalla
-
La ACM debe ser visualizada en toda su longitud
-
El volumen de muestra (1 mm) se ubica inmediatamente después del origen de la ACM de la carótida interna (1 a 2 mm)
-
El ángulo entre la dirección del flujo sanguíneo y el haz de ultrasonido debe ser lo más cercano posible a cero y siempre <30º. No se debe utilizar el corrector de ángulo
-
Las ondas (entre 3 y 5) deben ser similares entre sí. Se mide el PSV más alto
-
Repita los pasos antes señalados tres veces.
La corrección del ángulo, así como la toma de la muestra en regiones distales de la ACM, resultan en mayor variabilidad inter e intraobservador(12).
El diagnóstico definitivo de anemia fetal es mediante la cordocentesis, que es un procedimiento invasivo, al cual debemos llegar luego de obtener valores de PVS-ACM por encima de 1,50 MoM en forma constante. La cordocentesis mide directamente la hemoglobina fetal de la sangre del cordón umbilical y además permite el recuento de reticulocitos y células nucleadas, así como la bilirrubina sérica y los gases arteriales.
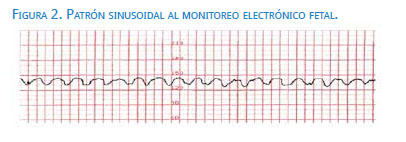
El monitoreo electrónico fetal permite detectar alteraciones en la frecuencia cardíaca fetal, como el patrón sinusoidal (figura 2), pero solo en casos de anemia fetal severa, ya que en la gran mayoría de fetos con anemia moderada se observa un patrón normal (reactivo)(13).
Manejo de la anemia fetal
Si la anemia es leve, se puede continuar el embarazo hasta las 37 o 38 semanas e inducir el parto, siempre y cuando no existan contraindicaciones obstétricas.
Si la anemia fetal es moderada a severa (Hto < 30% o Hb < 2 DE por debajo de la media para la edad gestacional), se indica transfusión intrauterina bajo guía ecográfica directa con aguja 20-22 G.
Los objetivos de la transfusión intrauterina son:
-
Prevenir la muerte fetal por anemia severa
-
Permitir la continuación del embarazo hasta un estadio en que el feto sea viable (idealmente 36 semanas)
-
Elevar el hematocrito fetal hasta 45%.
En cuanto al donante, este puede ser anónimo, un familiar materno o incluso la misma madre.
Se prefiere al familiar materno para disminuir el riesgo de enfermedad injerto-huésped. Sin embargo, si la Hb materna es mayor de 12, también se puede utilizar sangre materna previamente lavada, lo cual elimina el riesgo de sensibilización a nuevos antígenos de los glóbulos rojos.
Las características de la sangre a transfundir serán:
-
Hematocrito entre 70 y 85%
-
Anticoagulada con CPD (citrato-fosfato-dextrosa)
-
Leucodepletada
-
Menos de 5 dias de recolectada (vs hiperkalemia)
-
Anticuerpos anti citomegalovirus (CMV) negativos (básicamente IgM)
-
Irradiada (para prevenir enfermedad injerto-huésped)
-
Usualmente grupo O (o ABO idéntica al feto)
-
RhD y Kell negativa
-
Compatible con el plasma materno (prueba cruzada previa a la transfusión).
Se recomienda tener disponibles plaquetas si se sospecha infección por parvovirus B19 o CMV, ya que existen reportes de trombocitopenia severa en este tipo de infecciones fetales(14,15).
Transfusión Intrauterina
Preparación materna: 48 horas previas a la transfusión, la madre debe recibir corticoides prenatales (dexao betametasona), si la edad gestacional es entre 24 y 34 semanas. Debe permanecer en ayuno mínimo 6 horas antes de ingresar a la sala de operaciones y se le pueden administrar antibióticos (cefazolina 1 g EV) una hora antes del procedimiento(16). El objetivo de realizar el procedimiento en sala de operaciones es estar preparado para realizar una cesárea de urgencia si tiene lugar una complicación del procedimiento. Se recomienda sedación materna con midazolam o remifentanilo endovenoso y preparar el abdomen igual que para una cesárea (asepsia, antisepsia y colocación de campos estériles). El desplazamiento del útero hacia la izquierda evita la compresión aorto-cava.
Preparación fetal: se recomienda la administración de vecuronium u otro agente paralizante al feto en forma directa, para reducir el riesgo de complicaciones debidas a los movimientos fetales(17).
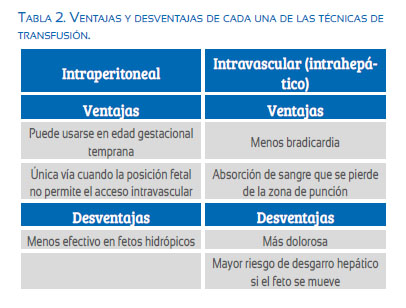
Elección del lugar de acceso: se prefiere la transfusión intravascular (TIV) a la intraperitoneal, debido a la mayor tasa de supervivencia(18), y se prefiere la vena umbilical (a nivel de su inserción placentaria) a la arteria umbilical, por su fácil acceso y menor incidencia de bradicardia(17).
Sin embargo, a edades gestacionales menores a 22 semanas, debido al reducido diámetro de la vena umbilical, se recomienda la transfusión intraperitoneal(19); así también en casos donde no es posible el acceso al cordón umbilical debido a la posición fetal o a placenta posterior.
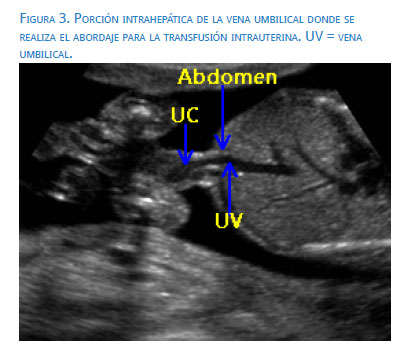
Otra técnica utilizada es la punción de la porción intrahepática de la vena umbilical (figura 3). Su elección dependerá de la experiencia y preferencia del operador(19), aunque hay quienes señalan que tiene tasas de éxito de 90% y menor incidencia de hemorragia fetomaterna(20). Es particularmente útil en casos de embarazos múltiples y a edades gestacionales avanzadas, cuando la placenta es posterior.
La tabla 2 muestra las ventajas y desventajas de cada una de las técnicas de transfusión.
El cálculo del volumen de sangre por transfundir se realiza mediante fórmulas que toman en cuenta diferentes variables, las cuales dependen del autor de la misma. Nosotros utilizamos y recomendamos la de Rodeck(21), la misma que se encuentra en la página web www.perinatology.com/protocols/rhc.htm y que toma en consideración el peso fetal estimado, el hematocrito del donante, el hematocrito fetal pretransfusión y, finalmente, el hematocrito al cual queremos llegar. La velocidad de transfusión es de 3 a 5 mL/min y al final de esta se aspira un mililitro de sangre para determinar el hematocrito fetal final.
Antes de las 24 semanas, el objetivo es llevar el hematocrito a 25, mientras que después de las 24 semanas se lleva a 45%.
En caso de transfusiones intraperitoneales, los cálculos son diferentes, ya que el objetivo es transfundir el máximo volumen de glóbulos rojos sin aumentar la presión intraabdominal, para que no comprometa el flujo sanguíneo venoso umbilical. La fórmula es la propuesta por Bowman(22), que consiste en restar 20 a la edad gestacional en semanas y multiplicarlo por 10. En casos de fetos de 20 semanas o menos, se recomienda transfundir solo 5 a 10 mL(16).
Dos horas después de finalizado el procedimiento, se indica una prueba no estresante (NST) para monitorizar el bienestar fetal, y 24 horas después una ecografía, ya que la mayoría de las muertes fetales atribuibles al procedimiento ocurre en este periodo.
Transfusiones subsecuentes
El momento de realizar las siguientes transfusiones puede basarse en métodos empíricos, como el propuesto por Moise(4), quien sugiere realizar la segunda 10 días después de la primera, la tercera dos semanas después y la cuarta tres semanas después de la primera; o teniendo en cuenta la velocidad de caída de la hemoglobina (0,4 g/dL/día)(23) o del hematocrito (1% por día)(24). Esto en razón que la VPS-ACM >1,5 MoM no sirve luego de la transfusión de glóbulos rojos adultos, ya que estos tienen menor viscosidad.
Momento del parto
Lo habitual es inducir el trabajo de parto tres semanas después de la última transfusión, generalmente a las 37 semanas, a menos que existan contraindicaciones obstétricas.
Resultados perinatales
A corto plazo: la tasa de supervivencia promedio es 84%, 70% en fetos hidrópicos y 94% en no hidrópicos(25).
A largo plazo: según el estudio LOTUS (long term follow-up after intrauterine transfusions), a los 8,2 años de edad la tasa de retardo severo en el neurodesarrollo es 3,1%, retardo psicomotor severo aislado es 1,7%, parálisis cerebral aislada 0,7%, sordera bilateral aislada 0,1% y las cuatro juntas 4,8%(26). El factor de riesgo más importante para este resultado adverso fue la presencia de hidropesía fetal severa. Otros autores señalan que la infección por parvovirus B19 sería el predictor más importante de retardo en el neurodesarrollo, debido a la neurotoxicidad viral(27).
En conclusión, la anemia fetal es la disminución de la concentración de hemoglobina por debajo de 2 desviaciones estándar o ≤0,84 MoM con respecto a la media poblacional.
El PVS-ACM parece ser la mejor de las pruebas para el diagnóstico no invasivo de la anemia fetal. Valores mayores o iguales a 1,50 MoM del PVS-ACM para la edad gestacional, se correlacionan con anemia fetal moderada a severa.
El diagnóstico definitivo de anemia fetal es mediante la cordocentesis, que es un procedimiento invasivo, que no está exento de riesgos.
El manejo de la anemia fetal severa implica la transfusión intrauterina de sangre hemoconcentrada, leucodepletada, fresca e irradiada.
El parto debe inducirse 3 semanas después de la última transfusión, generalmente a las 37 semanas.
El pronóstico actual de los fetos anémicos tratados mediante transfusión intrauterina es bueno, ya que la tasa de supervivencia llega hasta 94% en fetos no hidrópicos, con un neurodesarrollo normal hasta en 95% de los mismos.
Financiamiento: Autofinanciado.
Conflicto de interés: El autor señala no tener ningún conflicto de interés.
Citar como: Huertas E. Anemia fetal, diagnóstico y manejo actual. Rev Peru Ginecol Obstet. 2019;65(4):511-517. DOI: https://doi.org/10.31403/rpgo.v65i2211
Referencias Bibliográficas
1. Mari G. Noninvasive diagnosis by Doppler ultrasonography of fetal anemia due to maternal red-cell alloimmunization. N Engl J Med. 2000;342:9-14. DOI:10.1056/NEJM200001063420102. [ Links ]
2 Scheier M, Hernandez-Andrade E, Carmo A, Dezerega V, Nicolaides KH. Prediction of fetal anemia in rhesus disease by measurement of fetal middle cerebral artery peak systolic velocity. Ultrasound Obstet Gynecol. 2004;23(5):432-6. DOI:10.1002/uog.1010. [ Links ]
3. Nicolaides KH, Soothill PW, Clewell WH, Rodeck CH, Mibashan RS, Campbell S. Fetal haemoglobin measurement in the assessment of red cell isoimmunisation. Lancet. 1988;1:1073– 5. DOI:10.1016/s0140-6736(88)91896-x. [ Links ]
4. Moise KJ, Argoti PS. Management and prevention of red cell alloimmunization in pregnancy: a systematic review. Obstet Gynecol. 2012;120:1132–9. [ Links ]
5. Quispe P, León E, Parreño JM. Frecuencia de los sistemas ABO y RH en personas que acudieron al servicio académico asistencial de análisis clínicos. Ciencia e Investigación (Fac Farm Bioquim UNMSM). 2008;11(1):42-9. [ Links ]
6. Gallo MK. Isoinmunización RH: factores de riesgo y principales complicaciones fetales y neonatales en el Instituto especializado Materno Perinatal durante el periodo 2001-2003. Tesis para optar Título Profesional de Licenciado en Obstetricia. UNMSM. Lima – Perú. 2004. [ Links ]
7. Roberts AB, Mitchell JM, Pattison NS. Fetal liver length in normal and isoimmunized pregnancies. Am J Obstet Gynecol. 1989;161: 42–6. DOI:10.1016/0002-9378(89)90229-9. [ Links ]
8. Oepkes D, Meerman RH, Vandenbussche FP, van Kamp IL, Kok FG, Kanhai HH. Ultrasonographic fetal spleen measurements in red blood cell-alloimmunized pregnancies. Am J Obstet Gynecol. 1993;169:121–8. DOI: 10.1016/0002-9378(93)90145-9. [ Links ]
9. Nicolaides KH, Thilaganathan B, Rodeck CH, Mibashan RS. Erythroblastosis and reticulocytosis in anemic fetuses. Am J Obstet Gynecol. 1988;159:1063–5. DOI:10.1016/00029378(88)90413-9. [ Links ]
10. Oepkes D, Seaward PG, Vandenbussche FP, Windrim R, Kingdom J, Beyene J, Kanhai HH, Ohlsson A, Ryan G. Doppler ultrasonography versus amniocentesis to predict fetal anemia. N Engl J Med. 2006;355:156–64. DOI: 10.1056/NEJMoa052855. [ Links ]
11. Moise KJ Jr. The usefulness of middle cerebral artery Doppler assessment in the treatment of the fetus at risk for anemia. Am J Obstet Gynecol. 2008;198:161.e1-e4. DOI: https://doi.org/10.1016/j.ajog.2007.10.788. [ Links ]
12. Mari G, Abuhamad AZ, Cosmi E, Segata M, Altaye M, Akiyama M. Middle cerebral artery peak systolic velocity: technique and variability. J Ultrasound Med. 2005;24:425–30. DOI:10.7863/jum.2005.24.4.425. [ Links ]
13. Madonlou H, Murata Y. Sinusoidal heart rate pattern: Rea- ppraisal of its significance. J Obstet Gynecol Res. 2004;30:169- 80. [ Links ]
14. Saade GR, Moise KJ, Jr, Copel JA, Belfort MA, Carpenter RJ, Jr. Fetal platelet counts correlate with the severity of the anemia in red-cell alloimmunization. Obstet Gynecol. 1993;82:987– 91. [ Links ]
15. de Haan TR, van den Akker ES, Porcelijn L, Oepkes D, Kroes AC, Walther FJ. Thrombocytopenia in hydropic fetuses with parvovirus B19 infection: incidence, treatment and correlation with fetal B19 viral load. BJOG. 2008;115:76–81. DOI:10.1111/j.1471-0528.2007.01555.x. [ Links ]
16. Moise KJ. Intrauterine transfusion of red cells. UpToDate. Last actualization November 28, 2018. [ Links ]
17. Van Kamp IL, Klumper FJ, Oepkes D, Meerman RH, Scherjon SA, Vandenbussche, FP, Kanhai HH. Complications of intrauterine intravascular transfusion for fetal anemia due to maternal red-cell alloimmunization. Am J Obstet Gynecol. 2005;192:171–7.DOI:10.1016/j.ajog.2004.06.063. [ Links ]
18. Dodd JM, Windrim RC, van Kamp IL. Techniques of intrauterine fetal transfusion for women with red-cell isoimmunisation for improving health outcomes. Cochrane Database Syst Rev 2012. DOI: 10.1002/14651858.CD007096.pub3. [ Links ]
19. Abbasi N, Johnson JA Ryan G. Fetal anemia. Editorial. Ultrasound Obstet Gynecol. 2017;50:145-53. doi: 10.1002/uog.17555. [ Links ]
20. Nicolini U, Nicolaidis P, Fisk NM, Tannirandorn Y, Rodeck CH. Fetal blood sampling from the intrahepatic vein: analysis of safety and clinical experience with 214 procedures. Obstet Gynecol. 1990;76:47–53. [ Links ]
21. Rodeck CH, Nicolaides KH, Warsof SL, Fysh WJ, Gamsu HR, Kemp JR. The management of severe rhesus isoimmunization by fetoscopic intravascular transfusions. Am J Obstet Gynecol. 1984;150(6):769-74. DOI: 10.1016/0002-9378(84)90683-5. [ Links ]
22. Bowman JM. The management of Rh-isoimmunization. Obstet Gynecol. 1978;52:1. [ Links ]
23. Scheier M, Hernandez-Andrade E, Fonseca EB, Nicolaides KH. Prediction of severe fetal anemia in red blood cell alloimmunization after previous intrauterine transfusions. Am J Obstet Gynecol. 2006;195:1550–6. DOI:10.1016/j.ajog.2006.03.060. [ Links ]
24. Lobato G, Soncini CS. Fetal hydrops and other variables associated with the fetal hematocrit decrease after the first intrauterine transfusion for red cell alloimmunization. Fetal DiagnTher. 2008;24:349–52. doi: 10.1159/000162181. [ Links ]
25. Zwiers C, Oepkes D, Lopriore E, Klumper FJ, de Haas M, van Kamp IL. The near disappearance of fetal hydrops in relation to current state-of-the-art management of red cell alloimmunization. Prenat Diagn. 2018;38:943. doi: 10.1002/pd.5355. [ Links ]
26. Lindenburg IT, Smits-Wintjens VE, van Klink JM, Verduin E, van Kamp IL, Walther FJ, et al. Long-term neurodevelopmental outcome after intrauterine transfusion for hemolytic disease of the fetus/newborn: the LOTUS study. Am J Obstet Gynecol. 2012 Feb;206(2):141.e1-8. DOI:10.1016/j.ajog.2011.09.024. [ Links ]
27. De Jong EP, Lindenburg IT, van Klink JM, Oepkes D, van Kamp IL, Walther FJ, Lopriore E. Intrauterine transfusion for parvovirus B19 infection: long-term neurodevelopmental outcome. Am J Obstet Gynecol. 2012;206:204.e1–5. DOI:10.1016/j.ajog.2011.12.035. [ Links ]
Correspondencia:
Dr. Erasmo Huertas Tacchino
Av. Guardia Civil 715. San Borja. LimaPerú.
999144288
Recibido: 10 mayo 2019
Aceptado: 15 mayo 2019
Publicación online: 14 noviembre 2019