Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Ginecología y Obstetricia
versión On-line ISSN 2304-5132
Rev. peru. ginecol. obstet. vol.65 no.4 Lima oct./dic. 2019
http://dx.doi.org/10.31403/rpgo.v65i2221
SIMPOSIO ANEMIA EN LA GESTACIÓN
Resultados perinatales de la anemia en la gestación
Maternal anemia and perinatal outcomes
Carlos Gonzales-Medina1,a, Pedro Arango-Ochante1,b
1 Médico Cirujano, Especialista en Ginecología y Obstetricia, Facultad de Medicina, Universidad Nacional Mayor de San Marcos, Lima, Perú; Miembro, Sociedad Peruana de Ginecología y Obstetricia
a Junior Fellow, American College of Obstetricians and Gynecologists; Código ORCID: https://orcid. org/0000-0002-9840-1886
b Unidad Funcional de Investigación, Instituto Nacional Materno Perinatal, Lima, Perú
ABSTRACT
Identification of anemia in the pregnant woman is an essential aspect of prenatal control. The potential consequences of anemia are known. If the condition is managed from an integral perspective from the beginning, potential perinatal complications may be recognized early. Perinatal adversities in maternal anemia include premature rupture of membranes, preterm labor and preeclampsia; and in the newborn, low birth weight, perinatal asphyxia and hyaline membrane syndrome. Neurodevelopmental alterations occur in early childhood, and the mother is susceptible to chronic diseases.
Key words: Anemia, Pregnancy.
RESUMEN
Uno de los aspectos esenciales en el manejo adecuado del control prenatal es la identificación de la anemia en la gestante. Se conoce las potenciales consecuencias de obviar la condición de anemia. Si se maneja dicha condición desde una perspectiva integral, los resultados adversos perinatales pueden ser reconocidos tempranamente y evitados. Estos incluyen la rotura prematura de membranas, el parto prematuro y la preeclampsia. Y en el recién nacido, el peso bajo al nacer, la asfixia perinatal y el síndrome de membrana hialina. Asimismo, en la infancia temprana ocurren alteraciones del neurodesarrollo, y la madre es susceptible de sufrir enfermedades crónicas.
Palabras clave. Anemia, Gestación.
Introducción
La anemia constituye un problema mundial de salud pública(1). En países desarrollados y Europa occidental, los casos de anemia por deficiencia de hierro son menores que en los de países de pocos recursos económicos(2). Esta condición afecta a la cuarta parte de la población mundial y genera diversos problemas materno perinatales(3). Asimismo, la anemia por deficiencia de hierro durante el embarazo (definida con un nivel de ferritina sérica menor de 30 ng/mL) puede llevar a severas consecuencias en la salud de la madre y el recién nacido(4).
A pesar de que la anemia en el embarazo generalmente es de carácter fisiológica, la deficiencia de hierro debe ser reconocida durante el control prenatal y diferenciarse de los otros tipos de anemia por déficit vitamínico, de folato, vitamina B12 u otros, para su tratamiento oportuno(5).
La Organización Mundial de la Salud (OMS) ha calculado que 30% de las mujeres en edad reproductiva presenta anemia. Y en las gestantes, este porcentaje se incrementa a cifras superiores a 40%. Además, existen variaciones en relación en la raza blanca, con 7% de prevalencia, y en la raza negra(6), con prevalencia estimada de 27%(7). Sin embargo, hay un grupo de gestantes con déficit de hierro que cursan sin anemia, pero las predispone a desarrollar anemia ferropénica cuando se superan los umbrales de depósito de hierro corporal. Y es que una mujer que fisiológicamente pierde hierro a razón de 1 mg/ día producto de las menstruaciones, requerirá 0,8 mg/día adicional para compensar la pérdida fisiológica(8). Por ello, las mujeres en edad fértil que gestan con déficit vitamínico o depósitos insuficientes de hierro corporal tienen mayor riesgo de presentar anemia ferropénica durante el embarazo. Por tanto, la identificación oportuna de la anemia por deficiencia de hierro y el dosaje de ferritina son de vital importancia para un tratamiento óptimo y seguimiento antes de gestar y durante los controles prenatales(9).
La tasa promedio global de anemia durante la gestación en el mundo es 43% y, en América Latina y el Caribe, 37% en gestantes de 15 a 49 años(10). La población peruana de mujeres en edad fértil con anemia, según el ENDES, se ha incrementado en los últimos años, llegando a alrededor de 28%(11). Asimismo, el Ministerio de Salud (MINSA) peruano documentó para el año 2017 una tasa estimada de 29% de anemia en gestantes, y la seguridad social (EsSalud) peruana, alrededor de 30%(12). En las fuerzas armadas y en las clínicas privadas no se tienen registros publicados recientemente, pero se estima valores semejantes.
La anemia es una condición clínica que se caracteriza por la deficiencia cualitativa o cuantitativa de la hemoglobina o glóbulos rojos, lo que conlleva a reducción del aporte de oxígeno a nivel sanguíneo y tisular(13). La clasificación del nivel de anemia, según la OMS, se basa en los valores de su concentración sérica. Con cifras de 10 a 10,9 mg/dL, se considera anemia leve, de 9,9 a 7 mg/dL anemia moderada y menor de 7 mg/dL, anemia severa(14). Es importante señalar que el CDC (Centers for Disease Control and Prevention) considera una definición distinta a la anterior, denominando anemia en el segundo trimestre a cifra menor de 10,5 mg/dL o hematocrito menor de 32%(15). Esta última definición es avalada por el Colegio Americano de Ginecología y Obstetricia (ACOG) en sus distintos reportes y guías clínicas(16).
Un estudio multicéntrico de cohortes, realizado en Nueva Zelandia, Irlanda e Inglaterra, determinó que existe un mayor riesgo de resultados perinatales adversos en mujeres que se hallan anémicas desde el principio de su embarazo. Por ejemplo, son más frecuentes los casos de peso bajo al nacer, Apgar menos de 7 y parto pretérmino. Sin embargo, estos resultados no son estadísticamente significativos en su población de estudio(17). Asimismo, el desarrollo mental en niños de zonas rurales se ve favorecido por la suplementación de hierro, ácido fólico y múltiples micronutrientes en China. Así lo demuestra un seguimiento realizado en los hijos de madres que recibieron suplementación con hierro prenatal, que incluso no pudieron corregir a tiempo la anemia por deficiencia de hierro durante su embarazo(18).
El objetivo de la presente revisión es documentar los resultados perinatales frecuentemente reportados en la literatura médica y la medicina basada en evidencias y discutir algunos hallazgos desde el punto de vista fisiopatológico.
Evaluación de la anemia durante el embarazo
Se reconoce la existencia de la anemia fisiológica durante el embarazo, según la teoría hemodinámica del aumento del volumen plasmático (cifras entre 10 y 15%) y de los glóbulos rojos, que genera una caída del nivel de hemoglobina por hemodilución. Al respecto, la evidencia señala que desde la semana 6 y 12 de gestación, el volumen plasmático cambia de 15% a 50% para las semanas 30 a 34 de embarazo. Luego de la semana 34 hasta el término, estos valores se estabilizan(19). Esto genera un cambio importante en la hemodinámica materna, que se atribuye al aumento de la renina plasmática renal y la disminución del péptido natriurético auricular durante la gestación(20). La ganancia total a término es 1 100 a 1 600 mL y da como resultado un volumen plasmático de 4 700 a 5 200 mL, que es 30 a 50% superior al de las mujeres no gestantes.
La anemia por deficiencia de hierro es la que genera durante el embarazo las mayores cifras de resultados adversos. Y es la segunda causa más común de anemia luego de la anemia fisiológica. Por ello, es importante distinguir esta condición de la anemia fisiológica. En una serie publicada en 2018 se evaluó el estado de hierro en 299 mujeres jóvenes australianas; el 29% cursaba con deficiencia de hierro.
En relación al tamizaje de anemia durante el embarazo, la ACOG y la CDC coinciden en que el tamizaje debe hacerse dependiendo del tiempo de evaluación y el estudio del número de glóbulos rojos (tabla 1). En nuestro medio, este dato se obtiene de un hemograma completo en el inicio del control prenatal. En él se verifica la fórmula hematológica de glóbulos rojos, glóbulos blancos y plaquetas, con sus diferentes valores absolutos e índices de cada analizador. Sin embargo, no se evalúa los niveles de hierro durante el control prenatal.
En ausencia de anemia durante el embarazo, en Estados Unidos(21) se considera que no es pertinente realizar el tamizaje de deficiencia de hierro con la prueba de ferritina de forma rutinaria. Sin embargo, escoger para el tamizaje solo a las gestantes anémicas podría soslayar un importante 39% de casos de anemia con deficiencia de hierro como condición propia de una carencia vitamínica(22). Al respecto, es clara la asociación entre algunos déficits vitamínicos y la anemia durante el embarazo, como es el caso de la vitamina A, el ácido fólico y la vitamina B12. Si bien la carencia puede suplirse a partir de la ingesta vitamínica deficiente, la evidencia considera que la administración parenteral de hierro, como terapia de reemplazo, no es perjudicial para la madre o el feto. Lo mismo no ocurre con la vitamina A, que puede ser teratógena(23) y, por lo tanto, debe administrarse a dosis adecuadas en función de la edad gestacional.
Es importante reconocer a las gestantes que presentan en sus primeros controles o de forma pregestacional una hemoglobina de 14 g/dL y que repentinamente sus cifras disminuyen a 11 g/dL. Lo primero es distinguir si cursan con macrocitosis asociada; si es así, se debe sospechar un déficit de folatos o vitamina B12, y se solicitará reticulocitos para evaluar integralmente la anemia. En caso se tenga el valor de 11 g/dL y no se halle macrocitosis, el defecto por deficiencia de hierro es más probable(24).
El reconocimiento temprano de las gestantes con anemia por deficiencia de hierro es de vital importancia por la trascendencia del tratamiento precoz y la dificultad de mejorar los depósitos de hierro. Asimismo, el impacto en el neurodesarrollo fetal y neonatal(24).
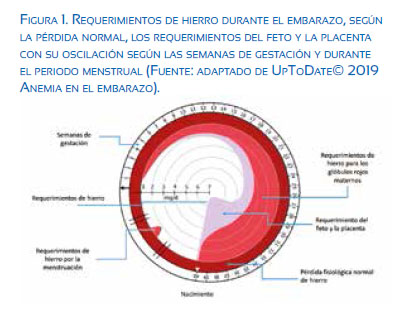
El aumento de los requerimientos de hierro para la producción de los glóbulos rojos es aproximadamente de 500 mg diarios, y para el crecimiento del feto y el tejido placentario de 300 a 350 mg(24). Estas cifras varían según los trimestres del embarazo, siendo los requerimientos basales del primer trimestre de 1 a 2 mg diarios, el segundo trimestre 4 a 5 mg diarios y el tercer trimestre 6 mg diarios como cifra máxima (figura 1)(25).
¿Cuál es la evidencia científica en relación al tamizaje y evaluación de la anemia?
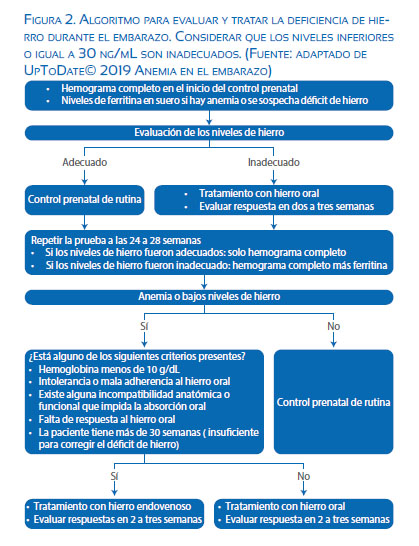
Por la medicina basada en evidencias, conviene citar las fuentes y los trabajos científicos que verifican las hipótesis médicas sobre el tamizaje. Se identificará el hemograma completo al inicio del control prenatal, con subsiguiente evaluación de los niveles de ferritina sérico según el algoritmo de la figura 2. Luego del segundo tamizaje, realizado en la semana 24 a 28, y ante la valoración de niveles bajos de ferritina o persistencia de anemia, es necesario el tratamiento médico oral o endovenoso, según los criterios para iniciar una medicación correctiva(26).
El tratamiento oportuno disminuye el riesgo de complicaciones perinatales adversas, siendo el tratamiento antes del tercer trimestre ideal para la neurogénesis dependiente de hierro, que ocurre durante el último trimestre y la vida posnatal temprana. El suministro inadecuado se asocia a déficit neurocognitivo en los recién nacidos y durante su infancia(27).
Se ha observado correlación positiva entre los niveles de ferritina sérica materna y los niveles de ferritina en el recién nacido, y este aspecto es claro incluso en madres no anémicas. La deficiencia de hierro en el feto o en el recién nacido puede llevar a consecuencias importantes a largo plazo en el niño y resulta necesaria su identificación(27).
Resultados perinatales
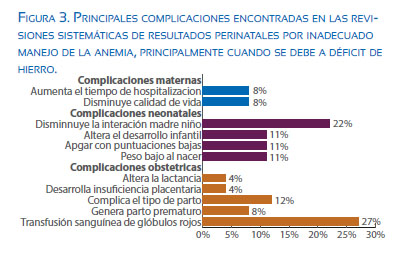
Existen diversas formas de evaluar los resultados de un inadecuado manejo de la anemia en la gestante. Una es la evaluación de la anemia por deficiencia de hierro. Una revisión sistemática publicada a principios de este año(28) señala como resultados objetivables maternos el tiempo de hospitalización y la disminución en la calidad de vida. Se considera la necesidad de transfusión sanguínea y la complicación del parto, el parto pretérmino, los desórdenes hipertensivos del embarazo relacionados con la insuficiencia placentaria, la alteración de la lactancia materna (figura 3). Dentro de las complicaciones neonatales, la afección en el neurodesarrollo, aspecto relacionado con el peso bajo al nacer y menor Apgar, en desmedro del potencial desarrollo infantil posterior(28).
Complicaciones maternas y obstétricas
En un estudio realizado por la OMS, la anemia materna prenatal y posnatal severa de cualquier tipo se asoció con mayor riesgo de muerte materna. Se estimó dos veces el riesgo de muerte materna (OR 2,36 [IC 95% 1,60 a 3,48])(29). Asimismo, existe asociación con transfusión materna, sepsis prenatal y posnatal, parto prematuro e ingreso a la unidad de cuidados intensivos neonatales(30).
En madres con déficit de hierro, el aumento de la severidad de la anemia se asocia con disminución del volumen del hipocampo neonatal y producción de un factor neurotrófico derivado del cerebro. Del mismo modo se ha observado la asociación entre el estado materno de hierro y el peso al nacer. La evidencia determinó que en 300 000 mujeres, aquellas que recibieron mayor cantidad de transfusiones producto de la anemia severa se correlacionó inversamente con la disminución del peso al nacer(31).
En animales de experimentación se ha demostrado una asociación clara del hierro en el desarrollo normal del cerebro, el crecimiento dendrítico y la formación de sinapsis(32), los comportamientos sociales como la falta de aseo, las tareas que requieren función ejecutiva, timidez y aprendizaje espacial deficiente. Sin embargo, aún faltan datos de estudios prospectivos que demuestren estas posibles relaciones causales en seres humanos. Existe evidencia limitada sobre si el déficit de desarrollo en los niños está relacionado de manera dependiente con los niveles de ferritina al nacer y si potencialmente el desarrollo alterado se podría corregir con la suplementación en la infancia(32).
Los riesgos a largo plazo en la madre es la afección en la calidad de vida debida al debilitamiento físico y a síntomas de origen mental(33).
En casos especiales de algunas comorbilidades asociadas en el embarazo, como el VIH, se ha descrito efectos adversos producto de la anemia. Estos incluyen la restricción del crecimiento intrauterino de predominio en la segunda mitad del embarazo (antes denominado asimétrico), el peso bajo al nacer, la prematuridad y el riesgo de óbito fetal y muerte neonatal temprana(34). La tasa de transmisibilidad materno infantil de la gestante VIH positiva se incrementa y hace que progrese la enfermedad debido a la anemia materna(35). El manejo de estas gestantes involucra el tratamiento con eritropoyetina recombinante, que aún se halla en estudio. La OMS recomienda usar diariamente 400 mg de ácido fólico y 60 mg de hierro en lugares de prevalencia de gestantes VIH positivas(35).
Un caso interesante es la gestante que padece de tuberculosis, en la que el cuadro pulmonar tiende a empeorarse, y si no se trata correctamente la enfermedad se correlaciona con el grado de anemia. La explicación fisiopatológica se halla en las consecuencias directas del estado inmunológico como consecuencia de la anemia. Un caso similar se da en aquellas pacientes que padecen de diabetes y cursan con anemia en el embarazo; la morbilidad y la mortalidad se agravan por el progreso de la enfermedad(36). La enfermedad renal progresa por el daño ocasionado por la hipoxia tisular y la disminución del aporte de sangre al parénquima renal. Del mismo modo ocurre con las neuropatías periféricas, la retinopatía diabética y las úlceras del pie diabético(37).
Sin duda, la anemia es considerada como un factor de riesgo independiente y modificable para hipertensión; hace que el cuadro clínico empeore. Del mismo modo, la hipertrofia ventricular izquierda, la insuficiencia cardíaca, y el riesgo de mortalidad cardiovascular se agravan por la anemia no tratada en la gestante(38).
El riesgo de infecciones maternas se incrementa y agravan con la anemia, debido a las afecciones de la inmunidad celular. Del mismo modo, la probabilidad de parto prematuro y la susceptibilidad de desarrollar una rotura prematura de membranas son altas en este grupo de pacientes, atribuidas a déficit en la síntesis de compuestos de colágeno y mucopolisacáridos dependiente de coenzimas y del hierro en su formación integral(39).
Una de las complicaciones maternas durante el posparto es la atonía uterina, que se da como resultado del deterioro de la capacidad contráctil del músculo uterino y que es vista incluso en adolescentes(40).
Complicaciones en el neonato y el niño
La inmunidad celular se ve afectada directamente en los recién nacidos de hijos de madres con anemia. Esta predisposición conlleva a infecciones neonatales. Se describe una predisposición de las madres anémicas de trasmitir a sus hijos la deficiencia de hierro(41). Esta deficiencia altera el desarrollo motor y neurofisiológico, hay déficit cognitivo y alteraciones en el desarrollo socioemocional de los niños(42). La evidencia experimental muestra la importancia de la función de los neurotransmisores y del sistema nervioso central con el metabolismo y aporte de hierro(43).
En un estudio longitudinal poblacional que incluyó 124 061 pacientes, se determinó que existía mayor riesgo de pérdida del bienestar fetal, con tasa de incidencia de 1,20, IC95% 1,13 a 1,27, y parto prematuro, con tasa de incidencia de 2,3, IC95% 1,15 a 1,31; además, los casos de peso bajo al nacer fueron más frecuentes en estas pacientes. No se pudo concluir que la anemia se asocie con algún grado de vulnerabilidad de los niños al ingresar a la escuela y que los predisponga a déficit cognitivo(44). Existe evidencia en el mismo sentido por la predisposición de asfixia perinatal y enfermedad de membrana hialina en recién nacidos de madres con anemia no tratada o identificada de forma oportuna en niños con peso bajo al nacer de madres anémicas(45).
En conclusión, la identificación de la anemia fisiológica y la anemia por deficiencia de hierro es el principal eslabón para reconocer desde el inicio del control prenatal los potenciales eventos adversos perinatales.
Los principales resultados adversos obstétricos producidos por la anemia durante la gestación, al no detectarla o por inadecuado manejo, son el aumento del parto prematuro y su potencial asociación con la rotura prematura de membranas, la insuficiencia placentaria que desarrolla trastornos hipertensivos del embarazo (preeclampsia), las complicaciones durante el trabajo de parto y la necesidad de transfusión sanguínea en el manejo de esta condición.
Los principales resultados adversos para el recién nacido producto de la anemia en la gestación, al no detectarla o por inadecuado manejo, son el recién nacido de peso bajo, la prematuridad, puntajes de Apgar bajos y potencial desarrollo infantil deficiente.
Financiamiento: autofinanciado.
Conflicto de interés: los autores señalan no tener conflicto de interés con alguna institución o empresa sobre lo señalado en la presente revisión
Citar como: Gonzales-Medina C, ArangoOchante P. Resultados perinatales de la anemia en la gestación. Rev Peru Ginecol Obstet. 2019;65(4):519-526. DOI: https://doi.org/10.31403/rpgo.v65i2221
Referencias Bibliográficas
1. McLean E, Cogswell M, Egli I, Wojdyla D, de Benoist B. Worldwide prevalence of anaemia, WHO Vitamin and Mineral Nutrition Information System, 1993-2005. Public Health Nutr. 2009 Apr;12(4):444-54. doi: 10.1017/S1368980008002401. [ Links ]
2. Bencaiova G, Burkhardt T, Breymann C. Anemia--prevalence and risk factors in pregnancy. Eur J Intern Med. 2012 Sep;23(6):529-33. doi: 10.1016/j.ejim.2012.04.008. [ Links ]
3. Milman N. Anemia--still a major health problem in many parts of the world! Ann Hematol. 2011 Apr;90(4):369-77. doi: 10.1007/s00277-010-1144-5. [ Links ]
4. Breymann C, Auerbach M. Iron deficiency in gynecology and obstetrics: clinical implications and management. Hematol Am Soc Hematol Educ Program. 2017 Dec 8;2017(1):152-9. doi: 10.1182/asheducation-2017. [ Links ]
5. Spary-Kainz U, Semlitsch T, Rundel S, Avian A, Herzog S, Jakse H, et al. How many women take oral supplementation in pregnancy in Austria? Who recommended it? A cross-sectional study. Wien Klin Wochenschr. 2019 May 16; doi: 10.1007/s00508-019-1502-9. [ Links ]
6. Nonterah EA, Adomolga E, Yidana A, Kagura J, Agorinya I, Ayamba EY, et al. Descriptive epidemiology of anaemia among pregnant women initiating antenatal care in rural Northern Ghana. Afr J Prim Health Care Fam Med. 2019 Apr 10;11(1):e1-7. doi: 10.4102/phcfm.v11i1.1892. [ Links ]
7. Mohamed MA, Ahmad T, Macri C, Aly H. Racial disparities in maternal hemoglobin concentrations and pregnancy outcomes. J Perinat Med. 2012 Jan 10;40(2):141-9. doi:10.1515/jpm.2011.137. [ Links ]
8. Levi M, Simonetti M, Marconi E, Brignoli O, Cancian M, Masotti A, et al. Gender differences in determinants of iron-deficiency anemia: a population-based study conducted in four European countries. Ann Hematol. 2019 May 9; doi: 10.1007/s00277-019-03707-w. [ Links ]
9. Engwa GA, Unaegbu M, Unachukwu MN, Njoku M-GC, Agbafor KN, Mbacham WF, et al. Low serum ferritin and G6PD deficiency as potential predictors of anaemia in pregnant women visiting Prime Care Hospital Enugu Nigeria. BMC Res Notes. 2017 Dec 8;10(1):721. doi: 10.1186/s13104-017-3051-5. [ Links ]
10. Stevens GA, Finucane MM, De-Regil LM, Paciorek CJ, Flaxman SR, Branca F, et al. Global, regional, and national trends in haemoglobin concentration and prevalence of total and severe anaemia in children and pregnant and non-pregnant women for 1995–2011: a systematic analysis of population-representative data. Lancet Glob Health. 2013 Jul 1;1(1):e16-25. doi: 10.1016/S2214-109X(13)70001-9. [ Links ]
111. Hernández-Vásquez A, Azañedo D, Antiporta DA, Cortés S. Análisis espacial de la anemia gestacional en el Perú, 2015. Rev Peru Med Exp Salud Publica. Enero 2017;34(1):43-51. doi: 10.17843/rpmesp.2017.341.2707. [ Links ]
12. Gonzales GF, Tapia V, Gasco M, Carrillo C. [Maternal hemoglobin in Peru: regional differences and its association with adverse perinatal outcomes]. Rev Peru Med Exp Salud Publica. Sep 2011;28(3):484-91. PMID:22086629. [ Links ]
13. Grewal A. Anaemia and pregnancy: Anaesthetic implications. Indian J Anaesth. 2010 Jan 9;54(5):380. doi: 10.4103/00195049.71026. [ Links ]
14. Salud OM de la. Concentraciones de hemoglobina para diagnosticar la anemia y evaluar su gravedad. Haemoglobin concentrations for the diagnosis of anaemia and assessment of severity [Internet]. 2011 [cited 8 Aug 2018]; http://apps.who.int/iris/handle/10665/85842. [ Links ]
15. Recommendations to prevent and control iron deficiency in the United States. Centers for Disease Control and Prevention. MMWR Recomm Rep Morb Mortal Wkly Rep Recomm Rep. 1998 Apr 3;47(RR-3):1-29. PMID:9563847. [ Links ]
16. American College of Obstetricians and Gynecologists. ACOG Practice Bulletin No. 95: anemia in pregnancy. Obstet Gynecol. 2008 Jul;112(1):201-7. doi: 10.1097/AOG.0b013e3181809c0d. [ Links ]
17. Masukume G, Khashan AS, Kenny LC, Baker PN, Nelson G. Risk factors and birth outcomes of anaemia in early pregnancy in a nulliparous cohort. PLoS One. 2015 Apr 15;10(4):e0122729. doi: 10.1371/journal.pone.0122729. [ Links ]
18. Chang S, Zeng L, Brouwer ID, Kok FJ, Yan H. Effect of iron deficiency anemia in pregnancy on child mental development in rural China. Pediatrics. 2013 Mar;131(3):e755-763. doi: 10.1542/peds.2011-3513. [ Links ]
19. de Haas S, Ghossein-Doha C, van Kuijk SMJ, van Drongelen J, Spaanderman MEA. Physiological adaptation of maternal plasma volume during pregnancy: a systematic review and meta-analysis. Ultrasound Obstet Gynecol. 2017 Feb;49(2):177-87. doi: 10.1002/uog.17360. [ Links ]
20. Chandra S, Tripathi AK, Mishra S, Amzarul M, Vaish AK. Physiological Changes in hematological parameters during pregnancy. Indian J Hematol Blood Transf. 2012 Sep;28(3):144-6. doi: 10.1007/s12288-012-0175-6. [ Links ]
21. Cantor AG, Bougatsos C, Dana T, Blazina I, McDonagh M. Routine iron supplementation and screening for iron deficiency anemia in pregnancy: a systematic review for the U.S. Preventive Services Task Force. Ann Intern Med. 2015 Apr 21;162(8):566-76. doi: 10.7326/M14-2932. [ Links ]
22. Johnson S, Lang A, Sturm M, O’Brien SH. Iron deficiency without anemia: A common yet under-recognized diagnosis in young women with heavy menstrual bleeding. J Pediatr Adolesc Gynecol. 2016 Dec;29(6):628-31. doi: 10.1016/j.jpag.2016.05.009.
23. Bastos Maia S, Rolland Souza AS, Costa Caminha M de F, Lins da Silva S, Callou Cruz R de SBL, Carvalho Dos Santos C, et al. Vitamin A and pregnancy: A narrative review. Nutrients. 2019 Mar 22;11(3). doi: 10.3390/nu11030681. [ Links ]
24. Sun D, McLeod A, Gandhi S, Malinowski AK, Shehata N. Anemia in pregnancy: A pragmatic approach. Obstet Gynecol Surv. 2017 Dec;72(12):730-7. doi: 10.1097/OGX.0000000000000510. [ Links ]
25. Bothwell TH. Iron requirements in pregnancy and strategies to meet them. Am J Clin Nutr. 2000;72(1 Suppl):257S-64S. doi: 10.1093/ajcn/72.1.257S. [ Links ]
26. Muñoz M, Peña-Rosas JP, Robinson S, Milman N, Holzgreve W, Breymann C, et al. Patient blood management in obstetrics: management of anaemia and haematinic deficiencies in pregnancy and in the post-partum period: NATA consensus statement. Transfus Med Oxf Engl. 2018 Feb;28(1):22-39. doi: 10.1111/tme.12443. [ Links ]
27. Radlowski EC, Johnson RW. Perinatal iron deficiency and neurocognitive development. Front Hum Neurosci. 2013 Sep 23;7:585. doi: 10.3389/fnhum.2013.00585. [ Links ]
28. Malinowski AK, D’Souza R, Khan KS, Shehata N, Malinowski M, Daru J. Reported outcomes in perinatal iron deficiency anemia trials: A systematic review. Gynecol Obstet Invest. 2019 Feb 1;1-18. doi: 10.1159/000495566.
29. Daru J, Zamora J, Fernández-Félix BM, Vogel J, Oladapo OT, Morisaki N, et al. Risk of maternal mortality in women with severe anaemia during pregnancy and post partum: a multilevel analysis. Lancet Glob Health. 2018;6(5):e548-54. doi: 10.1016/S2214-109X(18)30078-0. [ Links ]
30. Drukker L, Hants Y, Farkash R, Ruchlemer R, Samueloff A, Grisaru-Granovsky S. Iron deficiency anemia at admission for labor and delivery is associated with an increased risk for cesarean section and adverse maternal and neonatal outcomes. Transfusion (Paris). 2015 Dec;55(12):2799-806. doi: 10.1111/trf.13252. [ Links ]
31. Rigas AS, Pedersen OB, Sørensen E, Thørner LW, Larsen MH, Katz LM, et al. Frequent blood donation and offspring birth weight-a next-generation association? Transfusion (Paris). 2019 Mar;59(3):995-1001. doi: 10.1111/trf.15072. [ Links ]
32. Krebs NF. Dietary zinc and iron sources, physical growth and cognitive development of breastfed infants. J Nutr. 2000;130(2S Suppl):358S-360S. doi: 10.1093/jn/130.2.358S. [ Links ]
33. Gangopadhyay R, Karoshi M, Keith L. Anemia and pregnancy: a link to maternal chronic diseases. Int J Gynaecol Obstet. 2011 Nov;115 Suppl 1:S11-15. doi: 10.1016/S00207292(11)60005-2. [ Links ]
34. Villamor E, Saathoff E, Msamanga G, O’Brien ME, Manji K, Fawzi WW. Wasting during pregnancy increases the risk of mother-to-child HIV-1 transmission. J Acquir Immune Defic Syndr. 2005 Apr 15;38(5):622-6. PMID:15793376.
35. Bailey H, Zash R, Rasi V, Thorne C. HIV treatment in pregnancy. Lancet HIV. 2018;5(8):e457-67. doi: 10.1016/S23523018(18)30059-6. [ Links ]
36. Idris I, Tohid H, Muhammad NA, A Rashid MR, Mohd Ahad A, Ali N, et al. Anaemia among primary care patients with type 2 diabetes mellitus (T2DM) and chronic kidney disease (CKD): a multicentred cross-sectional study. BMJ Open. 2018 Dec 22;8(12):e025125. doi: 10.1136/bmjopen-2018-025125. [ Links ]
37. Tiongco RE, Arceo E, Clemente B, Pineda-Cortel MR. Association of maternal iron deficiency anemia with the risk of gestational diabetes mellitus: a meta-analysis. Arch Gynecol Obstet. 2019 Jan;299(1):89-95. doi: 10.1007/s00404-018-4932-0. [ Links ]
38. Jasper R, Skelding K. Cardiovascular disease risk unmasked by pregnancy complications. Eur J Intern Med. 2018;57:1-6. doi: 10.1016/j.ejim.2018.07.020. [ Links ]
39. Yi S-W, Han Y-J, Ohrr H. Anemia before pregnancy and risk of preterm birth, low birth weight and small-for-gestational-age birth in Korean women. Eur J Clin Nutr. 2013 Apr;67(4):33742. doi: 10.1038/ejcn.2013.12. [ Links ]
40. Pinho-Pompeu M, Surita FG, Pastore DA, Paulino DSM, Pinto E Silva JL. Anemia in pregnant adolescents: impact of treatment on perinatal outcomes. J Matern-Fetal Neonatal Med. 2017 MAy;30(10):1158-62. doi: 10.1080/14767058.2016.1205032. [ Links ]
41. Rendina DN, Blohowiak SE, Coe CL, Kling PJ. Maternal perceived stress during pregnancy increases risk for low neonataliron at delivery and depletion of storage iron at one year. J Pediatr. 2018;200:166-73.e2. doi: 10.1016/j.jpeds.2018.04.040. [ Links ]
42. Corapci F, Calatroni A, Kaciroti N, Jimenez E, Lozoff B. Longitudinal evaluation of externalizing and internalizing behavior problems following iron deficiency in infancy. J Pediatr Psychol. 2010 Apr;35(3):296-305. doi: 10.1093/jpepsy/jsp065. [ Links ]
43. Doom JR, Richards B, Caballero G, Delva J, Gahagan S, Lozoff B. Infant iron deficiency and iron supplementation predict adolescent internalizing, externalizing, and social problems. J Pediatr. 2018;195:199-205.e2. doi: 10.1016/j.jpeds.2017.12.008. [ Links ]
44. Smithers LG, Gialamas A, Scheil W, Brinkman S, Lynch JW. Anaemia of pregnancy, perinatal outcomes and children’s developmental vulnerability: a whole-of-population study. Paediatr Perinat Epidemiol. 2014 Sep;28(5):381-90. doi: 10.1111/ppe.12149.
45. Figueiredo ACMG, Gomes-Filho IS, Batista JET, Orrico GS, Porto ECL, Cruz Pimenta RM, et al. Maternal anemia and birth weight: A prospective cohort study. PloS One. 2019;14(3):e0212817. doi: 10.1371/journal.pone.0212817. [ Links ]
Correspondencia:
Dr. Carlos Alejandro Gonzales Medina
Alameda Eugenio Yacolevf Edificio 120, Dpto. 204. Las Torres de San Borja. Lima, Perú
996856039
Recibido: 16 junio 2019
Aceptado: 21 junio 2019
Publicación online: 14 noviembre 2019