Introducción
La placenta anormalmente adherida al útero y que no logra separarse espontáneamente luego del nacimiento del feto, abarca una amplia variedad de presentaciones, por lo que en la actualidad se la denomina espectro de placenta acreta (EPA). Ocasiona cuadros hemorrágicos puerperales graves con pérdidas sanguíneas severas superiores a 2 000 mL y que ameritan un manejo especializado eficaz y expedito, con apoyo multidisciplinario y transfusiones masivas de sangre para controlar el choque hemorrágico que generalmente acompaña el cuadro. En las últimas décadas existe incremento de la tasa de cesáreas, lo que conlleva al aumento significativo en las cifras de EPA y a elevada morbimortalidad materna. El manejo del EPA es quirúrgico y clásicamente está encaminado a la histerectomía obstétrica, que se asocia también a cuadros hemorrágicos, coagulopatías, riesgos transfusionales, lesiones intraoperatorias y potenciales fistulas de vías urinarias, por lo que se ha buscado alternativas para manejo conservador.
La presente revisión se centra en la epidemiología, patogenia, diagnóstico y tratamiento quirúrgico del EPA, haciendo énfasis en las alternativas para su manejo.
Métodos
Se ha obtenido la información mediante la búsqueda en Medline y Cochrane Library desde enero 2018 a julio 2019, utilizando las palabras clave: ‘espectro placenta acreta’, ‘histerectomía obstétrica’, ‘morbimortalidad materna’, ‘tratamiento conservador’, analizando las revisiones sistemáticas, ensayos controlados aleatorios y estudios observacionales.
Espectro de placenta acreta
Conocida como placenta mórbidamente adherida, el espectro de placenta acreta se refiere a la gama de situaciones de adherencia patológica de la placenta en el útero1. Existe inserción anormal de parte o de toda la placenta, con ausencia total o parcial de la decidua basal y anormalidad de la caduca verdadera y penetración de las vellosidades coriales al miometrio2. Puede ocurrir compromiso materno por intensa hemorragia aguda, a veces mortal, que a menudo requiere transfusión sanguínea. Las pacientes con EPA son más propensas a ser sometidas a histerectomía en el parto o puerperio, con estancias hospitalarias prolongadas3.
Las tasas del EPA están aumentando; los estudios observacionales a partir de los años 1970 y 1980 describen incremento de la prevalencia de la placenta adherida de 1/4 017 partos en 1982 a 1/533 partos en 20024. Este aumento es probablemente secundario a la tasa creciente de cesáreas en los Estados Unidos de 5% de todos los partos en 1970 a 32,8% en 20105. Hay varios factores de riesgo para el EPA; el más común es la cesárea previa, siendo importantes también la edad materna mayor de 35 años, multiparidad y placenta previa. En una revisión sistemática, la tasa del EPA aumentó de 0,3% en mujeres con una cesárea previa a 6,74% en mujeres con cinco o más cesáreas6. Existe evidencia epidemiológica convincente de que el EPA se ha convertido esencialmente en una condición iatrogénica, secundaria a la epidemia moderna de cesáreas7,8.
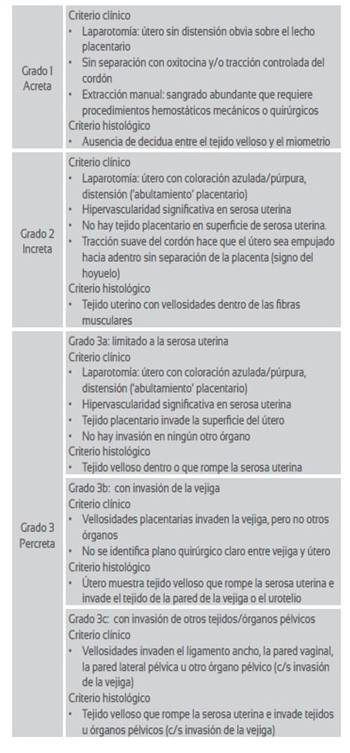
Hay tres variedades de EPA: a) acreta, que es la adherencia anormal total o parcial de la placenta a la pared uterina, sin que las vellosidades coriales penetren el miometrio; b) increta, con vellosidades coriales que penetran el miometrio; y, c) percreta, con invasión de los elementos coriales que sobrepasa la serosa del útero, pudiendo alcanzar órganos vecinos. Por su extensión, se reconocen tres tipos de EPA: focal (pequeñas áreas placentarias), parcial (uno o más cotiledones) y total (toda la placenta esta anormalmente adherida). Además, pueden coexistir diferentes grados de EPA en la misma placenta9. La Federación Internacional de Ginecología y Obstetricia (FIGO), debido a los múltiples criterios clínicos que se encuentran en la literatura con respecto al diagnóstico del EPA y que tienen impacto sobre la epidemiología, la comprensión de la patología y el desarrollo de mejores estrategias para su manejo, propone una clasificación para el diagnóstico clínico de acuerdo a grados de invasividad9().
Tabla 1 Clasificación general del espectro de placenta acreta según la Federación Internacional de Ginecología y Obstetricia9.
La hipótesis más favorecida con respecto a la etiología del EPA es que un defecto de la interfaz endometrio-miometrio conduce al fracaso de la decidualización normal en el área de una cicatriz uterina, lo que permite el anclaje placentario anormalmente profundo e infiltración del trofoblasto7.
Diagnóstico del espectro de placenta acreta
El diagnóstico y el conocimiento de la extensión de la invasión placentaria prenatal tienen papel decisivo en la optimización de los resultados de la paciente con EPA, permitiendo su referencia a un centro de tercer nivel con manejo multidisciplinario. El pilar del diagnóstico prenatal sigue siendo el ultrasonido Doppler10. El Grupo de Trabajo Europeo para EPA, en el año 201611, propuso la creación de criterios ecográficos diagnósticos actualizados a partir de 23 estudios de revisiones sistemáticas, siendo los más relevantes la pérdida de ‘zona clara’, las lagunas placentarias y, en Doppler color, la hipervasculatura útero-vesical asociada a puentes placentarios. La resonancia magnética (RM) en el diagnóstico del EPA es complementaria a la ecografía en casos aislados, alcanzando una sensibilidad y especificidad de 94 y 84%, respectivamente12. Un metaanálisis multicéntrico realizado en la unidad de medicina fetal de la Universidad San Jorge de Londres, el año 2014, determinó los signos placentarios de mayor sensibilidad y especificidad para la RM, siendo los más relevantes la señal placentaria heterogénea y la banda intraplacentaria9.
La confirmación anatomo-patológica microscópica para el diagnóstico del EPA es la ausencia de la decidua basal, como estándar de oro; sin embargo, su diagnóstico no resulta fácil por la distorsión que ocurre en el momento del alumbramiento, salvo que se realice histerectomía y así se obtenga la muestra del tejido. La Sociedad Internacional para la Placenta Anormalmente Invasiva (SIPAI)13) reconoce que, luego de un parto vaginal con retención placentaria se puede llegar al diagnóstico clínico del EPA focal o parcial cuando, al momento de la exploración manual de la placenta, se reconoce una zona placentaria firmemente adherida; y el diagnóstico clínico del EPA total es cuando no se logra identificar un plano de separación entre el borde placentario y el útero. Además, la SIPAI detalla un sistema de clasificación clínica para evaluar la gravedad del EPA al momento de realizar una cesárea, de acuerdo a los siguientes parámetros: resistencia de la placenta para su separación, apariencia de la serosa uterina, invasión a la vejiga u otro órgano13.
Idealmente, el diagnóstico del EPA debe ser realizado antes de las 32 semanas de gestación, por antecedentes y estudio de imágenes, siendo referida la paciente a un centro de multidisciplinario conformado, además del cirujano obstetra experimentado, por ecografista, anestesiólogo, urólogo, cirujano ginecooncólogo, intensivista, radiólogo intervencionista y neonatólogo. Las instalaciones deben incluir disponibilidad de 24 horas de centro quirúrgico, unidad de cuidados intensivos materno y neonatal, banco de sangre y laboratorio.
Manejo del espectro de placenta acreta
Un análisis de decisión del parto sugiere que las 34 a 35 semanas de gestación son óptimas, dada la capacidad de la mayoría de los centros grandes para manejar las complicaciones neonatales en esa edad gestacional y el mayor riesgo de sangrado después de las 36 semanas14. La maduración pulmonar fetal con corticosteroides prenatales es apropiada en mujeres con diagnóstico de EPA y parto anticipado antes de las 37 semanas de gestación, y es consistente con las recomendaciones actuales basadas en la edad gestacional15.
Manejo quirúrgico
Las medidas generales prequirúrgicas incluyen evaluación cistoscópica preoperatoria con/sin colocación de catéteres ureterales, necesidad de laparotomía mediana, cesárea corporal clásica evitando la placenta y valorar posibilidad de histerectomía o de ligadura de trompas al preservar el útero16.
Dentro de las medidas eficaces intraoperatorias se incluye el uso temprano del ácido tranexámico, que demostró su utilidad en reducir la mortalidad materna en el estudio multicéntrico MUJER17(grado de recomendación A)13.
Manejo Conservador
Desde hace décadas, el tratamiento universalmente aceptado ante un caso de EPA es la histerectomía total abdominal; sin embargo, en los últimos años ha surgido una corriente conservadora que evita la histerectomía y sus complicaciones, así como busca preservar la fertilidad futura de las pacientes.
El manejo del EPA en todas sus formas es quirúrgico. Según los miembros de La Sociedad Americana de Medicina Materno Fetal, cerca de 85% de los especialistas procedió con histerectomía el manejo de cualquier EPA, contrario al 15% que mantuvo manejo conservador18.
Surge entonces la siguiente interrogante: ¿Las alternativas terapéuticas conservadoras comparadas con las histerectomías obstétricas reducen la morbimortalidad materna en la gestante con EPA?
Shehata A. y col. comunicaron en 15 casos un éxito de 94,5% con mínimas complicaciones quirúrgicas y postoperatorias para su manejo conservador con tres pasos quirúrgicos: doble ligadura de la arteria uterina, extracción placentaria con suturas cuádruples en el segmento uterino y colocación de balón intrauterino19. La principal serie de casos de manejo expectante con placenta in situ en un estudio retrospectivo multicéntrico, que incluyó 167 casos de EPA en 40 hospitales, halló una tasa de éxito de 78%, con morbilidad materna grave en 6%20, obteniéndose útero vacuo espontáneamente en 75% de los casos y complementada con resección histeroscópica adicional o legrado en el 25% restante, teniendo un caso de muerte materna por inyección de metotrexato en el cordón umbilical. SIPAI informa que el tratamiento expectante dejando la placenta in situ parece estar asociado con menor pérdida de sangre y menor necesidad de transfusión, comparado con la histerectomía y las técnicas de útero-conservación, alcanzando tasas de éxito entre 60 y 93%, siendo las restantes sometidas finalmente a histerectomía por hemorragia o infección (grado B de recomendación)10. Por tanto, el manejo conservador puede ser una estrategia válida en pacientes que desean preservar su fertilidad o en quienes se considera que la histerectomía tiene un riesgo elevado de complicaciones. Se debe informar del riesgo de morbilidad materna grave en el 6% (grado B de recomendación)10.
Para el manejo de la placenta in situ, no hay evidencia para apoyar el uso del metotrexato, por el escaso número de casos comunicados y los efectos adversos graves, como pancitopenia y nefrotoxicidad20. Por lo que, la SIPAI no recomienda el uso de metotrexato para el manejo conservador de EPA (grado de recomendación B)13.
De otro lado, la embolización arterial profiláctica pélvica para el manejo de placenta in situ se acompaña de daños potenciales, a pesar de llegar a una tasa de éxito del 90%21; por lo que, SIPAI no recomienda la embolización profiláctica de la arteria uterina en mujeres sometidas a tratamiento conservador de EPA (grado B de recomendación)13. Sin embargo, la embolización terapéutica para hemorragia posparto puede evitar la histerectomía (grado D de recomendación)13. Clausen y col. publicaron un manejo conservador con resección local de útero, encontrando menores complicaciones de hemorragia e infección comparadas con histerectomía y dejar la placenta in situ para reabsorción22. Al respecto, SIPAI concluye que, en casos seleccionados, parece ser una elección razonable cuando no haya invasión a parametrios y/o cérvix. La resección local sería beneficiosa en los casos de EPA focal (grado B de recomendación)13. Otras alternativas quirúrgicas conservadoras se van encontrando a través de reportes de casos aislados, por lo que aún están en evaluación. La ligadura de la arteria ilíaca interna (LAII) es referida en pequeñas series de casos, con resultados disímiles. Camuzcouglu y col. informaron un manejo sin muertes maternas, pero con 28% de complicaciones severas, al asociar histerectomía con LAII23. IWATA y col., en un estudio retrospectivo de cohortes, hallaron que la LAII no contribuyó a una reducción significativa de hemorragias24.
La desvascularización uterina quirúrgica en el momento de la cesárea fue comunicada por Verspyck y col., quienes concluyen que puede ser útil para la conservación uterina; sin embargo, la capacidad reproductiva puede verse alterada por la retención crónica de la placenta y recurrencia del EPA. Al parecer, es una técnica razonablemente segura, siempre que no esté asociada con ligadura de la arteria ovárica25. También existe una publicación de ligadura profiláctica bilateral de la arteria ilíaca interna antes de la extracción de placenta acreta, pero que no logró ser eficaz para evitar la histerectomía en 29% de los casos26. Muchos autores abogan por su ligadura de rutina en el EPA27. Otros no informaron algún valor para su ligadura24. Por otro lado, algunos autores comunicaron complicaciones graves, como necrosis glútea, necrosis vesical, gangrena uterina y ocasionalmente isquemia de piernas, si la arteria ilíaca externa era ligada por error28,29. Las suturas compresivas asociadas a la extirpación de la placenta también han sido utilizadas como medidas conservadoras. Shahin y col. asociaron en 26 pacientes ligadura de las arterias uterinas y sutura B-Lynch, con muerte de dos pacientes30. Otros estudios que asocian otras suturas compresivas y taponamiento con balón intrauterino no cuentan con criterios diagnósticos definidos que diferencien la placenta adherida de la retención placentaria y atonía secundaria a su extracción, y resultan no concluyentes al no tener grupo control.
Otras recomendaciones clínico-quirúrgicas
Con respecto a la histerectomía en el EPA, la SIPAI recomienda una posición materna óptima para que la vagina esté accesible (litotomía o piernas rectas pero separadas) y facilite la manipulación del cuello uterino y la cuantificación del sangrado (grado D de recomendación)13. La incisión de piel en la línea media facilita la intervención, aunque no hay evidencia del beneficio de su uso rutinario, quedando la decisión a criterio del equipo médico, basándose en la ubicación placentaria, sospecha del grado de invasión, probabilidad de complicaciones intraoperatorias, edad gestacional, hábito corporal materno, preferencia del cirujano (grado D de recomendación)13. Evitar la histerotomía segmentaria y extracción fetal transplacentaria si, en la apertura del abdomen, es claramente evidente el acretismo y es razonable si hubo sospecha prenatal del EPA (grado D de recomendación)13.
Cuando hay sospecha prenatal de EPA, no debe utilizarse en el posparto inmediato oxitócicos profilácticos de rutina y deberá reservarse su uso solo si la placenta se desprende espontáneamente. En la EPA total, la contracción uterina no da lugar a sangrado; pero, si la EPA es focal o parcial, la contracción uterina puede provocar algo de separación, lo que lleva a un aumento de la pérdida de sangre; ello podría provocar que el cirujano intente retirar manualmente el resto de placenta aun adherida o tomar una decisión apresurada para realizar una histerectomía, según SIPAI13.
Al compararse los riesgos y beneficios de la histerectomía total versus la histerectomía supracervical, se encuentran resultados contradictorios y no hay evidencia para demostrar que la histerectomía supracervical de rutina en los casos de EPA reduzca la morbimortalidad materna en comparación con la histerectomía total, siendo la decisión individualizada según el caso, considerando extensión y grado de invasión, cantidad de sangrado, estabilidad hemodinámica, habilidades del cirujano y experiencia del equipo médico (grado C de recomendación)13. En casos de invasión al cérvix, será histerectomía total (grado de recomendación D)13. En relación al momento de realizar la histerectomía, Ansar A y col. compararon las histerectomías realizadas a continuación de la cesárea versus las histerectomías programadas días a semanas poscesárea, espe-
rando una disminución de la perfusión uterina y menor riesgo de hemorragia; hallaron menor sangrado, pero mayor tiempo de hospitalización y más complicaciones31. No hay evidencia que los beneficios de postergar la histerectomía superen las potenciales complicaciones (nivel de recomendación D)13. Selman publicó su histerectomía radical retrógrada, cuyo abordaje, ya en la cavidad abdominal, es desde el saco de Douglas con apertura de retroperitoneo y LAII luego de la extracción del feto, informando que no tuvo complicaciones, aunque la técnica es difícil de replicar32.
En paciente estable, con sangrado no profuso y previo consentimiento, se puede plantear tratamiento conservador de EPA dejando la placenta total o parcialmente in situ20 (grado de recomendación D) 10. Los procedimientos adicionales para disminuir la morbilidad o acelerar la reabsorción placentaria, como ligadura de arterias uterinas, la resección histeroscópica de los tejidos retenidos, uso de metotrexato, ligadura o embolización temporal de arteria ilíaca interna, no cuentan con ensayos controlados aleatorios que los respalden33,34.
En casos de pacientes hemodinámicamente inestables y/o con sangrado profuso, la histerectomía de emergencia debe realizarse lo más rápido posible. La compresión de la arteria ilíaca común o la aorta puede ser usada como medida temporal para ahorrar sangrado (grado D de recomendación 13.
Conclusiones
La histerectomía de emergencia continúa siendo la primera opción en casos de hemorragia severa e inestabilidad hemodinámica, quedando las medidas conservadoras como alternativas válidas, si hubo solicitud previa de la paciente y consentimiento informado, y cuando no hay compromiso hemodinámico. La existencia de múltiples alternativas quirúrgicas conservadoras para el manejo del EPA refleja la ausencia de una técnica ideal y confiable, obligando a afinar nuestro juicio clínico.















