Introducción
Al igual que en muchos países de América Latina, la hemorragia obstétrica sigue siendo la mayor causa de mortalidad materna en el mundo1. Durante las ultimas décadas, tanto el aumento significativo de partos por cesárea como la diminución de partos vaginales luego de una cesárea, han causado incremento en la prevalencia de anormalidades de implantación placentaria -placenta previa y placenta acreta. Estas entidades están fuertemente asociadas a mayor pérdida sanguínea durante el parto y mayor morbilidad y mortalidad materna2.
Durante las últimas décadas se prestó mucha atención al shock hemorrágico y, sobretodo, a la respuesta de la paciente a este evento3. Estudios recientes muestran que la respuesta del cuerpo humano a una hemorragia severa es bastante compleja, tanto en el nivel celular como en los diferentes órganos. En la célula, la disminución significativa del número de eritrocitos que puedan transportar oxígeno causa un estado de hipoxemia4. Al no poder cubrir con los requerimientos aeróbicos, la célula produce ácido láctico, radicales libres y fosfatos inorgánicos5. La liberación de moléculas asociada al daño (por ejemplo, alarminas, ADN mitocondrial) causa una respuesta inflamatoria sistémica6. La hipoxemia e inflamación sistémicas producen vasoconstricción y daño multisistémico, lo que es causa común de morbilidad severa y mortalidad en los sobrevivientes de shock hemorrágico7.
A nivel de tejidos, la hemorragia produce cambios sistémicos en el endotelio, lo que a su vez causa un estado de hipercoagulabilidad, con producción de coágulos de manera generalizada. Como repuesta, y para prevenir daños en órganos distantes a la lesión inicial, se activa la cascada fibrinolítica. Finalmente, todos estos factores y la activación excesiva de la plasmina son las causas de coagulopatía diseminada en las pacientes con hemorragia obstétrica severa7.
El manejo y tratamiento de la hemorragia obstétrica se basa en controlar la causa y reestablecer el volumen sanguíneo. Por muchos años, la primera línea para el manejo de la hemorragia se basaba en el uso de cristaloides. Estudios más recientes muestran que su uso excesivo puede empeorar el pronóstico8,9. Para empezar, el empleo desmedido de estas soluciones compromete aún más la capacidad de transportar oxígeno y los factores de coagulación9. Además, la administración de esta solución a temperaturas bajas puede exacerbar la pérdida de calor, requiriendo mayor producción de energía. Debido al aumento de la presión osmótica, los cristaloides aumentan la cantidad de fluido en el tercer espacio. Luego de una hora de su administración a un paciente críticamente enfermo, solo 20% del volumen total de cristaloides permanece en el espacio intravascular. Esto trae como consecuencia un riesgo incrementado de desarrollar síndrome compartimental abdominal10,11. Finalmente, el uso excesivo de cristaloides puede causar acidosis metabólica, limitando aún más la función de los factores de coagulación12. Por ello, el diagnóstico precoz, evitar el uso excesivo de cristaloides y el remplazo de volumen con compuestos sanguíneos, son cruciales para aumentar la sobrevivencia de estas pacientes.
En este artículo realizaremos una revisión sobre el uso de productos sanguíneos en el manejo de la hemorragia obstétrica, incluyendo el protocolo de transfusión masiva.
Resucitación hemostática en obstetricia
En muchos países, el uso de transfusiones sanguíneas en obstetricia se ha incrementado durante los últimos años13. En los Estados Unidos, por ejemplo, todos los centros obstétricos deben estar asociados con un establecimiento que cuente con productos sanguíneos disponibles, además de protocolos específicos para el uso de dichos productos14.
Tradicionalmente, la resucitación con productos sanguíneos se basaba en la administración de cristaloides y paquetes globulares. El uso de los otros productos, como plaquetas, plasma fresco congelado (PFC) y crioprecipitado, era dependiente de los resultados de las pruebas de laboratorio. La indicación del uso de estos compuestos era la presencia de coagulopatía (plaquetas menos de 50 000/mL, fibrinógeno menor a 100 a 150 mg/dL, tiempo de protrombina o tiempo de tromboplastina prolongado). Estos protocolos no eran efectivos para prevenir la coagulopatía temprana en pacientes con sangrado excesivo.
El concepto de resucitación hemostática se ha desarrollado como una solución a este problema. Este concepto limita el uso de cristaloides, usando los productos sanguíneos como principal solución en la resucitación.
En la resucitación hemostática, se realiza la transfusión sin esperar los resultados de laboratorio. Entre los beneficios de este concepto resaltan dos: menor riesgo de hemodilución y menor riesgo de tercer espacio.
Protocolo de transfusión masiva
La transfusión masiva es definida como la administración de 10 unidades globulares en 24 horas, en caso de sangrado masivo15. Otras definiciones incluyen el uso de 3 unidades globulares en una hora o 4 unidades de productos sanguíneos en 30 minutos16,17. El proceso de obtención de productos sanguíneos para el manejo del shock hemorrágico puede ser complicado y consume tiempo. Por ello, muchas instituciones han desarrollado protocolos de transfusión masiva (PTM).
El concepto de PTM fue inicialmente estudiado en casos de traumatismo severo. La implementación de PTM ha mostrado una mejora en el tiempo requerido para recibir los productos, además de ser costo efectivo cuando se compara con el uso de productos sin PTM18. Es posible que la adopción generalizada de PTM basada en la evidencia haya contribuido a la reducción de la mortalidad por shock hemorrágico observada durante los últimos años19,20. Es por esto que el Colegio Americano de Obstetricia y Ginecología (ACOG) recomienda que todos los centros obstétricos cuenten con una guía multidisciplinaria del manejo de hemorragia masiva, la cual debe incluir un PTM15.
Elementos del PTM
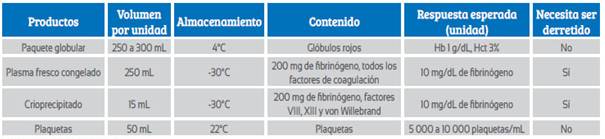
La forma más efectiva de reemplazar las pérdidas sanguíneas es mediante el empleo de sangre total21,22. El problema con este producto es que no está rápidamente disponible en muchos bancos de sangre. Es por esto que muchos protocolos se basan en el uso de los distintos productos sanguíneos, los cuales son presentados en la Tabla 1.
El paquete globular se obtiene tras centrifugar la sangre total y separarlo del plasma. La unidad globular contiene aproximadamente 250 mL. El hematocrito en una unidad es de 55 a 65% e incrementa la hemoglobina sérica en 1 g/dL y el hematocrito en 3%.
Para poder obtener plaquetas es necesario separarlas por centrifugación en sangre colectada no más de 8 horas antes. Una unidad de plaquetas obtenida de una unidad de sangre total aumenta el número de plaquetas en 5 000 a 10 000/mL. La dosis de plaquetas es 1 U por 10 kg de peso. Cada unidad contiene un pool de 6 paquetes de plaquetas.
El PFC contiene todos los factores de coagulación, incluyendo los factores lábiles como V y VIII. Es importante recalcar que el ratio normalizado internacional (INR, por sus siglas en inglés) aproximado del PFC es 1,6. El PFC contiene 2 gramos de fibrinógeno por cada 1 000 mL. Una unidad de PFC (200 a 250 mL) incrementa el fibrinógeno sérico en 10 mg/dL. Una unidad de plasma fresco congelado (PFC) puede ser almacenada hasta un año a -18°C o hasta 7 años a -65°C. Una vez derretido, el PFC debe ser usado dentro de los siguientes 5 días.
El crioprecipitado se obtiene al retirar el sobrenadante de un PFC derretido. La principal ventaja del crioprecipitado es su alta concentración de fibrinógeno. El crioprecipitado contiene 2 gramos de fibrinógeno por cada 100 mL. La dosis usual en un adulto es de 10 unidades, elevando el fibrinógeno sérico 100 mg/dL. Las desventajas del crioprecipitado son el tiempo que toma en ser derretido y el riesgo de transmisión de virus. Es importante recalcar que, en casos de hemorragia severa, la recomendación es mantener el nivel sérico de fibrinógeno por encima de 150 a 200 mg/dL. En pacientes con hemorragia obstétrica, un nivel de fibrinógeno menor a 200 mg/dL tiene un valor predictivo positivo de 100% para la progresión a hemorragia severa23,24.
El ácido tranexámico (ATX) ha sido incluido en muchos PTM, gracias a su propiedad antifibrinolítica. El ATX inhibe la degradación de fibrina al inhibir la acción de plasmina25. En pacientes con hemorragia severa, el uso de ATX aumenta la supervivencia sin un aumento en el riesgo de eventos tromboembólicos26. En la población obstétrica, ATX ha demostrado ser seguro, de bajo costo y efectivo en casos hemorragia posparto25,27. La dosis de 1 gramo endovenoso de ATX, administrado dentro de las primeras 3 horas del diagnóstico de hemorragia posparto, ha mostrado disminuir el riesgo de muerte por sangrado27.
El factor recombinante activado VII es un producto para el manejo de hemofilias e inhibe la degradación de los factores VIII y IX28. Este producto fue incluido en muchos PTM. Recientemente, algunos estudios han encontrado un incremento en el número de eventos tromboembólicos en pacientes que recibieron este medicamento29. Por otro lado, la evidencia con respecto al uso de este producto como parte de PTM no ha determinado un beneficio en supervivencia30. Debido a los riesgos asociados a este producto, además de su alto costo, no es recomendado como parte rutinaria de un PTM.
Composición del PTM
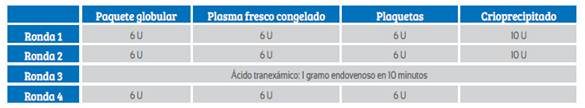
El PTM debe contener paquetes globulares de tipo O Rh negativo, PFC del tipo AB y plaquetas. Si bien estos son los componentes principales, todavía existen controversias sobre cuál es la ratio ideal de dichos productos. Muchos usan una ratio de administración de productos de 1:1:1 entre paquete globular, PFC y plaquetas de aféresis (o un pool de 6 plaquetas por cada 6 paquetes globulares). Este protocolo es el que ha sido adaptado por algunos hospitales del MINSA-Perú.
Una limitación al evaluar la evidencia de distintos PTM es la heterogeneidad y sesgos de algunas observaciones. Estudios retrospectivos han mostrado una mayor tasa de supervivencia en pacientes que recibieron una ratio alta de PF-
C:paquete globular31,32. La mayor limitación de estos resultados es la diferencia de tiempos para obtener un paquete globular (18 minutos) y uno de PFC (1 hora)33. Es posible que los pacientes que sobrevivieron hasta poder recibir el PFC no estaban tan enfermos como el grupo de controles.
Un estudio aleatorio que comparó ratios de 2:1:1 y 1:1:1 (paquete globular:FPC:plaquetas) no mostró diferencia en mortalidad a las 24 y 30 horas entre ambos grupos. Por otro lado, el grupo 1:1:1 tuvo un menor número de muertes por sangrado durante las primeras 24 horas y un mayor número de pacientes logró hemostasia34.
La muestra un protocolo sugerido. Una vez activado el banco de sangre, envía a sala de operaciones los productos sanguíneos como están descritos en la tabla. Si el protocolo no es desactivado, el banco de sangre seguirá enviando los productos. Si es que el PTM sigue activado luego de la ronda 4 y la paciente sigue inestable, el protocolo empieza nuevamente desde la ronda 1.
Las pruebas de coagulación deben ser enviadas de manera periódica. Es importante recalcar que, durante el manejo del shock hemorrágico, el nivel de fibrinógeno sérico se debe mantener entre 150 y 200 mg/dL.
Indicaciones Para la activación del PTM
Otro punto controversial es cuándo activar el PTM, ya que la evidencia es limitada15. En la práctica, esta es una decisión tomada por el cirujano y anestesiólogo. Pacheco y col. sugirieron la activación del PTM cuando: a) se anticipa que en las siguientes dos horas se necesite transfundir un volumen mayor al 50% del volumen sanguíneo de la paciente; b) si el sangrado continúa activo luego de 4 unidades de globulares en un periodo corto de tiempo; o, c) si la presión sistólica está por debajo de 90 mmHg y los latidos cardiacos por encima de 120 en una paciente que está sangrando activamente9.
Complicaciones de la transfusión masiva
Las complicaciones incluyen la toxicidad por citrato (usado como preservante de los productos sanguíneos almacenados), la cual se manifiesta como disminución de la contractilidad cardiaca y de la resistencia vascular periférica, así como hipercalemia e hipocalcemia35. La transfusión masiva de productos sanguíneos aumenta el riesgo de reacciones a transfusión, como por ejemplo daño pulmonar agudo, daño renal agudo, hipersensibilidad y fiebre36. El riesgo de complicaciones infecciosas también aumenta en estos casos15.
Conclusiones
La hemorragia severa sigue siendo una causa común de muerte materna en el Perú. El manejo de shock hemorrágico con resucitación hemostática ha mostrado tener un impacto importante en la supervivencia. Por ello se recomienda que los centros obstétricos cuenten con un protocolo de transfusión masiva, el cual debe ser basado en la evidencia y propuesto de manera conjunta con otros servicios de dicho hospital. El desarrollo del PTM no solo promueve el acceso a productos sanguíneos de manera eficiente, sino también el manejo multidisciplinario de la paciente con shock hemorrágico.