Introducción
Los inhibidores de los cotransportadores sodio-glucosa tipo 2 (SGLT2, por sus siglas en inglés) reducen la hiperglicemia al aumentar la glucosuria. Algunos efectos, además del control metabólico, son la reducción del peso, presión arterial y ácido úrico, así como de la mortalidad cardiovascular1. Los eventos adversos más comunes son las infecciones micóticas genitales2 y existen advertencias sobre el riesgo de cetoacidosis3 y fracturas óseas1,4. En relación a la cetoacidosis, Blau y col.5) publicaron en el año 2017, basándose en el FDA Adverse Event Reporting System (FAERS), que el uso de este grupo de medicamentos incrementaba el riesgo de cetoacidosis siete veces en comparación con los inhibidores de la enzima dipeptidil peptidasa tipo 4 (DPPIV).
El objetivo del presente artículo es compartir la experiencia en la severidad de un cuadro de cetoacidosis posterior a una intervención quirúrgica, en paciente que usaba empagliflozina.
Caso clínico
Paciente femenina de 42 años de edad con diabetes mellitus tipo 2 (DMT2) de 3 años de evolución, tratada con metformina 850 mg VO c/24 h y empagliflozina 12,5 mg VO c/12 h; presentaba obesidad mórbida y leiomiomatosis uterina. Ingresó a la unidad hospitalaria el día 03-10-16 por sangrado uterino anormal continuo hasta el día 1010-16, y dismenorrea. El ultrasonido pélvico del 04-10-16 fue informado como útero de 65 x 50 x 60 mm con miomatosis uterina de pequeños elementos tipo intramural, anexos sin alteraciones.
Durante su estancia hospitalaria requirió aporte de hemoderivados y hematínicos para mejorar la perfusión tegumentaria y cardiopulmonar. Se realizó biopsia de endometrio mediante aspiración manual endouterina hemostática, por sangrado uterino anormal. El reporte histopatológico fue de lesión intraepitelial de grado bajo, por lo que se decidió practicar histerectomía total abdominal. Durante su estancia se mantuvo con dieta de 1 500 kcal y ayuno no mayor a 8 horas y sin fármaco SGLT2 previo a la intervención quirúrgica el día 12-10-16.
A las 6 horas del posquirúrgico presentó taquicardia (140 lpm), presión arterial 90/60 mmHg, sin sangrado ni complicaciones en la herida operatoria o poliuria, con desorientación y mal estado general. Gasométricamente tuvo pH 6,98, 2, pCO2 8 mmHg, pO2 96 mmHg, HCO3 3 mmol. Fue trasladada al Hospital Materno-Perinatal "Mónica Pretelini Sáenz" (HMPMPS), en la ciudad de Toluca, México, debido a ausencia de ventiladores mecánicos en el hospital de procedencia. En urgencias del HMPMPS fue recibida con estado neurológico deteriorado (Glasgow 7 puntos, O-2, V-1, M-4), iniciándose manejo avanzado de la vía aérea, sedación e ingreso a la unidad de cuidados intensivos (UCI). Los datos del taller hemodinámico (Tabla 1) indicaron respuesta inflamatoria sistémica, por lo que se agregó antibioticoterapia de amplio espectro (carbapenémico, nitroimidazol y antifúngico).
Tabla 1 Taller hemodinámico.
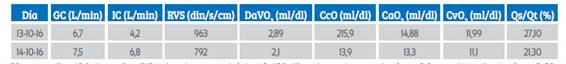
GC: gasto cardíaco, IC: índice cardíaco, RVS: resistencias venosas sistémicas, DaVO2: diferencias arteriovenosas de oxígeno, CcO: contenido capilar de oxígeno, CaO2: concentración arterial de oxígeno, CvO2: concentración venosa de oxígeno, Qs/Qt: shunt intrapulmonar
La paciente respondió parcialmente a la reposición hídrica con cristaloides. El estado ácido base fue manejado con aporte de bicarbonato a un tercio de los requerimientos totales (477 mEq). La evolución gasométrica se muestra en la Tabla 2.
Tabla 2 Gasometría arterial.
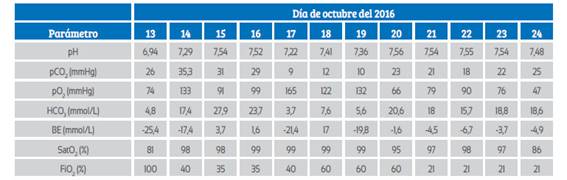
pH: acidez o alcalinidad, pCO2: presión parcial de dióxido de carbono, pO2: presión parcial de oxígeno, HCO3: bicarbonato, BE: déficit de base, SatO2: saturación de oxígeno, FiO2: fracción inspirada de oxígeno.
La paciente continuó con evolución tórpida, necesitando manejo con hemodiálisis por acidosis refractaria (dos sesiones), con buena respuesta inicial. Pero, 48 horas después de la segunda sesión, nuevamente se documentó acidosis metabólica, por lo que se inició manejo con diálisis peritoneal, completando un total de 17 recambios de solución dializante al 1,25%.
La paciente se mantuvo en apoyo mecánico ventilatorio por un total de 440 horas y con amina presora por 36 horas. La Tabla 3 muestra la evolución de la química sanguínea. Hematológicamente solamente tuvo leucocitosis los dos primeros días de su atención.
Tabla 3 Química sanguínea.
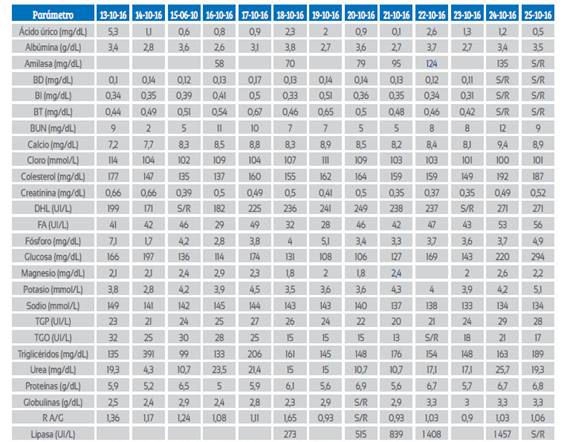
BD: bilirrubina directa, BI: bilirrubina indirecta, BT: bilirrubina total, BUN: nitrógeno ureico, DHL: deshidrogenasa láctica, FA: fosfatasa alcalina, TGP: transaminasa glutámico pirúvica, TGO: transaminasa glutámico-oxalacética, R A/G: relación albúmina/globulina, S/R: sin reactivo.
Una vez que se logró extubar a la paciente y revertir la acidosis, se optó por mantener el control metabólico con insulina NPH, egresando la paciente de la UCI después de 13 días de estancia. Permaneció en hospitalización 4 días más para continuar el ajuste en la dosis de insulina, luego de lo cual fue dada de alta en buena condición general.
Discusión
La empagliflozina puede ser usada sola o combinada con metformina6. Los resultados mostrados con su uso están en relación a factores dependientes del propio paciente, como la edad, comorbilidades asociadas, grado de control glicémico y la presencia de tratamientos concomitantes7,8.
Se ha observado en diversos estudios clínicos la eficacia de empagliflozina mediante la disminución de la HbA1c en monoterapia, con descenso de -0,74% (con dosis de 10 mg) y de -0,85 (con dosis de 25 mg). Asociada a metformina, se ha conseguido descensos más significativos en comparación con placebo, a las 24 semanas, -0,57% y 0,64% para las dosis de 10 mg y 25 mg, respectivamente. Así mismo, se ha notado disminución del peso corporal. No obstante el éxito con su uso, cabe mencionar que la eficacia y duración del efecto depende del grado de conservación de la función renal3.
Por otra parte, además del riesgo incrementado de infecciones genitales fúngicas y urinarias, principalmente en mujeres, y que solo en un pequeño porcentaje son graves, los inhibidores de SGTL2 pueden depletar el volumen intravascular secundario a la diuresis osmótica, llevando incluso a hipotensión y síncope, así como a alteraciones electrolíticas. Sin embargo, este cuadro es de predominio en personas de edad avanzada3.
En cuanto a la cetoacidosis diabética en pacientes tratados con SGLT2, se hace necesario considerar la presencia de sintomatología inespecífica, como náuseas, vómito, dolor abdominal, anorexia, sed excesiva, disnea, confusión, cansancio, somnolencia, todo esto con niveles de glicemia inclusive menores a 250 mg/dL, sugiriéndose siempre la determinación de cuerpos cetónicos.
Es obligatorio buscar las causas que pueden predisponer la presencia de cuerpos cetónicos, tales como la deshidratación, restricción de ingesta calórica, reducción de peso, infecciones, cirugía, vómitos, reducción de la dosis de insulina, mal control de la diabetes o ingesta de alcohol9,10. Todo esto fue descartado en nuestra paciente, quedando la duda sobre si los bajos niveles de insulina y péptido C fueron ocasionados por un tipo de insulitis por empaglifozina, o si estos niveles ya venían descendiendo antes del cuadro.
Posterior a la revisión de la información disponible acerca de los efectos secundarios de los inhibidores de SGLT2, concretamente empagliflozina en combinación con metformina y en relación al caso clínico referido, con los síntomas presentados consideramos el diagnóstico de cetoacidosis diabética, aún sin hiperglicemias mayores a 250 mg/dL, por el tratamiento interrumpido por ayuno para la histerectomía total abdominal, sin procesos infecciosos agregados. Cabe mencionar que existe un grupo susceptible representado por los pacientes con diabetes autoinmune latente del adulto (LADA)11) y que son diagnosticados como diabéticos tipo 2, aunque este diagnóstico no pudo ser corroborado en nuestra paciente.
La cetoacidosis en pacientes manejados con SLGT2 se presenta en forma atípica con síntomas inespecíficos y glicemia por debajo de 250 mg/dL7,9. Sin embargo, estos casos han ocurrido en los primeros meses de tratamiento y coinciden con otros factores de riesgo que conllevan a cetoacidosis12.
La cetoacidosis diabética presentada en la paciente fue considerada en primera instancia por deficiencia de insulina. Sin embargo, los niveles de insulina se encontraban en niveles bajos, pero aún en rango de referencia, sin evidencia de glicemias centrales mayores a 250 mg/dL desde el inicio del cuadro patológico. Por otra parte, fue llamativa la elevada producción de cuerpos cetónicos con la consecuente acidosis metabólica, con un mal pronóstico de inicio, ya que incluía datos de hipotensión, deshidratación, inestabilidad neurológica. Llamó la atención la ausencia de factores ya conocidos como gatillo de inicio para el cuadro de una cetoacidosis, como lo son infecciones, tratamiento insulínico inadecuado, trastorno de conducta alimentaria, pancreatitis, infarto agudo al miocardio, accidente cerebrovascular o fármacos como diuréticos, esteroides, antipsicóticos o simpaticomiméticos.
Es sabido el manejo de la cetoacidosis diabética con solución salina IV al 0,9% para compensar la pérdida de hasta 10% del peso corporal, y de insulina endovenosa a razón de 0,1 UI/kg/h, bicarbonato y electrolitos, de acuerdo al déficit que se muestre. Todos ellos fueron llevados a cabo en la paciente, sin respuesta en las primeras 24 h, por lo que se justificó el uso de hemodiálisis y posteriormente diálisis peritoneal, lo que representa un caso severo y poco usual hasta ahora en la literatura publicada7,9,10,13.
Después de hacer una búsqueda exhaustiva, encontramos un caso parecido reportado por Bteich y col.14) en una paciente de 58 años sometida a neurocirugía y que presentó el cuadro 48 horas después de la intervención, siendo necesario su manejo en terapia intensiva. Coincidimos con su grupo que habría que considerar implementar un esquema de insulina previo a la cirugía para disminuir el riesgo de cetoacidosis.
Concluimos que una cetoacidosis diabética secundaria a inhibidor de SGTL2 puede ser tan severa que requiera hemodiálisis o diálisis peritoneal por las condiciones críticas a las que puede llegar el paciente; por lo que el uso de SGTL2, si bien ha probado tener importantes beneficios15,16, no está exento de riesgos17. Y tal como lo han postulado otros autores, debe advertirse al paciente acerca de los mismos y actuar con cautela en pacientes de riesgo18 -difíciles de identificar-, pues no a todos se les puede pedir anticuerpos o niveles de insulina antes de iniciar el tratamiento.
Finalmente, es muy importante reforzar la cultura del reporte de efecto adverso de los medicamentos, primero a nivel institucional, siendo el caso para México los Comités de Calidad y Seguridad del Paciente (COCASEP) y, a nivel nacional, la Comisión Federal para la Protección contra Riesgos Sanitarios (COFEPRIS). En nuestro caso hicimos el reporte de este evento ante la Food and Drug Administration (FDA). Recordemos que, ante todo, nuestro compromiso es con la seguridad de los pacientes; y, aunque un medicamento sea excelente, si produce un efecto adverso, estamos en la obligación de reportarlo.














