Introducción
El depósito fibrinoide perivelloso masivo o infarto del piso materno de la placenta es una entidad poco frecuente, con incidencias de 0,3 a 0,5% del total de gestaciones (1. El exacto mecanismo fisiopatológico de este depósito de material ‘fibrinoide’ alrededor de las vellosidades coriales es desconocido y se ha propuesto asociación con diversas etiologías: infecciones, enfermedades autoinmunes (lupus), síndrome antifosfolipídico, coagulopatía materna, desequilibrio antiangiogénico e intervellositis crónica (1-3. La mayoría de series son retrospectivas y se basan en el análisis de las placentas en relación a restricción de crecimiento, óbito fetal y mal resultado perinatal. Nosotros presentamos el primer caso documentado en el país de restricción severa del crecimiento intrauterino con placenta anormal a la ultrasonografía y resultado anatomopatológico final con depósito fibrinoide perivelloso masivo.
Caso clínico
Primigesta de 36 semanas con 2 días, datado por ecografía precoz, fue evaluada por emergencia por disminución de movimientos fetales. Al examen físico, la altura uterina era 27 cm.
Se realizó ultrasonido, obteniéndose medidas de diámetro biparietal (BPD) 84 mm (percentil 4), circunferencia craneana (CC) 308 mm (p<3), circunferencia abdominal (CA) 281 mm (p<3), longitud del fémur (LF) 59 mm (p<3), con ponderado fetal de 1 921 g +/- 284 g, p<3 para edad gestacional (EG), oligohidramnios. Placenta corporal anterior engrosada (67 mm) de aspecto heterogéneo, con múltiples zonas hiperecogénicas en la base placentaria o que comprometían todo el grosor; zonas hipoecogénicas en el centro del cotiledón sugerentes de trombosis perivellositaria (Figura 1). Al estudio con Doppler. se encontró índice de pulsatilidad (IP) de arteria umbilical (AU) en 1,26 (adecuado para EG), IP de arteria cerebral media (ACM) 0,92 (alterado, con percentil <5 para EG) y pico sistólico en 72 cm/s (mayor a 2,5 Mom para EG), ductus venoso con IP 0,61 y arterias uterinas IP promedio 0,8 (adecuado para EG). Se catalogó como restricción de crecimiento intrauterino de inicio tardío, con signos de redistribución de flujo y placentomegalia.
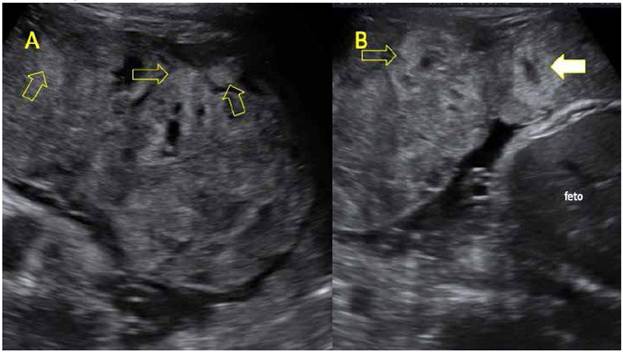
Figura 1 A-B imagen de ultrasonido de placenta de aspecto heterogéneo. las Flechas amarillas señalan zonas hiperecogénicas en la cara materna que corresponden con zonas de depósito FiBrinoide perivelloso masivo. Flecha Blanca: zona hipoecogénica central en el cotiledón, sospechosa de tromBo intervelloso.
Se terminó la gestación por cesárea de emergencia, con un recién nacido de sexo femenino peso 2 155 g, talla 44 cm y Apgar 8 al minuto y 9 a los 5 minutos. El examen macroscópico de la placenta mostró en la mayoría de los cotiledones en cara materna coloración gris-amarillenta, cara fetal de coloración amarillenta. Al corte seriado, se evidenció cara materna de coloración amarillenta blanquecina de grosor variable, con algunas zonas donde se extendía hasta la cara fetal, formando tractos irregulares; algunos cotiledones con trombo perivelloso (figuras 2 y 3). La macroscopia y microscopia mostraron depósito de material fribrinoide difuso en más del 50% de las vellosidades desde la cara materna hasta la cara fetal. En algunas zonas se observó también trombos perivellosos (Figura 4). El recién nacido evolucionó favorablemente, sin necesidad de soporte avanzado, y fue dado de alta de neonatología a los 7 días.
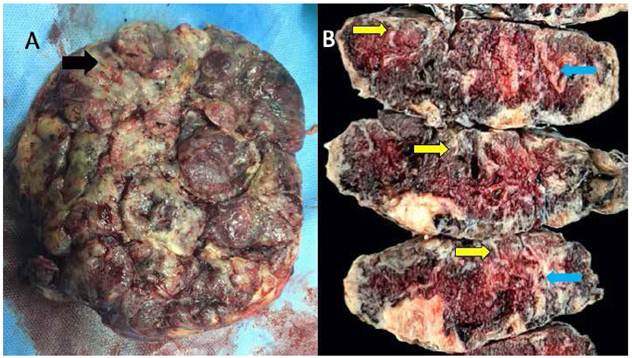
Figura 2 A Imagen de la cara materna placentaria. Se observa la coloración gris-amarillenta de los cotiledones comprometidos con zonas de depósito fibrinoide perivelloso masivo (flecha negra). B. cortes seriados macroscópicos de placenta donde se observa en lado materno banda amarillenta de diverso grosor en todos los cortes (flecha amarilla), que compromete grosor total en algunas zonas (flecha celeste).
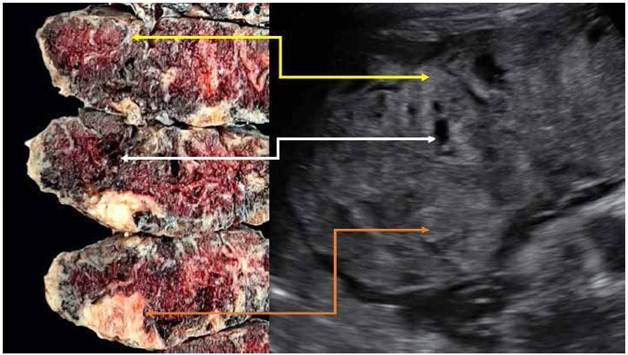
Figura 3 Se muestra la correlación entre los hallazgos patológicos y del ultrasonido. flecha amarilla: zona hiperecogénica en el ultrasonido que corresponde con depósito fibrinoide perivelloso (infarto de piso materno). Flecha Blanca: zona hipoecogénica al ultrasonido que corresponde con trombosis perivellosa. Flecha anaranjada: zona hiperecogénica cercana a la cara fetal placentaria, que se corresponde con infarto placentario.
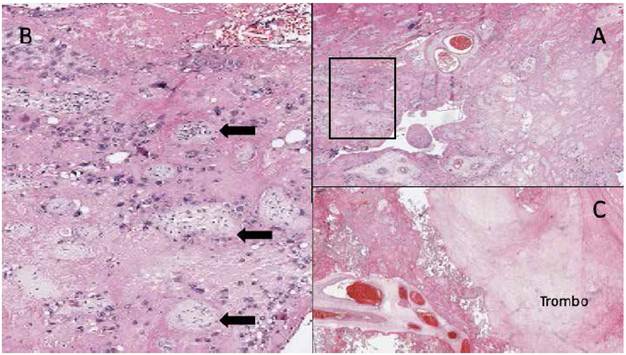
Figura 4 a. Visión panorámica de lámina que muestra la fibrina perivellosa que se extiende desde la superficie materna a la Fetal y encierra ≥ 50% de las vellosidades en ≥ 1 lámina. B. ampliación de recuadro de imagen a, donde se observa las vellosidades coriales (flechas negras) rodeadas de material fibrinoide abundante. c: lámina que muestra trombo perivelloso rodeado de vellosidades coriales con fibrina.
Discusión
El término infarto de piso materno (IPM) fue propuesto por Benirschke y Driscoll4, para describir el depósito de material fibrinoide en la cara materna (no constituye un verdadero fenómeno oclusivo vascular). Fox5, posteriormente definió al depósito fibrinoide perivelloso masivo (DFPM) como el depósito de fibrina que compromete la mayor parte de la placenta, pudiendo llegar a ser transmural. En la literatura, ambos términos han sido utilizados de forma semejante, al ser considerados como parte del espectro de la misma enfermedad. Katzman2 propuso clasificarla de forma semicuantitativa: infarto de piso materno (material fibrinoide en cara materna de más de 3 mm de grosor), DFPM transmural o severa (material fibrinoide que se extiende de cara materna a fetal con más del 50% de las vellosidades comprometidas en una lámina), DFPM borderline o moderada (material fibrinoide que se extiende de forma transmural o casi-transmural con 25 a 50% de las vellosidades comprometidas en una lámina), y no clasificable.
El diagnóstico es anatomopatológico, mos-lares y serpiginosas que pueden estar confitrando la placenta a la macroscopia una cara nadas a la cara materna o atravesar todo el materna de aspecto blanquecina, grisácea o espesor placentario3, características que se amarillenta. Los cortes seriados de placenta observó claramente en el presente caso (fimuestran zonas blanco-amarillentas irregu-guras 2 y 3). Microscópicamente, se observa el depósito perivellositario de la sustancia ‘fibrinoide’ que oblitera el espacio, sin colapsarlo (mixtura de proteínas sanguíneas como fibrina, colágeno de membrana basal, fibrinógeno, fibronectina, laminina), envolviendo vellosidades coriales viables o atróficas. La Figura 4 muestra la imagen que estableció el diagnóstico histológico en nuestro caso; frecuentemente se asocia a trombosis perivellosa, vellitis isquémica, deciduitis de células plasmáticas y vellitis de significado incierto2,3,6,7.
Al ultrasonido se puede observar placentas con zonas heterogéneas hiperecogénicas en la cara materna, que se pueden extender hacia la cara fetal, habitualmente acompañadas de engrosamiento placentario8,9. Se muestra estas zonas hiperecogénicas en la Figura 1. Es frecuente la asociación con otras imágenes al ultrasonido, sugerentes de trombosis perivellosa e infartos placentarios8,9. La Figura 3 intenta correlacionar lo que se observa al ultrasonido con la macroscopia placentaria, mostrando que las zonas heterogéneas hiperecogénicas se corresponden con depósito fibrinoide perivelloso.
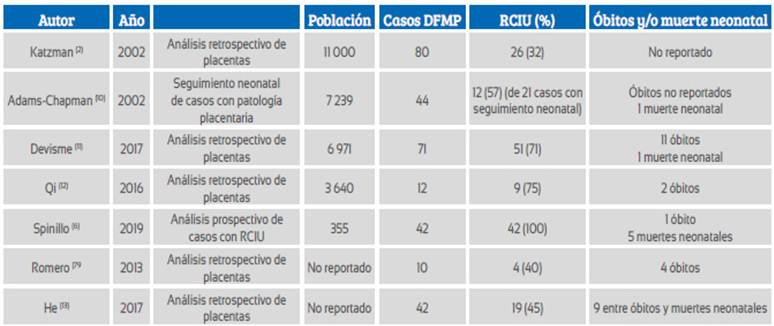
La presentación clínica más frecuente es la restricción de crecimiento intrauterino (RCIU), con incidencia entre 31 y 100%. Puede ser de inicio precoz o tardío y, en algunas ocasiones, se ha comunicado alteración del Doppler fetal o materno. La Tabla 1 resume las principales series en relación con RCIU. Devisme11, en 6 971 placentas, encontró 71 casos de DFPM, clasificándolos como casos severos (50% de las vellosidades comprometidas en una lámina) o moderados (25 a 50%). La incidencia de RCIU aconteció en 93% y 82% de los grupos, respectivamente, con alteraciones del Doppler de las arterias uterinas en la mitad de todos los casos. Así también, los DFPM severos presentaron 60% de casos con alteración del Doppler de la arteria umbilical versus 25% en DFPM moderado. Spinillo6, en una serie prospectiva de 355 fetos con RCIU, encontró 11,8% de incidencia global de DFPM, siendo los casos severos 3,1% y moderados 8,7%. El deterioro del Doppler fetal fue más frecuente en los casos severos, alterando principalmente el índice de pulsatilidad (36% vs 22%), sin llegar a mostrar diferencias para onda diastólica reversa/ausente. De la misma forma, la vasodilatación de la arteria cerebral media fue más frecuente en los casos severos (54% vs 25%). Esto pone en evidencia que la insuficiencia placentaria no sería la única explicación al resultado adverso perinatal, y sí la concomitancia de alteraciones vasculares placentarias e inflamación, aun no bien explicadas. Spinillo14, en 54 casos de placentas compatibles con DFPM y RCIU, encontró que estos mostraron un riesgo incrementado para alteraciones del Doppler de la arteria umbilical (OR 1,2, IP >percentil 95, y 2,1 para diástole reversa/ausente), sin evidenciarse mayor compromiso del Doppler en relación con la severidad del DFPM. En la ACM, en nuestro caso, se encontró vasodilatación y un índice cerebro placentario alterado, lo que evidencia redistribución del flujo en relación a insuficiencia placentaria. Llama la atención el aumento de la velocidad sistólica máxima de la ACM. que no tiene una explicación clara.
Tabla 1 Series publicadas de depósito fibrinoide perivelloso masivo y su relación con restricción del crecimiento intrauterino.
Otra forma de presentación clínica frecuente es el óbito fetal, que se encuentra entre 17 y 50% de las series (2,11,15 (ver tabla 1). En el 19% de 575 placentas de óbitos fetales, Man16 halló patología placentaria identificable, siendo el 10% de estas DFPM, las cuales en su mayoría fueron óbitos del tercer trimestre. Así también, Devisme11 informa un 9% de óbito fetal en los casos de DFPM severo y 2% en los moderados.
Un aspecto muy importante en el manejo de DFMP es el riesgo de recurrencia en las siguientes gestaciones, que puede llegar hasta 30%2-13. Basado en esto, el análisis de la placenta en los casos de RCIU es de vital importancia con miras a las próximas gestaciones. Algunos tratamientos se han reportado en casos puntuales en la literatura como el uso de aspirina y/o heparina de bajo peso molecular, con buenos resultados perinatales en las posteriores gestaciones evitando la recurrencia13,17.











 texto en
texto en 


