Introducción
La enfermedad de COVID-19 se propaga rápidamente en la población mundial, desde formas asintomáticas hasta casos severos1, ocasionando una mortalidad global de 5,98%, que varía según regiones2. En el contexto de la emergencia sanitaria en el Perú y el mundo, es importante conocer los grupos vulnerables, siendo las mujeres gestantes un grupo particularmente susceptible3,4. En estudios previos de coronavirus se ha comunicado resultados maternos adversos5; sin embargo, aún no está claro el efecto que puede tener el nuevo coronavirus SARSCoV-2 sobre el embarazo y el feto6,7. La mayoría de las gestantes son asintomáticas, pero cuando presentan síntomas, los más frecuentes son fiebre, tos y disnea, a semejanza de las pacientes no embarazadas3.
La clínica de la enfermedad se divide en tres períodos: fase de viremia, fase aguda y fase de recuperación. Se puede aplicar pruebas diagnósticas, tanto moleculares RT-PCR como detección serológica de inmunoglobulinas, según indicaciones específicas8. A pesar que la prueba molecular RT-PCR es recomendada para el diagnóstico, esta se ve limitada en escenarios donde los recursos son limitados para su desarrollo e implementación; mientras tanto, las pruebas serológicas contribuyen al diagnóstico clínico y la vigilancia epidemiológica9,10. Las pruebas serológicas pueden ser útiles para la identificación de infecciones asintomáticas, y contribuir al diagnóstico clínico en pacientes que no se hayan realizado pruebas moleculares11,12. Más aun, en un contexto donde la curva de infecciones se encuentra creciente y los recursos son limitados10.
El objetivo de esta investigación fue determinar la prevalencia y características clínico-epidemiológicas de las gestantes con anticuerpos antiSARS-CoV-2 atendidas en el Instituto Nacional Materno Perinatal.
Métodos
El presente es un estudio observacional de tipo transversal, con estrategia descriptiva y asociativa. Fue realizado en el Instituto Nacional Materno Perinatal (INMP), establecimiento dependiente del Ministerio de Salud del Perú, del tercer nivel de atención, con categoría III-2, el cual es centro de referencia nacional en Perú. Debido a la declaratoria del estado de emergencia sanitaria a nivel nacional por la pandemia de COVID-19, actualmente solo realiza atenciones en el servicio de emergencia y efectúa pruebas serológicas de anticuerpos anti-SARS-CoV-2 a toda gestante que tenga criterios de hospitalización, indicado por el médico especialista, para la atención del parto o por morbilidad en el embarazo.
En el estudio participaron todas las mujeres embarazadas atendidas en el Instituto Nacional Materno Perinatal de Lima, Perú, entre el 15 de abril y 15 de mayo del 2020, que cumplieron los siguientes criterios de inclusión: a) ingreso a hospitalización por indicación del médico especialista; b) haber realizado la prueba serológica anti-SARSCoV-2 al momento de la atención; c) tener resultado de la prueba serológica anti-SARS-CoV-2. Los criterios de exclusión fueron: a) historial médico con subregistro para las variables de estudio; b) no contar con el resultado de la prueba serológica aplicada al ingreso de hospitalización.
La prueba serológica utilizada en la Institución fue el One Step Test Kit Covid-19, prueba rápida que cuenta con la certificación y autorización de la Comunidad Europea, obligatoria para los insumos que se fabrican en Asia y comercializan en el Espacio Schengen. En la prueba se utilizó como muestra el suero/ plasma, y el método de inmunocromatografía para detectar simultáneamente las inmunoglobulinas IgM e IgG, cuyo rendimiento viene en las especificaciones del inserto de la prueba. Para la detección de la inmunoglobulina IgM, la sensibilidad es 94% y la especificidad 100%, con una coincidencia total de 97,1%. Para la detección de la inmunoglobulina IgG, la sensibilidad es 94% y la especificidad de 100%, con coincidencia total de 97,1%. Para la detección de ambas inmunoglobulinas, la sensibilidad conjunta es 97,6%, la especificidad conjunta 100%, con coincidencia total de 98,8%.
El procedimiento fue realizado por personal de laboratorio entrenado en la aplicación de dicha prueba, siguiendo las indicaciones en el inserto. La interpretación de los resultados procedió según presencia y/o ausencia de IgM o IgG, según indicaciones que viene en el inserto de la prueba. Para IgM negativo/IgG negativo: no hay infección o está en etapa muy precoz. IgM positivo/ IgG negativo: infección aguda en fase temprana. IgM positivo/IgG positivo: infección aguda en fase más evolucionada. IgM negativo/IgG positivo: fase de resolución de la infección.
Como variables del estudio, se consideró: edad materna indicada en años cumplidos previo al embarazo -adolescente (menor a 19 años), adulta (de 19 a 34 años) y edad materna avanzada (de 35 años a más)-; trimestre de gestación, según fecha de ultima regla o ecografía del primer trimestre; paridad, señalando como nulípara el no haber tenido un parto previo, primípara haber tenido un parto previo, y multípara, con dos o más partos previos; resultado de la prueba rápida, tanto IgM, IgG o ambas; controles prenatales, considerando como control adecuado al número de controles mayor o igual a 6; nivel educativo de acuerdo a los estudios realizados a nivel primaria, secundaria o superior; estado civil indicado como casada, conviviente, separada, soltera o viuda; síntomas respiratorios presentes o ausentes (correspondientes a tos, dolor de garganta, cefalea, fiebre, escalofrío y/o congestión nasal) presentados al ingreso hospitalario; tipo de complicación en el embarazo (aborto, amenaza de parto pretérmino, embarazo ectópico, hemorragia de segunda mitad del embarazo, hiperémesis gravídica, insuficiencia placentaria, preeclampsia, rotura prematura de membranas, trabajo de parto disfuncional, neumonía, infección urinaria); vía de parto según cesárea o parto vaginal.
Los resultados de la prueba rápida aplicada a cada gestante fueron obtenidos a partir de las fichas estandarizadas de pruebas serológicas de la oficina de Epidemiologia y Salud Ambiental del INMP, y la recolección de información materna, a partir de la historia clínica de cada gestante. Los sesgos de medición que se presentan en estudios retrospectivos al recoger la información, fueron disminuidos al comparar la información de cada ficha estandarizada de pruebas serológicas, realizado por un investigador, con la información respectiva en la historia clínica desde el ingreso de la paciente hasta su egreso con los diagnósticos definitivos, realizado por un investigador diferente.
Para la descripción de los resultados se utilizó estadística descriptiva bivariada mediante tablas de contingencia con resúmenes de frecuencias absolutas y relativas. El análisis inferencial consistió en la estimación de intervalos de confianza al 95%. Se realizó medidas de asociación cruzada entre variables empleando la prueba exacta de Fisher, con un nivel de significancia de 0,05. El procesamiento de los datos y la gráfica fue realizado en el software estadístico R versión 4,0.
En relación a las consideraciones éticas, la investigación tuvo la aprobación del Comité de Ética en Investigación del Instituto Nacional Materno Perinatal, y el permiso institucional correspondiente. Los datos fueron recogidos de forma retrospectiva y salvaguardando la identidad de las participantes.
Resultados
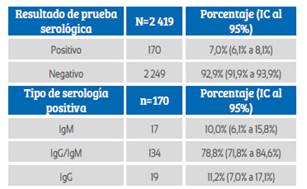
En el periodo de estudio se tamizó a 2 427 embarazadas que ingresaron a hospitalización. Se excluyó 8 pacientes por no contar con el historial médico al momento del estudio, por lo cual, el estudio se realizó con 2 419 pacientes que cumplieron con los criterios de selección establecidos. De ellas, 170 tuvieron anticuerpos anti-SARS-CoV-2, lo que significó una seroprevalencia de 7,0% (IC95%: 6,1% a 8,1%) en las embarazadas tamizadas. Entre los casos de seroprevalencia positiva, se observó IgM en 10% (IC95%: 6,1% a 15,8%), IgM/IgG en 78,8% (IC95%: 71,8% a 84,6%) e IgG en 11,2% (IC95%: 7,0% a 17,1%) (Tabla 1). El número diario de casos nuevos con anticuerpos anti-SARS-CoV-2 se mantuvo errático, sin mostrar una tendencia definida. Mientras tanto, el número de casos acumulados por día estuvo en ascenso durante el periodo de estudio (Figura 1).
Tabla 1 resultados de la prueba serológica para el virus sars-cov-2 en gestantes tamizadas ingresadas a hospitalización.
Fuente: Elaboración propia
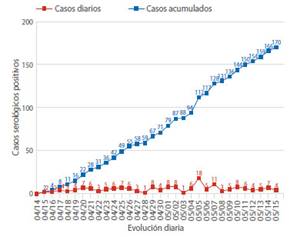
Figura 1 Descripción Diaria Del número casos nuevos y casos acumulaDos De gestantes con anticuerpos anti-sars-cov-2 al ingreso hospitalario.
Entre las gestantes que resultaron positivas a la prueba serológica, se observó con mayor frecuencia el tipo IgM/IgG, principalmente en la edad adulta y con edad materna avanzada. Ocurrió con mayor frecuencia en las gestantes atendidas durante el tercer trimestre de gestación, con control prenatal no adecuado, en primíparas y multíparas, convivientes, con nivel de educación secundaria y como ocupación ama de casa. No se encontró asociación entre estas características y el tipo de respuesta de anticuerpos anti-SARS-CoV-2 en la gestante (Tabla 2).
Tabla 2 asociación de características epidemiológicas y obstétricas según la respuesta de los anticuerpos anti-sars-cov-2.
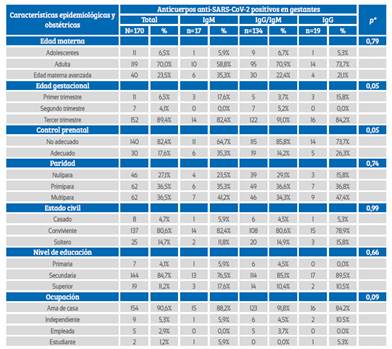
*prueba exacta de Fisher
Fuente: Elaboración propia
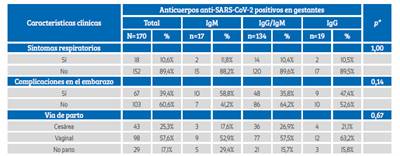
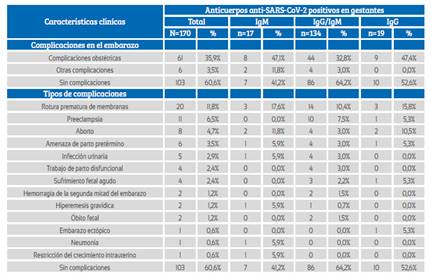
El 35,9% de las pacientes presentó complicaciones obstétricas, siendo más frecuentes la rotura prematura de membranas, la preeclampsia y el aborto espontáneo (Tabla 3). El 89,4% de gestantes fueron asintomáticas, 39,4% presentó algún tipo de complicaciones clínicas, y la vía de parto más frecuente fue la vaginal (57,6%); no se observó asociación entres estas características clínicas y el tipo de respuesta de anticuerpos antiSARS-CoV-2 (p>0,05) (Tabla 4).
Tabla 3 características clínicas de las gestantes ingresadas a hospitalización.
Fuente: Elaboración propia
Discusión
En breve lapso, los fabricantes de pruebas diagnósticas del mundo desarrollaron ensayos moleculares e inmunológicos para el diagnóstico del SARS-CoV-2. El criterio fundamental de la elección de estas pruebas para su adquisición y uso era la validación por alguna de las entidades de prestigio universal, como la Comunidad Europea (CE) y la Administración de Alimentos y Medicamentos (FDA) de los EE UU. En el presente estudio se ha utilizado un ensayo validado por la CE, con lo que se garantizó que los parámetros estuvieran dentro de los estándares aceptables internacionalmente.
A pesar que las pruebas serológicas son útiles para efectuar estudios que permiten determinar variables epidemiológicas de interés en salud pública13, aún existen reportes limitados de su aplicación en población de gestantes.
En el presente estudio, se observó una seroprevalencia de anticuerpos anti-SARS COV-2 de 7,0%, en las gestantes ingresadas a hospitalización. La prueba rápida aplicada cumplió la recomendación de detectar simultáneamente las inmunoglobulinas IgM e IgG10,12. Del total de gestantes con resultado positivo, se observó con mayor frecuencia IgM/IgG positivo. Los estudios sugieren que la mayoría de las pacientes se seroconvierten entre 7 y 11 días después de la exposición al virus10,11. Los hallazgos en la población estudiada representarían una posible infección de gestantes en la comunidad y que acuden a un centro especializado para atención del parto o por morbilidades. El profesional de la salud debe tener presente estos hallazgos, al momento de la atención y manejo integral correspondientes.
En el grupo de gestantes con resultado positivo a la serología anti-SARS-CoV-2, se observó mayor frecuencia en la edad adulta y añosa en comparación con la edad adolescente, de forma similar a la tendencia nacional14. En estudios previos, se ha identificado que la actual pandemia viene afectando principalmente a pacientes de mayor edad15, lo cual puede ser uno de los factores implicados también en las diferencias encontradas entre gestantes añosas y gestantes adolescentes. Las gestantes con resultado positivo con mayor frecuencia fueron gestantes convivientes, con nivel de educación bajo y amas de casa. Ello también refleja la tendencia de características socioculturales de la población de gestantes en Perú14. Así mismo, se debe considerar que la actual pandemia tiene una rápida propagación en la población peruana16, por lo cual su distribución sería similar entre las gestantes.
Las gestantes presentaron mayor frecuencia de resultado serológico positivo anti-SARS-CoV-2 durante el tercer trimestre, de manera similar a estudios recientes3,6. Uno de los factores implicados puede ser el actual sistema de controles prenatales, que son más continuos en el tercer trimestre17, así como a las morbilidades propias al término del embarazo, por las que las gestantes acuden a recibir atención17,18. No está claro aún el impacto del COVID-19 en la evolución propia del embarazo7.
En el estudio, 89,6% de las gestantes con prueba serológica positiva fue asintomática, siendo la frecuencia de síntomas respiratorios similar entre los tipos de respuesta de anticuerpos antiSARS-CoV-2. Estos hallazgos fueron parecidos a lo hallado por Sutton y col19 en Nueva York, pero utilizando prueba molecular de PCR, en el que 88% de las gestantes con infección por COVID-19 ingresadas para trabajo de parto eran asintomáticas. Vintzileos y col20 encontraron una menor proporción (66%) de asintomáticos. Por otro lado, debemos considerar que el rendimiento de la prueba depende de un factor difícil de mensurar y prever, que es el momento de la toma de muestra respecto al tiempo de enfermedad, el cual se puede calcular en los casos francamente sintomáticos, pero muy difícilmente en los asintomáticos u oligoasintomáticos, que según la mayoría de investigaciones alcanza de 80 a 85% de los infectados21. Estos resultados apoyan un tamizaje a toda gestante que ingresa a hospitalización, independientemente de la presencia o ausencia de síntomas respiratorios, ya que la mayoría de gestantes no presenta síntomas característicos, permitiendo a los establecimientos poder diferenciar la atención y el aislamiento respectivo de los casos positivos.
El 35,9% de las gestantes con anticuerpos positivos contra SARS-CoV-2 tuvo complicaciones obstétricas, con mayor frecuencia rotura prematura de membranas, preeclampsia y aborto espontáneo. Estos hallazgos fueron similares a estudios donde se empleó pruebas moleculares de PCR para identificar casos de enfermedad22. Mientras tanto, otros estudios hallaron mayor frecuencia de parto prematuro y restricción del crecimiento intrauterino3. También, se ha identificado la terminación del embarazo prematuramente, aunque estas mujeres además manifestaron complicaciones concurrentes, como preeclampsia, rotura prematura de la membrana, contracciones irregulares y antecedente de muerte fetal, sin poderse evidenciar si estas complicaciones estaban asociadas a la infección SARS-CoV-26.
En el estudio que se presenta, la vía de parto predominante entre las gestantes con prueba serológica positiva fue la vaginal (57,6%). Se observó que la indicación de cesárea fue por motivo obstétrico. En el periodo estudiado, la tasa de cesárea disminuyó a 25,3%, que es menor al histórico de nuestro hospital (43%) 23. Esto concuerda con la revisión realizada por Ashokka y col(24) y con el consenso de expertos25, en los que se recomienda que el modo de parto se base en indicaciones obstétricas, permitiéndose parto vaginal cada vez que sea posible y reservando la cesárea solo para cuando sea obstétricamente necesaria, no solo por la infección de la madre por el SARS-CoV-2. Sin embargo, existen estudios en gestantes con la infección por SARSCoV-2 en los que se incrementó la cesárea, no justificada por causas obstétricas ni gravedad de la enfermedad26,27, y disminuyó el parto vaginal entre 6,8%26) y 9,4% 27.
A pesar que se recogieron datos de una amplia población de gestantes, con prueba serológica empleada como tamizaje a toda paciente ingresada a hospitalización, existen limitaciones en el estudio, como la recolección retrospectiva de los datos y el uso de la prueba misma. Si bien, las pruebas serológicas no son de primera elección para el diagnóstico oportuno, son utilizadas cuando las pruebas moleculares no están disponibles o no sean fácilmente accesibles, como es el caso actual de nuestra población, ante un incremento de casos cada vez mayor y que saturan los servicios de salud. Por otro lado, los datos de sensibilidad y especificidad son variables en la literatura, y ello probablemente dependerá de la cinética de producción de anticuerpos en cada paciente, existiendo aun limitada literatura de su evaluación en población de gestantes.
En base a estos resultados se concluye que, en nuestro estudio, las gestantes con criterios de hospitalización para atención del parto o por morbilidad del embarazo presentaron una seroprevalencia de 7%. Mayormente, no mostraron evidencia clínica de infección y se encontrarían en una fase aguda más evolucionada, presentando anticuerpos anti-SARS-CoV-2 de tipo IgM/ IgG. Las complicaciones más frecuentes fueron la rotura prematura de membranas y la preeclampsia. No se evidenció asociación entre las características clínico-epidemiológicas analizadas y el tipo de respuesta de anticuerpos antiSARS-CoV-2.











 text in
text in