Introducción
El cáncer de cuello uterino es uno de los cánceres más comunes en las mujeres del mundo1. Se pronostican 585 278 casos nuevos y 327 899 muertes atribuibles en el 2010, presentándose más de 80 % de los casos en países en desarrollo. El cáncer de cuello uterino invasivo representa 15 % de los cánceres en las mujeres y ocupa entre el primer o segundo lugar entre los cánceres en las mujeres en 13 de las 23 regiones del mundo2.El cáncer de cuello uterino es causado por el virus del papiloma humano (VPH) y el conocimiento epidemiológico de la distribución de la infección por este virus en la población general es fundamental. Los virus del papiloma humano representan una familia heterogénea de virus de ADN doblemente distribuidos de la familia taxonómica Papillomaviridae3. Algunos tipos de papiloma humano tienen tropismo positivo por la piel y desempeñan un papel en el cáncer4. La técnica con más sensibilidad y especificidad en la detección del VPH, considerada el estándar de oro durante muchos años, es la reacción en cadena de la polimerasa (PCR) utilizando los cebadores de consenso MY09 y MY11, seguidos de secuenciación genética5. Los ensayos moleculares, específicamente la PCR, son muy eficaces en el diagnóstico del VPH6.
El objetivo del presente estudio es determinar la prevalencia de virus papiloma humano y factores asociados en pacientes de gineco-obstetricia con citología desconocida del norte del Perú.
Métodos
El presente es un estudio descriptivo de corte transversal. Se aplicó el muestreo no probabilístico consecutivo por conveniencia, el cual consistió en reclutar a todas las pacientes que cumplieron con los criterios de selección durante el periodo abril a junio del 2019. Las pacientes llenaron un cuestionario de preguntas cerradas con datos reproductivos, demográficos y de historia clínica sexual. Se recolectaron las muestras de cuello uterino del servicio de ginecoobstetricia durante el periodo, que fueron procesadas en el laboratorio de biología molecular del área de investigación del hospital.
El protocolo y el trabajo de investigación fueron aprobados por el Comité de Ética del Hospital Regional Lambayeque, Perú. Todas las mujeres participantes firmaron un consentimiento informado individual, previa explicación e información para la realización del estudio.
En la caracterización molecular de muestras, para el tratamiento previo se agitó con vórtex el tubo que contiene el citocepillo, a fin de desprender todas las células que pudieran quedar en el mismo. Se retiró con cuidado el citocepillo y la solución restante fue traspasada a un tubo de 1,5 mL. Se concentró la muestra por centrifugación a 12 000 rpm por 5 minutos, luego se eliminó todo el sobrenadante y se añadió el tubo blanco de extracción.
Para la extracción y purificación, se adicionó a la muestra 360 μL de buffer de lisis y 3 μL de β-mercaptoetanol. Se incubó durante 1 hora en baño maría a 65°C, agitando en vórtex cada 10 minutos. Se adicionó 90 μL de acetato de potasio 8 M y se centrifugó a 12 000 rpm por 5 minutos; luego, se recuperó el sobrenadante en otro tubo de 1,5 mL (se repitió este paso dos veces).
En la precipitación, se añadió 450 μL de isopropanol y se centrifugó a 12 000 rpm por 5 minutos; se eliminó el sobrenadante. Se lavó con 450 μL de etanol al 70% y se centrifugó a 12 000 rpm por 5 minutos. Luego se dejó secar hasta eliminar la humedad. Se resuspendió en 25 μL de H2O PCR.
La evaluación de calidad e integridad del ADN genómico se llevó a cabo mediante electroforesis en gel de agarosa, cuya concentración fue de 1% preparado con buffer tris-acetato-EDTA (TAE). Para esto se disolvió la agarosa en buffer tris-acetato-EDTA y se calentó en un microondas hasta su ebullición. En seguida se vertió en un soporte con el peine, esperando que gelificara. El gel listo fue colocado en la cámara de electroforesis conteniendo buffer tris-acetato-EDTA 1X. En los pocillos del gel de agarosa se cargó 1 μL de muestra previamente mezclado con 1 μL de tampón de carga y 8 μL de H2O PCR. Con la fuente de poder se aplicó corriente a 30V por 10 minutos, 70V por 30 minutos y 30V por 10 minutos. Transcurrido ese tiempo, el gel se tiñó en una solución con bromuro de etidio a concentración de 0,5 mg/mL. Luego se visualizó y capturó la imagen del ADN con la ayuda del foto-documentador Pharos Fx Plus. La calidad y cantidad de ADN fue determinado mediante electroforesis en geles de agarosa al 1%. La cuantificación se realizó usando un marcador con una concentración conocida.
El ADN que se extrajo fue amplificado mediante técnica de reacción en cadena de la polimerasa. Todas las muestras fueron amplificadas para los primers MY09 y MY11, y un control interno de calidad para verificar si fue ADN amplificable (betaglobina humana) con los primers PC04/ GH20, para observar sus componentes. Todas las muestras se amplificaron para las enzimas consenso de restricción de 450 pb del gen L1 del VPH, MY09: (5'-CGTCCMARRGGAWACTGATC-3') y MY11: (5'-GCMCAGGGWCATAAYAATGG-3')7-10 , y se usó como control interno, hemoglobina subunidad beta (HBB) GH20: (5′-GAAGAGCCAAGGACAGGTAC-3′) y PC04: (5′-CAACTTCATCCACG-TTCACC-3′) de 268 pb11.Si una muestra contenía ADN de β-globina detecTable, entonces el ADN del VPH estaba intacto y amplificable durante la reacción en cadena de la polimerasa12.
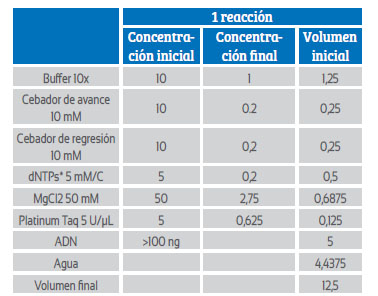
La preparación del mix para reacción en cadena de la polimerasa β-globina y virus papiloma humano se llevó a cabo según las Tablas 1 y 2, a un volumen final de 12,5 μL en cada reacción.
Tabla 1 concentraciones y volúmenes bgh taq platinum-in-vitrogen.
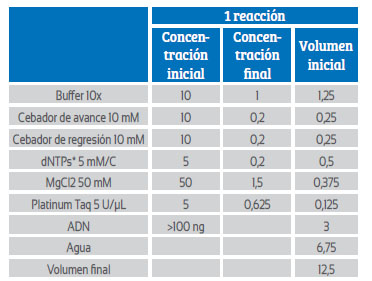
*dNTPs=desoxinucleótidos trifosfatos
Las reacciones de amplificación para reacción en cadena de la polimerasa VPH se llevaron a cabo en un termociclador Eppendorf y la secuencia de oligonucleótidos MY09 / MY11 con la secuencia MY09 (CGTCCMARRGGAWACTGATC), MY11 (GCMCAGGGWCATAAYAATGG) y PC04/GH20. Las condiciones termodinámicas óptimas constaron de los siguientes pasos: pre-naturalización 3 minutos a 94 °C; anillamiento 35 ciclos por 45 segundos a 94 °C, 1 minuto a 55 °C y 1 minuto a 72 °C; extensión a 72 °C por 7 minutos.
Con relación a la electroforesis y visualización de banda, las muestras resuspendidas fueron examinadas por electroforesis en un gel de agarosa al 1,5 %, usando un marcador de peso molecular de 100 pares de bases. Posteriormente, se llevó a corrida electroforética a 70 V por 10 minutos y luego a 120 V por 45 minutos. Luego los geles fueron teñidos por 10 minutos en una solución de concentración 0,5 mg/mL de bromuro de etidio. Para su visualización, se empleó un escáner molecular marca Pharos FX plus. Para identificar la asociación entre la infección por virus papiloma humano y las características demográficas (edad, grado de instrucción, estado civil, número de parejas sexuales), se realizaron las pruebas t-student y Mann-Whitney, utilizando el programa de Stata versión 15.
Resultados
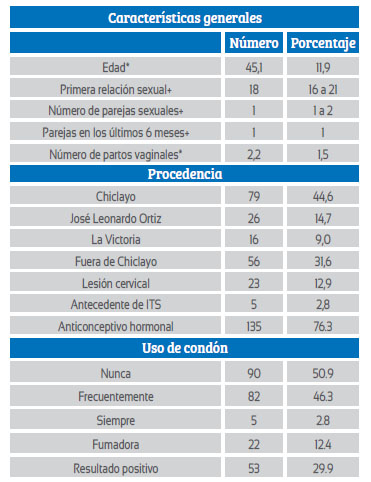
Se analizaron 186 muestras de pacientes; de ellas, 53 tuvieron un resultado positivo para virus del papiloma humano (29,9 %) (Tabla 3) y 124 fueron negativas para la prueba (70,1 %).
*dNTPs=desoxinucleótidos trifosfatos *Se usó la media y desviación estándar. +Se usó la mediana y rango intercuartílico. ITS=infección de transmisión sexual
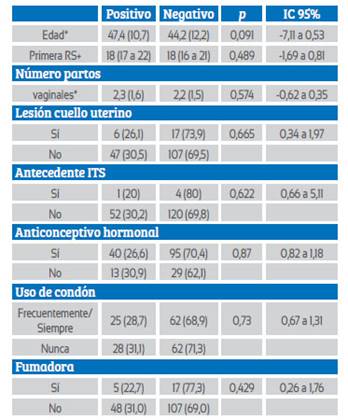
No se encontró diferencia estadística significativa entre los factores edad, primera relación sexual, número de partos vaginales, lesión de cuello uterino, antecedente de infección de transmisión sexual (ITS), uso de anticonceptivo hormonal y de condón, promiscuidad, fumadora y resultado positivo (Tabla 4).
Discusión
Un pequeño grupo de los papilomavirus son los agentes etiológicos de varios tipos de cánceres humanos, incluidos los carcinomas del tracto anogenital13. En el estudio que llevamos a cabo en una localidad en la costa norte de Perú, en la ciudad de Chiclayo, en pacientes con citología desconocida, se obtuvo una prevalencia de presentación del virus papiloma humano en el cuello uterino de 29.9 %, es decir, casi en un tercio de las participantes. Un estudio similar con las mismas características metodológicas realizado por Serquén-López en la misma ciudad de Chiclayo en trabajadoras sexuales, se encontró una prevalencia similar14. Estudios llevados a cabo en otras ciudades del Perú, como el de Valderrama y col. (2007) en estudiantes de Lima, Perú, la prevalencia fue 8.4 %15. Sullcahuaman-Allende y col., en un estudio en el Instituto Nacional de Enfermedades Neoplásicas, Lima, Perú, halló que 32.5 % dieron positivo16. Manrique-Hinojosa y col. encontraron alta prevalencia en estudiantes limeñas (43.4 %)17) mientras Iwasaki y col., 34.5 % en población urbana limeña18. Santos y col. detectaron ADN del VPH en 95.3 % de las mujeres con carcinoma de células escamosas y en 92,0 % de las mujeres con adenocarcinoma / carcinoma adenoescamoso, en comparación con 17,7 % en las mujeres control19. Estos resultados asemejan a los de Mendoza y col.8, en 2012, con prevalencia de 21 % en mujeres con citología negativa en una localidad paraguaya, y de Winer y col., en 603 estudiantes universitarias en el estado de Washington, EE UU, a intervalos de 4 meses entre 1990 y 2000; a los 24 meses, la incidencia acumulada de infección por primera vez fue 3,3 %20. La prevalencia en el estudio de Brot y col. fue 63 % en una población brasileña21, e Ingabire y col. hallaron que 8,6 % fueron positivas al VPH al inicio del estudio en 200722. Estas diferencias posiblemente se deben a los tipos de estudio llevados a cabo, así como la región en la que se realizó la investigación. En el Perú, las prevalencias de los estudios revisados son muy variadas.
Factores sociodemográficos como la edad y el estado civil sirven con frecuencia como marcadores de riesgo de exposición al VPH y otras infecciones de transmisión sexual16. Los resultados como la edad, inicio de vida sexual activa, número de parejas sexuales, promiscuidad, número partos vaginales, uso de condón, fumadoras, lesión cuello uterino, antecedentes de infecciones de transmisión sexual, uso de anticonceptivo hormonal no se asociaron a la infección de virus de papiloma humano en nuestro estudio. En otros trabajos sí se ha hallado asociación entre el VPH y estos factores23-29. Sathian y col. y Bosch y col. mencionan que la promiscuidad y el número de parejas sexuales son factores de infección por el VPH30,31 y el estudio de Francheschi y col. menciona que existe relación entre la infección por VPH y la edad de primera relación sexual32.
En nuestro estudio no se encontró significancia estadística entre la infección por virus de papiloma humano y el número de partos vaginales, similar a lo hallado por Rajkumar y col.33. Tampoco se halló significancia estadística entre el haber tenido alguna lesión de cuello uterino y la infección por VPH, lo que difiere de estudios como el de Bosch31, Oliveira34, Motoyama35, Naqvi, Wajid y Mitra36 y Harden y Munger13. Los antecedentes de ITS, uso de anticonceptivo hormonal y/o condón y fumar no mostraron significancia estadística con el resultado positivo por VPH; esto difiere con los estudios de Hellberg y de Vaccarella, que encuentran relación entre estos factores y la infección por VPH 23,37,38.
La prevalencia observada en nuestro estudio coincide con la de otros estudios. Si nos referimos a factores asociados, los resultados difieren con los hallados en otros continentes, pero tienen relación con estudios llevados a cabo en Perú. Según nuestros resultados, el número de parejas sexuales y la infección por VPH no tienen relación. Esto puede deberse a que se realizó el estudio en una población con un bajo número de parejas sexuales, una sociedad conservadora, siendo este factor importante en el contagio y la persistencia del virus papiloma humano en el organismo. Un porcentaje significativo de las pacientes fueron violadas, iniciando así su vida sexual. Además, las pacientes tenían tendencia a disminuir el número de parejas sexuales durante la entrevista, al igual que hubo mucho desconocimiento entre los tipos de métodos anticonceptivos.
Se encontró que poca parte de esta población es fumadora, por lo que este factor carcinogénico no se reflejaría en los resultados y necesitaría el estudio de una mayor población.
En estudios similares al presente existe información faltante en los registros médicos de las pacientes. Una fortaleza de nuestro estudio fue la repetición de las pruebas en caso de resultado indeterminado. Los servicios ginecológicos y oncológicos hospitalarios pueden mejorar los programas de tamizaje realizando pruebas moleculares en caso de citología negativa y con fuerte sospecha39. El presente estudio es uno de los primeros llevados a cabo en la región Lambayeque, Perú.
La Organización Mundial de la Salud ha informado que el cáncer cervical es la segunda causa de neoplasia maligna y muerte en mujeres en todo el mundo40. Los estudios epidemiológicos han mostrado que los genotipos de alto riesgo de virus de papiloma humano (AR-VPH) son la principal causa de esta enfermedad41. Es necesario utilizar herramientas de diagnóstico complementarias que permitan la detección del genoma AR-VPH, con el fin de aumentar el rendimiento de los métodos de diagnóstico morfológicos convencionales generalmente utilizados para detectar el cáncer cervical42. Una debilidad del estudio es no haber genotipificado a las pacientes positivas para virus de papiloma humano ni haber incluido en otro grupo a las pacientes con carcinoma epitelial en cualquiera de sus estadios, lo cual habría dado una mejor visión de los tipos que están circulando por la región. Se recomienda estudios posteriores que incrementen el número de muestra, estratificando mejor a las pacientes y ampliando la prueba a los varones, ya que son los reservorios de la enfermedad. Se han hecho avances con la vacunación a las niñas en Perú, pero este próximamente debería abarcar a los varones y enfocar mejor los tipos que se encuentren circulando en la región y en el país. Se debe fortalecer la investigación en este tema, por ser una importante causa de mortalidad femenina.
Concluimos que se encontró alta prevalencia de pacientes con virus del papiloma humano. No se halló diferencia estadística significativa entre la infección por virus del papiloma humano y la edad, edad de primera relación sexual, promiscuidad, número de partos vaginales, lesión cervical, antecedente de ITS, uso de anticonceptivo hormonal, uso del condón, tabaquismo.











 text in
text in