Introducción
La enfermedad por coronavirus 2019 o COVID-19 (coronavirus disease 2019) es una enfermedad de las vías respiratorias potencialmente grave. Esta enfermedad es producida por el coronavirus tipo 2 causante del síndrome respiratorio agudo grave o SARS-CoV-2 (severe acute respiratory syndrome coronavirus 2)1.
La COVID-19 fue descrita por primera vez a finales de diciembre del 2019 en la provincia de Wuhan, en la República Popular China. A partir de ese momento, la infección por el SARS-CoV-2 se fue propagando rápidamente a otros países de Asia, Europa y el continente americano. El 5 de marzo de 2020 se detectó el primer caso en Perú. El 11 de marzo, la Organización Mundial de la Salud (OMS) declaró oficialmente a la COVID-19 como una pandemia2. Hasta el 30 de agosto del presente año, más de 200 países habían comunicado un total de 25 057 670 casos confirmados y 842 915 muertes; estas cifras seguirán aumentando y se actualizan en tiempo real en la web del Coronavirus Resource Center de la Universidad Johns Hopkins, disponible en https://coronavirus.jhu.edu/map.html
Según la OMS, este virus se transmite por el contacto directo con gotas respiratorias que expulsan las personas infectadas al toser, hablar o exhalar. Así mismo, se puede transmitir por contacto indirecto cuando las microgotas exhaladas por el enfermo se adhieren a diferentes objetos y superficies, las cuales son transmitidas cuando una persona sana toca estas superficies y luego se toca la mucosa de los ojos, nariz o boca2.
El cuadro clínico predominante es el respiratorio, que puede ser desde leve en el 85% de los casos por compromiso de las vías respiratorias altas (semejante a un resfriado común) hasta grave y fatal, en el 5%, cuando afecta las vías respiratorias bajas (neumonía complicada con síndrome de dificultad respiratoria aguda -SDRA- y falla orgánica única o múltiple). Otros órganos o tejidos que también pueden ser afectados por el SRAS-CoV-2 forman parte del sistema cardiovascular, neurológico, gastrointestinal y dermatológico. La letalidad puede llegar a ser hasta del 5%, dependiendo del grupo poblacional estudiado. Entre los factores asociados a mayor letalidad se ha incluido la mayor edad -sobre todo de 60 a más años-, la presencia de comorbilidades, como la hipertensión arterial, diabetes mellitus, enfermedad pulmonar crónica, la obesidad y estados de inmunosupresión1.
El diagnóstico de la COVID-19 se confirma en una persona asintomática o sintomática con un resultado positivo en alguna de las pruebas moleculares o genómicas que detectan SARS CoV-2, como la reacción de cadena de la polimerasa con transcriptasa reversa o RT-PCR (reverse transcription polymerase chain reaction)3.
A la fecha, no existe un tratamiento farmacológico específico para prevenir o curar la COVID-19. Por ello, el manejo de los pacientes infectados es solo sintomático o con medidas de soporte, de acuerdo con la gravedad de la enfermedad3.
Conforme fue aumentando el número de personas infectadas a nivel mundial, aparecieron casos confirmados de mujeres embarazadas con el COVID-19. Algunos estudios han comunicado que las embarazadas infectadas no suelen evolucionar a casos muy graves, caracterizándose su cuadro clínico por la presencia de fiebre, seguido de síntomas respiratorios -como es la tos seca, disnea-, fatiga y/o mialgias y, en una menor proporción, síntomas gastrointestinales como la diarrea. En la actualidad no se sabe con certeza si la afección pulmonar o el patrón de neumonía de las embarazadas infectadas difiere con respecto al patrón de la población en general4.
Está bien documentado, y en base a la evidencia, que la transmisión del COVID-19 de humano a humano es a través de la vía respiratoria, aunque la presencia del SARS-CoV-2 también se ha encontrado en otros fluidos y secreciones, como la sangre, las heces, el líquido cerebroespinal, la saliva, las lágrimas, el semen y las secreciones conjuntivales. Esto ha generado que algunos autores hayan planteado la posibilidad de la transmisión fecal-oral1,5.
Existen algunas comunicaciones de alteración del resultado perinatal en gestantes con COVID-19 en función al trimestre en el que se produjo la infección, como casos de abortos espontáneos y partos pretérmino, pero en ninguno se demostró la transmisión de la infección de madre a hijo5.
Respecto a la transmisión vertical intrauterina del COVID-19, sigue existiendo controversia.
Abarzúa6 mencionó que se siguen informando casos de esta potencial ruta de transmisión, como sucedió en China, donde un neonato obtenido por cesárea de una madre que tenía neumonía por COVID-19 confirmada, resultó positivo para el SARS-CoV-2 en el estudio de hisopado faríngeo. Lamentablemente, no se contó con muestras en líquido amniótico, sangre de cordón, estudio de placenta o por leche materna, con lo cual se podría haber aclarado la hipótesis acerca del momento de la transmisión, si ocurrió antes del parto o posparto.
A la fecha, sigue habiendo duda sobre la posibilidad de la transmisión vertical intrauterina de la madre con COVID-19 al producto de la gestación, motivo por el cual es necesario revisar y analizar la información disponible sobre la misma. Por ello, se realizó una revisión sistemática para determinar si existe evidencia científica de transmisión vertical intrauterina en la gestante con COVID-19.
Métodos
Se realizó una búsqueda sistemática, del 26 de junio al 30 de julio de 2020, de estudios primarios utilizando términos MeSH (Medical Subject Headings) en bases de datos libres y dos repositorios de prepublicaciones (preprints), esto último con la finalidad de disminuir el sesgo de selección. Se incluyeron los reportes de casos, serie de casos, casos y controles, y estudios de cohorte de gestantes y neonatos con diagnóstico confirmado de COVID-19 por la prueba molecular: Los estudios fueron publicados en idioma inglés, español o portugués, entre el 31 de diciembre de 2019 y el 15 de julio de 2020. Se excluyeron los trabajos primarios duplicados, seleccionando el más actualizado y de mejor calidad científica, los casos de COVID-19 confirmados por pruebas no moleculares, y los casos de transmisión vertical no intrauterina.
Para maximizar la sensibilidad, se llevó a cabouna estrategia de búsqueda a través de bases de de publicaciones internacionales: MEDLINE/PubMed, Science Direct, Clinical Key, LILACS, SciELO y Google Scholar; y repositorio de prepublicaciones (preprints) médicas: medRxiv y SciELO Preprints. Se realizó la búsqueda en el título y resumen de la base de datos seleccionada con los siguientes términos MeSH: "Vertical transmission" AND "COVID-19" OR "SARS-CoV-2" NOT "Review*" OR "Meta-Analysis". Se siguió la guía PRISMA y se registró en la base de datos PROSPERO (código registro: CRD42020193798).
Los artículos fueron identificados, tamizados, revisados, seleccionados y analizados por los investigadores. En caso de existir algún desacuerdo sobre cualquier artículo o el contenido de este, se decidió la aceptación por mayoría simple, con el apoyo y orientación del investigador de más experiencia. Los datos recolectados fueron: la fuente bibliográfica, el tipo de estudio, la edad de la gestante, las semanas de gestación (trimestre del embarazo), los síntomas de la gestante, el tratamiento farmacológico de la mujer embarazada, el tipo de parto, el sexo del recién nacido, la edad en la que se realizó el diagnóstico de COVID-19 en el recién nacido, los síntomas del recién nacido y la presencia o ausencia de SARS-Cov-2 en tejidos o fluidos relacionados a una transmisión vertical intrauterina (por ejemplo, líquido y/o membrana amnióticos, cordón umbilical y placenta). Si el artículo fue un reporte de caso, los datos se extrajeron de forma individual. Si el artículo fue una serie de casos, casos y controles o cohorte, se calculó la media para las variables cuantitativas y la proporción del total para las variables cualitativas, además de los rangos de acuerdo con la disponibilidad de los datos.
El resultado primario fue la presencia o ausencia de COVID-19 neonatal confirmada por método molecular, debida a transmisión vertical intrauterina de gestante con COVID-19 confirmada por método molecular.
Resultados
Se identificaron un total de 419 estudios distribuidos en 410 (97,9 %) estudios de bases de datos médicas de revisiones por pares y 9 (2,1%) estudios de bases de datos de estudios pre publicados. Se descartaron 20 artículos duplicados durante el proceso, quedando 399 estudios para el tamizaje. Después de leer el resumen de los artículos tamizados, se excluyeron 339 estudios, siendo elegibles para revisión a texto completo 60 artículos. De estos, 30 fueron excluidos por los siguientes motivos: 10 artículos fueron cartas al editor, 8 artículos fueron revisiones narrativas y 12 artículos fueron revisiones sistemáticas. Finalmente, 30 artículos7-36 fueron incluidos en el análisis, síntesis y presentación (Figura 1).
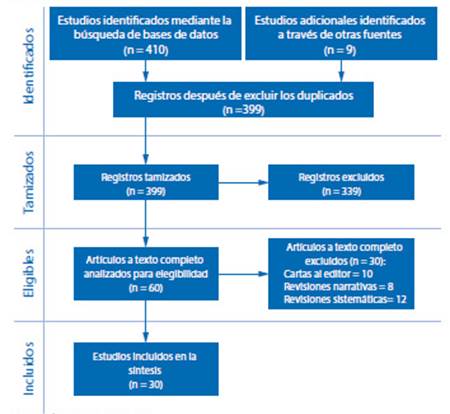
Figura 1 Diagrama de flujo del proceso De selección de los estudios incluidos para evaluar la transmisibilidad vertical intrauterina de gestantes con la enfermedad por coronavirus 2019 de acuerdo con la guía PRISMA.
Los 30 artículos incluidos reportaron 476 casos de gestantes con diagnóstico confirmado de COVID-19 con sus respectivos neonatos (477 por existir un embarazo gemelar). Trece estudios fueron reporte de caso (13 pacientes), 7 estudios observacionales (190 pacientes), 7 series de casos (144 pacientes) y 3 estudios de cohortes (129 pacientes), como se puede apreciar en la Tabla 1.
Tabla 1 Resumen y características de estudios primarios analizados para evaluar la transmisibilidad vertical intrauterina de gestantes con la enfermedad por coronavirus 2019.
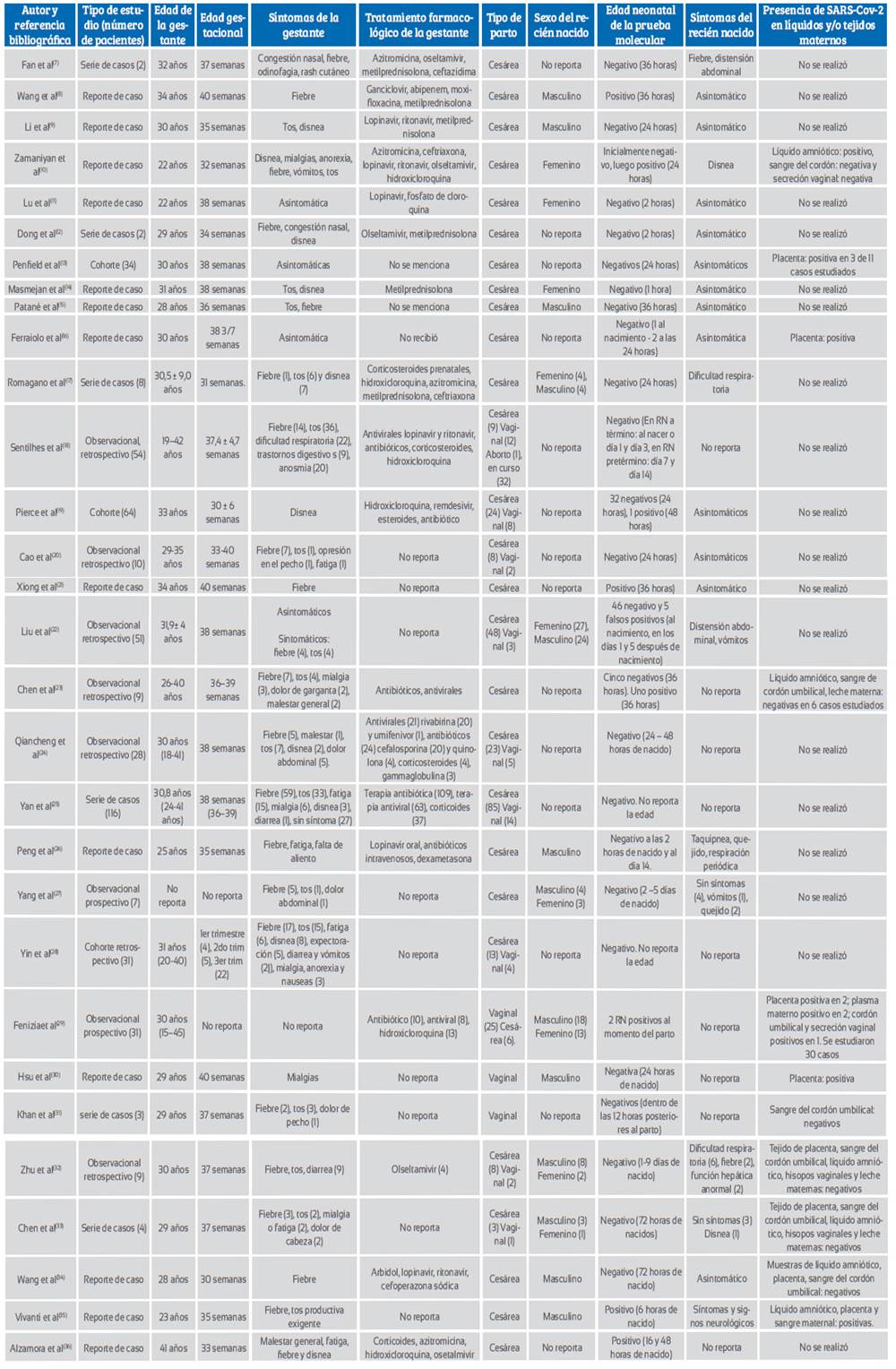
El rango de edad materna fluctuó entre los 15 y 45 años. La mayoría de los casos se presentaron durante el tercer trimestre del embarazo. Los síntomas maternos de la infección predominantes fueron: fiebre en 143 de los casos (30% de los casos), tos en 127 casos (26,7%), disnea en 29 (6,1%), fatiga en 25 (5,3%), mialgias en 13 (2,7%) y trastornos digestivos en 11 casos (2,3%), entre otros síntomas; por otro lado, las gestantes asintomáticas fueron 32 (6,7% de los casos).
Entre los fármacos indicados a las gestantes se encontraron los antivirales, los antibióticos, los corticoesteroides y la hidroxicloroquina. El término del embarazo en la mayoría de las pacientes fue por cesárea y se informó solo 78 partos vaginales (16,4%).
En 46% de los estudios revisados no se señaló el sexo de los recién nacidos; en el 54% restante, hubo 68 varones y 53 mujeres. La edad neonatal en la que se realizó la prueba molecular para el diagnóstico de COVID-19 fluctuó entre el momento de nacer hasta el décimo cuarto día de nacido.
En 8 de los 30 estudios incluidos8,10,19,21,23,29,35,36 se informó un total de 9 recién nacidos confirmados positivos. En 19 estudios del total, ninguno de los neonatos mostró síntomas sospechosos de COVID-19 y en los 11 restantes, se describe síntomas variados, como taquipnea, fiebre, vómitos, distensión abdominal, disfunción hepática y síntomas/signos neurológicos.
En 19 estudios no se investigó la presencia del SARS-CoV-2 molecular en tejidos y fluidos, relacionados a una transmisión vertical intrauterina; en los 11 estudios restantes10,13,16,23,29-35 se encontró el virus en 7 de 19 placentas estudiadas y solo en 3 de esas 7 placentas hubo coexistencia de COVID-19 neonatal. Se identificó el virus en 2 de 8 muestras de líquido amniótico, y en los casos de placenta positiva coexistió con COVID-19 neonatal. El SARS-CoV-2 se identificó en 2 de 9 muestras de sangre del cordón umbilical y en esos casos hubo coexistencia de COVID-19 neonatal. También se estudió la mucosa vaginal y la sangre o el plasma maternos.
Discusión
A pesar del tiempo transcurrido y el número creciente de casos de la enfermedad en gestantes y de los casos reportados de probable transmisión vertical intrauterina de la enfermedad, este mecanismo de transmisibilidad aún sigue en duda (1-5).
El objetivo del presente estudio fue determinar si existe evidencia científica de transmisión vertical intrauterina en la gestante con COVID-19.
A pesar de que la mayoría de los casos revisados de gestantes con COVID-19 han terminado su gestación con neonatos sin COVID-19 confirmado (98,1%, es decir, 468 de 477 casos), es importante tener en cuenta algunos aspectos que pueden condicionar este resultado.
La prueba molecular (RT-RCP) confirma la presencia del SRAS-CoV-2 y, por lo tanto, el COVID-19, incluso en los pacientes asintomáticos (1-4. Lamentablemente, su exactitud no es del 100%, tiene una alta especificidad y moderada sensibilidad; a pesar de ello, es considerado el estándar de oro por el momento (37-39. Por otro lado, la sensibilidad de esta prueba depende del método y lugar anatómico para la toma de la muestra, así como el tiempo de evolución de la enfermedad (37-39. Por ejemplo, si el hisopado neonatal se hace muy precoz o tardíamente, la sensibilidad puede ser menor a la deseada. Por lo tanto, ante la duda del momento exacto de la hipotética infección neonatal intrauterina, lo óptimo sería tomar la muestra de forma seriada.
Nuestra revisión encontró que en 16 estudios se realizó una sola toma de hisopado y fue dentro de las 36 horas del nacimiento; mientras en 2 estudios fue a las 72 horas, en 10 estudios se realizaron hisopados seriados y en los 2 restantes no se especificó el momento de la toma del hisopado. De los 9 neonatos encontrados con RT-PCR positivos, dos fueron muestreados al nacer29, uno a las 6 horas35, uno a las 16 horas36, uno a las 24 horas10, tres a las 36 horas8,21,23 y uno a las 48 horas (19) del nacimiento. Estos hallazgos nos mostrarían lo relativo que puede ser usar una sola toma de muestra como método de diagnóstico para demostrar o descartar la transmisión vertical.
Wang S y col8 mencionan que la transmisión vertical después de la infección primaria materna generalmente puede ocurrir durante la vida intrauterina a través de la vía transplacentaria, o durante el parto por la ingestión o aspiración de secreciones cervicovaginales; es por este último motivo que se opta por culminar la gestación a través de una cesárea, lo cual se hizo evidente en la mayoría de los artículos revisados, a excepción de diez artículos18-20,22,24,25,28-31, en donde el parto fue por vía vaginal. Seis neonatos positivos para la COVID-19 fueron obtenidos por cesárea8,10,21,23,35,36 y en los tres restantes, no se especificó19,29 la forma de nacimiento. Estos resultados no permiten recomendar con certeza una vía específica para la terminación de la gestación que evite la infección en el neonato.
Como se mencionó previamente, los resultados controversiales de la identificación de ARN viral en los diferentes tejidos y fluidos maternos mantienen la duda del mecanismo de transmisión intrauterina. A la fecha han aumentado los reportes de la presencia del SARS-CoV-2 en tejidos y fluidos maternos. Por lo tanto, si el virus se encuentra en la placenta, el líquido amniótico o el canal vaginal, la introducción de este a través de la vía aérea neonatal sería probable, aunque no haya aerosolización; y si adicionamos la duración del tiempo de exposición del feto a esos tejidos y fluidos, podría ser equivalente a la exposición a una carga viral ambiental. El ARN viral fue identificado en 8 de 14 muestras de líquido amniótico estudiados10,23,32-35; en dos casos, el neonato fue COVID-19 positivo; se identificó en 7 de 19 placentas13,16,29,30,32-35, de las cuales tres fueron neonatos COVID-19 positivo; se encontró SARS-CoV-2 en una muestra de sangre o plasma materna29,35 y estuvo asociada a dos neonatos COVID-19 positivo; en los tres neonatos positivos restantes8,19,36, no se investigó la presencia del virus en otros tejidos o fluidos corporales maternos. En algunos estudios se hizo la búsqueda de SARS-CoV-2 en tejidos y/o fluidos de madres con COVID-19, y los resultados fueron negativos, como lo describieron algunos autores23,31-34.
A pesar de existir un mayor reporte de casos probables de transmisión vertical intrauterina del COVID-19 respecto a revisiones previas40-47, la presencia de varios factores en los diferentes estudios no permiten obtener conclusiones definitivas. Entre estos factores podemos mencionar la heterogeneidad de la población reportada (edad materna, edad gestacional, tratamiento para COVID-19 recibido, forma de término de la gestación), así como el número de muestras y momento de la toma en los neonatos, la falta de muestreo de los tejidos y fluidos maternos en la mayoría de los casos.
Entre las limitaciones de esta revisión se considera que no se incluyeron estudios en otros idiomas, no se incluyeron manuscritos como las cartas al editor y la falta de accesibilidad a todas las bases de datos virtuales y escritas disponibles.
Conclusiones
La transmisión vertical intrauterina del SARSCoV-2 no ha sido demostrada de forma contundente en la gestante con COVID-19, debido a que la mayoría de las pacientes con la enfermedad no ha tenido neonatos con la prueba molecular positiva (98,3%). Sin embargo, la heterogeneidad de los estudios tampoco permite descartar esta posibilidad en los casos en los que confluyan factores maternos y fetales. Futuros estudios más completos y homogéneos pueden dar luces a nuestras dudas.











 text in
text in 



