Introducción
El cáncer colorrectal (CC) es la segunda causa de morbilidad y tercera causa de mortalidad por neoplasias malignas en mujeres. En Perú, es la sexta causa de mortalidad por cáncer1. Alrededor del 10% de los casos afecta a mujeres menores de 40 años y solo 2% a menores de 30 años 2-4. La aparición de tumores malignos en embarazadas es un fenómeno raro y uno de las neoplasias más raras es el CC (Tabla 1). La incidencia en embarazadas varía entre 0,002% y 0,007%2,3. Diferentes estudios muestran que el riesgo de padecerlo durante el embarazo es de 0,028 casos por cada 1 000 nacimientos4.
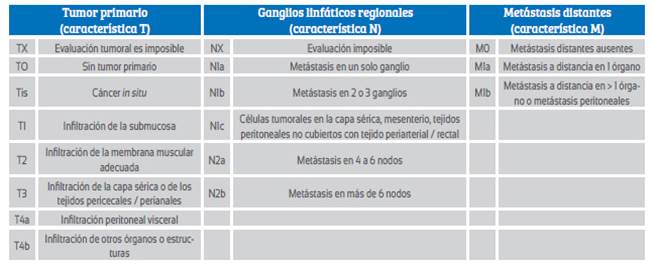
Debido a la baja frecuencia del CC en embarazadas, no existen esquemas diagnósticos y terapéuticos respaldados por ensayos clínicos. El conocimiento actual está basado principalmente en informes de casos. El tratamiento está determinado por el estadio clínico de la enfermedad y edad gestacional del embarazo al momento del diagnóstico. La clasificación TNM es la más utilizada en la práctica clínica y permite determinar en forma precisa la severidad del cuadro (Tabla 2). El objetivo de la presente revisión es establecer el manejo de cáncer colorrectal durante el embarazo.
Metodología de la búsqueda de la información
Entre julio y diciembre de 2019, se examinaron bases de datos electrónicas de literatura científica biomédica (UP To DATE, OVIDSP, Science-Direct, SciELO y PUBMED) para investigar los artículos elegibles en los últimos 30 años (1989 a 2019). Los términos de búsqueda fueron: "Cáncer colorrectal", "Embarazo", "Neoplasias malignas colorrectales", "Diagnostico" y "tratamiento". Se incluyeron artículos en inglés y español de estudios realizados en humanos, realizando posteriormente un análisis de los diferentes aspectos de diagnóstico, tratamiento y manejo del CC en embarazadas.
Diagnóstico
El cambio de hábitos evacuatorios, estreñimiento o sangrado rectal son síntomas comunes del CC. Sin embargo, la aparición de estas manifestaciones durante el embarazo no lleva a la sospecha diagnóstica de CC y, a menudo, son subestimadas. Esto puede llevar a que el diagnóstico y tratamiento sean realizados en forma tardía.
La evaluación clínica más simple, barata y accesible es el tacto rectal. A menudo permite diagnosticar el tumor durante la primera consulta. Toda paciente con sintomatología, especialmente cuando aparece antes del embarazo y/o se intensifican a pesar del tratamiento, deben ser sometidas a examen rectal, aún más si refiere antecedentes de patología rectal o anal. Las razones más comunes que no permiten la realización del examen rectal son cuando se considera que los síntomas están relacionados al embarazo, como hemorroides, y reticencia de la paciente.
En caso de sospecha de CC en embarazadas, es recomendable realizar la colonoscopia. Este método es seguro durante el embarazo, especialmente durante el segundo y tercer trimestre5. La evaluación endoscópica no debe retrasarse, especialmente si los síntomas persisten y no están relacionados al embarazo. Una ventaja adicional es la posibilidad de tomar muestras de sitios sospechosos y realizar un diagnóstico histopatológico confiable. La mayoría de los tumores en embarazadas aparecen en el recto o colon sigmoide (60% a 80%)6. Por lo tanto, la sigmoidoscopia puede ser suficiente para el diagnóstico, acortando el tiempo del examen y disminuyendo el riesgo de complicaciones. La colonoscopia durante el primer trimestre del embarazo está asociada con mayor riesgo de aborto espontáneo. Otros efectos adversos incluyen: efectos teratogénicos de la anestesia, aumento del riesgo de insuficiencia placentaria, hipoxia, hipotensión y desprendimiento prematuro de la placenta5,7. Para reducir estos riesgos, es recomendable utilizar meperidina (en lugar de benzodiacepinas), máscara de oxígeno, presión abdominal suave y vigilancia fetal continua.
Si es necesario realizar diagnóstico por imágenes, los métodos de elección son la ecografía y la resonancia magnética8. Sin embargo, la visualización de tumores colorrectales por ecografía es difícil. No obstante, la sensibilidad para detectar metástasis hepáticas es de 75%9. La resonancia magnética es más útil para detectar con precisión los cambios patológicos en colon e hígado. Otros métodos diagnósticos por imágenes, como radiografía abdominal simple y tomografía computada, tienen mayor riesgo de complicaciones fetales, principalmente debido a la radiación ionizante, un factor teratogénico conocido10.
El efecto fetal de la radiación ionizante depende de la dosis, ubicación del sitio irradiado y edad gestacional11,12. Existe evidencia que muestra que la edad gestacional no está asociada a la absorción fetal de radiación. La dosis fetal estimada para radiografías abdominales en dos proyecciones es 0,02 rads. La tomografía computada abdominopélvica produce una dosis de irradiación fetal de 2,6 rads13. Varios estudios han mostrado que una dosis fetal de radiación mayor de 5 rads no produce efectos adversos, especialmente después de la organogénesis11,12,14. Una dosis de 10 a 20 rads causa mal formación y reduce el consciente intelectual de los recién nacidos11. La exposición fetal a dosis menores de 1 rad aumenta el riesgo de neoplasias infantiles (especialmente leucemia) de 2 a 4 casos por cada 1 000 embarazos11,12.
En algunas situaciones es necesario utilizar métodos de diagnóstico que utilizan radiación. Por ejemplo, la obstrucción intestinal aguda requiere de diagnóstico rápido y preciso. Esta ocurre secundaria a CC en 7% a 30% de la población general15. Sin embargo, durante el embarazo, es extremadamente rara y solo existen 2 casos descritos16,17.
En embarazadas, la determinación sérica de marcadores tumorales tiene limitaciones. Las concentraciones de CA-125, gonadotropina coriónica humana, alfafetoproteína y proteína 4 del epidídimo humano son variables durante el embarazo y no pueden considerarse indicado res confiables del proceso tumoral ni son útiles en la práctica clínica habitual18. Por otra parte, las concentraciones de antígeno carcinoembrionario, CA 19-9 y lactato deshidrogenasa no muestran cambios significativos durante el embarazo19. Las concentraciones séricas de antígeno carcinoembrionario pueden ser útiles en casos de CC. Sin embargo, tienen sensibilidad y especificidad demasiado baja para utilizarlo rutinariamente en el diagnóstico de CC. Y, en el embarazo, aunque es una de las primeras pruebas realizadas, es poco útil20, especialmente porque el aumento de las concentraciones es proporcional al estadio del CC, y 60% de los casos en embarazadas son diagnosticados en estadio Dukes C6. Sin embargo, puede ser útil para evaluar la efectividad terapéutica y monitoreo de recurrencias. Tampoco puede ser utilizado para completar el diagnóstico, especialmente en casos en que la sintomatología de alarma persiste.
Tratamiento
La elección de la estrategia terapéutica adecuada es un desafío para los médicos (Figura 1). La decisión sobre método, técnica, tiempo de tratamiento y forma de parto debe considerarse individualmente para cada caso por un equipo multidisciplinario. El problema ético es establecer el momento de interrupción del embarazo, posibilidades de supervivencia fetal, riesgo de progresión de la enfermedad y pronóstico. Por lo tanto, la edad gestacional, edad materna, número de hijos y estadio del cáncer siempre deben ser tenidos en cuenta.
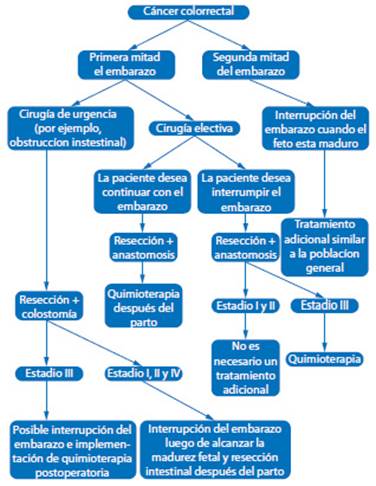
Figura 1 Diagrama de manejo terapéutico del cáncer colorrectal durante el embarazo adaptado de Salani y col., 201419.
Aunque no existe evidencia que el CC pueda tener efectos directos fetales, incluso en estadios avanzados, está claro que el desarrollo fetal depende del bienestar materno21. Durante la evolución del cáncer puede encontrarse anemia, hipoproteinemia y desnutrición, que pueden interferir con el crecimiento fetal.
Si el CC es diagnosticado durante la primera mitad del embarazo (menos de 20 semanas de gestación), se deben considerar todas las opciones terapéuticas, incluido la interrupción del embarazo22. Debido al pequeño número de casos en embarazos menores de 20 semanas, existen datos limitados sobre el manejo óptimo23. En aquellas mujeres que no desean interrumpir el embarazo, es recomendable posponer la cirugía hasta el segundo trimestre, ya que realizarla en el primer trimestre está asociada con mayor riesgo de aborto24.
El procedimiento recomendado en embarazadas es la resección tumoral. Existe evidencia que la cirugía de Miles puede realizarse en el primer trimestre sin manipulación del útero gestante9. La resección anterior baja es el método preferido, debido a menor número de efectos secundarios y mejor calidad de vida25. En el caso de la cirugía electiva, se recomienda la anastomosis intestinal. La cirugía de Hartmann debe reservarse para urgencias.
En aquellos casos de CC detectado después de las 20 semanas, el tratamiento debería posponerse hasta el posparto, a menos que existan indicaciones urgentes26. El momento para la interrupción del embarazo es entre la 32a y 35a semana27, pero puede planificarse antes de este periodo9. En casos de interrupción antes de las 34 semanas, se debe administrar corticosteroides para acelerar la maduración pulmonar fetal. Si existe indicaciones de cesárea o el tamaño tumoral impide el parto, es posible realizar la cesárea junto a la resección intestinal. En casos de parto vaginal, la cirugía debe posponerse hasta 6 semanas después del parto, cuando se produce disminución de tamaño y vascularización uterina, aumentando la posibilidad de mejores resultados. Independientemente de la vía de parto, la placenta siempre debe ser sometida a examen histopatológico, debido a la posibilidad de metástasis28.
En caso de obstrucción intestinal aguda, es posible colocar stents por vía colonoscópica. Esto permite estabilizar la paciente, preparar y planificar la cirugía, así como administrar esteroides para estimular la maduración pulmonar fetal16,17.
El CC con metástasis a ovarios con altas concentraciones de antígeno carcinoembrionario es un factor pronóstico desfavorable29-31. La prevalencia en la población general es 3% a 8%, pero en mujeres menores de 40 años aumenta al 23%6,31. En embarazadas, la metástasis a ovarios está presente en 25% de los casos21,30,32. No existe acuerdo si es necesario realizar la apendicectomía durante la cirugía inicial. Algunos autores recomiendan la anexectomía bilateral, ya que reduce el riesgo de progresión de la enfermedad y protege del cáncer primario de ovario. No obstante, este enfoque terapéutico aumenta el riesgo de aborto espontáneo, especialmente durante el primer trimestre33. La eliminación de anexos y apéndice cecal prolonga la supervivencia en 10 meses34. Otros autores no han podido confirmar estos hallazgos35.
La quimioterapia es ampliamente utilizada en el tratamiento del CC. Sin embargo, casi todos los fármacos citotóxicos cruzan la barrera placentaria y entran en la categoría D36. El efecto sobre el feto / neonato depende del medicamento, dosis, tiempo y duración de la exposición. Además, el tratamiento con múltiples fármacos aumenta el riesgo de efectos secundarios (25%) comparado con la monoterapia (17%)37. El mayor riesgo fetal está asociado a alquilantes y antimetabolitos38. Los más seguros son los derivados de platino, y los taxanos39. El efecto fetal desfavorable es más marcado durante el primer trimestre, y especialmente durante la organogénesis40. El riesgo de resultado adverso en el primer trimestre del embarazo es 10% a 20%, comparado con 3% en las embarazadas sanas41. Después de la organogénesis, los órganos y sistemas más vulnerables son el reproductivo, nervioso central, médula ósea y ocular.
Si bien no existen dudas sobre el efecto fetal de la quimioterapia durante el primer trimestre, el efecto de los citostáticos después de este período no está claro. El riesgo de defectos congénitos en el segundo y tercer trimestre es de 8% y 6%, respectivamente39. La quimioterapia después de 13 semanas aumenta el riesgo de restricción del crecimiento intrauterino42. Varios autores contradicen estos hallazgos, mostrando que la quimioterapia en este periodo no aumenta el riesgo de defectos al nacer, parto pretérmino o restricción del crecimiento intrauterino43. Diferentes estudios no han mostrado efectos de la quimioterapia después del primer trimestre, sobre el crecimiento, desarrollo o cualquier tipo de anomalías hematológicas e inmunológicas44.
El medicamento básico para el tratamiento de CC es el 5-fluorouracilo, que pertenece a los antimetabolitos al interrumpir la síntesis de ADN, y es independiente del ciclo celular. En estudios animales produce muerte fetal y en humanos es peligroso durante el primer trimestre del embarazo. Existen informes de malformaciones congénitas fetales en 14% a 19% de los casos. Después de las 13 semanas, la tasa de defectos congénitos disminuye a 1,3%45. El oxaliplatino, un derivado de platino de tercera generación, daña y bloquea la síntesis de ADN y ARN. En animales causa abortos espontáneos y restricción del crecimiento intrauterino fetal. Los efectos adversos de los quimioterapéuticos sobre el embarazo solo han sido confirmados en estudios animales. Por lo tanto, la simple transferencia de estos resultados a humanos puede ser poco confiable46. Los esquemas de quimioterapia más comunes utilizados en embarazadas con CC es la combinación de ácido folínico, 5-fluorouracilo y oxaliplatino o 5-florouracilo y leucovorina. Solo se ha reportado un neonato con alteraciones endocrinas y neurológicas47.
El uso de radioterapia en el tratamiento del CC en embarazadas es limitado. Dosis superiores a 20 rads son teratogénicas y provocan aborto espontáneo38. La mayoría de los esquemas terapéuticos proponen métodos terapéuticos alternativos (por ejemplo, quimioterapia preoperatoria) y recomiendan posponer la radioterapia hasta después del parto47.
Un riesgo adicional son los efectos adversos indirectos de la quimioterapia. Estos incluyen neutropenia, trombocitopenia, cardiotoxicidad y mayor riesgo de infección. Sus efectos sobre el feto son difíciles de evaluar y requieren mayor investigación.
Como conclusiones, el CC es raro en las embarazadas. Los síntomas gastrointestinales son comunes en ellas, pero los signos de alarma del cáncer (anemia, sangrado gastrointestinal inferior o cambio en los hábitos evacuatorios) también pueden ocurrir durante el embarazo sin complicaciones. Todos esos síntomas merecen atención en situaciones de persistencia o aumento de la severidad a pesar del tratamiento. Se debe tener en cuenta la posibilidad diagnóstica de cáncer. El diagnóstico de CC está basado en hallazgos colonoscópicos durante el segundo o tercer trimestre. Los estudios por imágenes (ecografía y resonancia magnética) son útiles para evaluar la severidad de la condición. Las concentraciones séricas de antígeno carcinoembrionario pueden ser útiles para evaluar el éxito del tratamiento y la detección temprana de la recurrencia. El tratamiento principal es la resección del tumor, seguido por la anastomosis término-terminal. El tratamiento adyuvante está basado en quimioterapia, con efectos secundarios demostrados en estudios con animales. La radioterapia no debe utilizarse en embarazadas con CC.











 texto en
texto en