Introducción
Los tumores de células esteroideas del ovario son neoplasias raras de los cordones sexuales. Están caracterizados por proliferación de células esteroides y representan menos del 0,1% de todos los tumores ováricos1. Estas lesiones pueden clasificarse en tres subtipos según el origen celular: luteomas estromales que surgen del estroma ovárico, tumores de células de Leydig que surgen de células hiliares de Leydig y tumor de células esteroideas sin otra especificación (TCEOE), cuando el origen es desconocido2.
Los TCEOE deben ser considerados como causa de hirsutismo, calvicie temporal y amenorrea en adultos. Estos tumores son raros y deben diferenciarse de otras neoplasias benignas y malignas de ovario2,3. En la literatura existen pocos informes de estas lesiones neoplásicas en el embarazo. Se presenta un caso de tumor de células esteroideas sin otra especificación durante el embarazo.
Reporte de caso
Se trata de paciente de 29 años, gesta 3, cesárea 1, aborto 1, con embarazo de 35 semanas, quien consultó por presentar crecimiento excesivo de vello en cara, piernas y tronco, acompañado de aumento de la libido desde el inicio del embarazo. Refería menarquía a los 14 años y menstruaciones normales hasta los 25 años, que luego se volvieron irregulares. El embarazo fue espontáneo y la cesárea fue realizada por desproporción cefalopélvica sin complicaciones, hacía nueve años. La paciente refería ciclos menstruales regulares antes del embarazo actual. Negaba antecedentes personales o familiares de importancia.
El examen físico reveló índice de masa corporal de 41,3 kg/m2, presión arterial 130/80 mmHg, alopecia androgénica, hirsutismo prominente en cara, tórax, abdomen, espalda, miembros superiores e inferiores (puntaje de Ferriman-Gallwey 21/36) y voz áspera. El abdomen estaba globoso a expensas de útero grávido con feto único en su interior. La evaluación ginecológica mostró clitoromegalia con un ancho de 9 milímetros. No había evidencia de estrías, acné, hematomas o debilidad muscular proximal.
En la ecografía de datación gestacional se observó feto único vivo masculino acorde a la edad gestacional, con volumen de líquido amniótico normal. Además, se veía tumor sólido, homogéneo, bien circunscrito en anexo izquierdo que medía 9 x 8 x 6 centímetros, con alta vascularización. La resonancia magnética abdominopélvica reveló riñones y glándulas suprarrenales normales y tumor sólido de 8 x 6 centímetros en el ovario izquierdo, heterogéneo, rodeado de folículos ováricos normales. No había evidencia de tumor suprarrenal o en otra ubicación, metástasis, líquido ascítico, linfadenopatías retroperitoneales o pélvicas.
Las pruebas de laboratorio mostraron aumento de las concentraciones séricas de testosterona 6,7 ng/mL (valor normal 0,4 a 0,76 ng/mL) y 4-androstenediona 3,5 ng/mL (valor normal: 0,4 a 3,4 ng/mL). Las concentraciones séricas de estradiol, prolactina, cortisol, tiroxina libre y hormona tiroestimulante estaban dentro de límites normales. Los resultados de las pruebas hematológicas y bioquímicas también fueron normales. Los valores de gonadotropina coriónica (35 000 mUI/mL; valor normal 940 a 60 000 mUI/mL), CA-125 30 UI/mL (valor normal menor de 35 UI/L), CA19-9 30 U/L (valor normal menor de 37 UI/L), antígeno carcinoembrionario 2 ng/ mL (valor normal menor de 2,5 ng/mL) y alfafetoproteína 50 ng/mL (valor normal de 10 a 230 ng/mL en el tercer trimestre del embarazo) estaban dentro de límites normales. El consenso fue realizar la exploración quirúrgica del tumor por parte del equipo de ginecología oncológica.
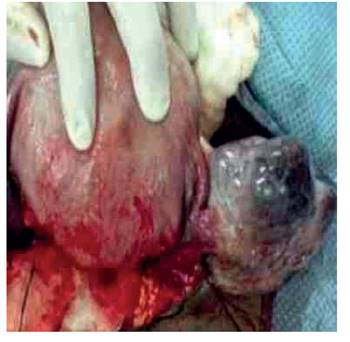
La paciente fue sometida a cesárea 3 semanas después, obteniéndose un recién nacido vivo masculino de 3 500 gramos con puntaje Apgar de 6 y 9 puntos al minuto y a los 5 minutos, respectivamente. No se observó evidencia de alteraciones macroscópicas. Durante la cirugía se advirtió tumor de ovario izquierdo que medía 9 x 5 x 4 centímetros con superficie rojiza brillante y algunas zonas amarillentas con signos de hemorragia difusa (Figura 1). No había evidencia de ascitis ni implantes peritoneales. El útero y ovario derecho eran normales en apariencia y no había evidencia de lesiones peritoneales. La sección congelada transoperatoria tuvo diagnóstico de tumor de células esteroides sin signos de malignidad. Se procedió a realizar ooforosalpingectomía izquierda más lavado peritoneal, biopsia de los ganglios linfáticos pélvicos y omentectomía parcial. Tanto el útero como el anexo derecho se dejaron para preservar la fertilidad.
El examen anatomopatológico informó tumor amarillento con varias zonas blanquecinas, que medía aproximadamente 7 centímetros de diámetro, con vasos congestionados, circunscrito al ovario y sin excrecencias externas. La sección de corte mostró tumor de consistencia friable. Al examen microscópico, el tumor estaba bien encapsulado, compuesto de lóbulos grandes y pequeños de células poligonales grandes con núcleos redondos ovalados pequeños, ubicados centralmente; con cromatina granular eosinófila y abundante citoplasma eosinofílico, separados por una red vascular densa. La mayoría de las células mostraron citoplasma espumoso, consistente con la presencia de lípidos. No había presencia de componentes sugestivos de fibroma, necrosis significativa, hemorragia, actividad mitótica, atipia nuclear de alto grado o cristales de Reinke. Las células tumorales fueron fuertemente positivas a sudán III. El tumor tuvo inmunotinción intensa a la alfa inhibina y calretinina, con positividad focal a S100, pero negativas a citoqueratina, EMA, sinaptofisina, cromogranina y SAL-4, receptores de progesterona y estrógeno (Figura 2). Los ganglios linfáticos disecados, ovario derecho, epiplón y lavados peritoneales fueron negativos para metástasis tumoral. Las características histológicas e inmunohistoquímicas sugirieron el diagnóstico final de TCEOE.
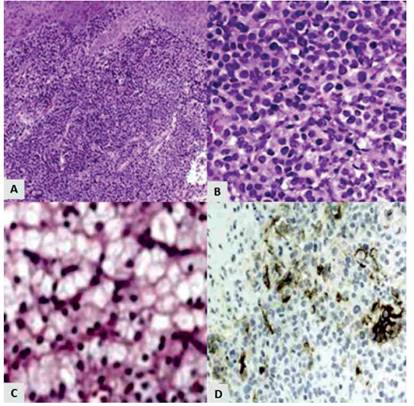
Figura 2 Histología del tumor de las células esteroideas sin otra especiFicación. (a) patrón de crecimiento diFuso con dos tipos de células eosinoFílicas y células claras. (B) células eosinoFílicas con aBundante citoplasma granular eosinoFílico y pequeños núcleos. (c) células claras vacuoladas con pequeños núcleos. (d) inmunotinción positiva diFusa para inHiBina.
Las concentraciones de andrógenos séricos disminuyeron a valores normales 3 días después de la cirugía. La paciente fue dada de alta al sexto día del postoperatorio sin incidencias. Los signos clínicos de hiperandrogenismo desaparecieron y los ciclos menstruales tornaron a la normalidad durante los seis meses de seguimiento.
Discusión
Los tumores ováricos de células esteroides son raros, especialmente durante el embarazo, con solo unos pocos casos comunicados. Surgen del estroma de las células adrenocorticales, de la luteína del estroma ovárico o de las células de Leydig y generalmente están compuestos por agregados celulares sólidos con nidos o trabéculas ocasionales. Estos tumores de células esteroideas se subdividen en tres tipos, a saber, tumor de células de Leydig, luteoma estromal y TCEOE. Estos últimos representan aproximadamente el 60% de los tres subtipos4.
El TCEOE puede aparecer en cualquier edad y es más grande que otros tumores de células esteroides al momento del diagnóstico. Causan manifestaciones androgénicas y estrogénicas en 50% y 10% de los casos, respectivamente3. Las manifestaciones más comunes son causadas por la producción de testosterona. Aproximadamente 56% a 77% de las pacientes presentan hirsutismo y virilización (voz ronca, alopecia androgénica, acné y aumento del vello facial y corporal). La secreción de estradiol ocurre en 6% a 23% de los casos y produce menstruación irregular o sangrado menopáusico5. Aproximadamente 25% de estos tumores no segregan hormonas. También existen informes de su asociación con el síndrome de Cushing, hipopotasemia, hipertensión e incluso casos relacionados con hipotiroidismo6. En vista de lo anterior, es necesario realizar un perfil hormonal completo para descartar cualquiera de estas patologías causadas por el tumor ovárico.
Durante el embarazo, existen cambios de las concentraciones circulantes de andrógenos. La testosterona total aumenta de manera constante, como resultado de la hipertrofia de las células intersticiales estimuladas por la gonadotropina coriónica. Además, la tasa de eliminación de la testosterona disminuye durante el primer trimestre. Asimismo, la síntesis de androstenediona aumenta durante el embarazo, mientras que el sulfato de dehidroepiandrosterona disminuye debido al aumento de la tasa de eliminación. El exceso de andrógenos en las embarazadas produce menos virilización comparado con las mujeres no embarazadas. Esto es debido a varios mecanismos de protección gestacional: aumento en la síntesis de globulina fijadora de hormonas sexuales con mayor unión de andrógenos y concentraciones elevadas de progestágenos que compiten con los andrógenos por sus receptores. Además, la placenta es capaz de aromatizar los andrógenos en estrógenos7.
La revisión de la literatura reveló tres informes similares de TCEOE durante el embarazo8-10. En las dos primeras neoplasias, las pacientes manifestaron síntomas de virilización materna, al igual que el presente reporte de caso, y ambas lesiones fueron encontradas al momento de la cesárea. El otro informe en la literatura fue un tumor en el ovario izquierdo de mayor tamaño que el descrito en los casos previos, detectado durante la cesárea, pero la paciente no mostró signos de hirsutismo y/o virilización.
El diagnóstico preoperatorio de los tumores ováricos productores de andrógenos es realizado por clínica, laboratorio e imágenes11. Las concentraciones séricas elevadas de testosterona y androstenediona, junto a concentraciones normales de sulfato de dehidroepiandrosterona, sugieren tumor ovárico productor de andrógenos. Las concentraciones séricas normales de 17-hidroxiprogesterona ayudan a descartar la hiperplasia suprarrenal congénita. Las concentraciones de testosterona séricas altas (por encima de 20 ng/L) indican origen ovárico12. La ecografía pélvica puede ser útil para determinar la ubicación anatómica del tumor y sus características. Los TCEOE generalmente son sólidos y bien delimitados, rara vez bilaterales. La evaluación ecográfica Doppler del flujo tumoral puede ser útil para discriminar entre masas pélvicas malignas y benignas. Las concentraciones séricas elevadas de CA-125 son poco frecuentes en estos casos11.
Los fetos masculinos generalmente no son afectados por los andrógenos, mientras que la virilización de los fetos femeninos es poco común debido a la alta capacidad de aromatización de la placenta13. La diferenciación de los genitales externos femeninos ocurre entre la séptima y la duodécima semana de gestación. La mayor exposición a andrógenos durante este período crítico puede provocar fusión labial. Luego de la duodécima semana puede ocasionar hipertrofia labial y clitoromegalia7. En la mayoría de los casos, estos cambios desaparecen espontáneamente después del nacimiento o puede ser corregida fácilmente.
El TCEOE es un tumor sólido y bien delimitado, con superficie amarilla o naranja, debido a los lípidos intracitoplasmáticos. Las neoplasias pueden ser de dos tipos. La variedad más común es aquella de células medianas y poligonales, con citoplasma eosinofílico, ligeramente granular y núcleo central con solo un nucléolo. La segunda variedad está caracterizada por células de mayor tamaño y abundante citoplasma vacuolado. Ambos están rodeados de estroma escaso con tejido conectivo fino y alta vascularización. Estos tumores se diferencian de los tumores de células de Leydig porque carecen de cristales de Reinke citoplasmáticos, que son inclusiones eosinofílicas en forma de bastón1.
Cuando se observa virilización materna durante el embarazo, es necesario considerar varios diagnósticos: patología ovárica, patología suprarrenal y causas iatrogénicas. El luteoma del embarazo es a menudo bilateral, comúnmente se asocia con hipertecosis estromal y desaparece espontáneamente después del parto7. La inhibina ha demostrado ser el marcador más específico, ya que la mayoría de estos tumores tienen inmunotinción positiva a este marcador. También se ha mostrado que tienen positividad variable para calretinina2. El tumor del presente caso tuvo positividad a alfa-inhibina y calretinina.
El comportamiento clínico de los TCEOE es incierto. La cirugía es el tratamiento recomendado para todos los tumores del estroma del cordón sexual ovárico. Un tumor ovárico sólido o quístico mayor de 5 centímetros de diámetro que no disminuye durante el seguimiento es indicación de cirugía de emergencia, en especial en pacientes con síntomas asociados a compresión de órganos vecinos. La rotura también es una complicación frecuente y es más común en embarazadas que en mujeres no embarazadas7. El tratamiento posterior debe individualizarse según las características patológicas del tumor, estadio quirúrgico de la enfermedad y deseo de fertilidad futura. En los casos con tumores confinados al ovario es posible realizar ooforosalpingectomía unilateral5. Para las mujeres que han completado su descendencia o presentan estadios neoplásicos avanzados, está indicada la histerectomía abdominal total con ooforosalpingectomía bilateral y estadificación quirúrgica completa14.
Aproximadamente 25% a 43% de los TCEOE son malignos y las metástasis suelen estar en la cavidad peritoneal y rara vez en sitios distantes. Las características histológicas de malignidad son: 2 o más mitosis por cada 10 campos de gran aumento, necrosis, diámetro igual o mayor de 7 centímetros, atipia de grado 2-3 y hemorragia5. Solo el tamaño del tumor estaba presente en este caso.
Debido a que los TCEOE son poco frecuentes y la mayoría de los casos son diagnosticados en etapa temprana, existen pocos ensayos clínicos con quimioterapia. Su uso depende de la histopatología y estadificación de la lesión, pero su efectividad terapéutica es poco conocida5. La combinación de bleomicina, etopósido y cisplatino usado en otros tumores del estroma ovárico es eficaz en el tratamiento de la enfermedad metastásica(15). La monitorización regular de las concentraciones postoperatorias de andrógenos es obligatoria para el seguimiento, ya que es útil como marcador tumoral.
En conclusión, el TCEOE es un tumor ovárico raro y es causa de virilización durante el embarazo. Suelen ser benignos, unilaterales y están caracterizados por proliferación de células esteroideas. La mayoría producen testosterona, virilización materna y, raras veces, virilización fetal. Las características radiológicas son variables por la cantidad de componentes lipídicos y estroma fibroso. El tratamiento es quirúrgico. El tipo de intervención está basado en las características histológicas del tumor, estadificación quirúrgica y deseo de conservar la fertilidad. Es necesario el seguimiento después de la cirugía, porque algunos casos pueden tener comportamiento maligno.











 text in
text in