Introducción
Las enfermedades trofoblásticas gestacionales (ETG) engloban un conjunto de patologías que surgen de la proliferación anormal del trofoblasto. Esta categoría incluye lesiones no neoplásicas y neoplásicas. Se clasifica las ETG benignas en nódulos del sitio placentario y molas hidatidiformes parciales y completas. Las lesiones neoplásicas o enfermedad trofoblástica neoplásica (ETN) tienen el potencial de invasión tumoral local y pueden generar metástasis a distancia e incluyen a las molas hidatidiformes invasivas y metastásicas, el tumor trofoblástico del sitio placentario, el tumor trofoblástico epitelioide y el coriocarcinoma1.
La mola hidatidiforme es la forma más común de ETG y representa el 80% de los casos. Se ha observado mola hidatidiforme en 1 de cada 600 abortos espontáneos y en 1 de cada 1 200 embarazos.
Las molas hidatidiformes se dividen en molas hidatidiformes completas y parciales. En las molas completas no se observa desarrollo fetal, vasos sanguíneos o glóbulos rojos. Las molas completas casi siempre tienen un complemento cromosómico totalmente derivado del genoma paterno. El cariotipo 46 XX es el más común y representa la reduplicación del genoma haploide del esperma y la exclusión del complemento cromosómico materno. 5 a 10% de las molas completas tienen un cromosoma Y consistente con fertilización dispérmica, que causa el 10 a 20% de las molas completas2.
Las molas parciales suelen tener trisomía completa derivada de dos sets de cromosomas haploides paternos y uno materno. La mayoría tienen un cariotipo 69,XXX o 69,XXY derivado de un óvulo haploide con reduplicación del set haploide paterno de un solo espermatozoide o de fertilización dispérmica.
La progresión a mola hidatidiforme maligna aumenta después de una mola completa, pero solo aumenta ligeramente después de una mola parcial. Las probabilidades de esta progresión son del 15% al 20%, y menos del 5% para las molas hidatidiformes completas y parciales, respectivamente2,3.
El coriocarcinoma es un tumor epitelial altamente maligno y extremadamente raro que comprende trofoblasto intermedio neoplásico, citotrofoblasto y sincitiotrofoblasto sin vellosidades coriónicas con necrosis central, que puede surgir de cualquier tipo de tejido trofoblástico (embarazo molar, aborto, embarazo ectópico y embarazo intrauterino pretérmino o a término). La incidencia de coriocarcinoma es alrededor de 1 en cada 50 000 a 1 en cada 160 000 luego de partos a término3.
El coriocarcinoma intraplacentario no es común y representa alrededor del 0.03% de la ETG. Por lo general, se encuentra en el examen de placentas del tercer trimestre. Histológicamente, hay una marcada proliferación de trofoblasto alrededor de un grupo de vellosidades coriónicas, mientras que el resto de la placenta es normal. El coriocarcinoma intraplacentario es muy importante de reconocer e informar, ya que puede haber enfermedad metastásica tanto en las madres como en sus neonatos4.
El diagnóstico de coriocarcinoma a menudo se retrasa después de un embarazo no molar, lo que puede resultar en en un desenlace fatal. El coriocarcinoma es el tipo histológico más agresivo de las ETG y se caracteriza por invasión vascular temprana y metástasis a distancia. Sin embargo, si el coriocarcinoma es diagnosticado y tratado a tiempo y de manera adecuada, la tasa de curación alcanza el 87,5%5).
Es importante mencionar que el puerperio es el período posterior al parto durante el cual los cambios anatómicos y fisiológicos maternos inducidos por el embarazo regresan al estado pregestacional. Su duración es inexacta, pero se considera entre 4 y 6 semanas6. En el período posparto se distingue tres fases. El período inicial comprende las primeras 6 a 12 horas posparto. La segunda fase es el período posparto subagudo que dura de 2 a 6 semanas. La tercera fase es el período posparto tardío, que puede durar hasta 6 meses. Los cambios durante esta fase son extremadamente graduales y la patología es rara.
Presentamos un caso de coriocarcinoma con metástasis pulmonares en una mujer de 31 años, en el período posparto tardío.
Presentación del caso
Una mujer de 31 años gesta 1 para 1001 fue evaluada en el consultorio tras padecer sangrado vaginal moderado 9 semanas después de un parto vaginal a término. El trabajo de parto se complicó por hipertensión gestacional y corioamnionitis. La paciente lactaba y no presentaba dolor, fiebre, náuseas o vómitos. Sus signos vitales estaban normales y la exploración cardiorespiratoria fue normal. El abdomen estaba blando y sin rigidez. En el examen ginecológico, el útero era de tamaño normal y durante el examen con espéculo se observó sangrado vaginal de color rojo brillante moderado. La ecografía transvaginal (ETV) mostró un útero y ovarios de tamaño normal, con la línea endometrial de 6,5 mm y sin evidencia de retención de productos de concepción.
A la paciente se le asignó el diagnóstico de subinvolución del sitio placentario con retención de coágulos sanguíneos. Se discutieron con la paciente las opciones de tratamiento, incluido el manejo expectante. La paciente optó por metilergonovina 0,2 mg por vía oral 3 veces al día durante 2 días.
La paciente fue vista nuevamente en el consultorio 8 días después por sangrado vaginal persistente y una segunda ETV mostró un área ecogénica de 12 x 6 mm en el endometrio. Se la programó para dilatación y curetaje (D&C) por sus síntomas y hallazgos de la ecografía, pero la paciente se presentó al departamento de emergencias cuatro días después para evaluación de dolor abdominal y sangrado vaginal persistente.
El examen físico en el servicio de urgencias fue notable por dolor a la palpación en el cuadrante superior derecho, con signo de Murphy positivo. La ecografía de vías biliares mostró colecistitis asociada a colelitiasis.
A su ingreso, la hCG-β fue 38 084 mUI/mL, hemoglobina 12,2 g/dL, aspartato aminotransferasa (AST) 22 U/L, alanina aminotransferasa (ALT) 43 U/L y glucosa sérica 99 mg/dL. La paciente fue sometida a colecistectomía laparoscópica por el equipo de cirugía. Se consultó al servicio de ginecología en el primer día posoperatorio para evaluar el sangrado vaginal posparto tardío en asociación con una hCG-β inadecuadamente elevada.
El examen ginecológico reveló una vulva y vagina normales y un útero anteverso no doloroso de 8 a 10 cm de tamaño. El cuello uterino estaba cerrado y con sangrado mínimo. La ETV mostró una línea endometrial normal, sin evidencia de masas anexiales o embarazo intrauterino. Se ordenó examen de hormona estimulante de la tiroides y radiografía de tórax, debido a la sospecha de ETG, y se obtuvo consentimiento informado para dilatación y curetaje bajo guía ecográfica.
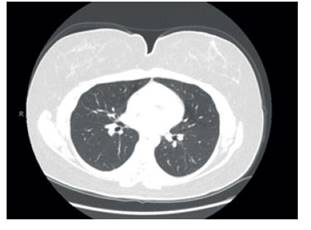
La hormona estimulante de la tiroides estaba suprimida a 0,28 uUI/mL y la radiografía de tórax mostró nodulación de 1 cm de diámetro en el lóbulo superior izquierdo. La paciente fue evaluada con tomografía computarizada de tórax, que mostró numerosos nódulos pulmonares bilaterales (Figuras 1 y 2). La resonancia magnética cerebral no mostró anomalías. La paciente fue sometida a D&C sin complicaciones y la muestra de endometrio reveló fragmentos de tejido endometrial benigno con efecto de progesterona y reacción de Arias Stella, sin evidencia de vellosidades coriónicas, tejido trofoblástico o malignidad.
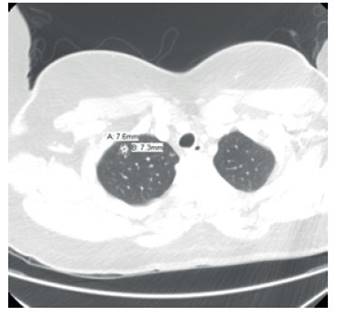
Figure 1 there is a 7.6 mm rounded nodule peripherally in the anterior right apex without pleural contact.
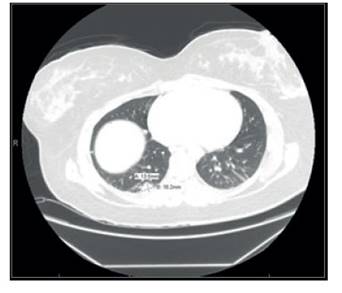
Figure 2 1.3 x 1.8 cm wedge-shaped lesion in the right lower lobe extending to the posterior pleural surface
La hCG-β fue 49 936 mUI/mL en el tercer día posoperatorio. Debido al aumento persistente de la hCG-β y la presencia de metástasis pulmonares, la enfermedad fue clasificada según los criterios de la OMS 2000. El diagnóstico de ETG de riesgo bajo en estadio III de la FIGO se realizó en base a una puntuación de 6 (antecedente de embarazo a término, hCG-β sérica de 49 936 mUI/mL antes del tratamiento y número de metástasis). La paciente fue trasladada al servicio de ginecología y oncología y se le aconsejó sobre sus opciones de tratamiento. La paciente optó por quimioterapia de agente único con actinomicina D cada dos semanas durante 3 ciclos, hasta obtener hCG-β negativa, seguida de un ciclo adicional de actinomicina D.
Como método anticonceptivo, la paciente optó por un dispositivo intrauterino de levonorgestrel y se le recomendó evitar el embarazo durante 12 meses. El tercer ciclo de actinomicina D comenzó 2 meses después de su ingreso en el servicio de urgencias. La hCG-β permaneció negativa durante 12 meses y una tomografía computarizada de tórax no mostró evidencia de enfermedad residual o recurrente (Figura 3).
Discusión
En el periodo posparto, el coriocarcinoma se diagnostica con mayor frecuencia en base a síntomas secundarios de lesiones metastásicas, como hemorragia posparto tardía, hemorragia abdominal, pulmonar o cerebral, hemoptisis, tos y déficits neurológicos. Las metástasis a menudo se desarrollan temprano, generalmente se diseminan por la sangre y los sitios más comunes son los pulmones y la vagina7.
El principal síntoma de presentación en nuestra paciente fue sangrado vaginal intermitente. Se le prescribió metilergometrina y se le realizó una prueba de embarazo sérica casi 2 semanas después de su evaluación clínica inicial.
Este tumor epitelial maligno en el período posparto tardío es difícil de diagnosticar clínicamente y sus síntomas con frecuencia conducen a diagnósticos errados, como retención de productos de la concepción, subinvolución del sitio placentario; aborto espontáneo y embarazo ectópico8.
Un estudio comunicó 57 casos de coriocarcinoma posparto. De ellos, 52 casos (91,2%) fueron mal diagnosticados y 15 (28%) fallecieron. El 59,6% de las pacientes fue diagnosticada entre 3 y 6 meses después de la atención del parto 9.
El sangrado vaginal es el síntoma más común del coriocarcinoma diagnosticado después de un aborto espontáneo o en el periodo posparto tardío. Las pacientes con metástasis en el sistema nervioso central (SNC) a menudo presentan signos y síntomas de aumento de la presión intracraneal, por hemorragia intracerebral, y las pacientes que desarrollan metástasis pulmonares extensas pueden presentar disnea, tos o dolor precordial10.
La subinvolución del sitio placentario se refiere al cierre fisiológico retrasado o inadecuado y al desprendimiento de las arterias espirales superficiales en el sitio de inserción placentaria. La subinvolución se puede identificar por los hallazgos histológicos en legrados endometriales posparto. El diagnóstico inicial de subinvolución del sitio placentario en esta paciente se basó únicamente en sus síntomas y hallazgos ecográficos, ya que no se documentó productos de concepción retenidos.
Aunque el legrado uterino tiene un papel limitado en la evaluación de la ETG, se recomendó este procedimiento, ya que la paciente presentó sangrado posparto con hCG-β elevada. La finalidad del procedimiento fue determinar si el diagnóstico era ETG, embarazo de localización desconocida o productos retenidos de la concepción.
El estadiaje de la ETG es importante para definir los grupos de buen pronóstico, de manera de dirigir la terapia óptima que produzca la tasa de curación más alta posible mediante la identificación de pacientes que probablemente sean resistentes a la quimioterapia con agente único. Las pacientes se clasifican en diferentes grupos de pronóstico sobre la base del tipo histológico, extensión y duración de la enfermedad, nivel de hormona gonadotropina coriónica humana, antecedente de embarazo y extensión del tratamiento previo. Dos sistemas son usados para clasificar a las pacientes con neoplasia trofoblástica gestacional. El sistema de estadiaje de la Federación Internacional de Ginecología y Obstetricia (FIGO 2000) es la clasificación estándar; pero, a las pacientes con ETG también se les asigna un puntaje modificado del índice de pronóstico de la Organización Mundial de la Salud.
El sistema FIGO 2000 no predice el resultado terapéutico final de forma individual. Mientras que casi todas las pacientes con puntuación de 0 a 4 se curarán con quimioterapia de agente único, más del 50% de las pacientes con puntuación de 5 a 6 fracasarán en el tratamiento con agente único y necesitarán quimioterapia de combinación11.
El tratamiento principal de la enfermedad trofoblástica neoplásica (ETN) es la quimioterapia, y las pacientes diagnosticadas con ETN deben someterse a una evaluación antes del tratamiento para determinar un régimen apropiado determinado mediante estadiaje y clasificación clínica. La mayoría de las pacientes con ETN de riesgo bajo (estadios I, II y III y una puntuación de riesgo ≤ 6) se las trata con quimioterapia de agente único con metotrexato (MTX-leucovorina) o actinomicina D. Un estudio del Grupo de Oncología Ginecológica comparó metotrexato intramuscular semanal 30 mg / m2 con actinomicina D intravenosa en bolo de 1,25 mg / m2. Entre las 216 mujeres tratadas en este ensayo, la actinomicina D en bolo mostró una tasa de remisión primaria superior en comparación con el metotrexato semanal (70% frente a 53%, p = 0,01). Las tasas de remisión primaria con regímenes de actinomicina varían de 69% a 94%. La revisión Cochrane más reciente, publicada en 2016 sobre neoplasia trofoblástica gestacional de riesgo bajo, concluyó que los regímenes de actinomicina D tenían más probabilidades de producir remisiones primarias con mayor riesgo de efectos secundarios graves. La evidencia de certeza moderada indica que la actinomicina D probablemente tiene más probabilidades de conducir a la curación primaria que el metotrexato (RR 0,65; IC del 95%: 0,57 a 0,75; seis ensayos, 577 participantes; I2 = 26%), y es probable que el tratamiento con metotrexato de primera línea falle cuando se le compara con el tratamiento con actinomicina D (RR 3,55; CI del 95%: 1,81 a 6,95; seis ensayos, 577 participantes; I2 = 61%; evidencia de certeza moderada)12).
La remisión de la enfermedad requiere tres valores semanales normales de hCG-β consecutivos (menos de 5 mUI /mL). Luego, el tratamiento debe continuarse durante tres ciclos adicionales para reducir el riesgo de recaída.
La ETN persistente o progresiva se define como un aumento o una meseta en dos valores consecutivos de hCG-β durante un intervalo de dos semanas o la detección de nuevas metástasis. Una vez alcanzada la remisión, la hCG-β debe medirse mensualmente hasta que se haya documentado un año de niveles séricos negativos.
Se utiliza los regímenes de quimioterapia combinada de múltiples fármacos para tratar a pacientes de riesgo alto (estadios II, III y IV con una puntuación de riesgo > 6). El régimen más común es etopósido, MTX-leucovorina y actinomicina, seguidos una semana más tarde por ciclofosfamida y vincristina; la tasa de respuesta completa es de 85% y la tasa de supervivencia general a 5 años de 75% a 90%. Desafortunadamente, la dosis acumulada de etopósido se ha asociado con un mayor riesgo de leucemia. Actualmente, EMA-CO (etopósido, metotrexato y actinomicina D alternando con ciclofosfamida y vincristina) se usa con mayor frecuencia. Las pacientes con puntuaciones de riesgo FIGO de 13 o más tienen mayor riesgo de mortalidad cuando se las trata inicialmente con terapia con agentes múltiples. Estas pacientes pueden desarrollar una respuesta tumoral masiva inicial, con síndrome de lisis tumoral, hemorragia catastrófica de sitios metastásicos, falla orgánica múltiple, mielosupresión y sepsis13.
Aunque el diagnóstico de coriocarcinoma se realizó 3 semanas después del período posparto, lo más probable es que el coriocarcinoma se haya establecido antes. Este caso ilustra la importancia de realizar un diagnóstico precoz y preciso de coriocarcinoma durante el periodo posparto. Llamó la atención el hallazgo de hCG-β de 38 084 mUI/mL, cuando debería ser 0 a las 9 semanas posparto.
El examen prudente y metódico en pacientes con hemorragia vaginal posparto tardía o síntomas tempranos de coriocarcinoma, incluido el examen de la placenta y la monitorización de la hCG-β en pacientes con riesgo alto, puede ayudar en el diagnóstico precoz y tratamiento eficaz y mejorar el pronóstico del coriocarcinoma posparto.











 texto en
texto en