Introducción
Las patologías del cerebro fetal son frecuentes (1-2/1 000 nacidos vivos) y requieren en todos los casos una evaluación exhaustiva, debido no solo a las implicancias sino también a su repercusión a largo plazo. Actualmente, la gran mayoría de malformaciones cerebrales diagnosticadas durante el embarazo representan cuadros aparatosos y evidentes. Sin embargo, muchas malformaciones ’sutiles’ o ‘menores’ -las cuales pueden llegar a tener graves repercusiones en el neurodesarrollo a largo plazo afectando la integración en la sociedad de estos niños- no son diagnosticadas durante la evaluación ultrasonográfica de rutina.
En la actualidad, la guía de evaluación rutinaria del cerebro fetal en el segundo trimestre1, así como la guía para evaluación básica del cerebro fetal2, propuestas por ISUOG (International Society of Ultrasound in Obstetrics and Gynecology), se limitan a un estudio transabdominal de cortes axiales del cerebro. Pero, como revisaremos a continuación, los alcances de esta evaluación tienen importantes limitaciones y generalmente deben ser ampliados cuando nos enfrentamos a una sospecha de patología cerebral fetal.
La presente revisión no pretende ser un manual de neurosonografía del cerebro fetal (examen amplio y dedicado), la cual es realizada por un experto con experiencia en la patología cerebral2, sino que tiene como objetivo proporcionar al operador, durante el cribado básico, los fundamentos para establecer una sospecha diagnóstica inicial y de esta forma poder referir a la paciente a un examen especializado. Sugeriremos y sustentaremos algunas herramientas que complementan, aunque no sustituyen, lo recomendado por ISUOG.
Metodología de la búsqueda de información
Se realizó la búsqueda de artículos originales y revisiones en las bases de datos OVIDSP, ScienceDirect, SciELO y PUBMED, con los términos de búsqueda ‘neurosonografia fetal’, ‘complejo anterior’, ‘cuerpo calloso’, ‘cisura de Silvio’, ‘cuarto ventrículo’. Se seleccionó los más relevantes en el ámbito prenatal y perinatal de los últimos 5 años; se incluyeron algunos de más de 10 años por su relevancia histórica y científica.
Evaluación del cerebro fetal
La evaluación rutinaria del cerebro fetal comienza por la identificación de la línea media, forma e integridad del cráneo. Parte primordial de este primer estudio es la identificación de estructuras cerebrales tales como los tálamos y el cavum de septum pellucidum (CSP). Se realizan las biometrías cefálicas -diámetro biparietal y circunferencia cefálica-, siempre valoradas en percentiles según la edad gestacional (plano transtalámico o biparietal) (figuras 1A y 2A).
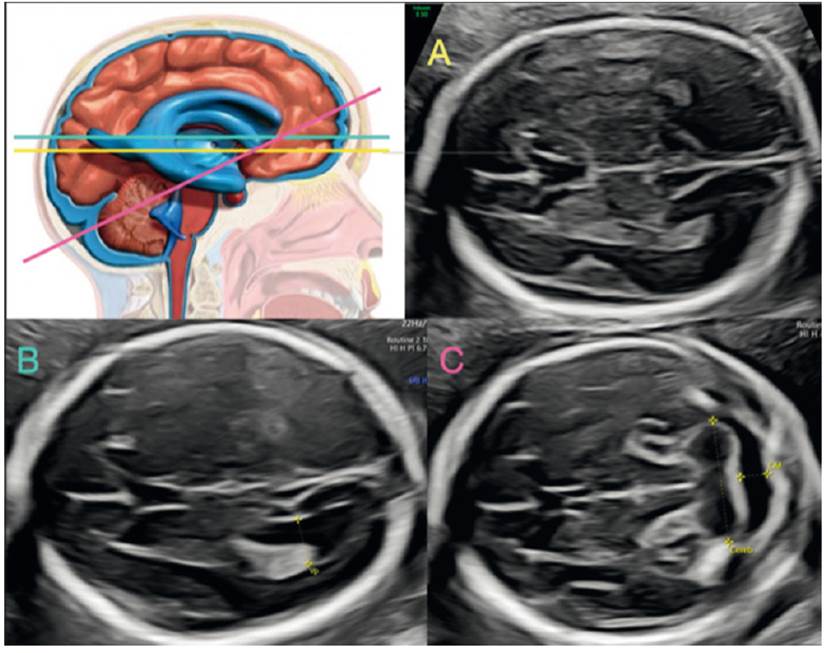
Figura 1 Cortes recomendados por ISUOG. A: corte transtalámico. B: corte transventricular. C: corte transcerebeloso.
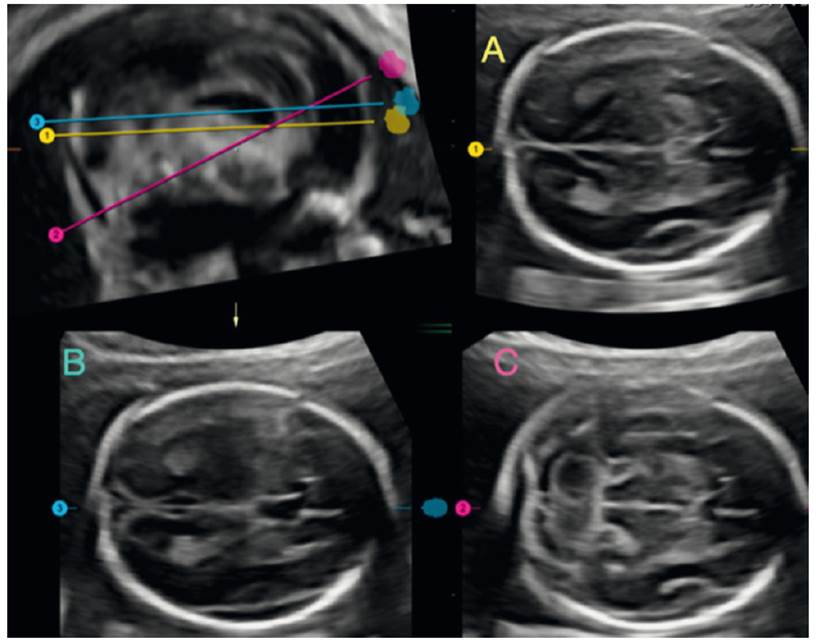
Figura 2 Análisis de imagen volumétrica del cerebro fetal, donde se muestra el nivel de cada corte recomendado por ISUOG. A: corte transtalámico. B: corte transventricular. C: corte transcerebeloso.
La segunda imagen cerebral requiere la identificación del sistema ventricular, en especial del atrio ventricular. Se establece un plano en el cual también se visualiza el CSP y las astas anteriores del sistema ventricular (plano transventricular). Se realiza con la intención de descartar dilataciones del sistema ventricular cerebral (ventriculomegalia, signo muy frecuente y común a muchas patologías cerebrales)3-10. Los reparos anatómicos para su correcta medida involucran la identificación de la cisura parieto-occipital, que marca el lugar donde se realiza la medida in to in de las paredes del atrio ventricular1,2; se sigue manteniendo el valor clásico de 9,9 mm como dogma de normalidad3-5(figuras 1B y 2B). Durante el primer trimestre y hasta la semana 20, este valor no debe ser tenido en cuenta. La sospecha diagnóstica se basa en la apreciación cualitativa del ventrículo lateral y su relación con el plexo coroideo, que normalmente debe ocupar todo el ancho del atrio11,12.
El tercer plano se enfoca en la fosa posterior: se identifica el cerebelo y se diferencia el vermis de los hemisferios cerebelosos (estructura central hiperecogénica). Nuevamente, se exige un plano en el cual también se visualiza el CSP y las astas anteriores del sistema ventricular1,2. Se mide la cisterna magna (CM), que va desde el vermis hasta la tabla interna del hueso occipital (con valor de 2 a 10 mm en el segundo y tercer trimestre). Tanto el colapso como la dilatación son signos comunes a muchas patologías de la fosa posterior y la columna13,14. Así mismo, se mide el diámetro transcebeloso (valorando su tamaño en percentiles en relación a la edad gestacional), que incluye los hemisferios y vermis. De forma subjetiva se adiciona la normalidad del cerebelo valorando la forma de su contorno y la no ‘comunicación’ del cuarto ventrículo con la cisterna magna15 (figuras 1C y 2C).
Evaluación del ‘complejo anterior’
Durante la evaluación del cerebro, la identificación del CSP es un punto de reparo cardinal para los tres cortes recomendados por ISUOG1,2; sin embargo, prestamos poca atención a la información que esta estructura nos ofrece. Debemos empezar a valorar la relación de los cuernos anteriores del sistema ventricular y el CSP, lo que Cagneaux y Guibaud16 denominaron ‘complejo anterior’. En este complejo anterior existen estructuras clave que debemos identificar, como la rodilla del cuerpo calloso, la integridad de la línea media y la forma de los cuernos anteriores (Figura 3). Viñals17) describe la morfología normal del complejo anterior, dejando en claro que el CSP puede ser de forma rectangular o de un triángulo de base anterior, y las astas anteriores del sistema ventricular parecen una ‘coma’ o un triangulo (figuras 3B y 3C).
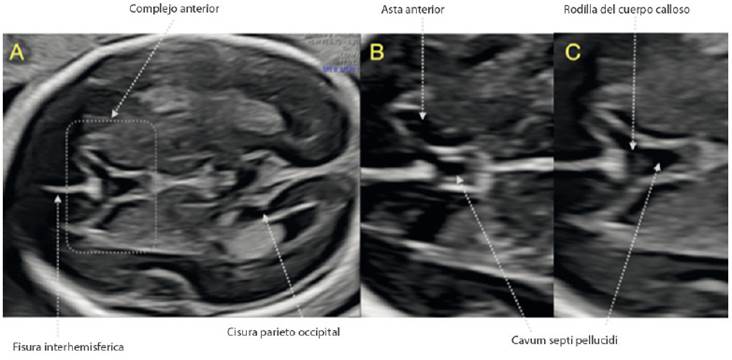
Figura 3 Complejo anterior. A: Corte transventricular donde se visualiza el complejo anterior. B y C: Estructuras que se identifican en el complejo anterior. Nótese la diferencia de la morfología normal del CSP y las astas anteriores entre ambas imágenes.
Esta evaluación cualitativa rápida aporta importante información sobre la existencia de al menos una porción del cuerpo calloso, y la simetría del sistema ventricular y de la zona periventricular, que puede ser asiento de patología del desarrollo cortical, hemorrágica o infecciosa18,19. Todo esto lo posiciona como una herramienta con potencial para la detección de holoprosencefalia20,21, anomalías comisurales (agenesia completa del cuerpo calloso, displasia septo-preóptica)22-28, esquisencefalia29 y barotrauma (ventriculomegalia obstructiva)30,31.
Visualización del cuerpo calloso
Dentro de la evaluación de la cara fetal recomendada por ISUOG1, el perfil fetal es una visión obligada, constituyendo una oportunidad valiosa para la visualización del cuerpo calloso (CC) (figura 4A). Si estamos en un estricto corte sagital y logramos aprovechar la sutura metópica o la fontanela anterior, la visualización del CC será generalmente adecuada, y de forma rápida podremos constatar su presencia, morfología normal y relación con estructuras cercanas, estableciendo sospecha de agenesia parcial, total o disgenesia32-38. Así también, como recomiendan Youssef y Pilu39, podría adicionarse el uso del Doppler para facilitar la visualización por la forma de la vasculatura (arterias pericallosas) (figura 4B).
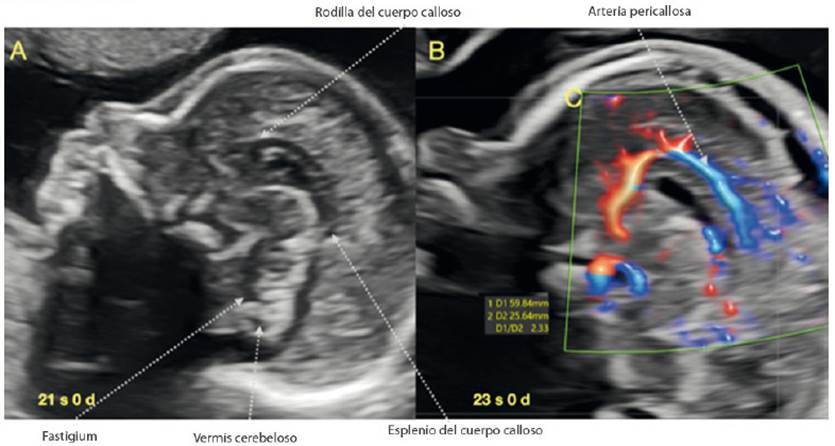
Figura 4 A: Corte sagital del cerebro fetal donde se logra la visualización del cuerpo calloso en un corte de perfil fetal. B: Visualización de la arteria pericallosa.
Si quisiéramos aplicar alguna medida sencilla más allá de la visualización directa de la estructura, en relación a las dimensiones del CC, nos permitimos sugerir valorar la relación entre la longitud de cuerpo calloso con el diámetro anteroposterior, en un corte sagital. Esta relación se mantiene constante entre 3,4 y 3,8 desde la semana 20 hasta el término y guarda relación con los valores encontrados en neonatos40-42.
Visualización de la cisura de Silvio
La evaluación de la corteza cerebral siempre ha sido un tópico complejo y de sistematización esquiva43-50. Al momento de realizar la evaluación del atrio ventricular, visualizamos necesariamente la cisura parieto-occipital como un punto de referencia y tenemos una idea intuitiva de la correspondencia de su forma con la edad gestacional43-45. Podemos adicionar a esto la visualización de la cisura de Silvio (CS) en una visión axial fácilmente reproducible51,52.
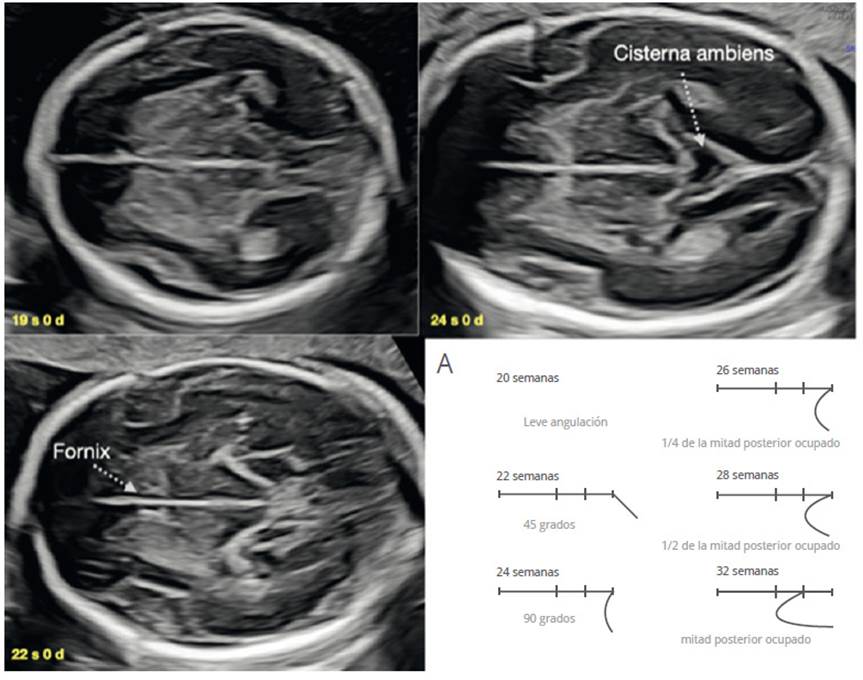
Quarello53, en el año 2008 valoró en 200 fetos la evolución de la relación entre la ínsula y el lóbulo temporal (operculización de la CS), desde las 22 a 32 semanas, y nos propone un puntaje de 0 a 10 relacionado a la edad gestacional. Esta evaluación se da en un corte axial, un poco más caudal a la vista transtalámica, en el cual debemos lograr visualizar tres puntos de estandarización del nivel de la CS: las columnas del fórnix en la parte inferior del CSP, tercer ventrículo en la parte central y la cisterna ambiens en la parte posterior (Figura 5). Guibaud54 simplifica la tabla de valoración de la CS (figura 5A) y la aplica contra diversas malformaciones cerebrales, mostrando que el anormal desarrollo de la operculización de la CS se encuentra no solo en malformaciones corticales sino también en patología comisural, defectos del tubo neural y de la fosa posterior47,49,52,55. Por ello, la evolución de la operculización de la CS es un elemento valioso, reproducible y efectivo en la sospecha de patología cerebral fetal.
Evaluación del cuarto ventrículo cerebral fetal
La evaluación de la fosa posterior presenta limitaciones, especialmente en los casos que tienen medidas de CM menores a 10 mm, dado que se tiende a evaluar únicamente la presencia del vermis superior, dejando de lado las alteraciones en posición (rotación) y forma56-58. La valoración de la forma del cuarto ventrículo en una visión axial puede darnos información adicional, al ser un indicador indirecto de la normalidad en el vermis y mesencéfalo (pedúnculos cerebrales), aunque la valoración sagital es lo ideal para una evaluación avanzada59-61.
En 1994, Baumeister62 describió la técnica para la evaluación del cuarto ventrículo en un corte axial, por medio de la inclinación del corte del diámetro transcerebeloso hasta lograr la visualización del cuarto ventrículo y los hemisferios cerebelosos (figuras 6A y 6C). Se identifica 3 formas: ovoide, triangular y boomerang (figuras 6A y 6B). Quarello63 resalta la forma normal cuadrangular del cuarto ventrículo con el diámetro transverso de mayor tamaño que el antero-posterior y, en los casos con síndrome de Joubert, observó que la forma del cuarto ventrículo era alargada. Haratz64, en base a estos estudios, en una serie prospectiva de 384 fetos normales propone la valoración rápida del cuarto ventrículo por la relación entre diámetro latero-lateral y antero-posterior, denominándolo indice del cuarto ventrículo (fourth ventricle índex - 4VI), el cual es mayor de 1 en fetos normales, independiente de la edad gestacional (figura 6A). Por medio de esa evaluación se podría lograr la detección de patologías como el síndrome de Joubert, romboencefalosinapsis, hipoplasia pontocerebelar y malformaciones corticales de tipo adoquinado65-70.
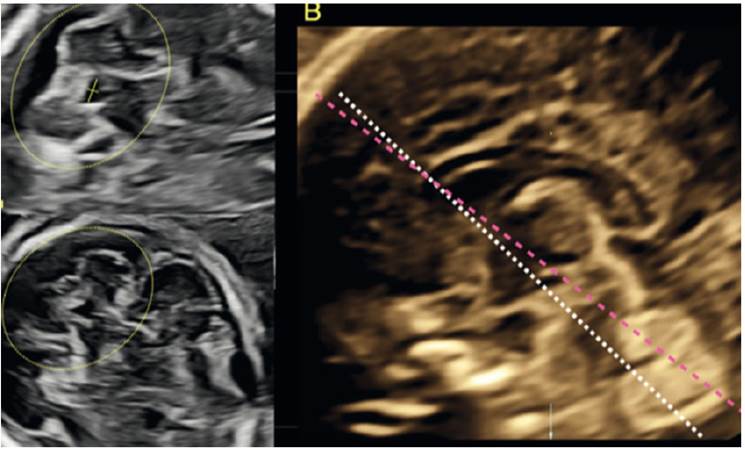
Figura 6 A: Visualización del cuarto ventrículo y como realizar la medición de los diámetros. B: Línea rosa representa el nivel del corte transcerebeloso, línea blanca es el nivel del corte para la visualización del cuarto ventrículo. C: Nótese la morfología en forma de boomerang del cuarto ventrículo
Conclusión
En la evaluación del cerebro fetal durante el tamizaje con ultrasonido, es factible examinar el complejo anterior, cuerpo calloso, cisura de Silvio y cuarto ventrículo (no es obligada su evaluación de acuerdo a las guías ISUOG). Ello potencialmente tiene impacto en la sospecha diagnóstica de algunas de las principales anomalías neurológicas fetales. Estas visualizaciones son complementarias a las recomendadas por ISUOG y, al ser generalmente reproducibles en la práctica clínica diaria, pueden ampliar nuestra capacidad de detección de patología cerebral fetal.











 text in
text in