INTRODUCCIÓN
La causa más común del hidrotórax (llamado quilotórax después del nacimiento) es la primaria (65 % de los casos). Su incidencia es de 1/10,000 a 1/15,000 nacidos vivos. Es un diagnóstico de exclusión, luego de haber descartado causas de hidrotórax secundario (anomalías cardiacas, secuestros o malformaciones adenomatoideas pulmonares, así como anemia, o infecciones por TORCH)1,2). Afecta más a fetos varones (52 vs. 44 %), y generalmente es bilateral (72,4 %)3). Se asocia con aneuploidías en 35 %, llegando al 50 % si se encuentra una malformación adicional4. En un neonato, el diagnóstico de quilotórax se hace mediante el hallazgo en el aspirado pleural de más de 1,000 leucocitos/μL, con 70 a 80 % de linfocitos, cantidad de proteínas similares al plasma y, más de 1,000 mg/dL de triglicéridos5. En un feto no se pueden usar estos valores, debido a la diferencia de la fuente de alimentación. En estos últimos, basta con encontrar > 80 % de linfocitos, en ausencia de infección6. Debido al efecto compresivo y desplazamiento mediastinal, los fetos tienen gran riesgo de hipoplasia pulmonar y disfunción cardiaca, por lo que la tasa de mortalidad, en general, tiene un rango de 22 a 55 %7. Ante ello, la terapia prenatal surge como una alternativa de manejo en casos severos. Reportamos el caso de un feto con hidrotórax severo a quien se le realizó una toracocentesis intrauterina; fue el segundo caso (como procedimiento único, sin shunt) en nuestro país8.
PRESENTACIÓN DEL CASO
Una paciente de 31 años, nulípara, con 34 semanas de gestación, ingresó a la emergencia del Hospital Nacional Alberto Sabogal Sologuren en Lima Perú, debido al hallazgo de hidrotórax y ascitis fetal en una ecografía extrahospitalaria. Se realizó una ultrasonografía morfológica detallada, encontrando un gran hidrotórax a predominio derecho, el cual comprimía los pulmones y desplazaba el mediastino hacia la izquierda (Figura 1).
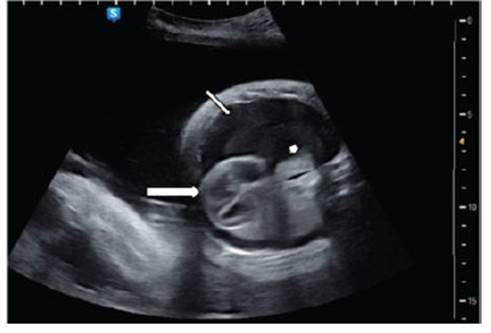
Figura 1 corte ecográfico axial del tórax fetal. se observa un gran hidrotórax (flecha mediana), el pulmón derecho colapsado (flecha pequeña) y el corazón desplazado hacia la izquierda (flecha grande).
Además de polihidramnios, se observó ascitis y edema de piel (hidropesía no inmune). La ecocardiografía mostraba signos de disfunción diastólica (Figura 2).
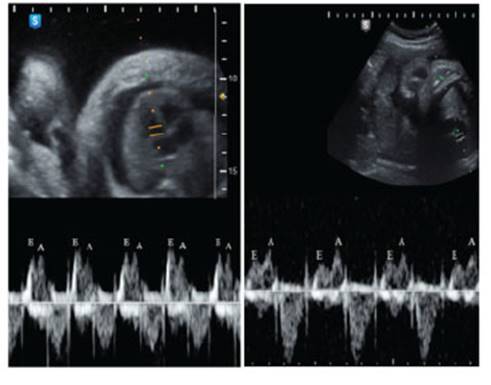
Figura 2 ecocardiografía fetal: a la izquierda se muestra, antes de la toracocentesis, la relación entre las ondas e/a igual o mayor de 1. a la derecha, después de la toracocentesis, la relación e/a normal (<1).
La neurosonografía y el estudio Doppler fueron normales, incluyendo la velocidad pico-sistólica de la cerebral media, alejando la posibilidad de anemia fetal. Los resultados de IgM e IgG para TORCH y parvovirus B19 en sangre materna fueron negativos. Se realizó una amniocentesis para cariotipo a las 34 3/7 semanas, resultando 46,XY (no contamos con microarray en el hospital). Se concluyó el caso como un hidrotórax primario. Las ecografías subsiguientes mostraron mayor hidropesía y desplazamiento mediastinal. Se realizó una junta médica para realizar una toracocentesis fetal, como primera opción para la descompresión torácica (reservando la derivación toraco-amniótica para el caso de recurrencia).
A las 35 6/7 semanas, con 2,700 g de ponderado fetal, usando cefazolina como profiláctico, bajo anestesia epidural materna se aplicó mediante guía ecográfica permanente una inyección intramuscular al feto con fentanilo 10 µg/kg, vecuronio 0,1 mg/kg y atropina 20 µg/kg. Lograda la inmovilización fetal, se realizó una punción rápida y firme con una aguja de 21 G a nivel del tercio superior derecho del tórax fetal, entre las líneas axilares anterior y media, hasta ingresar en el primer intento a la cavidad pleural (Figuras 3, 4 y 5).
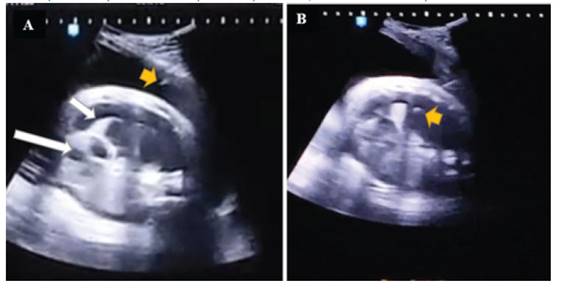
Figura 3 toracocentesis fetal: a la izquierda, se observa la aguja ingresando a la cavidad amniótica (flecha pequeña), el pulmón derecho colapsado (flecha mediana) y corazón desplazado (flecha grande). a la derecha, se muestra la punta de la aguja dentro del tórax fetal.
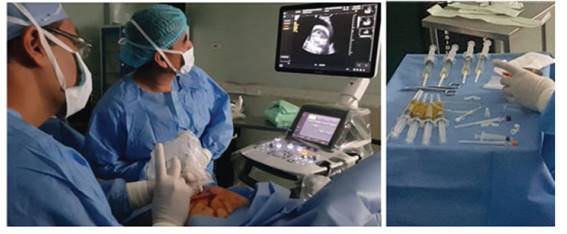
Figura 4 a la izquierda, momento quirúrgico de intervención prenatal. a la derecha, aspecto citrino y oleoso del líquido pleural fetal extraído.
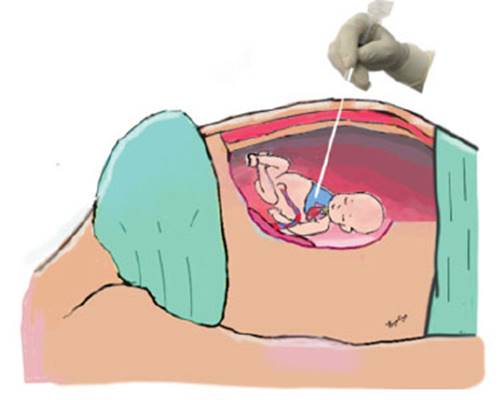
Figura 5 toracocentesis fetal: dibujo que ilustra la inserción de una aguja en el tórax fetal. elaboración propia.
Se procedió a extraer hasta 80 mL de líquido torácico, citrino, oleoso, el cual se envió al laboratorio. Luego extrajimos la aguja del tórax hasta la cavidad amniótica, realizando entonces un amniodrenaje, obteniendo 2,800 mL de líquido amniótico. Se retiró la aguja y se verificó el bienestar fetal. Se indicó nifedipina 10 mg cada 8 horas por 2 días. Los resultados de los análisis fueron: cultivos negativos, glucosa 66 mg/dL, recuento celular con 85 % de mononucleares. Las ecografías posteriores, tomadas cada 48 horas, mostraron los pulmones expandidos, la función cardiaca con función diastólica normal y la desaparición progresiva del edema de piel y de la ascitis fetal.
A las 38 semanas la paciente inició trabajo de parto y se realizó una cesárea por disfunción uterina, obteniendo un recién nacido masculino con 3,074 g, Apgar 8 y 9 al 1 y a los 5 minutos, respectivamente. La radiografía de tórax posnatal resultó normal y se le dio de alta hospitalaria a las 48 horas sin ningún síntoma. El infante lleva una vida normal hasta la actualidad.
DISCUSIÓN
En un feto con hidrotórax, el incremento de la presión intratorácica y el desplazamiento del mediastino disminuye el retorno venoso, aminora la compliance cardiaca y se produce insuficiencia, con efusión de líquido hacia la cavidad torácica y abdominal (hidropesía no inmune). Por otro lado, la compresión esofágica dificulta la deglución, produciéndose polihidramnios. Asimismo, la compresión pulmonar compromete su desarrollo, incrementando el riesgo de hipoplasia, sobre todo cuando se presenta en etapas tempranas del embarazo(9). Respecto de la función cardiaca, encontramos una tendencia a la inversión de la relación E/A en el espectro Doppler (Figura 2), cuya onda E representa el llenado ventricular pasivo y la A, la contracción auricular. En un feto normal, el índice E/A suele ser inferior a 1; sin embargo, con el hidrotórax haciendo un efecto de taponamiento, se observó una disfunción diastólica, en la que el corazón se vuelve menos complaciente y más dependiente en la contracción auricular. Luego de la descompresión, todos estos signos se normalizaron en 48 horas.
El pronóstico de un feto con hidrotórax depende, principalmente, de la presencia de hidropesía. Así, en un estudio con 287 fetos se encontró que los fetos hidrópicos tuvieron una chance de muerte fetal, neonatal e infantil más alta que aquellos sin hidropesía (13,9 %, 23,1 %, 5,1 % vs. 1,1 %, 1,1 %, 0 %, respectivamente), debido a que los primeros nacieron significativamente más prematuros (32,9 vs. 37,2 semanas) y requirieron más ventilación mecánica. Los factores de riesgo para muerte en fetos hidrópicos fueron tener menos de 30 semanas (OR= 2,1; p=0,005), ascitis y/o edema de piel (OR= 2,3; p=0,001) y efusión bilateral (OR= 3,1; p=0,02)10). En otro estudio no se observó beneficio de la colocación de una derivación toraco-amniótica vs. el manejo expectante en fetos sin hidropesía11. Por consiguiente, en un feto con hidropesía está indicado realizar un procedimiento invasivo, debido a que su regresión espontánea intraútero es rara (6,2 % vs. 25 %)10).
Las indicaciones cada vez más consensuadas para el tratamiento prenatal invasivo incluyen: hidrotórax primario que produce hidropesía no inmune, b) derrame pleural aislado sin hidropesía que ocupa más del 50 % de la cavidad torácica, el cual produce una desviación mediastínica marcada o que aumentaba rápidamente, y c) ausencia de malformaciones mayores9. Otros, consideran, además de las anteriores, la alteración de la función cardiaca determinada por ecocardiografía fetal1.
Por tanto, la terapia fetal invasiva en la forma de derivación toraco-amniótica o pleuro-amniótica (PAS, por las siglas del inglés pleuro-amniotic shunting) ha demostrado reducir significativamente la muerte en estos fetos (OR= 0,61; p=0,01)10). Asimismo, estudios observacionales indican que los fetos sometidos a intervención prenatal tienen mejor Apgar, menos trombosis y menos días con ventilador mecánico12.
Pero ¿en qué momento se puede realizar una toracocentesis? Este procedimiento tiene la desventaja de una posible nueva acumulación después del drenaje. Por ejemplo, en una revisión de 29 casos, el 76 % tuvo reacumulación de líquido pleural dentro de las 24 a 48 horas13. Sin embargo, cuando se está cerca del parto, puede considerarse para ayudar a la reanimación neonatal2. De acuerdo con las guías de la Sociedad de Medicina Materno Fetal, ante un gran hidrotórax que produce hidropesía, se puede colocar una PAS, sobre todo en gestaciones lejanas al término. Pero si la gestación es avanzada, puede considerarse una toracocentesis antes del nacimiento6. En nuestro caso, una toracocentesis realizada a las 35 6/7 semanas bastó para descomprimir el tórax y reconstituir la función cardiaca y pulmonar, con la consecuente desaparición de la hidropesía. Nuestra hipótesis, en consenso con los neonatólogos, y considerando que un hidrotórax se produce por agenesia, fístulas, atresia u obstrucción del conducto torácico, es que estuvimos frente a un caso de obstrucción de dicho conducto, el cual remitió al mejorar la hemodinamia circulatoria al reconstituirse las presiones vasculares, consecuencia de la descompresión torácica.
Por otro lado, para algunos autores, la descompresión torácica es importante incluso en gestaciones cercanas al término. Así, hay estudios en los cuales se reportan derivaciones colocadas en fetos con más de 36 semanas3, incluso a las 378,14,15). Esto es debido a que la reanimación de un recién nacido hidrópico representa un desafío médico debido al estado edematoso de sus vías respiratorias, lo cual dificulta la intubación; aparte de la afectación de la ventilación debido a los grandes derrames. Con un equilibrio de líquidos de 24 a 48 horas se facilita significativamente la reanimación neonatal inmediata14, por lo cual algunos abogan por el uso de derivaciones incluso en gestaciones a término16).
Finalmente, el parto puede considerarse a las 37 o 38 semanas, en un hospital de tercer nivel, capaz de estabilizar y tratar neonatos críticos6. Debemos tener en cuenta que, si el bebé nace sin tratamiento prenatal, la gran cantidad de líquido pleural puede dificultar la expansión pulmonar y comprometer gasto cardíaco, poniéndolo en riesgo de hipoxia severa y lesión isquémica, por lo que la asistencia respiratoria debe ser inmediata: suplementos de oxígeno, ventilación con presión positiva y/o intubación y drenaje.
En conclusión, el tratamiento prenatal invasivo mejora la supervivencia de los fetos con hidrotórax primario severo. La toracocentesis prenatal puede ser considerada en gestaciones cercanas al término.











 texto en
texto en 



