INTRODUCCIÓN
En las primeras 2 décadas de vida, cerca del 70% de los tumores ováricos se originan de las células germinales y un tercio de estos son malignos. Estos tumores malignos representan solo 0,1% de las neoplasias ováricas y aquellos con elementos neuroectodérmicos son aún más raros1.
El tumor neuroectodérmico primitivo primario (TNPP) es un sarcoma de tejido blando de células redondas pequeñas y comparte muchas características morfológicas con el sarcoma de Ewing, sobre la base de la translocación cromosómica compartida en EWSR1 (región 1 del punto de rotura del sarcoma de Ewing)2). Aunque suele producirse en los tejidos blandos de niños y adultos jóvenes, se ha notificado casos primarios en sitios viscerales como riñón, ovario, vagina, testículo, útero, cuello uterino, vejiga urinaria, glándula parótida, corazón, pulmón, recto, páncreas y vesícula biliar. Aquellos que se producen en el ovario son relativamente raros y se asocian con alta mortalidad3. Se presenta un caso de tumor neuroectodérmico primitivo de ovario.
CASO CLÍNICO
Se trata de paciente de 21 años, nulípara, quien asistió a la consulta por presentar dolor abdominal difuso, de leve a moderada intensidad y de aproximadamente 2 semanas de evolución, acompañado de aumento de la circunferencia abdominal. La paciente refería menstruaciones irregulares en los últimos 12 meses. Negaba alteraciones en el hábito evacuatorio, palpitaciones, taquicardia o sudoración. También negaba antecedentes de hipertensión, diabetes mellitus o personales de importancia y antecedentes familiares de neoplasias o cáncer.
Al examen físico, la evaluación cardiaca y torácica estaban normales. El examen abdominal mostró tumoración abdominopélvica de gran tamaño, a unos dos centímetros por encima de la sínfisis púbica, de forma regular de aproximadamente 13 x 10 centímetros del lado izquierdo del abdomen y adherida a estructuras adyacentes. El examen ginecológico no evidenció alteraciones, con cuello uterino cerrado sin sangrado genital, y el tacto rectal reveló la presencia de tumoración correspondiente a anexo izquierdo sin lesiones de la mucosa rectal.
La evaluación ecográfica mostró tumoración de superficie lisa y contenido heterogéneo complejo con algunas porciones sólidas y otras quísticas de aproximadamente 11 centímetros de diámetro y que aparentemente se originaba del anexo izquierdo. La resonancia magnética confirmó la presencia de la tumoración con estructuras sólidas y quísticas, que se extendía por la fosa iliaca izquierda sin afectación de órganos locales ni metástasis regionales o a distancia. Los marcadores tumorales (CA-125, alfafetoproteína, deshidrogenasa láctica y gonadotropina coriónica humana) estaban dentro de límites normales, al igual que las pruebas hematológicas, electrolitos, funcionalismo renal y hepático y de coagulación. Las radiografías simples de cráneo, tórax y huesos largos estaban dentro de límites normales. La endoscopia superior y la rectosigmoidoscopia no mostraron alteraciones. Se sospechó de la posibilidad de teratoma ovárico.
Durante la laparotomía exploradora se observó que el ovario izquierdo presentaba tumoración de superficie lisa de aproximadamente 15 x 12 x 10 centímetros con ovario derecho normal acompañado de 500 mL de líquido libre en cavidad. No se observó aumento de tamaño de los ganglios retroperitoneales ni enfermedad peritoneal. El apéndice cecal, útero y ovarios no exhibían signos de infiltración. La evaluación anatomopatológica de las secciones congeladas durante la cirugía fue compatible con teratoma inmaduro de ovario. Se realizó salpingoforectomía izquierda por el tamaño del tumor, resección en cuña de ovario derecho, linfadenectomía pélvica y omentectomía, debido a que la paciente deseaba preservar la fertilidad, a pesar de los potenciales riesgos de la tumoración.
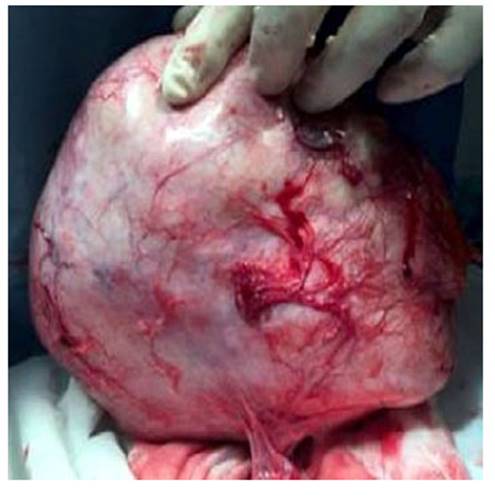
Al examen anatomopatológico, la tumoración era de superficie externa lisa, de coloración violácea-azulada y sin signos de rotura en la superficie (Figura 1). Al corte era homogénea y parda, con algunas áreas de aspecto quístico (la mayor medía 3 centímetros) con contenido hemorrágico y aspecto homogéneo. En el estudio histológico se encontró tejido neural y cartílago inmaduro, con escasos elementos maduros. Se observó un foco celular de 10 milímetros compuesto de complejos sólidos con alta concentración de células pequeñas con núcleos ovales hipercromáticos, escaso citoplasma y algunas rosetas, organizadas en lóbulos y divididas por septos fibrovasculares con patrón trabecular (Figura 2). La prueba de inmunohistoquímica mostró reacción positiva para CD99, cromogranina A, sinatrofisina, vimentina y enolasa específica de neuronas (Figura 3) y negativa para desmina, cromografina, citojeratina e inhibina. El diagnóstico definitivo fue de tumor neuroendocrino primitivo de ovario izquierdo, que se originaba de teratoma quístico inmaduro (clasificación IC de la Federación Internacional de Ginecología y Obstetricia). La muestra de ovario derecho, ganglios pélvicos y epiplón no mostraron evidencia de enfermedad neoplásica.
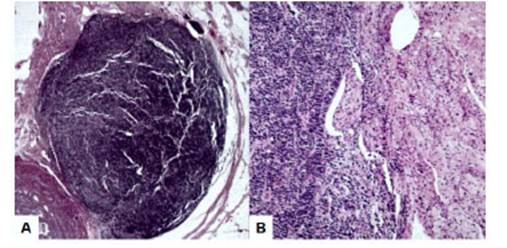
Figura 2 hallazgos histológicos del tumor neuroectodérmico primitivo primario de ovario. (a) lesión nodular con células redondas y ovaladas. coloración de hematoxilina - eosina, 20x. (b) zonas sólidas con acúmulos de células pequeñas redondas separadas por septos fibrovasculares y áreas de necrosis focal. coloración de hematoxilina - eosina, 100x.
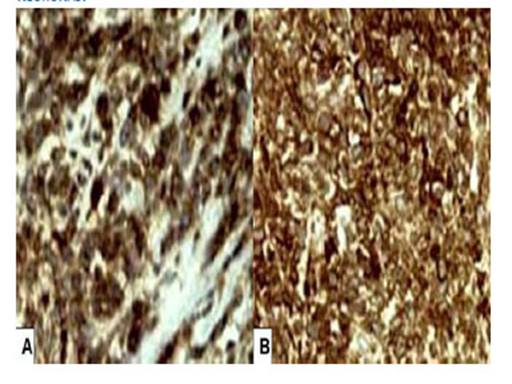
Figura 3 coloración por inmunohistoquímica. a) coloración positiva para cd99. B) coloración positiva la enolasa especiFica de neuronas.
No se produjeron complicaciones intraoperatorias y el postoperatorio no presentó eventualidades, siendo la paciente dada de alta a los 5 días. Se le aconsejó tratamiento con quimioterapia adyuvante, pero la paciente se negó a cualquier tipo de tratamiento adicional. No se ha comunicado recurrencia del tumor luego de 2 años de seguimiento.
DISCUSIÓN
El TNPP está compuesto de tejido neuroectodérmico inmaduro, representa el 3 a 6% de los tumores sólidos y de 1,4 a 8,8% de los procesos malignos. La mayoría de los tumores ocurre entre la segunda y tercera década de la vida, a una edad ligeramente más temprana que la forma bien diferenciada de los tumores neuroectodérmicos, y es más común en hombres. En un gran número de casos se observa a lo largo del eje central, particularmente en el tejido blando o hueso de niños y adultos jóvenes, siendo el segundo sarcoma más frecuente en estos grupos4. Se considera una forma diferenciada dentro de la familia del sarcoma de Ewing / TNPP debido a que tiene muchas similitudes en histomorfología, inmunohistoquímica y biología molecular. Ambos tumores resultan de la translocación recíproca de los brazos largos de los cromosomas 11 y 22 y se localizan en diferentes etapas de diferenciación neural. Independientemente del origen, son altamente agresivos y producen metástasis rápidamente a pulmón y hueso5.
El diagnóstico preciso es clave para el manejo y pronóstico óptimos en casos de TNPP. La manifestación clínica más frecuente es dolor, aumento de volumen y, en ocasiones, fiebre, pérdida de peso, anemia y leucocitosis. El examen físico a menudo revela tumor abdominal y/o pélvico acompañado de dolor abdominal6). Los estudios por imágenes, como la tomografía computarizada, muestran tumores heterogéneos que se originan de tejidos blandos y proporcionan información importante sobre el tamaño del tumor, participación de estructuras adyacentes y presencia de metástasis.
Se debe considerar la posibilidad de TNPP como diagnóstico diferencial de tumores ováricos con características inusuales, particularmente si la paciente es joven. El linfoma linfoblástico, neuroblastoma, rabdomiosarcoma, sarcoma sinovial poco diferenciado y tumor de Wilms se incluyen entre los diagnósticos diferenciales, debido a que todos son tumores de células redondas pequeñas. La histología característica del TNPP se compone de células pequeñas con núcleos hipercromáticos, redondos u ovalados con escaso citoplasma. Los lóbulos celulares están separados por tabiques fibrovasculares con algunas áreas de necrosis(4). La inmunohistoquímica es fundamental para establecer el diagnóstico. Los criterios diagnósticos más comúnmente usados son: positividad para glicoproteína MIC2 (CD99) y al menos dos o más marcadores neurales diferentes positivos y negativo para antígeno común de linfocitos y marcadores de inmunohistoquímica tumoral para excluir linfoma y tumores miogénicos de células redondas pequeñas7.
El concepto de TNPP está en constante evolución. Inicialmente se consideró que se limitaba exclusivamente al sistema nervioso central y constituía el tumor maligno más común en niños, ahora se reconoce que también se producen fuera del sistema nervioso central y se denominan en sus variantes centrales y periféricas. Aunque desde el punto de vista histológico son similares, representan variantes clínicas con diferentes localizaciones, perfiles inmunohistoquímicos y genética8. La variedad central es un tumor embrionario que se deriva del sistema nervioso central, mientras que la variedad periférica surge fuera del sistema nervioso central y expresa el gen quimérico EWS-FLI1, que puede detectarse mediante tinción inmunohistoquímica CD99. Hallazgos previos demuestran que la mayoría de los TNPP que se originan de células germinales testiculares u ováricas tienen características morfológicas de la variedad central en lugar de la variedad periférica9-11.
El TNPP de ovario es altamente agresivo y tiene mal pronóstico, especialmente en presencia de diseminación extraovárica. Debido a su muy baja frecuencia, no existe consenso sobre el método quirúrgico o terapia adyuvante, como la quimioterapia y la radioterapia. El manejo de estos casos se basa en informes de casos y se extrapola en gran parte del conocimiento de los tumores testiculares de células germinales masculinas transformadas4,12. La combinación de cirugía, radioterapia y quimioterapia logra un aumento en la supervivencia y la supervivencia libre de enfermedad.
La quimioterapia se considera uno de los métodos más eficaces para tratar los tumores con metástasis. No obstante, se ha descrito que esta solo es efectiva durante los primeros ciclos, ya que los tumores desarrollan resistencia muy rápidamente10-15. En el caso de los TNPP que aparecen desde tumores de células germinales, algunos autores recomiendan el uso de quimioterapia basada en bleomicina, etopósido y cisplatino16. Sin embargo, otros autores consideran que, a pesar de surgir dentro de los tumores de células germinales, estos tumores generalmente son resistentes al tratamiento basado en el cisplatino17 y sugieren quimioterapia con ciclofosfamida, doxorrubicina, vincristina alternada con ifosfamida y etopósido18. Otros autores han utilizado quimioterapia dirigida tanto al TNPP como al tumor de células germinales19.
Por otro lado, la radioterapia adyuvante se utiliza en las recidivas locales, así como para tumores no resecables o resecados de forma incompleta. Se observó una alta respuesta completa inicial del 94% en pacientes tratados con quimioterapia más radioterapia local1. Debido a lo anteriormente expuesto, el pronóstico generalmente es malo con una alta tasa de mortalidad. La tasa de supervivencia varía de 10 meses a 3 años4.
En el presente caso la decisión fue realizar cirugía conservadora más quimioterapia de acuerdo con la edad y los deseos de la paciente sobre su fertilidad. Existe evidencia de la utilidad de la cirugía de preservación de la fertilidad seguida de quimioterapia para tumores germinales malignos ováricos (incluso en estadios avanzados), con tasas de fertilidad variables20,21. Una de las mayores series de cirugías de preservación de fertilidad en pacientes con tumores germinales de ovario informó una tasa de embarazo del 76%20). La mayoría de las pacientes de esa serie estaban en el estadio I de la Federación Internacional de Ginecología y Obstetricia.
En conclusión, el TNPP de ovario es un tipo raro de tumor de células germinales y debe ser considerado en el diagnóstico diferencial de la neoplasia ovárica maligna, particularmente en mujeres jóvenes. Se debe realizar el diagnóstico correcto de estos tumores atípicos utilizando los métodos clínicos y auxiliares disponibles para su tratamiento correcto y oportuno, debido al mal pronóstico en comparación con otras neoplasias. No existe consenso sobre la estrategia de tratamiento, aunque la cirugía, quimioterapia y radioterapia se usan habitualmente.











 texto en
texto en