Introducción
Los trastornos tiroideos son uno de los trastornos endocrinos más comunes en el embarazo, y la prevalencia de hipotiroidismo en la gestación oscila entre el 0,4% y el 11% en todo el mundo 1. El hipotiroidismo puede ser manifiesto o subclínico. El hipotiroidismo manifiesto se caracteriza por una elevación en sangre de la hormona estimulante de la tiroides (TSH) y un nivel de tiroxina libre (fT4) por debajo de lo normal, mientras que el hipotiroidismo subclínico (HSC) se caracteriza por un nivel elevado de TSH y un nivel normal de fT4, normalmente por encima del límite superior de referencia 2. El hipotiroidismo no tratado está estrechamente asociado a varios trastornos relacionados con el embarazo. El hipotiroidismo puede provocar un retraso en el desarrollo neurológico, ya que el feto depende casi por completo de las hormonas tiroideas maternas en el primer trimestre 3. Además, el hipotiroidismo durante el embarazo se asocia a resultados maternos y perinatales adversos como el aborto espontáneo, el parto prematuro, la preeclampsia, la diabetes mellitus gestacional, el desprendimiento prematuro de la placenta, la hemorragia posparto, la muerte fetal y el parto por cesárea 4-6.
El hipotiroidismo subclínico es la forma leve de hipotiroidismo y se define como un nivel normal de fT4 con un nivel elevado de TSH más allá del límite superior de referencia 7. Al inicio del embarazo, el nivel de TSH en el suero materno disminuye debido al aumento de los niveles de fT4 tras el débil efecto estimulante de la gonadotropina coriónica humana (hCG) sobre la glándula tiroidea 8. Por lo tanto, el límite superior de TSH en el embarazo difiere entre trimestres y se define generalmente como 2,5 mUI/L en el primer trimestre y 3,0 mUI/L en el segundo y tercer trimestre 7. La prevalencia del HSC en el embarazo oscila entre el 2% y el 2,5%, y estudios recientes han mostrado resultados contradictorios entre el hipotiroidismo subclínico y los resultados perinatales adversos 6. Algunos estudios han informado de que el HSC se asocia a varios resultados perinatales adversos, como el aborto espontáneo, el parto prematuro y la preeclampsia 9,10, mientras que otros no han encontrado ninguna asociación entre el HSC y los resultados perinatales adversos 11,12. Estas inconsistencias pueden atribuirse principalmente a las diferencias en los criterios de diagnóstico del HSC (diferentes umbrales de TSH) en los distintos estudios, a la positividad de los anticuerpos antitiroperoxidasa tiroidea (TPOAbs) y a si los casos recibieron o no reemplazo de hormonas tiroideas. En consonancia con los actuales valores de referencia de TSH y las opiniones de que el HSC puede estar sobrediagnosticado en la mayoría de las mujeres embarazadas y puede llevar a un sobretratamiento innecesario, en 2017, la Asociación Americana de Tiroides (ATA) determinó el límite superior de referencia de TSH como 4,0 mUI/L en gestantes sanas 13. Sin embargo, hay pocos estudios que evalúen la relación entre los valores de referencia de TSH recomendados por la ATA y el hipotiroidismo subclínico con los resultados perinatales 14. Además, muchos estudios han examinado las funciones de la glándula tiroidea en el primer trimestre o a principios del segundo, y pocos han evaluado la relación entre la función de la glándula tiroidea en el tercer trimestre y los resultados perinatales. Por esta razón, no hay suficientes indagaciones sobre el valor superior de referencia de la TSH que pueda afectar los resultados perinatales en los casos con hipotiroidismo subclínico en semanas avanzadas de la gestación 15.
En este trabajo nos propusimos evaluar los resultados perinatales de las gestantes con hipotiroidismo subclínico en el tercer trimestre, excluyendo factores de confusión como la positividad de los TPOabs y el reemplazo hormonal, y definiéndolos con diferentes valores de referencia de TSH.
Métodos
Este estudio prospectivo de casos y controles se realizó entre enero de 2020 y agosto de 2021 en el Departamento de Obstetricia y Ginecología de un centro de atención terciaria en Izmir, Turquía. El protocolo de la investigación fue aprobado por el Comité de Ética institucional local (número de aprobación: 2019/ 6-18). Todas las mujeres fueron informadas sobre el estudio y se obtuvo el consentimiento por escrito.
Un total de 554 mujeres embarazadas, incluyendo 509 gestantes con pruebas de función tiroidea normales y 45 gestantes con hipotiroidismo subclínico, fueron incluidas en el ensayo. Los criterios de exclusión del estudio fueron (1) trastorno tiroideo manifiesto, (2) uso previo o actual de tiroxina o fármacos antitiroideos, (3) positividad de TPOabs, (4) otras enfermedades autoinmunes, (5) embarazo múltiple y (6) técnica de reproducción asistida.
Las funciones tiroideas de todas las gestantes incluidas fueron analizadas en el tercer trimestre. Se tomaron muestras de sangre venosa en ayunas por la mañana para evaluar la función tiroidea de todas las participantes. El suero se aisló tras la centrifugación y se almacenó a -80°C hasta la realización de las pruebas. Las concentraciones séricas de TSH, fT4 y TPOAbs se midieron con un inmunoensayo de electroquimioluminiscencia y kits de diagnóstico relacionados. Las funciones tiroideas se evaluaron utilizando los valores de referencia específicos del trimestre recomendados por el Colegio Americano de Obstetricia y Ginecología (ACOG) y las directrices de la Asociación Americana de Tiroides (ATA)7,13. Si la TSH estaba entre 3 y 10 mIU/L (ACOG) o 4 y 10 mIU/L (ATA) y la fT4 estaba dentro del rango normal específico del trimestre, se definió como hipotiroidismo subclínico. Los TPOAbs maternos se consideraron positivos cuando eran > 600 UI/mL.
La información sobre las siguientes características maternas (edad, paridad, índice de masa corporal (IMC), tabaquismo, enfermedades adicionales) y los resultados perinatales (tipo de parto, semana de parto, peso al nacer, puntuación de Apgar y resultados maternos y neonatales adversos) se registraron en el sistema informático de datos.
Los datos fueron evaluados con el paquete estadístico para las ciencias sociales (SPSS) (IBM Corp., Armonk, Nueva York, EE. UU.) v26.0. Se utilizaron gráficos de histograma y la prueba de Kolmogorov-Smirnov para evaluar la distribución normal de los datos. Los datos con distribución normal consistentes en variables continuas se analizaron mediante la prueba t de student. Los datos sin distribución normal se analizaron mediante la prueba U de Mann-Whitney. Las variables categóricas fueron analizadas mediante la prueba del chi-cuadrado. Un valor de p<0,05 se consideró estadísticamente significativo.
Resultados
Se evaluaron las pruebas de función tiroidea y los valores de TPOAbs de 596 mujeres embarazadas en el tercer trimestre. Se incluyeron en el estudio 554 gestantes, 509 (85,5%) con pruebas de función tiroidea normales y 45 (7,5%) con hipotiroidismo subclínico (>3 mIU/L). Se excluyeron del estudio 3 (0,5%) embarazadas con hipotiroidismo manifiesto, 8 (1,3%) gestantes con hipertiroidismo y 31 (5,2%) embarazadas con positividad de TPOAbs.
Las características maternas y los resultados de laboratorio de las embarazadas con hipotiroidismo subclínico (TSH > 3 mUI/L) y eutiroidismo se presentan en la Tabla 1. Se evaluaron un total de 509 gestantes eutiroideas y 45 con hipotiroidismo subclínico. La edad materna media fue significativamente mayor en las gestantes eutiroideas (28,7±7,1) que en las embarazadas hipotiroideas subclínicas (24,6±4,6) (p<0,001) y la edad materna avanzada (> 35) fue significativamente mayor en las gestantes eutiroideas (p=0,002). La tasa de nuliparidad fue significativamente mayor en las embarazadas con hipotiroidismo subclínico (p<0,001). El índice de masa corporal (IMC) durante la prueba y las tasas de tabaquismo fueron similares en ambos grupos (p=0,612 y p=0,341, respectivamente). El valor medio de TSH fue significativamente mayor en las embarazadas con hipotiroidismo subclínico (1,96±0,71 vs 4,4±1,52; p<0,001) y los valores medios de fT4 fueron similares en los dos grupos (0,62±0,12 vs 0,59±0,08; p=0,155).
Tabla 1 Características maternas y hallazgos de laboratorio de las gestantes con hipotiroidismo eutiroideo y subclínico (TSH >3 mIU/L
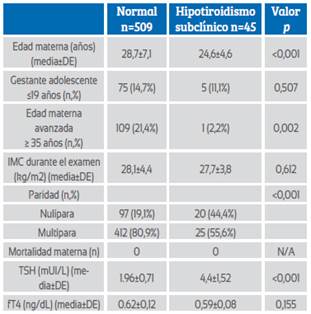
Abreviaturas: DE: desviación estándar, IMC: índice de masa corporal, TSH: hormona tiroestimulante, fT4: tiroxina libre
Los resultados maternos y fetales de ambos grupos se presentan en la Tabla 2. No hubo diferencias significativas entre los dos grupos en cuanto al tipo de parto y las indicaciones de parto por cesárea. No hubo diferencias significativas entre los dos grupos en cuanto a trastornos relacionados con el embarazo, como enfermedades hipertensivas, diabetes mellitus gestacional y colestasis. Solo hubo una gestante que ingresó a la unidad de cuidados intensivos en el grupo eutiroideo, y la morbilidad y mortalidad maternas fueron similares en los dos grupos. La media de semanas gestacionales del parto fue similar en ambos grupos (37,4±3,5 vs 37±3,7; p=0,974) y no hubo diferencias significativas en las tasas de partos prematuros (<34, 34-37, <37 semanas) entre los dos grupos. No hubo diferencias significativas entre los grupos en cuanto a resultados fetales adversos, como peso bajo al nacer (<2500 g), puntuaciones Apgar bajas en el primer y quinto minuto (<7), síndrome de dificultad respiratoria (SDR), ingreso en la unidad de cuidados intensivos neonatales (UCIN) y mortalidad neonatal.
Tabla 2 Resultados maternos y fetales de gestantes con hipotiroidismo eutiroideo y subclínico (TSH >3 mIU/L).
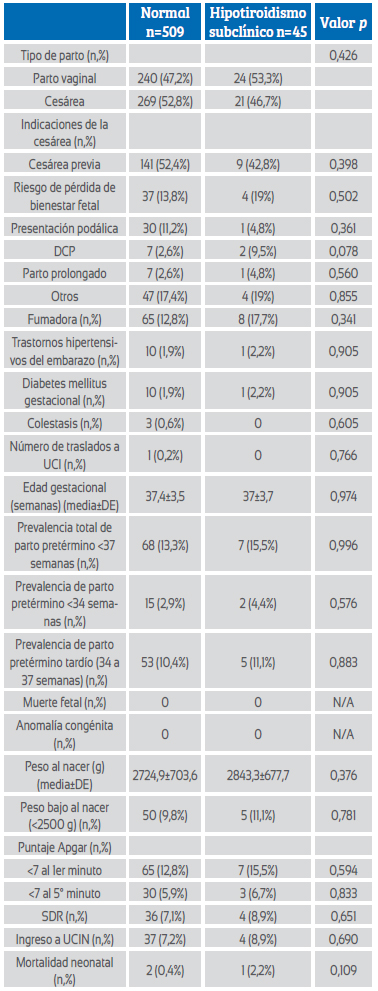
Abreviaturas: DCP: desproporción cefalopélvica, UCI: unidad de cuidados intensivos, DE: desviación estándar, SDR: síndrome de distrés respiratorio, UCIN: unidad de cuidados intensivos neonatales
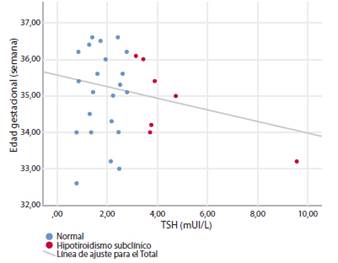
Cuando el valor de corte de la TSH se aceptó como 4 mUI/L y las embarazadas se evaluaron como hipotiroideas subclínicas y eutiroideas, la tasa de mortalidad neonatal fue significativamente mayor en las gestantes eutiroideas (2 (0,4%) frente a 1 (4,5%); p=0,009). Todos los demás resultados perinatales adversos fueron similares entre los dos grupos, al igual que el embarazo con hipotiroidismo subclínico con un valor de corte de TSH de 3 mUI/L (Tabla 3). No hubo una correlación significativa entre los valores de TSH y las semanas de parto de las gestantes con parto prematuro (r=0,169, p=0,146) (Figura 1).
Tabla 3 Resultados materno-fetales del hipotiroidismo subclínico suponiendo TSH >4 mIU/L.
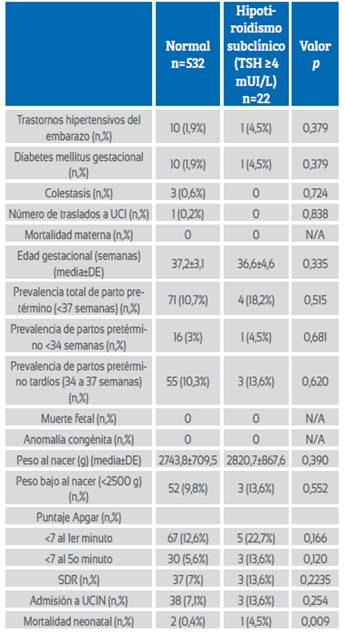
Abreviaturas: UCI: unidad de cuidados intensivos, DE: desviación estándar, SDR: síndrome de distrés respiratorio, UCIN: unidad de cuidados intensivos neonatales
Discusión
En este estudio, se evaluaron los resultados perinatales de gestantes en el tercer trimestre definidas con hipotiroidismo subclínico, de acuerdo con los valores superiores de referencia de TSH de las directrices del ACOG de 2020 y de la ATA de 2017. Todas las mujeres fueron negativas a los TPOAbs y no recibieron tratamiento médico. Los resultados perinatales de las embarazadas con HSC evaluadas con ambos límites superiores de referencia fueron similares a los de las gestantes eutiroideas. Cuando el límite superior de TSH se aceptó como 4 mIU/L, la mortalidad neonatal fue significativamente mayor en las gestantes eutiroideas. Estos resultados mostraron que no se asoció con resultados perinatales adversos en los embarazos definidos como HSC en el tercer trimestre en los valores de referencia actuales.
Los criterios de diagnóstico del HSC en el embarazo han variado a lo largo de los años. La prevalencia de las enfermedades tiroideas difiere entre los países, ya que la autoinmunidad tiroidea, los antecedentes genéticos, la insuficiencia de yodo y los factores ambientales difieren entre las distintas poblaciones. Además, dado que la edad gestacional también afecta a los niveles de TSH, es muy importante utilizar un rango de referencia de TSH específico para cada trimestre según el laboratorio o la población 13. Estudios recientes han mostrado resultados contradictorios respecto al efecto del hipotiroidismo subclínico en el embarazo sobre los resultados perinatales adversos. En el estudio de Cleary-Goldman y col., en el que evaluaron los resultados perinatales de las gestantes con HSC en el primer y segundo trimestre, mostraron que no había relación con los resultados perinatales adversos en ambos trimestres. Sin embargo, no evaluaron el efecto de la positividad de los TPOAbs y el tratamiento médico en los resultados perinatales de las pacientes con HSC en el estudio 11. De forma similar, Ong y col. mostraron que los embarazos definidos como HSC con un valor de corte de 2,5 mIU/L en el primer trimestre no se asociaron a resultados perinatales adversos (16). Mannisto y col. determinaron la relación entre la positividad de HSC y TPOAbs y los resultados perinatales y encontraron que el HSC no estaba relacionado con resultados perinatales adversos, pero la positividad de TPOAbs estaba asociada con la enfermedad hipertensiva del embarazo 17. Korevaar y col. también hallaron que la relación significativa entre el parto prematuro en el HSC no era significativa cuando se excluían los casos positivos a los TPOAbs 18. De forma similar a los resultados de Mannisto y Korevaar, en este estudio encontramos que los embarazos con HSC sin positividad para TPOAbs no se asociaron con resultados perinatales adversos.
También hay estudios que muestran que el HSC conduce a resultados perinatales adversos. Su y col., en su estudio que aceptó el rango normal de TSH como 0,3 a 3,6 mIU/L antes de la 20ª semana de gestación, mostraron que el sufrimiento fetal, el parto prematuro, el mal desarrollo de la visión y el retraso del neurodesarrollo eran significativamente mayores en las mujeres embarazadas con HSC. Sin embargo, su estudio carecía de datos sobre el estado de los TPOAbs y el pequeño número de individuos afectados dio lugar a una baja potencia para el análisis estadístico 10. Karakosta y col. mostraron que el HSC en el primer trimestre se asocia con el peso bajo al nacer y, con la adición de la positividad de los TPOAbs, también puede asociarse con la diabetes mellitus gestacional. En este estudio se incluyeron pacientes que utilizaban medicación tiroidea, pero no se evaluó por separado el estado de las pacientes que no utilizaban medicación 19. Kumru y col. encontraron que las tasas de parto prematuro eran significativamente mayores en la positividad aislada de TPOAbs y en la positividad de HSC y TPOAbs, pero no hallaron una diferencia significativa en los resultados perinatales adversos en las mujeres embarazadas con HSC aislado. También mostraron que el hipotiroidismo subclínico que acompaña a la positividad a los TPOAbs provoca un mayor aumento del riesgo de parto prematuro (2,5 frente a 4,8 veces) 20.
La mayoría de los estudios que evalúan los resultados perinatales del HSC se realizaron en función de los valores de la TSH del primer trimestre o del principio del segundo trimestre. Hay pocas investigaciones que evalúen el HSC en el tercer trimestre. En este estudio, se determinó en forma prospectiva los valores de TSH en el tercer trimestre de gestantes que no recibieron reemplazo de hormonas tiroideas y que no tenían enfermedad tiroidea, y no se halló una correlación significativa entre el HSC y los resultados perinatales adversos. Chen y col. evaluaron los resultados perinatales del HSC en el tercer trimestre y mostraron que el HSC estaba asociado con resultados perinatales adversos como la rotura de membranas antes del parto, la restricción del crecimiento intrauterino y el peso bajo al nacer. En su estudio, el grupo de HSC se formó con los valores locales de referencia de TSH del tercer trimestre (0,67 a 4,99 mUI/L) y los valores de TPOAbs de los casos no fueron incluidos en el estudio 21. En el trabajo de Wu y col., que incluía el periodo preconcepcional y los tres trimestres, el HSC se asoció significativamente con las enfermedades hipertensivas del embarazo en el primer y segundo trimestre, pero no hubo una asociación significativa entre el HSC y los resultados perinatales adversos en el periodo preconcepcional y el tercer trimestre. En esta investigación, el grupo de control estaba formado por embarazadas eutiroideas TPOAbs negativas, pero no se incluyó la relación de los casos de hipotiroidismo subclínico con los valores y resultados de TPOAbs 22.
En 2017, las directrices de la ATA recomendaron el límite superior de TSH como 4 mIU/L, con la preocupación de que los actuales valores de referencia de TSH en el embarazo pueden causar un sobrediagnóstico en las enfermedades tiroideas y ello puede conducir a un sobretratamiento 13. Hasta donde sabemos, solo hay dos estudios que evalúan los valores de referencia de TSH de las directrices actuales de la ATA y los resultados perinatales del HSC 14,23. Lee y col. mostraron que el síndrome de dificultad respiratoria fue significativamente mayor en las pacientes con HSC cuyo límite superior de TSH se aceptó como 4 mIU/L en su estudio que incluía a gestantes de todos los trimestres. Sin embargo, no se encontraron diferencias significativas entre el grupo de control en términos de resultados perinatales adversos en los casos de HSC cuyo límite superior de TSH se evaluó como 3 mIU/L. Además, no se incluyeron los valores de fT4 y TPOAbs en la evaluación en este trabajo 23. De manera similar a nuestro estudio, Li y col. determinaron los resultados perinatales de las gestantes negativas para TPOAbs con HSC. En este trabajo realizado con los valores del primer trimestre, encontraron la enfermedad hipertensiva del embarazo significativamente mayor en el grupo con valores de TSH en el rango de 2,5 a 4 mIU/L. Se halló que la enfermedad hipertensiva del embarazo, el parto prematuro, la placenta previa y el total de resultados perinatales adversos eran significativamente mayores en los casos de hipotiroidismo subclínico con valores de TSH en el rango de 4 a 10 mIU/L14.
Este estudio tiene algunas limitaciones. En primer lugar, no incluyó una muestra de gran tamaño debido a su diseño prospectivo. En segundo lugar, no se registraron la dieta y la ingesta de yodo de las mujeres embarazadas, y no se pudieron evaluar los efectos de estos factores en las funciones tiroideas. Este trabajo también tiene muchos puntos fuertes. Hasta donde sabemos, este es la primera investigación en el tercer trimestre sobre la relación entre el HSC negativo a los TPOAbs y los resultados perinatales, de forma prospectiva. Además, es uno de los pocos que evaluó los resultados perinatales del HSC con diferentes valores de referencia de TSH en línea con las directrices de la ATA de 2017.
En conclusión, en este estudio se utilizaron diferentes valores de referencia de TSH recomendados por las directrices de la ACOG de 2020 y de la ATA de 2017 en el tercer trimestre para el diagnóstico de hipotiroidismo subclínico y se demostró que no había una relación significativa entre los casos de hipotiroidismo subclínico con TPOAbs negativos y los resultados perinatales adversos.











 texto en
texto en