INTRODUCCIÓN
La colestasis intrahepática del embarazo (CIE) es una enfermedad hepática específica del embarazo que afecta al 0,1 a 2% de los embarazos, con amplias variaciones geográficas y étnicas. Los síntomas maternos de la enfermedad incluyen prurito, elevación de los ácidos biliares totales (ABT) en suero y deterioro de las pruebas de función hepática 1-3). Los niveles de bilirrubina sérica pueden estar elevados en una minoría de casos. Los niveles séricos de ácidos biliares en ayunas representan la prueba de laboratorio definitiva para el diagnóstico. Tiene una etiología compleja que incluye factores hormonales, ambientales y genéticos 4). Aunque la etiología subyacente varía, los hallazgos clínicos se asocian a un aumento de los niveles séricos de ABT. La enfermedad da lugar a resultados perinatales adversos, como partos prematuros espontáneos, líquido amniótico teñido de meconio y mortinatos, y estos resultados se correlacionan con los niveles de ABT en el cordón umbilical y en el suero materno5). El mecanismo del aumento de los niveles de ácidos biliares y los resultados perinatales adversos no está bien definido 6). Se subraya que los ácidos biliares elevados pueden causar mortinatos por arritmia cardiaca repentina o vasoespasmo placentario, y aumentar el riesgo de parto prematuro espontáneo al incrementar la sensibilidad y expresión del receptor de oxitocina 5,7).
La hormona estimulante del tiroides (TSH) es producida por la glándula hipófisis anterior y es el principal regulador de la síntesis y secreción de la hormona tiroidea. La TSH también tiene efectos extra tiroideos, y los estudios han demostrado que la TSH puede suprimir la actividad de la 7a-hidroxilasa de colesterol (CYP7A1), que es la enzima que limita la tasa de síntesis de ácidos biliares en el hígado a través del receptor de la TSH, y puede conducir a una disminución de los niveles de ácidos biliares 8). Como es sabido, existen dos formas principales de hormonas tiroideas, la triyodotironina (T3), que es la forma activa, y la tiroxina (T4), una prohormona activada por las deiodinasas a nivel celular y circulatorio 9). La hormona tiroidea interviene en muchos eventos metabólicos a través de los receptores nucleares TH en varios tejidos. El metabolismo de las lipoproteínas está fuertemente influenciado por la hormona tiroidea, y la dislipidemia es común en los trastornos tiroideos. En estudios con animales, se ha demostrado que la hormona tiroidea es eficaz en la conversión de colesterol en ácidos biliares y en la secreción biliar de colesterol y ácidos biliares 10). Todos estos efectos muestran una relación entre el mecanismo de la hormona tiroidea y la vía intrahepática.
En estudios anteriores se ha demostrado un aumento de la frecuencia de CIE en mujeres embarazadas con enfermedad tiroidea 11). Sin embargo, hay pocos estudios que evalúen la función tiroidea en casos de CIE 12-14). Por lo tanto, en este estudio, nos propusimos evaluar la relación entre los niveles de TSH, tiroxina libre (fT4) y ácidos biliares y los resultados perinatales mediante la evaluación de las pruebas de función tiroidea en mujeres embarazadas con CIE.
MÉTODOS
Este estudio transversal de casos y controles se realizó con mujeres embarazadas seguidas en el Departamento de Perinatología del Hospital de Formación e Investigación de la Universidad de Ciencias de la Salud Tepecik, Izmir, Turquía, entre el 1 de enero de 2019 y el 31 de diciembre de 2021. Los datos se recogieron del sistema de registro digital del hospital. El protocolo del estudio fue aprobado por el Comité de Ética institucional local (número de aprobación: 2022/ 01-13).
Se incluyeron en el estudio las gestantes con diagnóstico de colestasis intrahepática del embarazo que dieron a luz en nuestro hospital entre las fechas pertinentes. El diagnóstico de CIE se basó en la presencia de prurito asociado a niveles elevados de ABT (≥ 10 μmol/L)(15). Las gestantes que dieron a luz en el mismo período y no tenían ninguna enfermedad crónica, mediante aleatorización computarizada representaron un control para cada caso. Se excluyeron del estudio las gestantes con embarazos por fecundación in vitro, embarazos múltiples o comorbilidades (trastornos hipertensivos, diabetes mellitus gestacional y pregestacional, enfermedad hepática conocida, enfermedad tiroidea conocida).
Los datos bioquímicos extraídos del suero materno del tercer trimestre fueron los niveles de ABT en ayunas, TSH, fT4, alanina aminotransferasa (ALT), aspartato aminotransferasa (AST) y bilirrubina total. Los casos de CIE se dividieron en dos subgrupos según los niveles de ABT. Los niveles de ABT entre 10 y 40 µmol/L se definieron como CIE leve, y los niveles de ABT de 40 µmol/L y superiores se definieron como CIE grave. Las enfermedades tiroideas se definieron según las directrices del Colegio Americano de Obstetricia y Ginecología (ACOG) de 202016). Las gestantes con niveles de TSH >10 mIU/L o aquellas con niveles de TSH en el rango de 3 a 10 mIU/L pero con niveles de fT4 por debajo de los valores de referencia del tercer trimestre (0,7 a 1,20 ng/dL) se definieron como hipotiroidismo manifiesto. El hipotiroidismo subclínico se definió como niveles de TSH en el rango de 3 a 10 mIU/L y niveles de fT4 dentro de los valores de referencia normales específicos del trimestre. El hipertiroidismo manifiesto se definió como niveles de TSH inferiores a 0,3 mIU/L y niveles de fT4 superiores a los valores de referencia. El hipertiroidismo subclínico se definió como niveles de TSH inferiores a 0,3 mIU/L y niveles de fT4 dentro de los valores de referencia normales. La hipotiroxinemia aislada se definió como una concentración de TSH materna normal combinada con una concentración de fT4 por debajo de los valores de referencia.
Se compararon las características maternas (edad, paridad, índice de masa corporal (IMC)), los resultados perinatales (tipo de parto, semana de parto, peso al nacer, puntuación de Apgar y resultados maternos y neonatales adversos), los niveles de TSH, los valores de la hormona tiroidea y los niveles de ABT del grupo de CIE y del grupo de control. Además, se examinó la correlación entre los niveles de TSH, fT4 y ABT.
El análisis de los datos se realizó con el Statistical Package for the Social Sciences versión 26.0 (IBM Corporation, Armonk, Nueva York, EE.UU.). La distribución normal de las variables se evaluó según las pruebas de Kolmogorov-Smirnov. Si las variables tenían una distribución normal, se utilizó la prueba T de Student, y si las variables no tenían una distribución normal, se utilizó la prueba U de Mann-Whitney. Para las variables categóricas entre grupos se utilizó la prueba de chi-cuadrado. La prueba de correlación de Spearman se usó para evaluar la correlación entre grupos. Los resultados se consideraron significativos cuando la p<0,05.
RESULTADOS
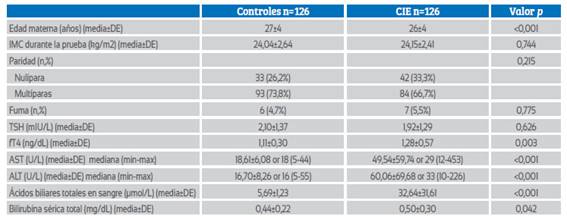
Se evaluaron las pruebas de función tiroidea del tercer trimestre y los niveles de ABT de un total de 252 mujeres embarazadas, 126 con CIE y 126 con controles. Las características maternas y los resultados de laboratorio de ambos grupos se presentan en la tabla 1. La edad materna media del grupo con CIE fue de 26±4, y la del grupo de control fue de 27±4 (p<0,001). No hubo diferencias significativas entre los dos grupos en cuanto a la paridad media, el IMC medio y las tasas de tabaquismo. Los niveles séricos maternos de AST, ALT y bilirrubina total fueron significativamente mayores en el grupo de CIE (p<0,001, p<0,001, p=0,042; respectivamente), y el nivel medio de ABT fue significativamente mayor en el grupo de CIE (5,69±1,23 frente a 32,64±31,61; p<0,001). No hubo diferencias significativas en los niveles medios de TSH en suero materno entre los dos grupos (p=0,626), pero el nivel medio de fT4 fue significativamente mayor en el grupo de CIE (p=0,003).
Tabla 1 Características maternas y resultados de laboratorio del grupo Colestasis intrahepática del embarazo y del grupo de Control.
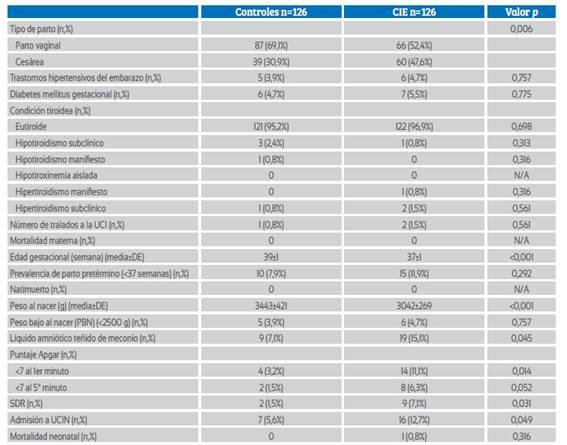
Los resultados maternos y fetales de ambos grupos se presentan en la tabla 2. La semana gestacional media del parto fue significativamente mayor en el grupo de control (39±1 frente a 37±1, p<0,001), pero no hubo diferencias significativas en la prevalencia de partos prematuros (<37 semanas) entre los dos grupos (p=0,292). La tasa de partos por cesárea fue significativamente mayor en el grupo de CIE (30,9% frente a 47,6%; p=0,006). No hubo diferencias significativas entre los dos grupos en cuanto a la morbilidad materna (trastornos hipertensivos del embarazo, diabetes mellitus gestacional, traslado a la unidad de cuidados intensivos (UCI)) y enfermedades tiroideas del tercer trimestre. El peso medio al nacer fue significativamente mayor en el grupo de control (3,443±421 frente a 3,042±269; p<0,001), pero las tasas de recién nacidos con peso bajo al nacer (PBN) fueron similares en ambos grupos (p=0,757). Los resultados neonatales adversos, como el líquido amniótico teñido de meconio, la puntuación de Apgar al primer minuto <7, el síndrome de dificultad respiratoria (SDR) y el ingreso en la unidad de cuidados intensivos neonatales (UCIN), fueron significativamente mayores en el grupo de CIE (p< 0,05, para todos).
Tabla 2 resultados maternos y fetales del grupo Colestasis intrahepática del embarazo y del grupo de Control.
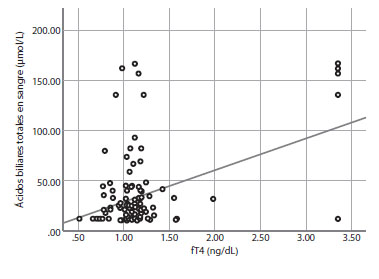
Los resultados maternos y neonatales del grupo de CIe se evaluaron como CIE leve y grave según los niveles de ABT en suero de la madre (tabla 3). No hubo diferencias significativas en los niveles medios de TSH en suero entre los dos grupos (p=0,317), pero los niveles de fT4 fueron significativamente mayores en el grupo de CIE grave (1,21±0,38 frente a 1,46±0,88; p=0,025). Además, se examinó la correlación entre los niveles de ABT y los niveles de TSH y fT4 en el grupo de CIE (Figuras 1 y 2). Hubo una correlación positiva significativa entre los niveles de ABT y los niveles de fT4 (r = 0,451, p<0,01), pero no se encontró una correlación significativa entre los niveles de ABT y los niveles de TSH (r = 0,091, p>0,01). Los niveles medios de AST, ALT y bilirrubina total fueron significativamente mayores en el grupo de IE grave (p<0,05, para todos). Las semanas gestacionales medias en el momento del parto y el peso al nacer fueron significativamente mayores en el grupo de CIE leve (p<0,05, para todos), pero las tasas de partos prematuros (<37 semanas) fueron similares en ambos grupos. Los resultados neonatales adversos, como el líquido amniótico teñido de meconio, la puntuación de Apgar en el primer minuto <7, el SDR y el ingreso en la UCIN fueron significativamente mayores en el grupo de CIE grave (p<0,05, para todos).
Tabla 3 resultados perinatales y hallazgos de laboratorio del grupo de Colestasis leve y del grupo de Colestasis grave.
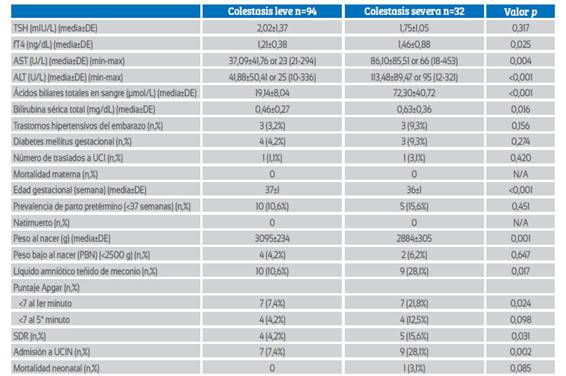
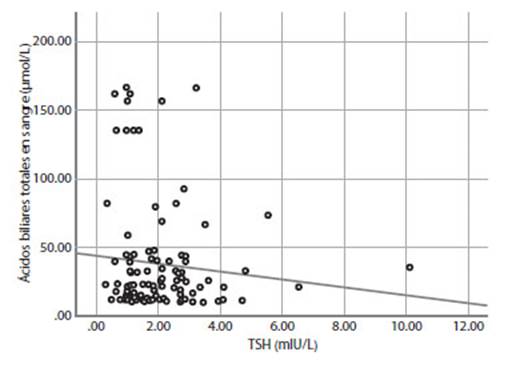
figura 1 análisis de Correlación de los ácidos biliares séricos Totales y la TSH en el grupo de Colestasis intrahepática del embarazo (r = -0,091, p>0,01).
DISCUSIÓN
En este estudio, hemos evaluado las pruebas de la función tiroidea en el tercer trimestre en los casos de CIE sin enfermedad tiroidea conocida y hallamos que los niveles de fT4 eran significativamente más altos en los casos de CIE. Además, había una correlación positiva entre los niveles de fT4 y los niveles de ABT en el grupo de CIE. Los niveles de TSH no estaban correlacionados
con los niveles de ABT y no había diferencias significativas entre los dos grupos. La tasa de partos por cesárea fue significativamente mayor en el grupo de CIE y los resultados neonatales adversos fueron significativamente mayores en el grupo de CIE y CIE grave.
La CIE es una enfermedad específica del embarazo y en estudios anteriores se ha demostrado su asociación con resultados perinatales adversos. Puede causar partos prematuros espontáneos o iatrogénicos, líquido amniótico teñido de meconio, asfixia fetal y mortinatos 5,15,17). Los resultados perinatales adversos aumentan en correlación con el incremento de los niveles de ABT en la sangre materna y fetal 5). Sin embargo, sigue siendo difícil predecir completamente los resultados perinatales adversos. La muerte fetal se produce de forma repentina y las evaluaciones del bienestar fetal, tal como la prueba no estresante, son inútiles en la predicción 18,19). Los esfuerzos por prevenir esta complicación imprevisible también pueden causar un parto prematuro iatrogénico 20). Al igual que en estudios anteriores, los casos de CIE se asociaron a resultados perinatales adversos en este estudio. El parto por cesárea, el líquido amniótico teñido de meconio, la puntuación de Apgar baja en el primer minuto, el SDR y las tasas de ingreso en la UCIN fueron significativamente mayores en los casos de CIE. Aunque la semana media de parto fue significativamente menor en los casos de CIE, las tasas de parto prematuro fueron similares a las del grupo de control. Estos resultados perinatales adversos fueron mayores en los casos de CIE grave en relación con el nivel sérico de ABT. Estudios recientes han demostrado que la CIE está asociada a trastornos metabólicos como la dislipidemia, la diabetes gestacional y los trastornos hipertensivos 21). En este estudio, también se evaluó la prevalencia de enfermedades como la hipertensión y la diabetes gestacional que pueden acompañar a la colestasis y no se hallaron diferencias significativas entre los dos grupos.
La etiología de la CIE no ha sido dilucidada por completo, pero se ha demostrado su asociación con factores genéticos, endocrinos y ambientales 4,22,23). Aunque la etiología de la CIE difiere, los hallazgos clínicos se producen con un aumento de los niveles de ABT. Los ácidos biliares se sintetizan en el hígado y son el punto final inicial del catabolismo del colesterol. Una vía enzimática de múltiples pasos logra esto, y la síntesis está mediada en parte por el primer paso limitante de la tasa, la hidroxilación 7-alfa del colesterol, la enzima CYP7A1 del citocromo P45024). Las hormonas progesterona y estrógeno, cuyas concentraciones aumentan a medida que avanza el embarazo, contribuyen a las modificaciones en el metabolismo de los ácidos biliares 25). El estrógeno y sus metabolitos aumentan la actividad de la enzima CYP7A1 y provocan un aumento del nivel de ácidos biliares. La progesterona tiene un efecto similar a través de los receptores, y debido al aumento de los niveles de estas hormonas durante el embarazo, se produce un aumento del nivel de ABT, aunque ligero, en el embarazo normal 25).
La hormona tiroidea es un potente regulador de múltiples vías metabólicas a través de la interacción con sus receptores en diversos tejidos. El metabolismo de las lipoproteínas de la tiroides se ve fuertemente afectado, y la dislipidemia es común en los trastornos tiroideos. Las hormonas tiroideas permiten la conversión del colesterol en ácidos biliares, y la disminución del colesterol LDL en plasma es una característica del hipertiroidismo. El efecto de la hormona tiroidea en el metabolismo del colesterol es similar al de la hormona del estrógeno y aumenta su conversión en ácido biliar mediante la estimulación de la enzima CYP7A110). La TSH es el principal regulador de la síntesis y secreción de la hormona tiroidea. Sin embargo, también se ha informado de que ejerce efectos extra tiroideos. La TSH puede suprimir la actividad del CYP7A1 a través del receptor de la TSH (TSHR) en el hígado y hacer que los niveles de ABT disminuyan. Los estudios en animales y humanos han demostrado que las concentraciones de TSH en plasma están fuerte e inversamente correlacionadas con los niveles de ABT en plasma 8,26,27).
Hay estudios que muestran que la prevalencia de la CIE puede verse afectada en las enfermedades tiroideas durante el embarazo, pero se han realizado pocas investigaciones para evaluar la relación entre los casos de CIE y las hormonas tiroideas 11). En primer lugar, Pineda y col. evaluaron los niveles de hormonas tiroideas en la CIE y descubrieron que los niveles de fT3 eran significativamente mayores en los casos de CIE, mientras que los niveles de TSH y fT4 eran similares a los del grupo de control 13). Sin embargo, este estudio incluyó 26 casos de CIE y no se evaluó la ingesta de hormonas tiroideas de sustitución. Zheng y col. evaluaron los niveles de TSH y de anticuerpos contra la peroxidasa tiroidea (TPOAb) en los casos de CIE y descubrieron que los niveles de TSH y TPOAb eran significativamente más altos en los casos de CIE y se correlacionaban positivamente con la gravedad de la CIE. También estudiaron el efecto del tratamiento con ácido ursodesoxicólico y adenosina metionina sobre los niveles de TSH y TPOAb y mostraron que había una disminución de los niveles de ambas hormonas tanto en los casos de CIE grave como en los leves 12). Sin embargo, en este estudio no se evaluó la sustitución de la hormona tiroidea ni los niveles de esta, que se espera que afecten los niveles de TSH. En un estudio reciente, Yang y col. evaluaron las hormonas tiroideas, la hormona TSH y los niveles de ABT de mujeres embarazadas en el primer y tercer trimestre en su estudio prospectivo 14). Encontraron que un nivel más alto de fT4 tanto al principio como al final del embarazo se asociaba con una mayor concentración de ABT y un mayor riesgo de CIE. También descubrieron que un nivel elevado de TSH al principio del embarazo se asociaba a una mayor concentración de ABT al principio del embarazo, pero a una menor concentración de ABT posteriormente en el embarazo, y no hubo una relación significativa entre la TSH y la CIE. Los resultados de su estudio mostraron que el hipertiroidismo manifiesto o subclínico puede estar asociado a la CIE.
En este estudio, evaluamos los niveles de TSH y fT4 en el tercer trimestre del embarazo en 126 casos de CIE sin enfermedad tiroidea conocida y que no recibían sustitución de hormonas tiroideas. Encontramos que los niveles de fT4 eran significativamente más altos en los casos de CIE y los niveles de TSH fueron similares a los del grupo de control. Además, los niveles de fT4 eran significativamente más altos en los casos de CIE grave que en los casos de CIE leve, y hubo una correlación positiva entre los niveles de ABT y los niveles de fT4. Cuando se evaluaron los niveles de TSH y fT4 con los valores de referencia específicos del trimestre, no se encontraron diferencias significativas entre los dos grupos en cuanto a las enfermedades tiroideas. La similitud de las prevalencias de enfermedades tiroideas en los dos grupos puede deberse a que el estudio se diseñó con mujeres embarazadas sin enfermedades tiroideas conocidas y a la baja prevalencia de enfermedades tiroideas en la población.
La limitación de este estudio fue que no pudimos evaluar la relación entre los valores de TSH y fT4 del primer trimestre de las mujeres embarazadas y los niveles de CIE y ABT, ya que las gestantes fueron remitidas a este centro de atención terciaria en el tercer trimestre. Los puntos fuertes de este estudio fueron que se trata de uno de los pocos estudios que examinaron los niveles de TSH y fT4 en casos de CIE y que no se incluyeron en el estudio gestantes que se sabía tenían una enfermedad tiroidea o que estaban recibiendo terapia de sustitución de hormonas tiroideas que pudieran afectar los niveles de estas hormonas.
En conclusión, este estudio mostró que un mayor nivel de fT4 se asoció con un mayor nivel de ABT, y el nivel de fT4 se asoció con un mayor riesgo de CIE y con la gravedad de la CIE. Sin embargo, el nivel de TSH no se asoció con un mayor nivel de ABT ni con mayor riesgo de CIE. Esta información apoya que la CIE puede estar asociada a la función tiroidea. Se necesitan estudios que evalúen la ABT y los niveles de hormonas tiroideas al principio y al final del embarazo y que examinen el efecto de la sustitución de hormonas tiroideas en los resultados.











 texto en
texto en