INTRODUCCIÓN
El síndrome del folículo vacío (SFV) se define como la incapacidad total para recuperar ovocitos después de la estimulación ovárica controlada, la monitorización del crecimiento folicular múltiple y la punción ovárica con aspiración folicular, a pesar de un desarrollo aparentemente normal de los folículos ováricos y la producción adecuada de estradiol por las células de la granulosa. Su incidencia es prácticamente anecdótica (0,045 % a 3,5 %) 1), pero conlleva un fuerte impacto emocional en pacientes estériles. Su etiopatogenia es incierta en la mayoría de los casos. Entre los factores de riesgo destaca cualquier noxa que pueda provocar una supresión hipofisaria excesiva. Presentamos el caso de una paciente con endometriosis ovárica y niveles basales de LH disminuidos, probablemente secundarios al uso prolongado de anticonceptivos combinados orales en pauta continua.
El autor primer firmante del manuscrito de referencia, en su nombre y en el de todos los autores firmantes, declara que no existe ningún potencial conflicto de interés ni financiación relacionado con el artículo.
COMUNICACIÓN DEL CASO CLÍNICO
Se trata de una pareja con esterilidad primaria de 4 años de evolución. Él tenía 38 años y no refería antecedentes familiares ni personales de interés. Ella tenía 34 años y no presentaba antecedentes familiares relevantes. Entre sus antecedentes médico-quirúrgicos destacaba una cistectomía ovárica bilateral laparoscópica por endometriomas de 10 y 15 cm de diámetro máximo, a los 28 años, sin hallazgos radiológicos demostrativos de endometriosis profunda. Con relación a los antecedentes gineco-obstétricos, era nuligesta, menarquia a los 10 años, presentaba una fórmula menstrual 4/28 y era usuaria de anticonceptivos orales combinados (AOC) en pauta continua desde la intervención, que han mejorado significativamente los síntomas de dolor pélvico, dispareunia y disquecia.
La paciente presentaba un índice de masa corporal (IMC) de 24,52 kg/m2. La exploración física e inspección genital no hallaron patología. En el estudio hormonal en fase folicular precoz presentó los siguientes valores: folitropina (FSH) 3,18 UI (3,5 a 12,5 U/l), lutropina (LH) 0,7 U/I (2,5 a 12,5 U/l), estradiol 10 pg/mL (26,7 a 156 pg/mL) y hormona antimülleriana (AMH) 3,06 ng/mL (1,20 a 9,20 ng/mL). Ecográficamente se objetivó un endometrioma de 25 mm en el ovario derecho. El recuento total de folículos antrales (RFA) en fase folicular temprana fue 12. La paciente aportó una histerosonosalpingografía (HSSG) que mostraba ambas trompas de Falopio permeables y de morfología ecográfica normal. La pareja presentaba un recuento de espermatozoides de 80 millones/ mL con movilidad y morfología normales (según criterios de la Organización Mundial de la Salud, año 2010). Los cariotipos de ambos eran normales. El varón no era portador de mutaciones para la fibrosis quística (panel de 50 mutaciones).
Se inició ciclo de estimulación ovárica controlada para procedimiento de fecundación in vitro con gonadotropina menopáusica humana y folitropina alfa, asociadas a antagonistas de la GnRh. Para la maduración ovocitaria se administró una dosis de 250 mcg de coriogonadotropina alfa 36 horas de la punción folicular. El día de la estimulación (trigger), el nivel de estradiol fue 4,267 pg/ mL (3,5 a 12,5 U/l) y el recuento de folículos antrales (RFA) mayores de 17 mm fue de 10. Tras punción folicular sin incidencias no se obtuvo ningún cúmulo ovocitario.
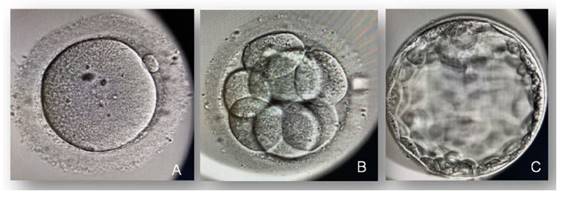
Previo al segundo ciclo de estimulación ovárica, se interrumpió el AOC durante 2 ciclos previos a la estimulación, para evitar una excesiva supresión hipofisaria como consecuencia del uso prolongado del AOC. Se administró folitropina alfa 300 UI/ día, seguido a partir del sexto día de inicio de la estimulación, de folitropina alfa junto con lutropina alfa 300 UI para el desarrollo folicular, asociadas a antagonistas de la GnRh, y triptorelina junto a coriogonadotropina alfa (estrategia de doble descarga: análogo de la GnRH 0,2 mg a las 40 horas y hCG 250 mcg a las 34 horas previa a la punción folicular) para la maduración ovocitaria. Tras la punción folicular se obtuvieron 22 cúmulos ovocitarios, 18 ovocitos maduros y 7 embriones evolutivos en estadio de blastocisto (figura 1). Se congeló los 7 embriones y posteriormente se realizó ciclo sustitutivo con valerato de estradiol oral (6 mg/ día) para transferencia electiva de embrión único (calidad según ASEBIR AB), sin emplear diagnóstico genético preimplantacional, que dio lugar a un recién nacido varón sano, mediante parto vaginal, con peso al nacimiento de 3,450 g.
DISCUSIÓN
El síndrome del folículo vacío (SFV) se define como la incapacidad total para recuperar ovocitos después de la estimulación ovárica controlada, la monitorización del crecimiento folicular múltiple y la punción ovárica con aspiración folicular (recuperación de ovocitos), a pesar de un desarrollo apartemente normal de los folículos ováricos y la producción adecuada de estradiol por las células de la granulosa 1). Durante el desarrollo folicular, el ovocito en crecimiento estará rodeado por las células del cúmulo, y estas, a su vez, están unidas a las células de la granulosa que unen estrechamente el óvulo a la pared del folículo 2). El pico fisiológico de LH a mitad del ciclo, que puede ser imitado por la administración de coriogonadotropina o análogo de la hormona liberadora de gonadotropina, promueve las rupturas de las uniones intercelulares y permite que el complejo cúmulo-ovocito flote libremente en el líquido folicular para poder ser aspirado 3).
En la práctica clínica, el número de ovocitos recuperados en el momento de la extracción suele ser inferior al número de folículos puncionados, siendo el fallo completo de recuperación una situación excepcional. Existe un amplio rango de prevalencia que oscila entre el 0,045 y 7 %, según lo notificado en la literatura científica 4,5).
La fisiopatología del SFV es hasta el día de hoy desconocida. Hay descrita causas multifactoriales. En primer lugar, habría que descartar errores en la administración de la medicación para la maduración ovocitaria entre 34 y 38 horas antes de la punción folicular (‘SFV falso’)(6). Cabiendo está la posibilidad en este caso de que no se haya aplicado correctamente la inyección de hCG recombinante. Además, se han descrito inversiones pericéntricas en el cromosoma 2(7), pero esta causa fue descartada en nuestra paciente gracias a la realización de cariotipo molecular de la paciente mediante microarrays. Por otra parte, la administración de análogo de la hormona liberadora de gonadotropina para la maduración ovocitaria va a producir un efecto flareup liberando LH y FSH, de forma análoga al ciclo natural, imprescindible para la maduración ovocitaria final 8), siendo esto diferente al trigger con hCG que únicamente provoca la elevación de LH. El aumento de FSH ayuda en la maduración nuclear, la reanudación de la meiosis y la expansión del cúmulo y también induce la formación del receptor de LH en las células de la granulosa a finales fase folicular 9).
Resulta evidente que el uso de anticonceptivos combinados va a conllevar una disminución marcada de los niveles basales de LH y, para mayor abundamiento, esta inhibición transitoria va a tener una correlación con el tiempo y la dosis de exposición al fármaco 10). Por tanto, en nuestra paciente planteamos como estrategia inicial suspender el AOC un mínimo periodo de tiempo, siempre y cuando no exacerbara los síntomas propios de la endometriosis.
Existe evidencia de calidad moderada que confirma una tasa inferior de nacidos vivos y gestaciones en curso tras el pretratamiento con AOC en los protocolos de estimulación con antagonistas de la GnRH en comparación con ningún pretratamiento (6 ECA, OR 0,74, IC 95% 0,58 a 0,95, 1335 mujeres) 11); el tipo de AOC utilizado en los estudios fue heterogéneo con respecto al estrógeno y componentes de progestágenos, así como los días de inicio o duración. La duración varió de 12 a 28 días. Otra condición importante con cierta heterogeneidad entre los estudios es el periodo de lavado entre la interrupción y el inicio de la estimulación 12). Aunque no se ha encontrado en los estudios que la causa de una menor tasa de embarazos sea por la ocurrencia de un síndrome de folículo vacío, se podría considerar esta estrategia como riesgo teórico a evitar en la situación de nuestra paciente.
La ESHRE (European Society of Human Reproduction and Embryology) no recomienda el pretratamiento con AOC en protocolo de antagonista de la GnRH debido a la reducción de la eficacia 13).
Adicionalmente, Noushin y col. en un reciente estudio concluyen que el uso de la doble descarga para inducir la ovulación junto con el retraso en la punción tras la administración del trigger (siguiendo la pauta agonista GnRH y hCG, 40 y 36 h previas a la punción, respectivamente) muestra un aumento significativo en el número de ovocitos maduros, número de fertilizados y de embriones transferibles, lo cual habla a favor de ser una estrategia de tratamiento segura para disminuir el SFV 14).
Como conclusiones, el síndrome del folículo vacío 15 es una entidad muy infrecuente que va a conllevar un fuerte impacto emocional en la paciente y un alto coste económico. Actualmente, su etiopatogenia es incierta cuando se asegura una correcta administración de los fármacos que van a permitir la maduración ovocitaria final. Estrategias novedosas como la maduración ovocitaria con doble descarga para desencadenar la ovulación son buena arma para disminuir su prevalencia, como se empleó en nuestro caso, agregando así una nueva opción de manejo en el arsenal para esta condición poco común, pero angustiosa y desafiante.











 texto en
texto en