Introducción
En diabetes pregestacional (DPG) el control glicémico debe ser estricto, con un monitoreo frecuente de niveles de glucosa para ajustar el tratamiento a medida que el embarazo progresa1. La glucometría capilar es el método más utilizado para el monitoreo de glucosa y se recomienda realizarla hasta 7 veces por día2. El monitoreo continuo de glucosa (MCG) es una alternativa que mide glucosa intersticial3. El sensor contiene la enzima glucosa oxidasa, la cual hace que la glucosa intersticial reaccione con oxígeno y los electrones liberados de esta reacción son medidos por el sensor, de manera dependiente de la concentración de la glucosa4.
La Asociación Americana de Diabetes (ADA) y el Colegio Americano de Obstetricia y Ginecología (ACOG) han establecido metas específicas para gestantes que utilizan MCG2,3.
El uso del MCG durante la gestación en el Perú es limitado. El presente estudio de casos evaluó los parámetros glicémicos del MCG en pacientes con diabetes mellitus tipo 2 pregestacional por 2 semanas durante su gestación, así como el impacto que tuvo en el manejo de la diabetes.
Comunicación de los casos
Esta comunicación presenta cuatro casos de gestantes mayores de 18 años con DPG atendidas en el consultorio de endocrinología del Hospital Nacional Docente Madre Niño San Bartolomé, Lima, Perú. A las gestantes se les colocó un MCG Libre 2 por dos semanas y participaron de videoconferencias semanales de educación nutricional que incluyeron conceptos de nutrición, conteo de carbohidratos y registros diarios de ingesta alimentaria. Adicionalmente, tuvieron controles semanales con su endocrinólogo. Se inició insulina cuando el tiempo por encima de 140 mg/dL era >20%.
El estudio fue aprobado por el Comité de Ética del Hospital. Todas las participantes firmaron un consentimiento informado.
Descripción de los casos:
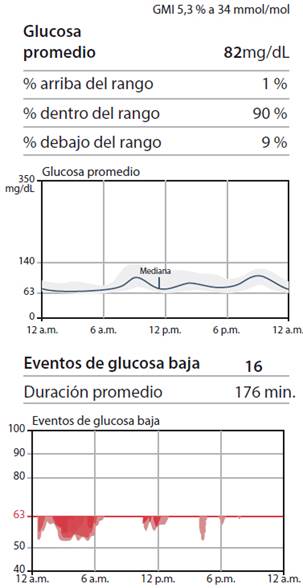
Gestante 1: 34 años de edad, sin tratamiento previo. El MCG fue colocado en la semana 32 de gestación, inició insulina detemir y se disminuyó la dosis en 3 ocasiones debido a hipoglicemia nocturna (Figura 1). El desenlace fue cesárea a término, con un recién nacido de 4,3 kg.
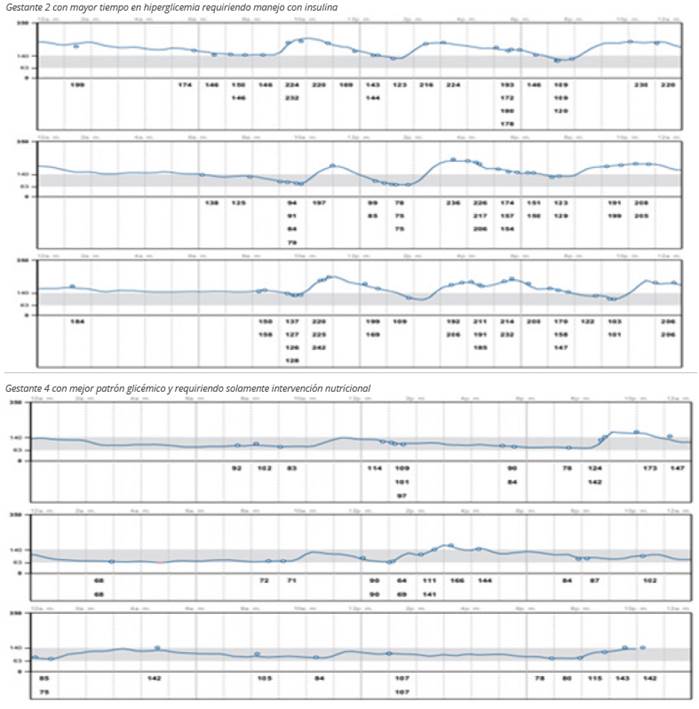
Gestante 2: 29 añosde edad, con historia de hipotiroidismo, tratamiento previo con metformina y glibenclamida. Durante la gestación se inició tratamiento con insulina NPH y regular; se ajustó la dosis previa al uso del MCG en 2 ocasiones. El MCG fue colocado a las 22 semanas de gestación. El desenlace fue un óbito fetal de 3 kg de peso a las 37 semanas de gestación.
Gestante 3: 39 años de edad, tratamiento previo con metformina y glibenclamida, con antecedente de hipotiroidismo. Durante la gestación se empezó insulina NPH y regular y las dosis se ajustaron 8 veces antes del MCG. La MCG fue colocada a las 8 semanas de gestación. El desenlace fue un aborto retenido a las 10 semanas de gestación.
Gestante 4: 31 años de edad, tratamiento previo con metformina. El sensor fue colocado a las 17 semanas de gestación; el sensor no calculó la HbA1c estimada. La paciente requirió únicamente manejo dietético. Fue ingresada a las 39 semanas y 3 días por sospecha de colestasis intrahepática, polihidramnios y macrosomía fetal. Durante la hospitalización, desarrolló insuficiencia placentaria y fue una cesárea inducida, con un recién nacido de 3,9 kg.
Discusión
En nuestro estudio, el MCG ayudó a establecer patrones glicémicos y ajustes en el tratamiento. Estos dispositivos sirvieron de retroalimentación positiva a las pacientes, que modificaron su alimentación al ver en tiempo real el efecto de los alimentos sobre su nivel de glucosa. Estudios anteriores han mostrado como el MCG ayuda a establecer un tratamiento farmacológico temprano en DPG4.
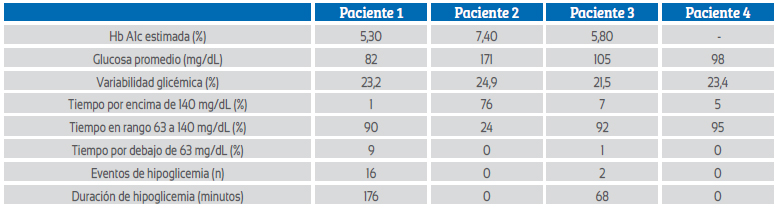
Una gestante logró un adecuado control glicémico con solo educación nutricional apoyada con el uso del sensor (Figura 2). En otra paciente, la dosis de insulina fue reducida debido a hipoglicemias nocturnas identificadas con el MCG, un hallazgo informado previamente5.
La gestante 2 tuvo como desenlace un óbito fetal; su tiempo en rango (TER) fue el más bajo del grupo (Figura 2). El TER alto y un promedio bajo de glucosa diaria están asociados con un riesgo menor de complicaciones neonatales6.
La gestante 3 tenía diabetes descontrolada, requiriendo ajustes en la insulina antes del uso del MCG. Luego de colocarse el sensor, la paciente mantuvo control glicémico adecuado con un TER de 92%. Es probable que el descontrol glicémico previo al uso del sensor pudo contribuir al aborto retenido, apoyando la necesidad el buen control glicémico incluso en la preconcepción2.
El principal beneficio del MCG es la disminución de patologías materno-perinatales como la preeclampsia, macrosomía, parto por cesárea y parto prematuro7-9. El MCG ha sido relacionado con mejor control glicémico y menor variabilidad glicémica en gestantes y por consecuencia mejores desenlaces en los neonatos1. Las gestantes de esta serie de casos informaron una mejor comprensión entre su ingesta dietética y los valores de glicemia posprandial.
En conclusión, el MCG es útil para el manejo de pacientes con diabetes mellitus tipo 2 durante el embarazo, permitiendo identificar patrones glicémicos que requieren intervención temprana para evitar complicaciones materno-neonatales.











 texto en
texto en