Introducción
El carcinoma de células escamosas (CCE) primario ovárico es poco frecuente. La mayoría surgen de quistes dermoides y otros se asocian con tumores de Brenner o endometriosis preexistentes, pero aquellos que no surgen de alguna lesión ovárica preexistente son extremadamente raros1. El desarrollo de novo del CCE primario puro en un ovario sin lesiones, es inusitado -existen reportes de menos de 30 casos- y posiblemente deriva de la metaplasia del epitelio superficial. Debido a su baja frecuencia, existe poca información sobre las características clínicas y no se ha identificado tratamientos útiles y eficaces2-4. Se presenta un caso de carcinoma de células escamosas primario puro de ovario.
Caso clínico
Una paciente de 35 años, gesta 3, para 2 y un aborto fue referida a la consulta ginecológica por presentar dolor abdominal progresivo y distensión abdominal de aproximadamente 6 meses de evolución. La paciente refería pérdida de aproximadamente 12 kilogramos de peso en dicho lapso, sin cambios en apetito, hábito evacuatorio-miccional o hemorragia uterina. Ella negaba antecedentes personales de patologías crónicas, el uso de medicamentos y consumo de alcohol, tabaco o drogas recreativas. Los ciclos menstruales eran normales.
En el examen físico se observó palidez cutáneo-mucosa sin ictericia ni linfadenopatías cervicales o axilares. La evaluación mamaria estaba dentro de límites normales. La palpación abdominal mostró la presencia de tumoración firme y móvil que ocupaba gran parte de la pelvis. No se encontró evidencia de ascitis. El examen ginecológico reveló tumoración dura y firme, de 16 x 9 centímetros, con movilidad restringida que parecía originarse del anexo derecho y ocupaba todo el fondo del saco de Douglas. El anexo izquierdo estaba libre. El útero era de tamaño normal, pero estaba desviado a la izquierda. En la exploración rectal, la mucosa rectal estaba libre.
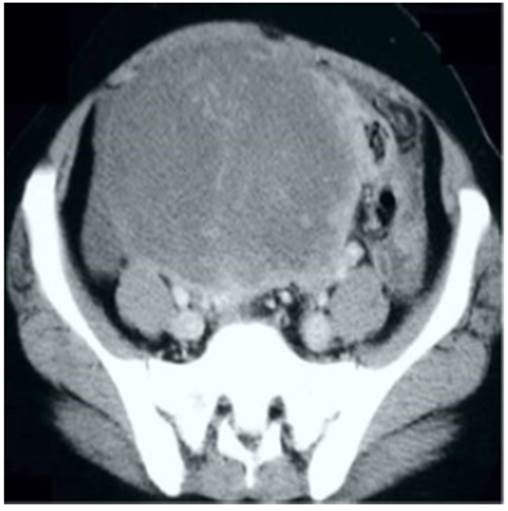
La ecografía transvaginal y la tomografía computarizada abdomino-pélvica con contraste mostraron tumoración heterogénea de 14 x 9 x 6 centímetros que ocupaba gran parte del abdomen inferior y que aparentemente se originaba del mesenterio intestinal en fosa iliaca derecha (Figura 1). También se hallaron múltiples nódulos en mesenterio y peritoneo. Las pruebas bioquímicas, de hematología, coagulación, electrolitos y funcionalismo hepático y renal fueron normales. En vista de los hallazgos de posible enfermedad metastásica por imágenes, se decidió realizar la determinación de los marcadores tumorales que tuvieron los siguientes resultados: CA-125, 29 UI/mL (normal: 0 a 35 UI/mL); CA 19-9, 35 UI/mL (0 a 40 UI/mL) y antígeno carcinoembrionario, 2,8 ng/mL (0,4 a 3,1 ng/mL). En el examen citológico del cuello uterino no se encontraron células anormales.
La paciente fue programada para laparotomía exploradora en la que se encontró tumoración sólida, de color grisáceo que se originaba del anexo derecho, fuertemente adherida al colon sigmoides. También se observó enfermedad metastásica peritoneal con afección del epiplón y depósitos en mesenterio del intestino delgado. La biopsia por congelación sugirió tumor ovárico maligno de tipo escamoso. Se realizó resección quirúrgica de todos los tumores abdomino-pélvicos visibles más histerectomía abdominal total, salpingoforectomía bilateral, omentectomía total, apendicetomía, resección del intestino delgado con anastomosis termino-terminal, linfadenectomía pélvica y para-aórtica, colectomía sigmoidea con cierre primario del muñón rectal y exteriorización del colon proximal junto con lavado peritoneal.
El estudio anatomopatológico encontró tumor ovárico de color grisáceo con áreas de hemorragia y necrosis. En el examen microscópico se observaron células escamosas poligonales que tenían queratinización de algunas células individuales y puentes intercelulares, pero las perlas de queratina estaban ausentes. La celularidad era alta con pleomorfismo nuclear y figuras mitóticas numerosas. Los núcleos eran relativamente grandes con cromatina granular gruesa, distribuida de manera desigual. No se encontró evidencia de parénquima ovárico normal, teratoma quístico concomitante, tumor de Brenner o endometriosis (Figura 2). Todos estos hallazgos llevaron al diagnóstico de CCE primario puro de ovario bien diferenciado.
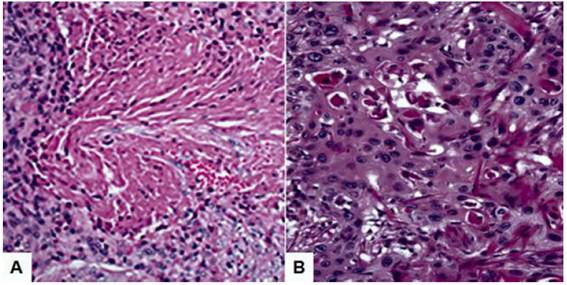
Figura 2 Microfotografía que revela carcinoma de células escamosas primario puro de ovario bien diferenciado. Coloración hematoxilina-eosina. A. 200X; B. 400X.
Las características histopatológicas de los depósitos tumorales peritoneales fueron idénticas al tumor anexial. Los márgenes de resección de la lesión y los ganglios linfáticos extirpados estaban libres de lesiones tumorales. Para determinar si había lesiones cervicales asociadas, se sometieron a examen anatomopatológico al cuello uterino y manguito vaginal, pero no se encontró evidencia de tumores o displasia. El útero, trompas de Falopio y ovario izquierdo estaban normales. La estadificación clínica del tumor ovárico fue estadio IIIC según la clasificación de la Federación Internacional de Ginecología y Obstetricia.
A pesar del uso de quimioterapia adyuvante con cisplatino - etopósido por tres meses, la tomografía computarizada de seguimiento postoperatorio de abdomen y pelvis del paciente mostró progresión tumoral pélvica con metástasis hepática.
Discusión
El CCE del ovario puede ser primario o metastásico. Aproximadamente 5% a 6% de los casos de cáncer ovárico es metastásico de otros órganos y la variedad primaria pura del ovario comprende el 2% de todos los casos de cáncer de ovario4-6. La mayoría de las neoplasias malignas (80% a 90%) que surgen dentro de quiste dermoide ovárico son CCE1,2. Aquellas variedades metastásicas se originan comúnmente en el cuello uterino por extensión directa, mientras que la variante primaria ovárica aparece con mayor frecuencia a partir de los quistes dermoides, tumor de Brenner, cistoadenoma mucinoso o endometriosis2,7. El CCE primario puro del ovario no asociado a lesión ovárica preexistente es aún más raro, con informes de menos de 30 casos3,4.
Varios mecanismos han sido propuestos para el origen de estos tumores. Como surgen del epitelio de la superficie ovárica pueden contener elementos escamosos y algunos pueden aparecer directamente desde este epitelio. La transformación maligna se produce en el componente ectodérmico y se propaga por invasión local directa y siembra peritoneal5. Además de los casos publicados de CCE primario de ovario, la asociación más significativa identificada es con la displasia cervical. Esta asociación podría explicarse por las siguientes teorías: diseminación contigua a lo largo de la superficie mucosa del tracto genital femenino hacia el ovario, carcinoma cervical angioinvasivo microscópico no detectado en el cuello uterino con metástasis al ovario y efecto de campo6,8.
La presentación clínica puede ser silenciosa o manifiesta, dependiendo de la etapa de la enfermedad. Usualmente las manifestaciones más frecuentes son presencia de tumoración abdominal y dolor. Sin embargo, esta sintomatología no permite diferenciar un tumor benigno de uno maligno. El gran tamaño de la tumoración ovárica puede sugerir un proceso de enfermedad de larga duración que, probablemente, podría explicar el desarrollo de la transformación maligna observada en los estudios histológicos8,9.
En vista que el CCE primario es el tipo histológico común de malignidad en el cuello uterino, vulva, vagina, ano, pulmón, cabeza y cuello, se debe considerar obligatoria la exploración física, pruebas citológicas y estudios por imágenes de estos sitios anatómicos. Aunque el cáncer cervical primario es el sitio original más común para el CCE ovárico metastásico, la incidencia del primero es inferior al 1%10.
A diferencia de otros tipos de cáncer epitelial de ovario, el CCE primario tiene características localmente invasivas similares a las que producen en otros sitios anatómicos. Sin embargo, debido a que el CCE primario puro se considera cáncer de ovario epitelial, se debe sugerir el tratamiento estándar para estos casos que incluye cirugía de estadificación completa con cito-reducción de volumen máxima seguida de quimioterapia adyuvante9,11.
El papel del tratamiento adyuvante en los CCE de ovario es incierto. La experiencia limitada sugiere que el tratamiento quirúrgico con un seguimiento cercano es suficiente para la enfermedad en el estadio IA al momento de la cirugía12. Los estadios IB y superiores han sido tratados con diferentes esquemas de terapia adyuvante con resultados variables. Se ha observado un control relativamente pobre de la enfermedad con esquemas convencionales para tratar otros carcinomas de ovario epiteliales, como cisplatino, vincristina, mitomicina C y bleomicina13,14.
La radioterapia también ha sido utilizada basado en el hecho que el CCE es radiosensible, pero los resultados han sido variables en aquellos casos que se originan de quistes dermoides1,9. Algunos casos de lesiones que se originan de teratoma quísticos maduros, la combinación de cito-reducción agresiva, radioterapia de la pelvis y quimioterapia basada en platino han mostrado beneficios14. Sin embargo, no está claro si las pacientes con CCE primario de novo del ovario se beneficiasen de un abordaje terapéutico adyuvante similar.
El pronóstico para las pacientes con CCE de ovario, independiente del tipo, es peor que el de aquellas con paciente con cáncer epitelial de otros tipos histológicos. La supervivencia general de las pacientes con CCE primario puro es similar al de las pacientes con teratoma maligno7. El estadio al momento del diagnóstico se correlaciona mejor con la supervivencia, que otras características como edad al momento del diagnóstico, tamaño tumoral o presencia de necrosis14. La supervivencia a cinco años es mayor cuando se logra la cito-reducción óptima. La evidencia es limitada, pero la quimioterapia adyuvante (principalmente basada en platino) parece prolongar la supervivencia en pacientes con enfermedad en estadios III y IV14,15.
En conclusión, el CCE primario puro de ovario es una entidad extremadamente rara. Sobre la base de los datos existentes, el manejo debe ser la cito-reducción quirúrgica del tumor, similar al manejo de otros carcinomas epiteliales ováricos. La quimioterapia de combinación y la radioterapia pélvica ha mostrado algún beneficio en el control local de la enfermedad. Sin embargo, actualmente no está claro el papel de la terapia adyuvante en este grupo de pacientes.











 text in
text in