INTRODUCCIÓN
El tumor carcinoide de células caliciformes (TCCC) apendicular es una neoplasia rara y distintiva que ocurre casi exclusivamente en el apéndice y que muestra diferenciación neuroendocrina y mucinosa 1). Representa 5% de los tumores apendiculares y en forma característica está dispuesto en pequeños grupos de células caliciformes (células de anillo de sello) con algunas células neuroendocrinas. Puede ser difícil de diagnosticar, incluso después de estudios clínicos, de laboratorio y por imágenes 2). La caracterización adecuada de estos tumores tiene una importancia clínica fundamental en el pronóstico y manejo clínico.
Las metástasis genitales por un carcinoma primario extragenital ocurren principalmente en los ovarios y la vagina. El compromiso uterino es más raro debido al alto contenido fibroso, drenaje linfático pélvico, flujo sanguíneo de la circulación distal y sitio anatómico pequeño 3). La metástasis de carcinoma de células en anillo de sello, una forma de adenocarcinoma, es extremadamente rara y puede observarse tanto en carcinomas lobulillares invasores de mama como en carcinomas gastrointestinales. Hasta el momento solo se ha observado un caso de tumor carcinoide apendicular de las células caliciformes con metástasis endometrial 4). Se presenta un caso de tumor carcinoide de células caliciformes apendicular con metástasis endometrial.
CASO CLÍNICO
Se trata de paciente femenina de 70 años quien consultó por presentar sangrado genital en moderada cantidad de aproximadamente 3 meses de evolución. Negaba dolor abdominal, fiebre, náuseas, diarrea, vómitos y pérdida de peso. La paciente refería antecedentes de dislipidemia e hipertensión desde hacía 20 años tratados de forma irregular. Negaba antecedentes familiares de neoplasias intestinales o ginecológicas.
Al examen físico solo se encontró dolor de leve intensidad a la palpación profunda en fosa iliaca derecha e hipogastrio sin defensa o dolor a la descompresión. El útero estaba aumentado de tamaño a mitad de la distancia entre la cicatriz umbilical y el pubis. El examen ginecológico mostró sangrado genital en moderada cantidad de color rojo-marrón sin dolor a la movilización del cuello uterino y el cuello uterino estaba endurecido. En el tacto rectal se palpó el cuerpo y cuello uterinos indurados con superficie irregular y sin tumoraciones palpables en anexos y fondo de saco de Douglas.
La ecografía pélvica denotó útero aumentado de tamaño con bordes irregulares y endometrio ligeramente engrosado (8 milímetros). En vista de los hallazgos, la paciente fue programada para realización de dilatación del cuello uterino y biopsia endometrial, en el que se obtuvo escaso material de tejido conteniendo nidos de células mucinosas con morfología de anillo de sello. La inmunotinción mostró reactividad difusa y fuerte a CK20, MUC5, CA19.9, CDX2 y antígeno carcinoembrionario y fue negativa a CK7, receptor de estrógenos, p16, MUC6 y PAX8. El índice proliferativo fue de 20% en las células tumorales teñidas con Ki-67 (Figura 1). La impresión diagnóstica provisional fue carcinoma metastásico predominantemente mucinoso mal diferenciado de origen gastrointestinal.
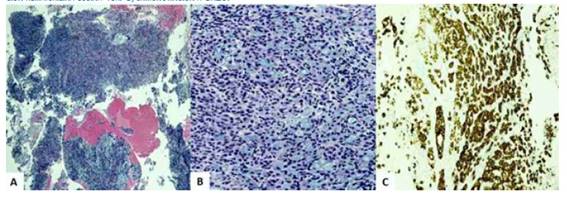
Figura 1 grupo de células en anillo de sello en las muestras de la biopsia endometrial a) coloración hematoxilina-eosina 10x. b) coloración hematoxilina-eosina 40x. c) inmunotinción a cK20.
Se realizó evaluación radiológica completa debido a la posibilidad de tumor primario de origen gastrointestinal. Los resultados de radiografía de tórax, cistoscopia, endoscopia superior y colonoscopia fueron normales, así como las pruebas de hematología, función hepática y renal, perfil de coagulación, hemograma y marcadores tumorales. Las imágenes de tomografía computada de abdomen y pelvis mostraron útero aumentado de tamaño, irregular, con engrosamiento desigual del miometrio, numerosas calcificaciones y lesiones quísticas superficiales, ambos anexos sin tumoraciones. Además, había engrosamiento del epiplón, diseminación peritoneal y escasa cantidad de líquido libre en cavidad pélvica. No se encontraron lesiones en tórax y el resto del abdomen. En vista de todos estos hallazgos la paciente fue programada para cirugía.
Durante la intervención se observó que el útero tenía consistencia pétrea y estaba fuertemente adherido al recto y colon sigmoides. Se observaron múltiples implantes quísticos extensos en cuerpo y cuello uterino y en el fondo de saco de Douglas. El apéndice cecal estaba fibrótico, grueso y con adherencias firmes a la pared abdominal y colon. El epiplón estaba engrosado con varios nódulos tumorales. Se realizó histerectomía abdominal total, ooforosalpingectomía bilateral, hemicolectomía derecha, omentectomía parcial, linfadenectomía pélvica paraaórtica y toma de muestra de líquido peritoneal.
La evaluación anatomopatológica confirmó que el cuello, istmo y cuerpo uterinos, junto a las trompas de Falopio y tejido fibroadiposo, presentaban infiltrados de células tumorales. Las secciones anatómicas del cuello y cuerpo uterino mostraron focos de adenocarcinoma de células en anillo de sello infiltrando parcialmente el estroma sin evidencia de otro tipo de carcinoma primario y/o embolias tumorales. Las glándulas endocervicales no mostraron signos de displasia o neoplasia. En el apéndice cecal se halló tumor entre el tercio medio y superior de aproximadamente 1 centímetro de diámetro formado por proliferación epitelial de acúmulos de pequeño tamaño e irregulares que infiltraban toda la mucosa, submucosa y muscular propia apendicular sin invasión focal a serosa, meso apéndice y borde quirúrgico. Estos grupos estaban compuestos por gran cantidad de células caliciformes (células de anillo de sello) que contenían mucina junto a escaso número de células neuroendocrinas bien diferenciadas con citoplasma pálido, eosinofílico y núcleos centrales redondos ovalados mezclados con células de la mucosa. Las células tumorales aparecieron individualmente y en pequeños grupos. La inmunotinción fue positiva a sinaptofisina, CDX-2, EMA, CK20, CD56 focal y negativa a CK7, antígeno carcinoembrionario (Figura 2). También se encontraron acúmulos de células caliciformes que mostraron inmunoreactividad focal a sinaptofisina en la evaluación histológica del epiplón (Figura 3). Estos hallazgos confirmaron el diagnóstico de TCCC.
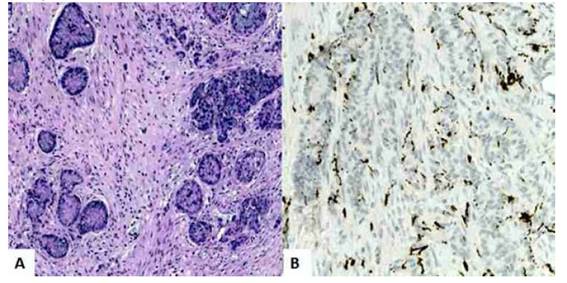
Figura 2 tumor carcinoide de células caliciformes. grupos aislados de células neuroendocrinas y células caliciformes con abundante cantidad de mucina intracitoplasmática en la pared del apéndice cecal y patrón de crecimiento concéntrico. a) coloración hematoxilina -eosina 100x. b) inmunotinción positiva a sinaptofisina.
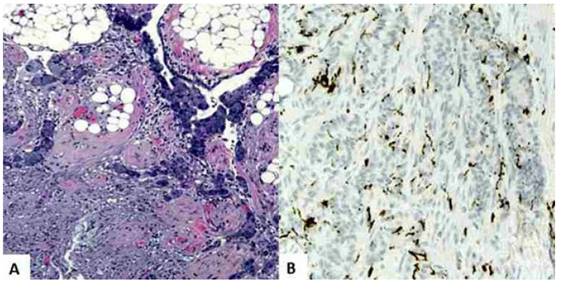
Figura 3 tumor carcinoide de células caliciformes. las células tumorales están dispuestas en grupos en el epiplón. las células en anillo de sello contienen vacuolas de mucina intracelular Formando pequeños grupos. a) coloración hematoxilina-eosina, 100 x. b) inmunotinción positiva a sinaptofisina.
La paciente fue referida a la consulta de oncología médica para iniciar tratamiento quimioterapéutico y seguimiento regular. No ha mostrado signos de recurrencia luego de 26 meses de la cirugía.
DISCUSIÓN
El TCCC, también descrito como tumor adenocarcinoide apendicular, carcinoide mucinoso, carcinoma de células de la cripta, es una de las neoplasias malignas más comunes del apéndice cecal, diferente a los tumores carcinoides y al adenocarcinoma 3). Es un tumor de dos tipos histológicos, con diferenciación neuroendocrina y células caliciformes (células en forma de anillo de sello), y una tasa de metástasis (15% a 30% de los casos) superior al tumor carcinoide apendicular convencional 5,6). Aunque es casi exclusivo del apéndice cecal, en raros casos puede encontrarse en recto, íleo o colon. Tiene distribución similar entre hombres y mujeres y ha sido diagnosticado en pacientes de 18 a 89 años 2).
El TCCC es considerado como tumor anficrino, con características tanto exocrinas como endocrina que aparentemente surge de las células pluripotentes de las criptas con diferenciación divergente 3). El análisis ultraestructural de las células tumorales muestra que contienen vacuolas mucinosas de tamaño variable y gránulos ocasionales unidos a membrana 5). Las mutaciones TP53, KRAS, BRAF y APC, frecuentes en los adenocarcinomas colorrectales, son raras o están ausentes en estos tumores. Las neoplasias muestran alteraciones en los genes asociados a la señalización de Wnt (USP9X, NOTCH1, CTNNA1, CTNNB1, TRRAP). Además, presentan mutaciones en los genes de remodelación de la cromatina ARID1A y ARID2, CDH1, RHPN2, MLL2, SOX9 y RHOA 1).
Los tumores pueden cursar sin síntomas, pero la mayoría de los casos puede presentar sintomatología de apendicitis aguda (debido a obstrucción luminal) o de peritonitis aguda (por rotura apendicular). Algunos casos pueden tener episodios recurrentes de dolor abdominal, tumor palpable en hemiabdomen inferior, obstrucción intestinal, hemorragia gastrointestinal y complicaciones genitourinarias secundarias 7,8). También pueden diseminarse a cavidad peritoneal sin producir destrucción tisular, formación de tumores y/o síntomas gastrointestinales significativos. Aparte del presente caso solo existe un informe previo de hemorragia genital como manifestación inicial del tumor 4). El diagnóstico es accidental durante la cirugía, ya que el tumor puede ser difícil de descubrir, incluso después de diferentes estudios clínicos. Algunos casos con enfermedad avanzada pueden mostrar tumores ováricos que pueden llevar al diagnóstico preoperatorio de neoplasia ovárica primaria o tumor de Krukenberg 8,9). Los sitios metastásicos más comunes son peritoneo, epiplón, ovarios, colon e íleon derecho. Las metástasis a arcos costales, vértebras, ganglios linfáticos, hígado, cerebro y próstata son raras 7,10).
El diagnóstico definitivo del TCCC está basado en las características histológicas. Los carcinoides apendiculares pueden ser divididos de acuerdo con sus patrones histológicos: carcinoide típico de células argentafines y enterocromafines, carcinoide células L no argentafines y carcinoide de células caliciformes. En este último, el apéndice cecal puede ser normal o causar engrosamiento de la pared con afección circunferencial y extenderse longitudinalmente a lo largo del apéndice cecal. La dimensión del tumor, por lo tanto, debe determinarse midiendo la extensión del tumor a lo largo del apéndice y se estima que es mayor de 2 centímetros en la mayoría de los casos. Los tumores no producen cambios adenomatosos, displásicos o neoplásicos sugestivos de una tumoración mucinosa, excepto en las áreas donde los grupos celulares tumorales están conectados a la base de las criptas. Las células tumorales están dispuestas en patrones de criptas intestinales, nidos, rosetas o grupos sin lúmenes distintos 4). Luego de la infiltración extensa, la pared apendicular aparece endurecida y la luz intraluminal puede desaparecer secundaria a la fibrosis difusa 9). Debido a que surge dentro de la lámina propia inferior, y generalmente no existe destrucción tisular o tumor bien definido, los estudios de imágenes muestran solo un ligero engrosamiento de la pared apendicular 4).
Aunque con frecuencia puede confundirse con el carcinoma de células en anillo de sello, el TCCC tiene características típicas, como lo son dos tipos de células dispuestas en pequeños nidos: células neuroendocrinas con citoplasma granular eosinófilo y células caliciformes de tipo gastrointestinal. El tumor está formado por glándulas con distintos grados de diferenciación mucinosa. Las células neuroendocrinas están mezcladas con células mucosas y su proporción es menor que en el tumor carcinoide clásico. Las glándulas infiltran las estructuras adyacentes sin destruir ni provocar reacción desmoplásica del estroma. No existe una tinción inmunohistoquímica estándar para estos tumores. La mayoría de los casos muestra positividad fuerte y difusa para CK20 y son CK7 positivo entre 70% y 75% de los casos (positividad que varía de focal a difusa) 11). También muestran expresión focal y desigual a marcadores neuroendocrinos como sinaptofisina, somatostatina, serotonina, enolasa específica de neuronas y polipéptido pancreático. Las manchas periódicas de ácido-Schiff-diastasa y mucicarmina destacan la presencia de mucina intracelular abundante dentro de las células caliciformes 7).
El diagnóstico diferencial incluye adenocarcinoma mucinoso, adenocarcinoma con células en anillo de sello y tumor mixto carcinoide adenocarcinoma. Los tumores neuroendocrinos carecen de células caliciformes, muestran inmunoreactividad difusa a sinaptofisina y cromogranina y son negativos a CK7 y CK20. La presencia de grupos de células caliciformes focales, pleomorfismo nuclear y actividad mitótica, con áreas sólidas o cribiformes y destrucción del estroma o músculo liso son características del adenocarcinoma apendicular de tipo colorrectal 12). En los casos de adenocarcino más endometriales inusuales con células prominentes de anillo de sello, se debe considerar el TCCC metastásico del apéndice en el diagnóstico diferencial, especialmente luego de excluir los tumores gastrointestinales y ováricos más comunes 13-16). Las inmunotinción del tejido endometrial de este caso fue similar a la encontrada en casos previos con metástasis en órganos vecinos.
Como se practicó en el presente caso, la cirugía es el tratamiento del TCCC. No está claro en qué situaciones es necesario realizar apendicetomía simple o hemicolectomía derecha, ya que se trata de un tumor más agresivo que el carcinoide y con mayor riesgo de metástasis. La hemicolectomía derecha es recomendada cuando existe afección de la base apendicular y/o ciego, márgenes de resección positivos, tamaño tumoral mayor de 2 centímetros, atipias severas y más de 2 mitosis por campo. El hallazgo de invasión linfática perineural no es indicación para realizar hemicolectomía 10,12). También puede ser necesario realizar la ooforosalpingectomía profiláctica debido al alto riesgo de metástasis ováricas. Incluso en los casos de tumor de Krukenberg de origen desconocido es recomendable realizar apendicetomía para descartar un posible TCCC 7). La cirugía citorreductora y la quimioterapia hipertérmica intraperitoneal se han utilizado en casos de carcinomatosis peritoneal. Sin embargo, la efectividad de estos regímenes de quimioterapia sigue siendo controvertida 1,17). El papel de la quimioterapia no está claramente establecido, aunque los casos con enfermedad estadio IV pueden ser tratados con quimioterapia adyuvante basada en 5-fluorouracilo, en forma similar a los adenocarcinomas colorrectales 18,19). La paciente del presente caso fue sometida a quimioterapia con resultados favorables.
El pronóstico es intermedio entre el carcinoide y el adenocarcinoma bien diferenciado del apéndice cecal, con supervivencia a los 5 años que puede llegar al 76%(3,8). Además de los factores pronósticos establecidos, como tamaño y ubicación del tumor o presencia de metástasis, existen otros marcadores que pueden tener valor pronóstico, como resección incompleta en la base del apéndice, diseminación extraapendicular, invasión tisular y atipia celular 5,6,20). La paciente de este caso se ha mantenido por más de dos años libre de recurrencias tumorales.
En conclusión, el TCCC es una entidad rara con características histológicas típicas, tanto con células mucinosas como neuroendocrinas, y un comportamiento más agresivo que el tumor carcinoide apendicular convencional. Los adenocarcinomas endometriales inusuales con gran cantidad de células en anillo de sello deben considerarse como metástasis del TCCC apendicular, luego de excluir la presencia de otros tumores primarios más comunes. El diagnóstico está basado en los hallazgos anatomopatológicos e inmunohistoquímicos específicos. La cirugía es fundamental para aumentar la tasa de supervivencia global.











 text in
text in 



