Introducción
Durante el ciclo menstrual, de la fase folicular hacia la fase lútea el endometrio desarrolla modificaciones dirigidas hacia el proceso de implantación. Bajo la influencia de la LH, las células de la granulosa producen progesterona (P), que induce la transformación secretora del endometrio mediante engrosamiento y mayor vascularización. Luego de la ovulación, se desarrolla el cuerpo lúteo, con cambios bioquímicos y morfológicos que se conocen como ‘luteinización’, con la función de producir P. Ante la existencia de embarazo, el trofoblasto secreta gonadotropina coriónica que actúa en el ovario, manteniendo y estimulando el cuerpo lúteo para la producción de estradiol y P hasta la séptima semana de embarazo, para luego estas hormonas ser producidas por la placenta.
Los procedimientos de fertilización in vitro (FIV) se acompañan de deficiencia lútea. Se pensaba que ello era originado por la aspiración folicular1. Con el objetivo de mejorar la eficiencia de la FIV, esta es asociada a estimulación ovárica con gonadotropinas para lograr un gran número de ovocitos, pero con la producción de niveles suprafisiológicos de estrógenos y P, inhibición de la secreción de LH y FSH en la hipófisis y modificaciones endometriales. Adicionalmente, un 15% de pacientes de FIV pueden experimentar un pico prematuro de LH y los análogos de GnRH son utilizados para evitarlo. Sin embargo, esto genera niveles inadecuados de P y estrógenos que afectan el endometrio y el proceso de implantación2.
Es por ello por lo que el soporte de la fase lútea (SFL) es esencial en los ciclos de FIV y se logra principalmente con el uso de P, que puede ser natural o sintética y administrada a través de diferentes vías: P intramuscular (PIM), cápsulas orales o vaginales (CV), gel vaginal o el anillo vaginal (AV). El SFL es recomendado hasta el término del primer trimestre del embarazo. Sin embargo, algunos investigadores plantean que el SFL podría ser suspendido desde la prueba positiva de embarazo.
Las mujeres receptoras de ovocitos donados tienen una pequeña o nula función ovárica. En ellas el soporte de P es utilizado como un reemplazo hormonal, debido a que esta hormona está en cantidad insuficiente o no se produce. En este grupo, así como en las pacientes que reciben transferencia diferida (descongelación y transferencia de embriones), se recomienda el uso de agonistas GnRH de depósito con el objetivo de inhibir el funcionamiento del ovario y evitar la interferencia del estradiol endógeno con el uso del estradiol sintético.
Los fármacos y vías de administración de P para el SFL deben permitir el uso adecuado y correcto por la paciente, evitando efectos secundarios gastrointestinales y el efecto del primer paso hepático que disminuye los niveles de P y conlleva la necesidad de dosis altas del fármaco. El AV es un dispositivo de fácil inserción que proporciona la liberación continua de P con niveles séricos y locales suficientes y por largo tiempo.
El presente estudio compara la efectividad del AV y de las CV en el SFL en mujeres receptoras de embriones logrados de ovocitos y espermatozoides donados.
Métodos
El presente es un estudio retrospectivo en mujeres receptoras de embriones logrados por FIV de ovocitos y espermatozoides donados, desde abril de 2014 a marzo de 2021, en el Centro de Fertilidad y Ginecología del Sur, en Cusco, Perú.
El comité ético de nuestra institución aprobó el estudio y todos los pacientes firmaron el consentimiento informado para la realización del procedimiento y para el uso de sus datos.
Utilizamos el programa OpenEpi, calculando un tamaño muestral de 37 pacientes para cada grupo, considerando un nivel de confianza de 95% y una potencia de 80%. La asignación de los pacientes en cada grupo fue aleatoria, dependiendo de la disponibilidad del AV en nuestro país.
Las mujeres donantes de ovocitos recibieron estimulación ovárica con gonadotropina menopáusica humana o FSH recombinante, en asociación con antagonistas de GnRH en protocolo flexible. Seguimos el desarrollo folicular a través de ultrasonido vaginal y se realizó la aspiración de los folículos a las 36 horas luego de la administración de gonadotropina coriónica humana o agonista GnRH. La aspiración folicular fue efectuada con aguja de un solo lumen y bajo guía de ultrasonido. Realizamos inyección intracitoplasmática de espermatozoides (ICSI) en todos los ovocitos; las muestras de semen del banco fueron descongeladas y preparadas bajo gradientes de densidad y colocadas en gotas de 10 μL en el plato de ICSI.
Se utilizó medio de cultivo Life-Global ™ para la manipulación de los gametos, y se realizó cultivo continuo de los embriones en las mini-incubadoras AstecTM EC-6S or K-SystemTM G210 InviCell con 9,0% de concentración de CO2 y a 37ºC de temperatura. Luego de 16 horas se evaluó la fecundación y los embriones fueron colocados en platos de cultivo hasta el estadio de blastocistos.
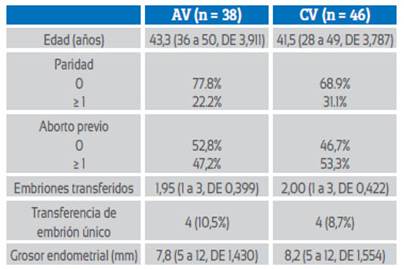
En las pacientes receptoras se aplicó 3,75 mg de acetato de leuprolide (LorelinaTM) por vía intramuscular 1 semana antes del inicio de la menstruación. Ellas utilizaron valerato de estradiol en vía oral en dosis ascendentes desde 2 a 12 mg diariamente desde el primer día de menstruación hasta lograr un grosor endometrial ≥ 6 mm. 38 pacientes utilizaron el AV y 46 utilizaron las CV. Las características generales de las pacientes fueron similares en ambos grupos (tabla 1).
Tabla 1 Características de la población en estudio.
AV=anillo vaginal, CV=cápsulas vaginales, DE=desviación estándar, mm=milímetros
En el grupo de AV, las pacientes aplicaron el anillo (FertiringTM, Silesia o ABL Pharma) en el fondo vaginal el día previo a la aspiración de ovocitos hasta la semana 11 de gestación y se añadió 400 mg de P natural micronizada (PNM) diariamente en la vagina desde la semana 9 hasta la semana 11 de gestación.
En el grupo de CV, las pacientes iniciaron la aplicación vaginal de 800 mg de PNM (Utroges tanTM, Ferring, Geslutin PNMTM, Tecnofarma o ProgendoTM, Gynopharm) desde el día previo a la aspiración folicular hasta la semana 9 de embarazo, y luego solo 400 mg de PNM hasta la semana 11 de embarazo.
La transferencia de embriones (TE) se realizó bajo guía de ultrasonido abdominal, estando la vejiga llena, usando un catéter flexible y brindando reposo físico por 45 minutos. Luego de 13 días de la TE, se realizó dosaje de β-hCG, y en caso de resultado positivo se efectuó ultrasonido vaginal luego de 1 semana y la paciente siguió control prenatal.
La tasa de implantación (TI) fue definida como el número de embriones con actividad cardiaca presente sobre el número de embriones transferidos. La tasa de embarazo clínico (TEC) fue el número de pacientes con embrión activo sobre el número de pacientes con TE. La tasa de nacido vivo (TNV) fue definida como el número de pacientes con parto de un neonato mostrando algún signo de vida -independiente de su edad gestacional3- sobre el número de pacientes con TE.
La significancia estadística de las diferencias encontradas se analizó con la prueba exacta de Fisher.
Resultados
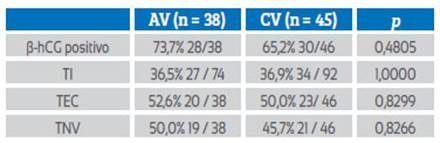
Tanto el grupo de AV como de CV tuvieron tasas de embarazo similares: TI (36,5% vs. 36,9%, p = 1,0000), TEC (52,6% vs. 50,0, p = 0,8299) y TNV (50,0% vs. 45,7%, p = 0,8266), sin diferencias estadísticamente significativas (tabla 2).
Discusión
Desde el nacimiento de Louise Brown en 1978, la FIV se ha extendido por todo el mundo para ayudar en el tratamiento de las parejas con in-fertilidad. Lucena reportó el nacimiento del primer bebe logrado por FIV en América Latina en 1984, en Colombia. Noriega y Prazak iniciaron la FIV en Perú en 1989, y nuestro centro CFGS logró el primer bebe de FIV en los andes peruanos en el 20054. Actualmente, en América Latina se realizan más de 100,000 ciclos de FIV cada año5.
En el CFGS, en el año 2020, el 70% de los ciclos de FIV fueron producto de ovodonación (del 2005 al 2015, el 44,6% fueron productos de ovodonación)6, en contraste al 18,1% en América Latina5. Debido a que las pacientes receptoras tienen una pequeña o nula función ovárica, el SFL es determinante y es usado en ellas como reemplazo.
Diferentes alternativas para el SFL han sido evaluadas y utilizadas. P es la principalmente utilizada, pero también la hCG (estimula la producción de P) y los agonistas de GnRH (restablece los niveles de LH y brinda un SFL natural) son opciones para el SFL7. La PNM por vía vaginal es utilizada con seguridad y buenos resultados y tiene efecto similar que la PIM en el SFL. Shapiro comparó la P en gel vaginal con la PIM en la transferencia de embriones descongelados y encontró resultados similares en la TI (45,6% vs. 46,4%, respectivamente), TEC (60,5% vs. 61,7%, respectivamente) y TNV (48,9% vs. 49,1%, respectivamente)8. La administración oral de P no logra buena absorción. Pero, en los últimos años, el uso por vía oral de la didrogesterona sintética ha tenido resultados similares que la P vaginal9-14.
La P vaginal es la más utilizada en el mundo para el SFL en FIV. Vaisbuch obtuvo información de 408 centros de 82 países, concluyendo lo siguiente: la P vaginal es usada en el 90% de los centros (77% como fármaco único y en el 17% combinado con PIM), en el 80% de los ciclos el SFL es iniciado en el día de la aspiración folicular, la hCG como fármaco único no es utilizado como SFL, y en el 72% de los ciclos el SFL es administrado hasta las 8 a 10 semanas de gestación o más15.
Debido a que el epitelio vaginal tiene una alta permeabilidad a la P y a la facilidad de aplicación de productos por esta vía, es posible lograr la liberación continua de fármacos con dosis bajas diariamente16. Las CV contienen pequeñas partículas de P (PNM), brindando una mayor su perficie y mejor absorción. Estas características permiten una alta biodisponibilidad de P en el útero con mínimos efectos metabólicos y vasculares (‘efecto de primer-paso uterino’).
El AV es un dispositivo de silicona (polisiloxano), lo suficientemente flexible para una fácil inserción, lo suficientemente rígido para permanecer en su lugar y lo suficientemente suave para evitar abrasión del epitelio. Las siliconas son un tipo de polímeros sintéticos con una columna hecha de puentes repetidos de silicona y oxígeno, siendo esta unidad repetitiva denominada siloxano. La principal característica de las siliconas es su estabilidad química, baja energía en su superficie y el ser hidrofóbicas. Debido a su biocompatibilidad y baja toxicidad, las siliconas son ampliamente utilizadas en la fabricación de productos médicos que permanecen en contacto directo con el cuerpo humano16.
El AV contiene moléculas de P que están homogéneamente dispersas en silicona. Luego de la inserción, toda la superficie del anillo está en contacto con el epitelio vaginal, y en una primera fase se presenta una liberación explosiva de moléculas de P separadas de la red cristalina; en una segunda fase, las moléculas de P cerca de la superficie del anillo se desplazan a través de la silicona hacia el fluido vaginal o al fluido intersticial del epitelio vaginal.
El AV contiene 1 g de P natural, brinda una liberación continua de 10 mg de P diariamente, logrando concentraciones séricas de 3,14 a 6,28 ng/mL (10 a 20 nmol/L) durante 90 días17.
En un modelo in vitro, Dragonas comparó dos tipos de AV de silicona con diferente grosor de pared y con 1 g de P micronizada pura, y encontró una liberación lineal de 0,34 ng/hora de P, sin diferencias entre los dos tipos de anillo. Luego utilizó el anillo de pared gruesa para un modelo in vivo, encontrando elevación de la concentración sérica de P desde las 2 horas de inserción del AV, y permaneciendo elevada hasta las 24 horas de observación, con una media de 1,38 ng/mL (4,39 nmol/L)18.
Zegers-Hochschild comunicó por primera vez el uso del AV para el SFL en el año 2000. Comparó el AV con la aplicación diaria de PIM y encontró TEC similares (36,6%) en 505 pacientes de FIV con ovocitos propios. Pero en 153 pacientes receptoras de ovodonación, halló mejor TI (19,9% versus 11,6%, p = 0,006) y TEC (39,8% versus 28,6%, respectivamente)17. Otra experiencia del uso de AV en el SFL fue la realizada por Schwarze, en 2013, en parejas de inseminación intrauterina, encontrando mejores TEC en el grupo que utilizó AV, aunque sin diferencias estadísticamente significativas (19,1% en el grupo de AV y 11,3% en el grupo sin SFL)19.
Stadtmauer realizó biopsias endometriales en pacientes receptoras de ovodonación y bajo la administración del AV o del gel vaginal de P como SFL, encontrando fase secretora en todas. Luego, en un estudio piloto con transferencia de embriones, logró embarazo en 4 de 5 pacientes con AV y solo en 1 de 4 pacientes que usaron el gel vaginal20. En el 2013 comparó el uso del AV y el gel vaginal de P como SFL en 1,297 pacientes de FIV, encontrando similares TEC (45%), de aborto y TNV21.
Nosotros comparamos el AV y las CV como SFL en pacientes receptoras de embriones logrados de ovocitos y espermatozoides donados, hallando similares TI (36,5% versus 36,9%, respectivamente), TEC (52,6% vs. 50,0%, respectivamente) y TNV (50,0% vs. 45,7%, respectivamente), sin diferencias estadísticamente significativas (tabla 2).
Debido a la facilidad en su uso, la aplicación del AV garantiza el cumplimiento del tratamiento, requiriendo solo de una inserción vaginal, liberando P de manera continua y suficiente como SFL para los procedimientos de FIV, evitando las altas dosis de hormonas y la incomodidad de la aplicación diaria.
Conclusión
El SFL es crucial en los procedimientos de FIV, siendo la P vaginal la opción más utilizada para este propósito. En nuestro estudio, evaluamos la efectividad del AV en comparación a las CV de P en pacientes receptoras de embriones logrados de ovocitos y espermatozoides donados. El AV de P brinda un SFL óptimo, con similares TI, TEC y TNV que las CV. Debido a su facilidad de uso y cumplimiento de la prescripción, efectos secundarios mínimos y la liberación adecuada de P, el AV se presenta como una buena alternativa de SFL en pacientes de FIV.











 text in
text in