INTRODUCCIÓN
El sarcoma del estroma endometrial es un tumor maligno poco frecuente, de etiología desconocida y que representa menos del 10% de todos los sarcomas uterinos y aproximadamente 0,25% de todas las neoplasias malignas uterinas1. Tiene comportamiento clínico agresivo y mal pronóstico, ya que puede presentar recidivas tardías y metástasis hasta tres décadas después del diagnóstico1,2.
El sarcoma del estroma endometrial de bajo grado (SEE-BG) aparece generalmente en mujeres de mediana edad y puede confundirse con leiomiomas, especialmente de tipo degenerativo3. Es difícil de reconocer por hallazgos clínicos / radiológicos específicos. En la mayoría de los casos el diagnóstico se realiza por la evaluación anatomopatológica. Los hallazgos histopatológicos clásicos son proliferación de células tumorales pequeñas con núcleos redondos u ovalados, similares a las células proliferativas del estroma endometrial. Su tratamiento es quirúrgico y se recomienda el seguimiento a largo plazo4. Se presenta un caso de sarcoma del estroma endometrial de bajo grado.
COMUNICACIÓN DEL CASO
Se trata de paciente de 51 años, gestas II, para II, quien fue referida a la consulta de ginecología por presentar sangrado genital abundante y recurrente, el cual había empeorado en los últimos 6 meses, acompañada de tumoración abdominal en hipogastrio. La paciente refería menarquía a los 14 años con ciclos regulares y menopausia natural a los 49 años. Negaba uso de tratamiento hormonal y antecedentes personales, familiares, médicos o quirúrgicos de importancia.
La paciente estaba en condiciones clínicas estables, afebril e hidratada. El examen físico reveló tumoración abdominal central y móvil que estaba ubicada a tres dedos por encima de la sínfisis púbica, equivalente a un embarazo de 18 semanas. En el tacto vaginal, la palpación bimanual mostró que el útero estaba aumentado de tamaño, sin masas anexiales, con evidencia de sangrado genital en moderada cantidad de color rojo oscuro y el orificio cervical externo cerrado.
Las pruebas de hematología, perfil de coagulación, funcionalismo hepático y renal, examen de orina y electrolitos estaban dentro de límites normales. Las concentraciones de marcadores tumorales (CA-125, CA19-9, lactato deshidrogenasa, gonadotropina coriónica y antígeno carcinoembrionario) también estaban dentro de límites normales. La citología cervical mostraba cambios atróficos y la biopsia endometrial no evidenció alteraciones endometriales malignas.
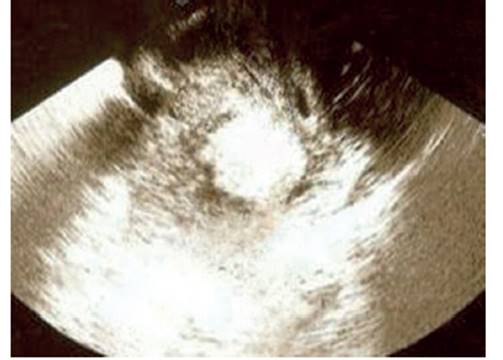
La ecografía transvaginal reveló útero aumentado de tamaño con tumoración heterogénea, intramural, mal definida, fibroide, hipoecoica de 12 centímetros ubicada en la pared uterina posterior, que deformaba la cavidad endometrial (figura 1). El endometrio era lineal y ambos anexos normales, con ausencia de líquido libre en cavidad abdominal. Las imágenes de resonancia magnética abdomino-pélvica mostraron tumoración heterogénea, multinodular, irregular, con cambios degenerativos y áreas necróticas hemorrágicas de 11 x 8 x 8 centímetros en la cara uterina posterior cerca del cuello uterino (figura 2). La lesión parecía corresponder a leiomioma degenerado. No se encontraron evidencias de linfadenopatías ni de afección de otros órganos abdominopélvicos. En vista de estos hallazgos se programó a la paciente para cirugía.
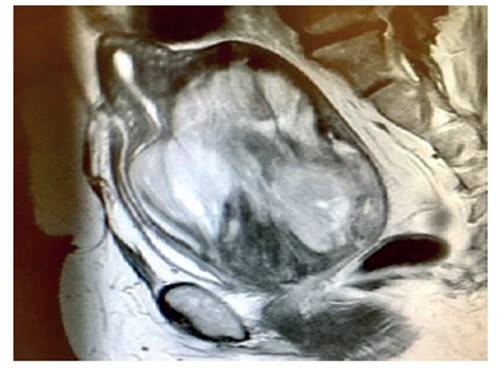
Figura 2 imagen de resonancia magnética de la tumoración en la cara uterina posterior cerca del cuello uterino, con cambios degenerativos y áreas necróticas y hemorrágicas.
Durante la intervención se observó útero voluminoso con tumor que infiltraba la pared uterina posterior, friable, amarillenta, con áreas marrones mal definidas y de aproximadamente 12 centímetros de diámetro. Tanto los ovarios como las trompas de Falopio estaban atróficos, sin evidencia de lesiones. No se observaron adherencias ni diseminación peritoneal. La sección congelada del útero mostró proliferación celular nodular de células ovoides y fusiformes de pequeño a mediano tamaño, que formaban haces gruesos entrelazados. Se realizó histerectomía abdominal total, ooforosalpingectomía bilateral, omentectomía, apendicectomía y disección de los ganglios pélvicos y paraaórticos.
A la sección, el corte de la tumoración intramural era sólido, de color amarillo blanquecino, con algunas áreas de necrosis. La cavidad endometrial, canal cervical y ambos anexos no presentaban anomalías. La evaluación microscópica mostró células uniformes con núcleos pequeños, fusiformes, redondos u ovalados, citoplasma eosinofílico claro con nucléolos poco visibles, que formaban una estructura alveolar de forma irregular en forma de remolino alrededor de las arteriolas. También se observaron áreas con abundante estroma colágeno entremezclado y amplias zonas de necrosis coagulativa. La actividad mitótica era baja (menos de 5 mitosis por 10 HPF). No había evidencia de invasión linfovascular ni miometrial. El cuello uterino, endometrio, ganglios pélvicos y paraaórticos, epiplón mayor y el apéndice cecal fueron negativos para el tumor. Las tinciones de inmunohistoquímica mostraron fuerte positividad de las células tumorales para CD10, receptores de estrógeno y progesterona, mientras que la tinción para SMA, citoqueratina y desmina fueron negativas (figura 3). El Ki67 fue menor de 5%. La histología final fue consistente con SEE-BG.
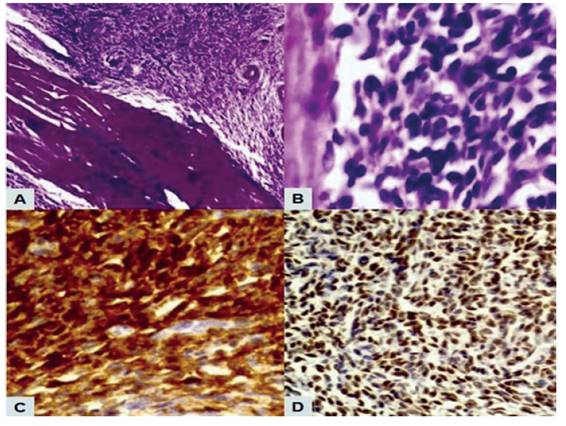
Figura 3 hallazgos anatomopatológicos del see-bg. a) células tumorales elípticas y relativamente pequeñas crecían densamente en Forma de remolino alrededor de las arteriolas (coloración hematoxilina - eosina, 40x). b) células tumorales con escasas atipias celulares y actividad mitótica baja (coloración hematoxilina - eosina, 400x). c) inmunotinción diFusa para cd10 de las células tumorales. d) inmunotinción positiva para receptores de estrógeno.
La paciente se recuperó satisfactoriamente y fue dada de alta al cuarto día del postoperatorio. Posteriormente, fue referida al servicio de oncología médica para su tratamiento y seguimiento regular. Durante los 20 meses de seguimiento, la paciente no ha mostrado evidencia de recurrencia.
DISCUSIÓN
Los sarcomas del estroma endometrial son un subconjunto de neoplasias mesenquimales uterinas formadas por células similares a las proliferativas normales del estroma endometrial2. La Organización Mundial de la Salud clasificó estas neoplasias según su morfología, actividad mitótica, celularidad y presencia de necrosis en cuatro categorías: nódulo del estroma endometrial, SEE-BG, sarcoma del estroma endometrial de alto grado y sarcoma uterino indiferenciado2.
Aunque el SEE-BG representa menos del 1% de las neoplasias uterinas, es el segundo tumor mesenquimal uterino maligno más común luego del leiomiosarcoma5. Su etiología es desconocida, pero algunos casos están asociados a obesidad, síndrome de ovarios poliquísticos, diabetes, menarquía temprana y tratamiento de sustitución de estrógenos o tamoxifeno6. Generalmente, afecta a mujeres durante la cuarta y quinta década de vida. La sintomatología es inespecífica y varía desde dolor pélvico hasta sangrado genital anormal progresivo7.
El diagnóstico preoperatorio del SEE-BG es difícil, ya que el definitivo solamente puede realizarse con los hallazgos anatomopatológicos. Ningún hallazgo de imágenes puede diagnosticar esta condición, puesto que posee características similares a leiomioma, leiomiosarcoma uterino u otros sarcomas. Tampoco se han podido identificar marcadores tumorales8. La histeroscopia diagnóstica y la biopsia endometrial también tienen baja sensibilidad y especificidad diagnóstica9.
El SEE-BG aparece como lesiones intracavitarias polipoides o intramurales con bordes mal definidos -aunque algunos tumores pueden estar bien circunscritos-, que penetran en el miometrio. Su superficie de corte es generalmente sólida, carnosa y de color amarillo o blancuzco grisáceo, con algunas áreas de hemorragia / necrosis y con tamaño que varía entre 5 y 10 centímetros10. Desde el punto de vista microscópico, los hallazgos patognomónicos son las islas irregulares de células tumorales que invaden el miometrio como protuberancias en forma de lengua. Las células tumorales son pequeñas con citoplasma ovalado a fusiforme y núcleos uniformes que se ubican alrededor de vasos sanguíneos pequeños similares a arteriolas. Esto está acompañado de placas hialinas, cambios quísticos, hemorragias y necrosis coagulativa11. Las células tumorales muestran fuerte positividad para vimentina y receptores hormonales (estrógeno y progesterona), mientras que son negativas para desmina, SMA y citoqueratina12. Además, la positividad difusa y fuerte para el CD10 es un marcador diagnóstico valioso y útil para distinguirlo del leiomioma celular7.
Los SEE-BG deben diferenciarse de otros tipos de diferenciación, como focal de tipo músculo liso, rabdoide focal o estructuras tipo cordones sexuales10. Además, otros diagnósticos diferenciales incluyen al leiomioma epitelioide, leiomiosarcoma epitelioide, PEComa, tumor mülleriano mixto y metástasis de tumor de cordones sexuales ovárico13.
El tratamiento de elección del SEE-BG es la histerectomía total con ooforosalpingectomía bilateral y resección de cualquier otra lesión detectable14. En algunos casos en estadio I puede realizarse intervenciones con el fin de preservar la fertilidad, especialmente en mujeres jóvenes con deseos de fertilidad. No obstante, al conservar los ovarios, la probabilidad de recidiva es cercana al 100%(3). Debido a la elevada probabilidad de positividad de receptores hormonales en las células tumorales, algunos autores han sugerido la posibilidad de tratamiento con agonista de hormona liberadora de gonadotropinas para reducir el tamaño tumoral previo a la cirugía mediante un mecanismo hipoestrogénico4.
El estadio del SEE-BG es el factor pronóstico más importante. La atipia citológica, tamaño y número de mitosis no tienen importancia pronóstica15). La supervivencia a diez años en los estadios I y II es superior al 90% y disminuye hasta 66% en los estadios III y IV. Sin embargo, estos tumores, independientemente del estadio, tienen alta probabilidad de recidivas tardías y metástasis 10 a 15 años después del diagnóstico inicial y pueden tratarse con resección quirúrgica, radioterapia, progestágenos o terapias combinadas11. Es necesario el seguimiento prolongado, ya que casi un tercio de los casos presentan extensión pélvica extrauterina, más comúnmente al ovario, incluso en estadios iniciales7.
En conclusión, podemos decir que el SEE-BG es un tumor maligno poco frecuente. El diagnóstico puede ser difícil y en la mayoría de los casos se realiza luego de la confirmación histológica. Por lo tanto, es importante tener un alto índice de sospecha de este tipo de neoplasias raras. Su tratamiento es quirúrgico y el seguimiento debe ser a largo plazo por el alto riesgo de recidivas y metástasis tardías.











 text in
text in