INTRODUCCIÓN
Entre 1990 y 2019, a nivel mundial los casos nuevos de sífilis, clamidia, gonorrea, tricomoniasis y herpes genital incrementaron de 486,7 a 769,8 millones; en los países andinos, el incremento fue de 3 163 540 a 6 028 7501). En esta última región, en mujeres de 10 a 25 años, la prevalencia de clamidiasis varió de 3,2% a 30,9%, mientras que la de gonorrea estuvo entre 0,2 y 9%2). Ambas infecciones se presentan como un síndrome de secreción vaginal, el cual es un problema de salud pública frecuente. Por otro lado, la úlcera genital es menos frecuente. En América Latina y el Caribe la seroprevalencia del virus herpes simple tipo 2 que se manifiesta como úlcera genital dolorosa y recurrente fue del 20,8%, mientras que en Perú dicha frecuencia fue 11,7%3). Otro estudio encontró que el 2,3% de 12 058 mujeres en Perú tuvo úlceras genitales en los últimos 12 meses4).
La violencia íntima de pareja (VIP) es otro problema de salud pública que afecta a las mujeres de países ricos y pobres. La VIP tiene varias formas, entre ellas la emocional, física y sexual5). En la región andina se encuentran elevadas prevalencias de VIP física y sexual. Por ejemplo, en Bolivia (año 2016) la prevalencia de VIP física o sexual por la pareja actual o más reciente fue de 58,5%, mientras en Perú el 2017 fue de 31,2%6). Ambas prevalencias están muy lejanas de los objetivos de eliminación para el 20307). De hecho, en el Perú al 2021, el 54,9% de mujeres de 15 a 49 años sufrió alguna vez cualquier tipo de VIP por su esposo o compañero, y como cifra más alarmante el 5,9% de las mujeres fueron victimizadas sexualmente8). Estas prevalencias hacen que Perú esté entre los 20 países con mayor violencia hacia la mujer en el mundo, según datos de la Organización para la Cooperación y el Desarrollo Económicos (OECD).
La VIP incrementa el riesgo de diabetes, de contraer infecciones de transmisión sexual (ITS), de comportamientos nocivos como el abuso de drogas y alcohol, y de desarrollar enfermedades crónicas9). Incluso se ha visto que las mujeres violentadas tienen mayor riesgo de problemas de salud mental, como ansiedad, depresión, síndrome de estrés postraumático10). Algunos de estos desenlaces podrían estar mediados por las alteraciones estructurales en el cerebro que se han encontrado en las mujeres sobrevivientes a VIP11).
Entre los desenlaces descritos en mujeres violentadas, las ITS han sido sujeto de diversos estudios. Uno de ellos estuvo basado en encuestas poblacionales de 7 países de África subsahariana y halló asociación entre cada una de las formas de VIP y el tener ITS en los últimos 12 meses12). Otros estudios basados en encuestas poblacionales de Nepal13), Togo14), Estonia15 y Timor Oriental16 muestran resultados consistentes para la asociación entre VIP física como un factor de riesgo de ITS. Entre dichos estudios, solo dos(11, 14), ambos en países africanos, analizaron la asociación de la ITS en los últimos 12 meses y la VIP física y sexual por separado.
En vista de las elevadas prevalencias, tanto de las ITS que causan secreción y úlceras genitales como de la VIP en mujeres en el Perú, es pertinente evaluar la asociación entre ambos problemas de salud pública. La evidencia disponible a nivel mundial sugiere que la VIP de diversos tipos incrementa el riesgo de ITS(12-14,17). Mientras que en Perú, los estudios realizados no han sido publicados en revistas científicas y tienen resultados a favor de la asociación18,19), y sin demostrarla20). Por lo descrito, el objetivo del presente estudio fue evaluar la asociación entre la VIP emocional, física y sexual con el auto reporte de secreción y úlcera genital entre mujeres de 15 a 49 años participantes de una encuesta poblacional de salud aplicada en Perú el 2021.
MÉTODOS
Realizamos un análisis de fuente secundaria basado en la Encuesta Nacional Demográfica y de Salud Familiar (ENDES) de Perú del año 2021. Dicha encuesta tiene diseño muestral bietápico y probabilístico y brinda estimaciones representativas para el nivel nacional y regional, así como para el ámbito urbano y rural y por región natural (Lima Metropolitana, Costa, Sierra y Selva)(21).
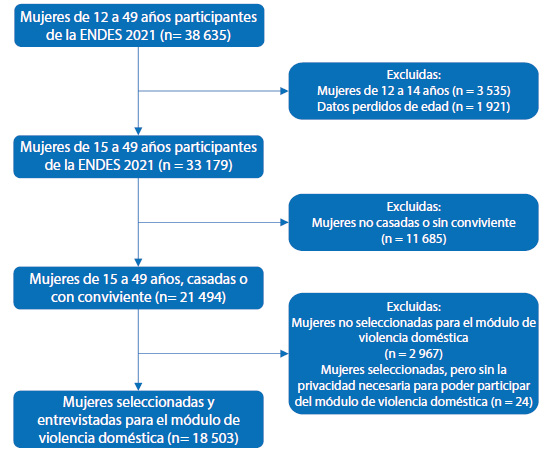
La ENDES 2021 entrevistó a mujeres de 12 a 49 años de 35 847 viviendas. Se encontraron 87 635 mujeres elegibles y 36 714 entrevistas fueron completadas. La encuesta fue presencial en los hogares de las mujeres entre enero y diciembre del 2021. La ENDES tiene un módulo sobre violencia doméstica, el cual es aplicado a una mujer por hogar seleccionada aleatoriamente. La entrevista directa es realizada al final de la encuesta y requiere que ningún miembro de la familia esté presente con excepción de la encuestadora y la mujer. Cuando no había privacidad, el módulo no fue aplicado.
El estudio se centró en 33 179 mujeres de 15 a 49 años que participaron en la ENDES 2021. Los criterios de inclusión fueron los siguientes: mujeres casadas o convivientes y mujeres seleccionadas y entrevistadas para el módulo de violencia doméstica. Excluimos a aquellas sin datos de edad.
Entre las variables de exposición, definimos VIP emocional si al menos uno de los siguientes 4 ítems fue contestado afirmativamente: ¿Le ha dicho o le ha hecho cosas para humillarla delante de los demás? ¿Le ha amenazado con hacerle daño a usted o a alguien cercano a usted?; ¿Le insulta o hace sentir mal? ¿Le ha amenazado con irse de la casa, quitarle a los hijos o la ayuda económica?
Definimos VIP física presente si la mujer contestó afirmativamente al menos uno de los siguientes 7 ítems ¿Su esposo/compañero alguna vez …….. ?: 1. ….la empujó, sacudió o le tiró algo?; 2. ….la abofeteó o le retorció el brazo?; 3. ….la golpeó con el puño o con algo que pudo hacerle daño?; 4. ….la ha pateado o arrastrado?; 5. ….trató de estrangularla o quemarla?; 6. ….la amenazó con un cuchillo, pistola u otro tipo de arma?; y, 7. ….la atacó/agredió con un cuchillo, pistola u otro tipo de arma? La VIP física leve fue definida si alguno de los ítems del 1 al 4 estuvo presente, mientras que la forma severa fue definida si alguno de los ítems del 5 al 7 estuvo presente. Para no ser víctima de violencia física, todos los ítems debieron estar ausentes.
La VIP sexual fue definida como presente cuando al menos uno de los siguientes 2 ítems tuvo respuesta afirmativa a la pregunta: ¿Su esposo/ compañero alguna vez ……?: 1. ha utilizado la fuerza física para obligarla a tener relaciones sexuales, aunque usted no quería; y 2. la obligó a realizar actos sexuales que usted no aprueba.
Además de considerar como exposición a cada tipo de VIP, reconstruimos la variable «cualquier tipo de VIP» cuando la mujer sufrió uno o más de los tres tipos de violencia. Una segunda aproximación para la exposición fue considerar a la VIP física y sexual simultáneamente. Estas definiciones han sido empleadas en estudios similares12,14,16).
La variable dependiente fue el auto reporte de úlcera o secreción genital en los últimos 12 meses. Para ser positivo, al menos uno de los 2 ítems a continuación debía tener respuesta afirmativa: ¿Usted ha tenido alguna llaga o úlcera en sus genitales en los últimos 12 meses?; y ¿Usted ha tenido algún flujo o secreción genital que olía mal en los últimos 12 meses? Si bien la ENDES cuenta con la pregunta: ¿Le han diagnosticado alguna ITS en los últimos 12 meses?, un análisis exploratorio de los datos mostró que captura a menos del 0,6% de las mujeres elegibles, este abordaje ha sido empleado en estudios previos12,13,22).
Las covariables del estudio fueron agrupadas en aquellas vinculadas a las mujeres y aquellas vinculadas al esposo/compañero. Las variables vinculadas a la mujer fueron las siguientes: edad en años recategorizada en rangos de 15 a 24, 25 a 34 y 35 a 49; lugar de residencia (urbano y rural); estado conyugal (conviviente y casada); número de uniones en la vida recategorizada en «una vez» y «más de una vez»; número de parejas sexuales en el último año medido como ninguna, una, y dos o más; nivel de educación recategorizado en «sin educación-primaria», «secundaria» y «superior»; índice de riqueza en 5 categorías desde «más pobre» hasta «más rico»; trabaja actualmente (sí - no); y región natural (Lima Metropolitana, resto de la Costa, Sierra y Selva).
Incluimos las siguientes variables sobre la información de las mujeres respecto a las ITS: ¿ha escuchado sobre alguna ITS?, la cual fue medida como «sí» o «no» a partir de los ítems S815AA a S815AX. Luego se consideró si conocen los síntomas de ITS en varones [úlceras/llagas genitales (S816G), secreción/goteos (S816B), secreción mal oliente en genitales (S816C)], todas medidas como «sí» o «no»; y conocimiento de los siguientes síntomas en mujeres [secreción de flujo vaginal (S816AB), secreción mal oliente (S816AC), úlceras/llagas genitales (S816AG)] medidas como «sí» o «no». Además, se incluyó el uso actual de método anticonceptivo recategorizada en «no usa método», «método folclórico o tradicional» y «método moderno».
Las covariables vinculadas al esposo/compañero fueron el nivel educativo medido en «sin educación-primaria», «secundaria», «superior» y «no sabe»; edad de la pareja recategorizada en 15 a 24, 25 a 34, 35 a 44 y 45 o más; y consumo de alcohol («sí» o «no»).
Además, incluimos dos preguntas para evaluar las características de comunicación mujer- esposo/compañero. La primera fue ¿En los últimos 12 meses, ha comentado sobre planificación familiar con esposo/pareja? de respuesta dicotómica («sí» o «no»), y la segunda fue sobre la decisión conjunta de uso de anticonceptivos recategorizada como «sí» o «no». Las covariables fueron seleccionadas luego de la revisión de la literatura12-14,16,17 (Material suplementario figura 1).
Aplicamos el diseño muestral complejo de la ENDES 2021; para ello usamos la variable V001 (conglomerado), V022 (estrato) y V005 correspondiente al factor de ponderación. El peso para el factor de ponderación fue calculado dividiéndolo por 1 000 000. Realizamos el análisis con el comando svy del programa STATA versión 16; las estimaciones fueron realizadas para la subpoblación definida por mujeres casadas o convivientes de 15 a 49 años que respondieron el módulo de violencia doméstica.
El análisis estadístico tuvo los siguientes pasos: realizamos el análisis descriptivo de la VIP física, sexual y emocional, así como del auto reporte de secreción o úlcera genital y las covariables de interés a través de frecuencias absolutas y proporciones ponderadas puntuales con sus intervalos de confianza al 95% (IC95%). Aplicamos un análisis bivariado considerando como resultado al auto reporte de secreción o úlcera genital y como variables de exposición a los tipos de VIP contra la mujer y demás covariables. Para la comparación de proporciones empleamos la prueba chi cuadrado de Pearson con corrección de Rao y Scott de segundo orden23); además, estimamos la razón de odds ratio (OR) con su IC95%.
Formulamos tres modelos para el análisis multivariado. El primero incluyó como covariables a las características vinculadas a la mujer, el segundo agregó a las características del esposo/ compañero, mientras que el tercero (completo) incluyó, además de las previas, a las características de comunicación mujer-esposo/compañero. En todos los modelos incluimos a las covariables que tuvieron un valor de p < 0,10 (a dos colas) en el análisis bivariado. Formulamos modelos separados considerando como exposición a cada tipo de VIP, además de estar expuesta a cualquier forma de VIP, y otro de exposición a VIP física y sexual (simultáneamente). Para la estimación de las razones de momios (odds) ajustadas usamos la regresión logística binaria, todas las covariables ingresaron en bloque a cada uno de los modelos. Presentamos el IC95%, el cual se usó para evaluar la significancia estadística cuando su intervalo no incluyó a la unidad. Se valoró la bondad de ajuste de los modelos con el estimador de la función log de máxima pseudoverosimilitud y el pseudo R2 de McFadden.
Realizamos el diagnóstico de multicolinealidad entre las variables independientes de los tres modelos aplicando un modelo de regresión lineal y verificamos que los valores del factor de inflación de la varianza (VIF) de las covariables no fueran superiores a 2,524).
Dentro de los aspectos éticos, los datos analizados se encuentran públicamente disponibles en el portal web del Instituto Nacional de Estadística e Informática (http://iinei.inei.gob.pe/microdatos/). Las bases de datos se encuentran anonimizadas. Además, el protocolo de la investigación fue aprobado por el Comité Institucional de Ética de Investigación de la Universidad de Piura.
RESULTADOS
El proceso de selección de participantes es descrito en la figura 1. En las características vinculadas a la mujer, el 49,3% tuvo 35 a 49 años, el 76,7% provenían de un área urbana, el 68,8% fueron convivientes. Además, el 86,1% refirió tener una unión en la vida. Otras características se muestran en la tabla 1.
Tabla 1 Características de las mujeres participantes de la Encuesta Demográfica y de Salud Familiar del Perú (2021) incluidas en el análisis.
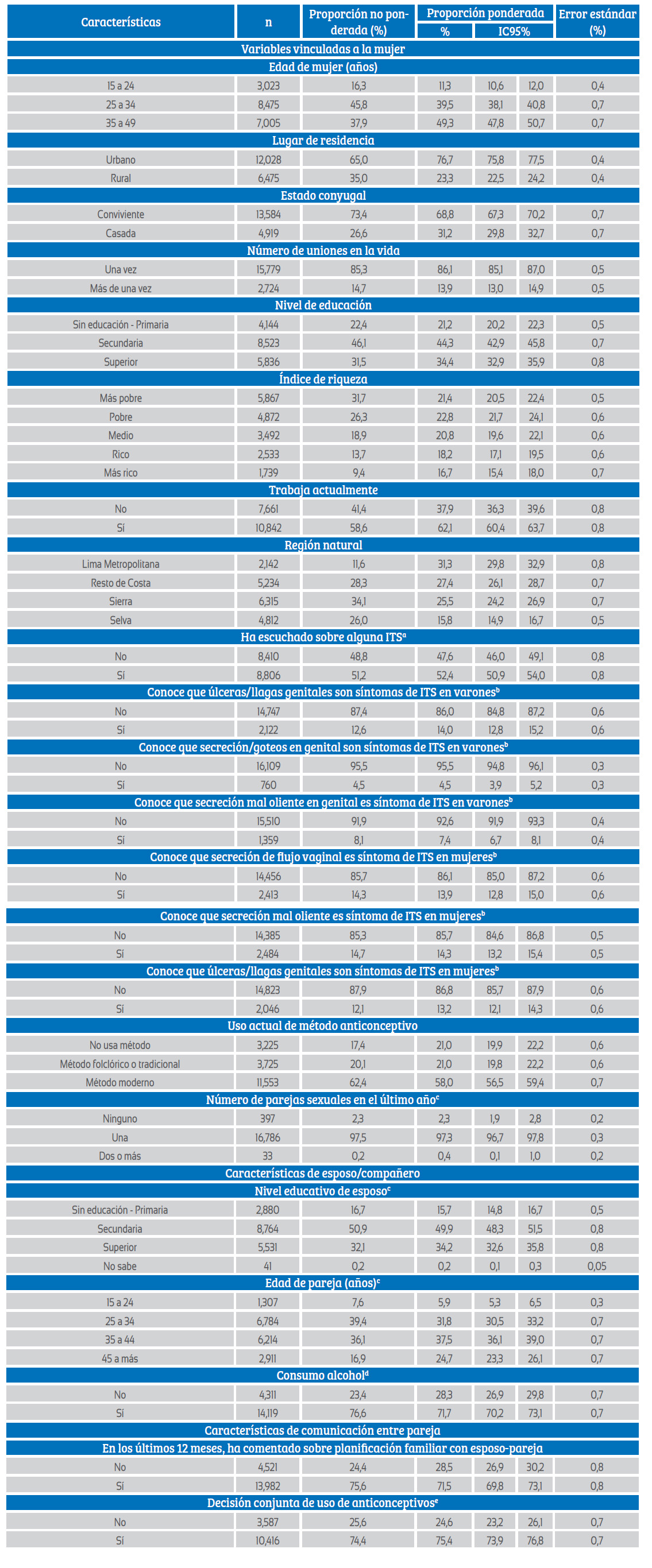
a 1,287 casos con datos perdidos, b 1,634 casos con datos perdidos, c casos con 1,287 datos perdidos, d casos con 73 datos perdidos, e 4,500 casos con datos perdidos ITS: infección de transmisión sexual
La prevalencia de VIP emocional fue de 17,7% (IC95%: 16,7 a 18,8), la prevalencia de VIP física leve fue de 15,6% (IC95%: 14,6 a 16,6) mientras que la severa afectó al 5,3% (IC95%: 4,8 a 5,9); fi nalmente la VIP sexual afectó al 3,3% (IC95%: 2,9 a 3,8) de las mujeres. De esta manera, el 28,1% (IC95%: 26,9 a 29,4) de las mujeres sufrió cualquier tipo de VIP (tabla 2).
Tabla 2 Prevalencia de violencia íntima de pareja en mujeres incluidas en el estudio.
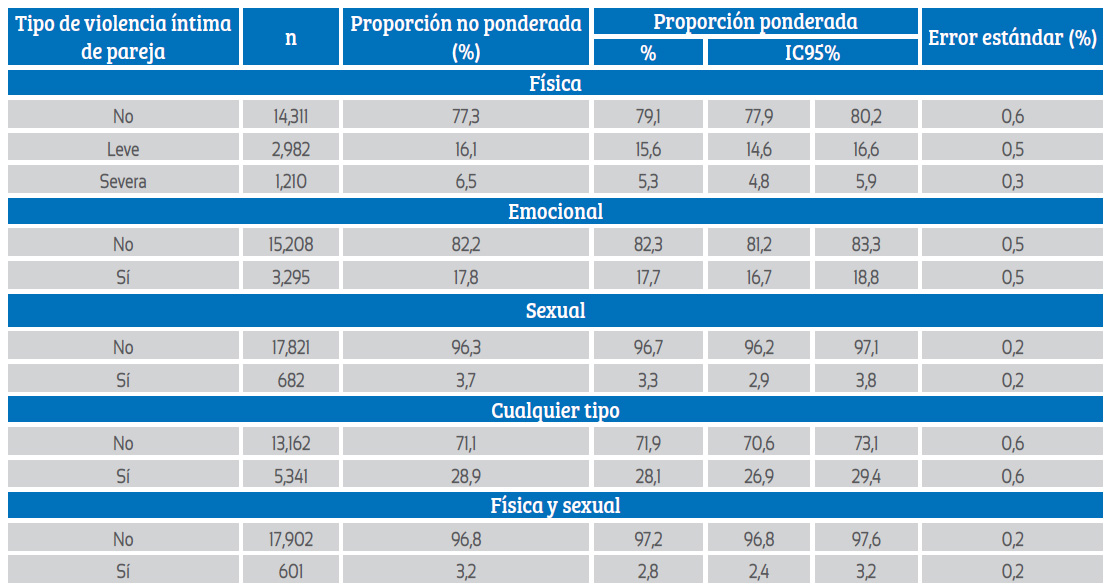
n: frecuencia absoluta no ponderada
Entre las mujeres no expuestas a VIP física, la prevalencia de VIP sexual fue 0,6% (IC95%: 0,4 a 1,0), entre las expuestas a VIP física leve la prevalencia subió a 7,8% (IC95%: 6,2 a 9,7), mientras que en las expuestas a VIP física severa la VIP sexual afectó al 29,7% (IC95%: 25,5 a 34,4). La VIP física leve generó un OR de 13,48 (IC95%: 8,20 a 22,14) para VIP sexual, respecto a las que no la sufrieron; mientras que entre aquellas expuestas a VIP física severa el OR fue 67,67 (IC95%: 41,60 a 110,06). Entre las mujeres no expuestas a VIP emocional, la prevalencia de VIP sexual fue 1,0% (IC95%: 0,7 a 1,3), mientras entre aquellas que sufrieron violencia emocional dicha proporción fue 14,2% (IC95%: 12,3 a 16,3), generando un OR de 17,21 (IC95%: 11,81 a 25,06).
El 10,0% (IC95%: 9,1 a 11,0) comunicó haber tenido úlcera o secreción en los genitales en los últimos 12 meses. 1,518 mujeres señalaron haber tenido secreción, lo que genera una prevalencia ponderada de 9,4% (IC95%: 8,5 a 10,4). El reporte de úlcera genital fue menos frecuente (1,3%, IC95%: 1,0 a 1,6%, recuento no ponderado = 191).
Entre las mujeres que sufrieron VIP emocional, la probabilidad de comunicar úlceras o secreción en los últimos 12 meses fue 2,26 veces (IC95%: 1,99 a 2,56) respecto a las no violentadas emocionalmente. La fuerza de asociación fue mayor entre las mujeres que sufrieron VIP física severa (OR = 2,69, IC95%: 2,01 a 3,61) y entre las que sufrieron VIP sexual (OR = 3,39, IC95%: 2,37 a 4,84). La odds fue incluso mayor entre aquellas que sufrían simultáneamente la VIP física y sexual (OR = 3,85, IC95%: 2,64 a 5,59) (tabla 3).
Tabla 3 Estimación de la prevalencia de auto reporte de secreción y úlcera genital y factores asociados entre mujeres incluidas en el análisis
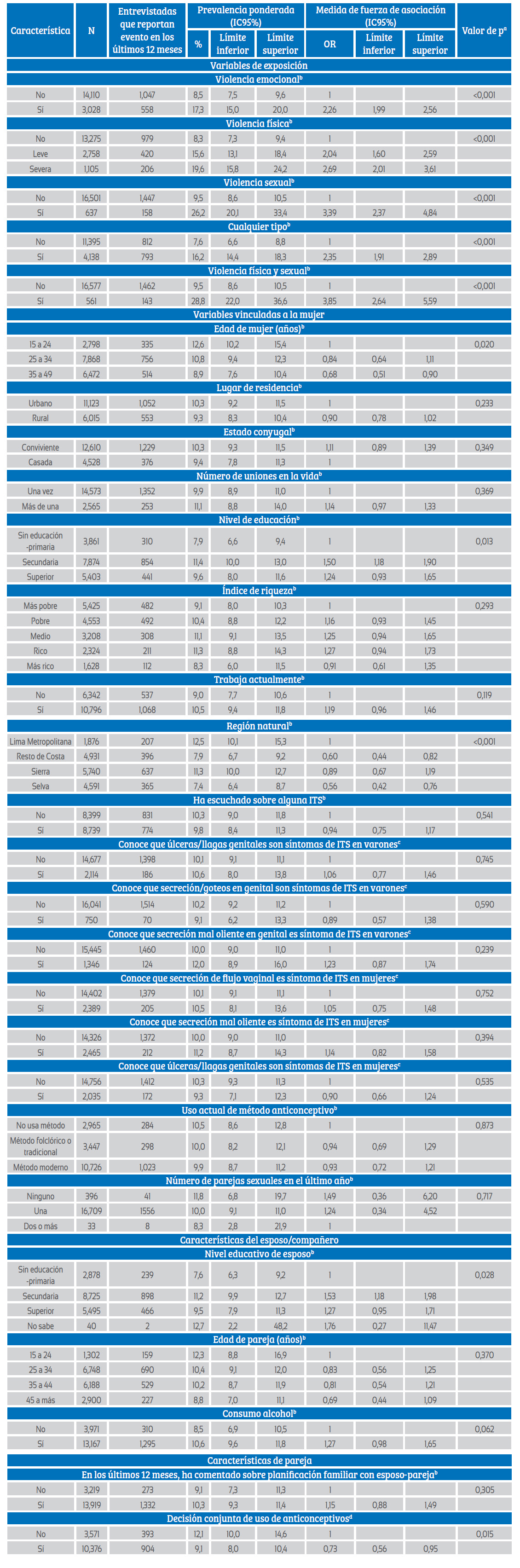
a Chi-cuadrado de Pearson con corrección de Rao y Scott de segundo orden. b 1,365 casos con datos perdidos, c 1,712 casos con datos perdidos, d 4,556 casos con datos perdidos,
N: número de entrevistadas incluidas en estudio, ITS: infección de trasmisión sexual, OR: razón de momios
Entre las variables vinculadas a la mujer, el rango etario de los 15 a 24 años presentó la mayor prevalencia del auto reporte de úlcera o secreción genital en los últimos 12 meses (12,6%, IC95%: 10,2 a 15,4). Las mujeres con educación secundaria y las que residen en Lima Metropolitana informaron en mayor proporción haber tenido úlceras o secreción, con 11,4% y 12,5%, respectivamente. Entre las características de la pareja, las mujeres con compañeros de nivel educativo secundario tuvieron mayor proporción de reporte (11,2%, IC95%: 9,9 a 12,7), el consumo de alcohol por parte de la pareja también se asoció a una mayor prevalencia (10,6%, IC95%: 9,6 a 11,8), respecto a los que no consumen (8,5%, IC95%: 6,9 a 10,5). Las mujeres que toman decisión conjunta del uso de anticonceptivos tuvieron menor presencia de secreción o úlcera genital (9,1%, IC95%: 8,0 a 10,4) respecto a las que no aplicaban dicha estrategia (12,1%, IC95%: 10,0 a 14,6) (tabla 3).
En los tres modelos multivariantes estudiados se encontró un incremento del OR a mayor intensidad de exposición a la VIP física. En el modelo completo, el OR para informar secreción o úlcera genital entre las que sufrieron VIP física leve comparado con las que no sufrieron VIP fue 2,25 (IC95%: 1,71 a 2,95); el OR incrementó a 3,42 (IC95%; 2,39 a 4,90) entre mujeres que sufrieron VIP física severa. El OR generado por la exposición a VIP sexual fue incluso mayor (3,84, IC95%: 2,47 a 5,96). Sin embargo, la mayor posibilidad de comunicar los síntomas estuvieron en las mujeres víctimas de la VIP física y sexual simultáneamente (OR = 4,53, IC95%: 2,91 a 7,05) (tabla 4). El modelo completo generó los mayores OR para los tres tipos de VIP y sus combinaciones; además, dicho modelo presentó una mejor bondad de ajuste.
Tabla 4: Razón de momios e intervalos de confianza al 95% para la asociación entre los tres tipos de violencia íntima de pareja e infección de trasmisión sexual.
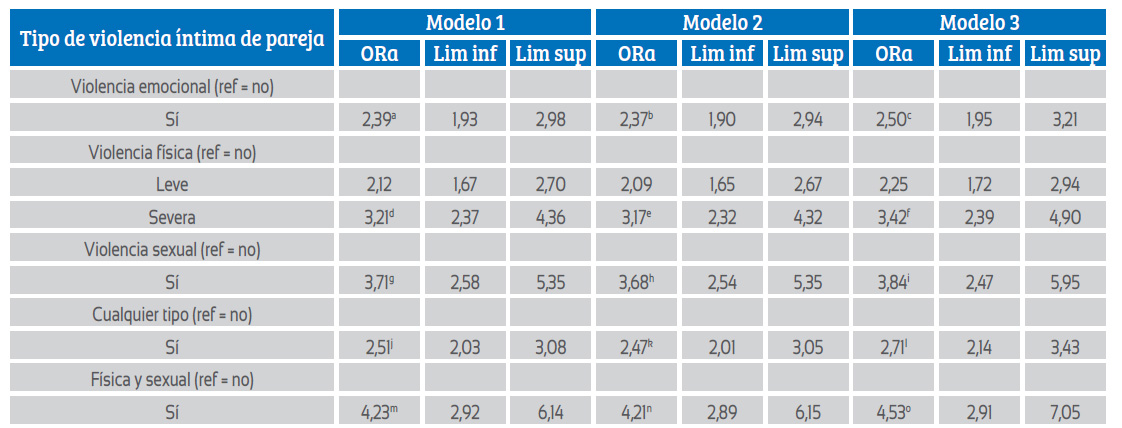
ORa: razón de momios ajustada, Lim inf: límite inferior, Lim sup: límite superior.
Modelo 1: modelo ajustado por características de la mujer, incluye como variables de ajuste a edad, nivel educativo y región natural. Los VIF de la variable en estudio
y covariables fueron ≤1,06. Modelo 2: modelo ajustado por características de la mujer y de la pareja, incluye como variables de ajuste a edad, nivel educativo, región natural, nivel educativo de pareja y consumo de alcohol por pareja. Los VIF de la variable en estudio y covariables fueron ≤1,44.
Modelo 3: modelo completo que incluye las variables del modelo 2 más la decisión conjunta de uso de anticonceptivos. Los VIF de la variable en estudio y covariables fueron ≤1,44.
R2 = Pseudo R2 de McFadden a Log pseudolikelihood = -4365,24, p <0,001, R2 = 0,024; b Log pseudolikelihood = -4358,86, p <0,001, R2 = 0,026; c Log pseudolikelihood = -3333,89, p <0,001, R2 = 0,029; d Log pseudolikelihood = -4353,76, p <0,001, R2 = 0,027; e Log pseudolikelihood = -4348,26, p <0,001, R2 = 0,028; f Log pseudolikelihood = -3320,52, p <0,001, R2 = 0,033; g Log pseudolikelihood = -4393,02, p <0,001, R2 = 0,018; h Log pseudolikelihood = -4384,99, p <0,001, R2 = 0,019; i Log pseudolikelihood = -3358,24, p <0,001, R2 = 0,022; j Log pseudolikelihood = -4331,30, p <0,001, R2 = 0,032; k Log pseudolikelihood = -4326,31, p <0,001, R2 = 0,033; l Log pseudolikelihood = -3298,03, p <0,001, R2 = 0,039; m Log pseudolikelihood = -4388,13, p <0,001, R2 = 0,019; n Log pseudolikelihood = -4379,83, p <0,001, R2 = 0,021; o Log pseudolikelihood = -3352,71, p <0,001, R2 = 0,024 Log pseudolikelihood = pseudoverosimilitud logarítmica
DISCUSIÓN
Las mujeres expuestas a lo largo de su vida a VIP emocional, física y sexual tuvieron mayor posibilidad de informar secreción o úlcera genital en los últimos 12 meses. La mayor fuerza de asociación se encontró con la violencia sexual, seguida de la violencia física severa; sin embargo, cuando ambas coexistieron, el riesgo fue cuatro veces más. Nuestras razones de momios fueron estimadas en tres modelos que se diferenciaron por la inclusión progresiva de confusores vinculados a las mujeres, como edad, nivel educativo y lugar de residencia; aquellos vinculados a la pareja como el nivel educativo y consumo de alcohol; y un modelo completo, que además de las variables previas sumó la decisión conjunta para el uso de anticonceptivos.
La asociación entre la VIP sexual y el reporte de secreción o úlcera genital en los últimos 12 meses tuvo resultados consistentes entre los tres modelos. En todos ellos se encontró una fuerte fuerza de asociación. Este hallazgo ha ocurrido en 32,409 mujeres de 7 países de África subsahariana. Dicho estudio estimó que las mujeres que experimentaron VIP sexual tuvieron 69% mayor posibilidad de comunicar secreción o úlcera genital respecto a las no expuestas. Este riesgo fue superior al generado por el antecedente de VIP física y emocional12). En otro país africano (Togo) se estimó el triple de riesgo para informar síntomas de ITS entre mujeres que experimentaron VIP sexual; este riesgo resultó mayor que el generado por la VIP física y emocional14). En nuestro estudio y los descritos, la aproximación a la ITS fue realizada por el auto reporte en los últimos 12 meses de dos síntomas (secreción y úlcera genital). Por otro lado, la exposición a VIP se midió para alguna vez en la vida, lo cual trata de configurar un periodo de exposición previo al desarrollo de los síntomas en el último año.
Nuestro hallazgo y el de los estudios señalados no son consistentes cuando se explora la misma hipótesis, pero realizando el diagnóstico de ITS con pruebas de laboratorio para identificar C. trachomatis, N. gonorrhoeae y T. vaginalis, y midiendo la exposición a la VIP durante el último año. Un estudio con esta metodología halló que el ser sexualmente victimizada en el último año redujo en un 50% la chance de ITS17). Este resultado podría explicarse por la forma de medición de la VIP, pues la experiencia de VIP en el último año no es equivalente a la exposición de vida. Otra explicación es que las mujeres victimizadas tienen mayor motivación para realizarse el diagnóstico e iniciar tratamiento y con ello reducir el número de mujeres con ITS en una medición transversal. Esta última explicación podría no ser aplicable en países en vías de desarrollo, en los cuales la búsqueda de atención ante la presencia de síntomas se ve afectada por barreras, como la confidencialidad, gastos de bolsillo y estigmatización 25); o se ve influenciada por el nivel educativo o facilidades de acceso al servicio de salud26).
Los mecanismos que vinculan la VIP sexual con el desarrollo de síntomas de ITS en la mujer pueden ser similares a los encontrados para la VIP sexual y el embarazo no deseado27,28). La adquisición de la ITS y el embarazo no deseado son consecuencias negativas de la práctica de sexo no seguro, y el único método que puede prevenir ambas son los métodos de barreras29). La VIP sexual limita el control de la mujer para usar anticonceptivos o acceder a ellos30,31). Durante un ataque sexual, la pareja o compañero agresor no acepta el uso de condón32), y no es posible la negociación del uso del preservativo; incluso en dicha situación el agresor puede sabotear el uso del anticonceptivo de barrera incrementando el riesgo de infección.
En la VIP sexual se incrementa el riesgo de ITS debido a que el varón tiende a emplear conductas sexuales agresivas. Biológicamente, las relaciones sexuales forzadas resultan en lesión del canal vaginal y tejidos adyacentes, favoreciendo la susceptibilidad al contagio de microorganismos(33). Un estudio en Nueva York encontró que la VIP física fue un factor de riesgo independiente para la no utilización de preservativos34). Otro estudio en Boston halló que las adolescentes que sufrieron VIP física o sexual mostraron, además, otros factores de riesgo sexuales como la infidelidad sexual, el miedo a solicitar a la pareja utilizar condón y a las consecuencias de dicho pedido, y la coerción para no utilizar el mismo32). Una revisión sistemática ratificó una asociación positiva entre la VIP física y/o sexual y el no utilizar condones o anticonceptivos orales35). Nuestros hallazgos son consistentes con dichos mecanismos, pues el mayor riesgo para comunicar los síntomas de ITS estuvo entre las mujeres que sufrieron simultáneamente VIP física y sexual.
Encontramos que la VIP física incrementó las posibilidades de ITS; esto ha sido hallado en mujeres del África subsahariana12). Además, observamos un efecto dosis respuesta entre la intensidad de la VIP física y la frecuencia de síntomas de ITS. Esta gradiente se explicaría por la diferencia entre los niveles de gravedad de las acciones violentas del esposo o compañero. La agresión física leve implica agresión sin empleo de armas o agentes físicos, mientras en los casos de violencia física severa, las mujeres están expuestas a mayor temor y angustia por el empleo de cuchillos, armas de fuego, entre otros, que las hacen vulnerables al acto sexual en contra de su voluntad.
La VIP emocional también estuvo asociada a comunicar secreción y úlceras genitales. Sin embargo, su fuerza de asociación fue menor comparada con la física y sexual. Si bien una acción de violencia emocional no resulta directamente en daño físico relacionado o no con un acto sexual sin protección, esta puede conllevar a trastornos psicológicos graves. Se ha informado que la VIP emocional incrementó en 47% a 50% la posibilidad de no usar condón y en 88% el uso frecuente de alcohol; ambos factores incrementan el riesgo de ITS(40, 41). Estos hallazgos reflejan el efecto negativo de la VIP emocional sobre la auto eficacia de la mujer para la negociación del uso del condón. Esta afectación puede acompañarse de reducción de la autoestima en la mujer.
Existen otras rutas causales entre la VIP y la presencia de síntomas de ITS que incluyen variables mediadoras no incluidas en este análisis. Por ejemplo, se ha descrito que la VIP física y psicológica afecta negativamente la respuesta inmune a la infección por el virus herpes simple -1(38); a través de este mecanismo se podría potenciar el riesgo para ITS. Sin embargo, se requieren estudios con mayor tamaño muestral, prospectivos y que integren marcadores inmunológicos e inflamatorios para confirmar esta hipótesis39). Otro mecanismo inicia con el consumo de alcohol que incrementa el riesgo de violencia física, sexual y además de sexo no seguro, todos ellos factores de riesgo para ITS40). Otra ruta involucra alteraciones estructurales (volumen y grosor cortical) en las regiones límbicas, parietal, frontal, temporal y surco lateral entre las mujeres sobrevivientes de VIP11). Existe evidencia que alteraciones de este tipo pueden generar problemas de conducta (comportamiento agresivo, falta de regulación emocional, decisiones riesgosas) comparados con adultos de desarrollo normal41).
El estudio tuvo las siguientes limitaciones. Al ser una medición transversal no fue posible determinar la temporalidad entre la exposición a VIP y el desarrollo de ITS. Por ello, medimos la exposición de vida a la VIP y la presencia de los síntomas en los últimos 12 meses. El informe de las mujeres respecto a la ocurrencia de secreción o úlcera genital, así como la exposición a VIP pueden verse afectados por un sesgo de memoria o deseabilidad social. Al tratarse de un estudio de fuentes secundarias no fue posible medir otras potenciales variables confusoras en la asociación de VIP y auto reporte de secreción o úlcera genital.
El auto reporte de la ITS no es comparable al diagnóstico laboratorial. Sin embargo, las encuestas poblacionales de salud22,42 y estudios primarios6 aplican dicha técnica para medir la presencia de secreción y úlceras genitales ocurridas en el último año. Se ha evaluado que el auto reporte de secreción vaginal tiene un bajo rendimiento diagnóstico comparado con el examen ginecológico43). El informar los síntomas, incluyendo la secreción vaginal y úlceras genitales, también tiene un rendimiento inferior comparado con las pruebas laboratoriales44). A pesar de estas limitaciones, el auto reporte es una manera eficiente de medir la frecuencia de las ITS en muestras representativas. Además, permite comparaciones con los resultados obtenidos en otros estudios basados en encuestas poblacionales de salud.
CONCLUSIÓN
Hemos hallado que una de diez mujeres comunicó úlcera o secreción genital en los últimos 12 meses. La exposición de vida a VIP sexual incrementó las posibilidades de informar sobre úlcera o secreción genital, en mayor medida que la VIP física severa y emocional; sin embargo, la presencia de la VIP física y sexual es la que generó el mayor riesgo. Entre estas últimas, la posibilidad de comunicar síntomas de ITS fue 4,53 veces respecto a las no expuestas.











 texto em
texto em