En las ultimas décadas, las mujeres tienen roles importantes en la sociedad, con trabajos, proyectos y metas personales, por lo que posponen la maternidad. Además, los seguros sociales nacionales y privados no cubren tratamientos de reproducción asistida (TRA). Por tal motivo, el grupo etario de nuestras pacientes es mayor del que se observa en otros países.
Ante una paciente mayor de 40 años, es importante evaluar la posibilidad de conseguir un bebe sano. Las tasas de fecundidad disminuyen con los años, entre 4 % y 8 % más bajas en las mujeres de 25 a 29 años, 15 % a 19 % más bajas en las mujeres de 30 a 34 años, 26 % a 46 % más bajas en las de 35 a 39 años y hasta 95 % más bajas en mujeres de 40 a 45 años1,2.
Las tasas de éxito logradas con TRA utilizando óvulos propios disminuyen a medida que aumenta la edad, debido a que el número de ovo-citos extraídos, los embriones disponibles, las tasas de implantación, embarazo y nacidos vivos son menores en las mujeres mayores. Reportes anuales del Centro de Control y Prevencion (CDC) en los Estados Unidos desde 1989 muestran consistentemente que la edad es el factor individual más importante que afecta la probabilidad de éxito con TRA. Las tasas de embarazo y nacidos vivos para los ciclos de TRA que utilizan embriones u óvulos propios frescos varían poco para las mujeres menores de 32 años, pero luego disminuyen consistentemente de manera casi lineal a medida que aumenta la edad. Esto ocurre independientemente de si las tasas de éxito se calculan por ciclo, por aspiracion de óvulos o por transferencia de embriones.
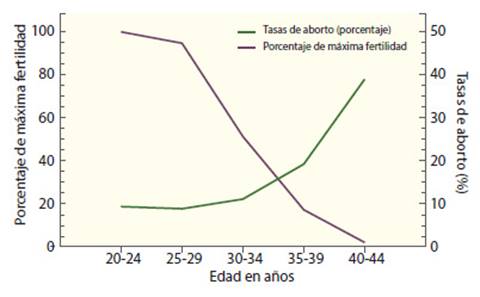
En el resumen nacional de la Sociedad de Tecnología de Reproducción Asistida de los E.E. U.U. (SART, por sus siglas en inglés) del 2021, la tasa de nacidos vivos por transferencia de embriones fue 52,5 % para las mujeres menores de 35 años, 42% para las de 35 a 37 años, 28,4 % para las de 38 a 40 años, 13,3 % para las de 41 a 42 años y 4,3 % para mujeres de 43 a 44 años, a pesar de que se transfiere un mayor número de embriones a mujeres mayores3. La edad no solo se relaciona con disminución de la fertilidad con las TRA, sino también con el aumento de la tasa de abortos (figura 1). Las tasas de aborto espontáneo en los ciclos de concepción natural son generalmente bajas antes de los 30 años (7 % a 15%) y aumentan con la edad solo levemente entre los 30 y 34 años (8 % a 21 %), pero es mayor entre los 35 y 39 años (17 % a 28 %) y mayores de 40 años (34 % a 52 %)4-6. El mismo patrón se observa en los embarazos resultantes de TRA. En el resumen nacional de resultados de TRA de E.E. U.U. en el 2021, las tasas de aborto espontáneo estaban por debajo del 15 % en mujeres menores de 35 años, casi el 29 % a los 40 años y 65 % en mujeres de 44 años o más3.
Figura 1. relación de la edad de la mujer con la disminución de la Fertilidad y aumento de los abortos con las TRA 7.
Fisiopatogenia
Se han descrito modelos para explicar el patrón de agotamiento folicular relacionado con la edad. El modelo más aceptado describe una tasa de depleción folicular que aumenta gradualmente, es decir que, a medida que el ritmo de disminución avanza disminuye el número de folículos restantes, respaldado por evidencia de que los factores paracrinos secretados por los folículos primordiales inhiben el reclutamiento y regulan el tamaño de la reserva folicular en reposo8-10.
Salvo una enfermedad que destruya o provoque la eliminación del tejido ovárico o cualquier daño ambiental importante, el número total de folículos al nacer y la edad en que se agotan están determinados genéticamente11-20.
Existe una buena correlación entre la edad de la menopausia en madres e hijas y entre hermanas, lo que sugiere que los factores genéticos desempeñan un papel importante en la determinación de la edad de la menopausia21-23. Aproximadamente el 10 % de las mujeres llegan a la menopausia a los 45 años13,24, probablemente por tener menor reserva folicular ovárica que se agota a una edad más temprana.
Así mismo, las mujeres que tienen mala respuesta de forma repetida a la estimulación con gonadotropinas exógenas también tienden a una menopausia más temprana25-28. Esto sugiere que su pobre respuesta refleja una etapa avanzada de agotamiento folicular que comienza años antes de lo esperado normalmente26.
Mientras que el número de folículos ováricos remanentes disminuye constantemente con el aumento de la edad, las observaciones en ciclos estimulados sugieren que los folículos envejecidos también se vuelven progresivamente menos sensibles a la estimulación con gonadotropinas. A medida que aumenta la edad, se necesita aumentar la dosis medicamentosa y la duración del tratamiento para estimular el desarrollo folicular múltiple. El aumento y el pico de los niveles de estradiol disminuyen, lo que se refleja en cohortes más pequeñas de folículos que se pueden reclutar. Sin embargo, la cantidad de estradiol secretada por los folículos que emergen y crecen hasta la madurez parece comparable a la de las mujeres más jóvenes29.
En los estudios de desarrollo folicular ovárico y de niveles de hormonas del líquido folicular preovulatorio tanto en mujeres mayores o más jovenes (ovulatorias), no se encuentra disminución de la funcion folicular relacionada con la edad una vez que comienzan el crecimiento y el desarrollo. Los folículos preovulatorios en mujeres mayores y más jóvenes son similares en tamaño y el líquido folicular contiene los mismos niveles de inhibina y progesterona; las proporciones de estrógeno/andrógeno son incluso más altas en mujeres mayores que en mujeres jóvenes29.
Las mujeres mayores ovulan con la misma regularidad y con más frecuencia que las mujeres más jóvenes. Aparentemente sus niveles crecientes de FSH compensan con bastante eficacia cualquier disminución en la sensibilidad folicular a la estimulación con gonadotropinas. Los folículos preovulatorios en ciclos de mujeres mayores comienzan antes, pero crecen a un ritmo normal y alcanzan un tamaño normal; las características del líquido folicular sugieren que también son bastante saludables.
¿Por qué entonces la fertilidad en las mujeres declina progresivamente con la edad?
La evidencia disponible indica que tanto la disminución de la fertilidad femenina relacionada con la edad como el aumento del riesgo de aborto espontáneo pueden atribuirse a un aumento en la proporción de ovocitos anormales en un grupo folicular que envejece y se reduce.
A medida que disminuye el número de folículos, la calidad de los ovocitos también disminuye, principalmente debido a un aumento de la falta de disyunción meiótica, lo que resulta en una tasa creciente de aneuploidía de ovocitos y embriones en mujeres que envejecen31-34.
Alteraciones genéticas
Se ha utilizado una amplia variedad de técnicas para estudiar la composición cromosómica de ovocitos humanos. La mejor evidencia disponible derivada de un análisis citogenético detallado de ovocitos recuperados para FIV que no lograron fertilizar sugiere que la tasa global de aneuploidía de ovocitos aumenta con el avance de la edad materna35,36.
Un análisis de biopsias de trofoectodermo de más de 15,000 blastocistos humanos también mostró que la tasa de aneuploidía aumenta con la edad. Esto es cierto para todos los cromoso mas y es más alto para los cromosomas 15, 16, 18, 19, 21 y 2237. Otros factores embrionarios además de la aneuploidía podrían influir en la competencia de los embriones euploides de forma dependiente de la edad.
Los cambios en la expresión genética de los embriones, el metabolismo y la salud epigenética pueden explicar el destino adverso de algunos embriones euploides. Por ejemplo, se cree que la edad paterna avanzada (que a menudo se asocia con la edad materna avanzada) contribuye a alteraciones en el crecimiento embrionario temprano a través de mecanismos no genéticos. La hipometilación inducida por el envejecimiento en sitios de unión específicos en el genoma del espermatozoide puede ser una característica molecular clave que modula los programas de desarrollo de embriones y descendientes38.
El aumento de aneuploidía relacionado con la edad fue más pronunciado para los cromosomas acrocéntricos (donde el centrómero se encuentra cerca de un extremo del cromosoma; por ejemplo, el cromosoma 21)37 (Figura 2).
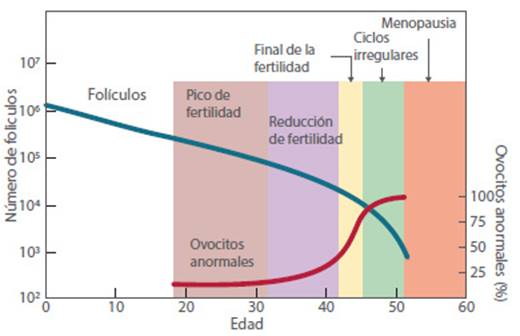
Figura 2 Variación en el número de folículos y ovocitos y ovocitos anormales en relación con la edad37,38.
En resumen, la evidencia acumulada sugiere fuertemente que la causa principal de la disminución de la fecundidad dependiente de la edad y el aumento de la incidencia de abortos espontáneos es una prevalencia creciente de aneuploidía en los ovocitos que envejecen como resultado, al menos en parte, de mecanismos reguladores desordenados que gobiernan la formación y función del huso meiótico.
Alteraciones uterinas
Tiempo atrás se mencionaba que la edad parecía no generar ningún efecto adverso significativo en el útero. Hallazgos recientes sugieren que la edad afecta significativamente la expresión del gen endometrial y que los cambios importantes en la función endometrial ocurren después de los 35 años(39). Utilizando un enfoque funcional no dirigido a todo el genoma se han observado cambios en los procesos moleculares afectados por la edad en el endometrio, incluida una proliferación reducida de células epiteliales debido a la detención del ciclo celular y la regulación positiva de los procesos ciliares.
Así mismo, se conoce que la incidencia de miomas aumenta con la edad. Y la percepción sobre la adenomiosis es que afecta a mujeres en edad reproductiva mayores. La adenomiosis y los miomas uterinos, al modificar la arquitectura vascular, alterar la contractilidad normal y cambiar la producción de factores angiogénicos, podrían alterar el medio endometrial local y distante y, en consecuencia, la función endometrial. No podemos excluir que otros factores menos conocidos puedan coincidir con nuestros hallazgos40-42.
Sin embargo, aún existe evidencia limitada que sugiere que la edad uterina en sí misma tiene un impacto importante en la fertilidad43-45. Con el aumento de la edad materna, existe un mayor riesgo de antecedentes de cirugía uterina (especialmente cesáreas y miomectomías) y trastornos del metabolismo de la glucosa. Ambos factores se han asociado fuertemente con un mayor riesgo de aborto espontáneo en un gran estudio prospectivo reciente basado en registros46,47. Además, se observa un mayor riesgo de aborto espontáneo en pacientes con autoanticuerpos tiroideos positivos. El mecanismo fisiopatológico exacto sigue siendo controvertido, pero se sabe que las mujeres eutiroideas con autoanticuerpos tiroideos positivos son mayores que las mujeres eutiroideas con autoanticuerpos negativos48.
Reserva ovárica
El término reserva ovárica se refiere a: 1) el tamaño y la calidad de foliculos que tienen sus ovarios, y 2) la capacidad de los ovarios para responder a la estimulación de gonadotropina exógena, que son conceptos relacionados. Dado que el principal efecto del envejecimiento del potencial reproductivo de una mujer es la disminución del número de ovocitos y el aumento de la aneuploidía de los ovocitos, el concepto de reserva ovárica es relevante para el envejecimiento reproductivo femenino.
Las pruebas de reserva ovárica tienen dos propósitos: 1) predecir la fecundidad y 2) obtener información pronóstica sobre la probabilidad de una respuesta exitosa a la estimulación ovárica en mujeres que se someten a un tratamiento de infertilidad.
Las pruebas de reserva ovárica en este grupo etario tienen como objetivo identificar a las mujeres con ‘reserva ovárica disminuida’ (ROD). Es importante enfatizar que dichas pruebas no pueden y no establecen un diagnóstico de ROD; solo identifican a las mujeres con mayor probabilidad de mostrar una respuesta deficiente a la estimulación con gonadotropinas y potencialmente tienen una menor probabilidad de lograr un embarazo con el tratamiento
Se utiliza principalmente el dosaje de la hormona antimülleriana (AMH, por sus siglas en inglés) y el conteo de folículos antrales al inicio del ciclo para determinar la reserva ovárica. La calidad de los óvulos lo predice la edad de la paciente.
Las pruebas de reserva ovárica también se han convertido en un elemento de rutina de la evaluación diagnóstica de la infertilidad. Los defensores de la aplicación liberal de las pruebas de reserva ovárica argumentan que las pruebas anormales pueden ayudar a persuadir a las mujeres mayores para que abandonen los planes de seguir un tratamiento agresivo, costoso y probablemente inútil, y convencer a las mujeres jóvenes de hacer exactamente lo contrario para aprovechar al máximo una ventana de oportunidad que se cierra rápidamente.
Las pruebas de reserva ovárica siempre deben interpretarse con precaución. La aplicación rígida de los resultados de las pruebas corre el riesgo de recomendaciones inapropiadas para el tratamiento, o para ningún tratamiento, y ambos deben evitarse. Un resultado anormal de la prueba no excluye la posibilidad de embarazo. Excepto quizás cuando sean muy anormales, los resultados de las pruebas no deben usarse para negar el tratamiento, sino solo para obtener información pronóstica que pueda ayudar a guiar la elección del tratamiento y el mejor uso de los recursos disponibles. Aunque la probabilidad de embarazo puede ser baja, muchas personas con resultados anormales en las pruebas lograrán el embarazo si se les brinda la oportunidad. En última instancia, independientemente del pronóstico, la tasa de éxito para cualquier mujer será del 0 % o del 100 %.
Indicaciones de FIV con óvulos propios en mujeres mayores de 40 años
La edad avanzada presenta desafíos y consideraciones adicionales en comparación a las mujeres jóvenes. El objetivo principal es conseguir un embrión euploide, es decir, un bebe sano.
1. Disminuir el tiempo de búsqueda: conseguir el embarazo sin ayuda o con procedimientos de baja complejidad genera tasas muy bajas de éxito. Por lo que se debe proponer iniciar FIV lo más pronto posible.
2.Realizar asesoramiento genético: con el fin de disminuir la tasa de aborto, aceptar realizar estudio genético a los embriones para descartar aneuploidías (PGT-a).
3.Considerar pacientes idealmente menores de 44 años debido a que la tasa de recién nacidos (RN) es 2 %.
4.Evaluación de la reserva ovárica y que esta se encuentre en rangos aceptables, tomando en cuenta fundamentalmente la AMH y el recuento de folículos antrales.
5.Expectativas realistas: deseo de intentar procedimientos FIV a pesar de conocer los resultados bajos. Reconocer y aceptar la posibilidad de obtener un reservorio de embriones.
6.Finalmente, firmar consentimiento informado especial orientado a la paciente mayor de 40 años que señale las tasas de recién nacido vivo (RNV) que ofrece el propio centro.
Estimulación ovárica en mujeres mayores de 40 años
La dosis por administrar para la estimulación depende de la reserva ovárica. Si esta es adecuada, se deben administrar dosis completas.
Por el contrario, si la reserva ovárica está disminuida (2 a 3 foliculos antrales), se sugiere que la estimulación sea minima y considerar realizar multiples ciclos, con el objetivo de tener mínimo 3 embriones para enviar a estudio genetico preimplantacional (PGT); este procedimiento es denominado acumulacion de embriones y/o banking.
Presentamos un grupo de pacientes del Instituto de medicina reproductiva de la Clínica Ricardo Palma que realizaron banking49 (Figura 3).
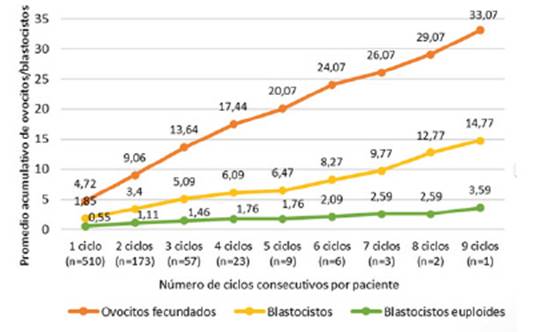
Figura 3 Número de ciclos consecutivos de estimulación ovárica por paciente ≥ 40 años para acumulación de embriones para PGT entre el 2017 y 2022 en el Instituto de Medicina Reproductiva Clínica Palma
La acumulación de embriones planteada en este grupo de pacientes con el fin de incrementar las posibilidades de tener embriones euploides y la chance de una transferencia, también fue analizada por nuestro grupo. En la figura 3 presentamos el número de ciclos consecutivos de estimulación hormonal que se realizó en algunas pacientes. Un primer ciclo de TRA fue realizado en 510 pacientes; de ellas, 173 tuvieron un segundo ciclo, 57 un tercer ciclo, 23 un cuarto ciclo, y así sucesivamente hasta 1 paciente que realizó 9 ciclos. Con cada ciclo nuevo, se observa un aumento en el número promedio de los ovocitos fecundados. No obstante, el promedio de blastocistos y blastocistos euploides no incrementa en el mismo ritmo.
Resultados
La Red Latinoamericana de Reproducción Asistida (REDLARA) comenzó en 1990 como el primer registro multinacional y regional de tecnologías de reproducción asistida (TRA). Al igual que en años anteriores, el último informe N° 32 brinda información sobre la utilización, disponibilidad, efectividad, seguridad y resultados perinatales de los TRA iniciados entre el 1 de enero y el 31 de diciembre de 2020 y las tasas de recién nacidos hasta septiembre de 202150. Se recopilaron datos sobre TRA de 188 centros en 16 países de América Latina, cubriendo ciclos de FIV con óvulos propios frescos e inyección intracitoplasmática de espermatozoides (ICSI), pruebas genéticas preimplantacionales (PGT), transferencia de embriones congelados (TEC) precedida tanto por ciclos de transferencia de embriones frescos como por ciclos de ovulos propios congelados, donación de óvulos incluida la transferencia de embriones frescos y congelados, preservación de la fertilidad y ciclos de ovocitos descongelados tanto propios como donados. Los 87,732 ciclos iniciados durante 2020 resultaron en 12,778 partos y 14,405 nacidos vivos.
Como se observa en la figura 4, en los últimos 7 años, la proporción de mujeres de 34 años o menos se ha reducido de 31,7 % a 24,7 % y las mujeres ≥ 40 han seguido aumentando de 27 % a 34 %. El 75,3 % de las mujeres atendidas en la región tenían 35 años o más, con profundas variaciones entre países. La proporción de mujeres ≥ 40 en los principales contribuyentes fue: Brasil 35,3 %, México 25,3 %, Argentina 41,9 % y Perú 40,4 %. Esto es muy importante cuando se comparan los resultados de tratamientos FIV/ ICSI entre diferentes países y regiones. La proporción de mujeres ≥ 40 es solo 18 % en Europa y aproximadamente 26 % en los E.E. U.U.
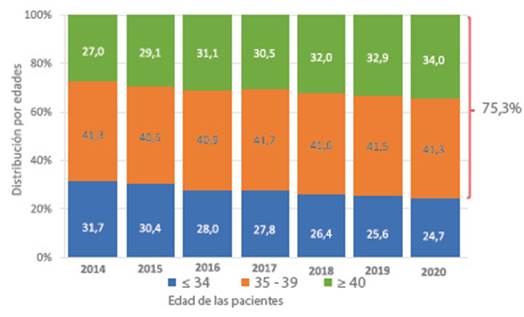
Figura 4 Distribución por edad en mujeres con FIV e ICSI en América Latina, 2014-2020. Fuente REDCLARA.
Resultado de los ciclos de FIV e ICSI en Fresco y congelados con óVulos propios según la edad de la mujer y el número de embriones transferido
En el 2020, hubo 39,418 ciclos de FIV/ICSI recién iniciados, pero como se informa en la Figura 5, después de descartar los ciclos cancelados, los ciclos congelados y otras condiciones que impedían la transferencia de embriones se redujo a 17,253 la cantidad de ciclos en los que se recolectó al menos un ovocito maduro. Además, tras descartar los casos con fecundación fallida, sin desarrollo embrionario y los casos de PGT sin embriones normales, el número de ciclos de transferencia se redujo aún más, a 11,101. La tabla 1 proporciona las tasas de embarazo clínico (TEC) y las tasas de parto por ovocitos obstenidos y transferencia de embriones según la edad de la mujer y el tipo de proceso de fecundación.
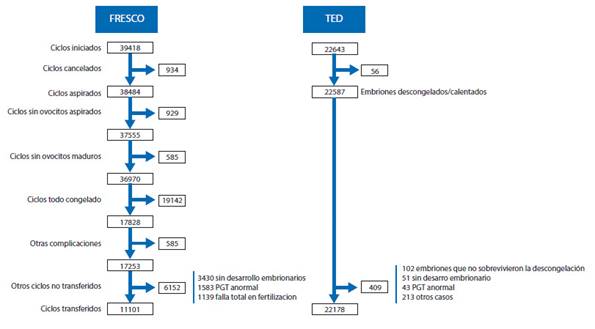
Figura 5 Eventos que aFectan la eVolución de FiV/icsi en Fresco, donación de oVocitos congelados o Frescos, transFerencia de embriones propios conGelados en latinoamérica 2020. ted = transFerencia de embriones desconGelados. Fresco = ciclos iniciados con ovulos propios para Fiv/icsi. pGt = estudio Genetico preimplantacional (pGt-a, pGt-m, pGt-sr reportados en conjunto). Fuente: redlara50.
Tabla 1 tasa de embarazo clínico (tec) y tasa de parto en ciclos Frescos de FiV e icsi con óVulos propios según edad de la mujer, en 2020(50).
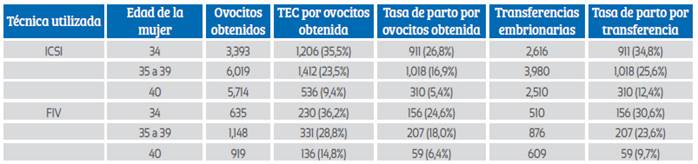
TEC = Tasa de embarazo clínico; ICSI= Inyección intracito1plasmática de espermatozoides
En el informe de la REDLARA como en años anteriores, el ICSI representa el 84,8 % de las transferencias. Esta alta proporción de ICSI, sin una explicación clara más allá del miedo al fracaso de la fecundación, se ha mantenido estable en la última década, 85,7 % en el informe del 2010. Cuando se estratificó según edad de la pareja femenina, la tasa de embarazo por ovocitos obtenidos fue significativamente mayor en FIV que en ICSI solo en mujeres ≥ 35 años (p < 0,0001). Sin embargo, no hubo diferencias en la tasa de parto por ovocitos obtenidos y la tasa de parto por transferencia de embriones. Como era de esperar, las posibilidades de lograr un parto disminuyeron con la edad.
Las tasas difieren cuando se transfiere 1 embrión o 2 embriones; o cuando se transfiere 1 solo embrión teniendo otros, es decir, escogiendo al mejor, comparado cuando es el único embrión, es decir, no hay mas embriones disponibles. Generalmente, en mujeres ≥ 40 se dispone de 1 solo embrión.
En la REDLARA, la proporción de transferencia de embriones en estadio blastocisto sobre embriones en división aumenta año tras año. Esta proporción representó el 30,3 % de todas las transferencias en el 2016, aumentando a 77,6 % en el 2020. Y, como se mencionó anteriormente, en los casos de TEC representó el 86,8 % de todas las transferencias frente al 53,3 % en FIV/ICSI en fresco. Al comparar la tasa de partos y la tasa de nacimientos múltiples después de la transferencia electiva de embriones en división de 8 células (día 3) y la transferencia electiva de blastocistos del día 5 en ciclos de FIV e ICSI, las tasas de partos fueron significativamente más altas después de la transferencia de blastocistos.
Influencia del PGT en el resultado del TRA
En los últimos 5 años, la proporción de aspiraciones que conducen al PGT ha aumentado casi 2,5 veces en todas las categorías de edad (Figura 6). En el 2020, un total de 144/188 centros (76,6 %) informaron 8,920 aspiraciones de ciclos frescos con óvulos propios donde se realizó PGT. Esto corresponde al 24,1 % de las aspiraciones con al menos un ovocito maduro. Al estratificar por edad, el porcentaje de aspiraciones con PGT fue 12,9 % en mujeres ≤34 años, 23,7 % en mujeres de 35 a 39 años y 33,4 % en mujeres con ≥ 40 años.
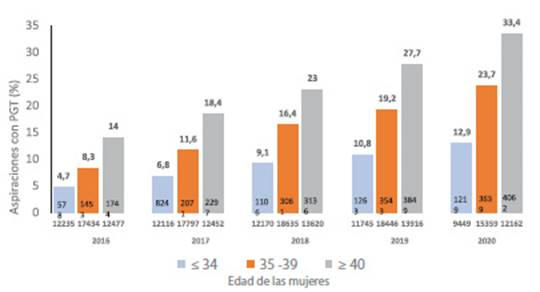
Figura 6 tendencia en 5 años del uso del estudio Genético preimplantacional (PGT) en ciclos Frescos de óvulos propios en aspiraciones de al menos 1 ovocito maduro en los diferentes Grupos de edad en Latinoamérica, 2016 a 2020.
La edad media de las mujeres que se sometieron a PGT con óvulos propios fue de 38,3 (DE 3,97) y la distribución por edades incluyó 17,6 % en mujeres de ≤ 34 años, 20,2 % en mujeres de 35 a 37 años, 19,7 % en mujeres de 38 a 39 años y 42,5 % en mujeres ≥ 40 años.
El efecto del PGT sobre la tasa de parto y aborto espontáneo se puede ver en la tabla 2. Cuando se estratificó por edad, el PGT disminuyó significativamente el porcentaje de aborto espontáneo en todas las categorías de edad, incluidas las mujeres ≤ 34 años (p = 0,041) y las mujeres con donación de óvulos (p = 0.002). En cuanto al efecto del PGT sobre la probabilidad de lograr el nacimiento, las diferencias en partos con y sin PGT son otra vez significativamente mayores con PGT en todos los grupos de edad, incluida la donación de óvulos (p < 0,001).
Tabla 2 Efecto de PGT en la tasa de parto y aborto dependiendo de la edad de la mujer en transferencia de óvulos descongelados (TED) con óvulos propios y TED con óvulos donados (2020)50.
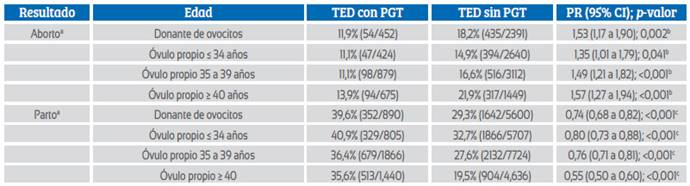
TED = Transferencia de embrión descongelado; OD = Ovulos donados; PGT = Examen genético preimplantacional; PR = Ratio de prevalencia
a Para aborto, el denominador es los embarazos clínicos; para partos, el denominador es las transferencias embrionarias
b Probabilidad de aborto. Grupo de referencia es "con PGT"
c Probabilidad de parto. Grupo de referencia es "con PGT"
Las tasas de parto acumuladas en la REDLARA se calcularon en un subgrupo de 4,344 mujeres que, además de sus transferencias frescas, tenían embriones supernumerarios congelados para transferencias posteriores, independientemente de si fueron utilizados durante el 2020. Para calcular los partos acumulados, este último grupo es el que mejor refleja lo que son las chances acumuladas, porque las mujeres sin embriones congelados tenían su única oportunidad después de la transferencia fresca. La tasa de parto por transferencia fresca es notablemente más alta en todas las edades en las mujeres que tienen embriones excedentes congelados. Otra observación interesante en este grupo de mujeres que tenían embriones excedentes fue la pendiente menos pronunciada de la caída en los partos a medida que aumentaba la edad.
Preservación de la fertilidad
Se comunicaron un total de 7,558 ciclos iniciados de vitrificación de óvulos para preservación de la fertilidad, de los cuales 7,204 tenían al menos un ovocito maduro (95,3 %). La distribución por edades de las mujeres ha mostrado cambios mínimos en los últimos años y la proporción de mujeres que intentan preservar su fertilidad a los ≥ 38 años sigue siendo muy alta (44,8 %) (figura 7). El número medio (DE) de ovocitos vitrificados en metafase II fue de 7,04 (σ 5,83), con amplias variaciones según la edad de la mujer. En mujeres ≤ 34 años la media fue 9,02 (σ 7,05), en mujeres de 35 a 38 años fue 7,32 (σ 5,73), en las de 39 a 40 años fue 5,77 (σ 4,52) y en las mujeres ≥ 40 fue 4,54 (σ 3,76) ovocitos. En el 95,1 % de los casos, el motivo de la vitrificación de los óvulos fue un aplazamiento de la fertilidad por motivos distintos al cáncer, que representó el principal motivo de preservación de la fertilidad en el 4,9 % de los casos.
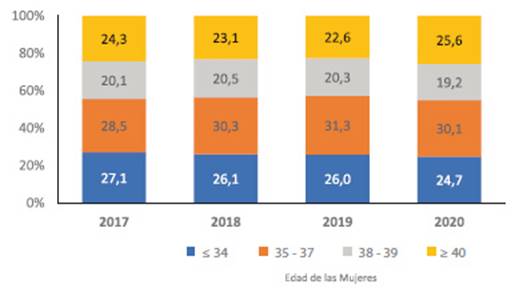
Figura 7 Ciclos de preservación de la Fertilidad por año de acuerdo con la edad de la mujer de Latino América, 2017 a 2020. los números incluyen solo los ciclos en los que se recolectó al menos un ovocito maduro50.
Transferencia de embriones congelados
La proporción de ciclos TEC continúa aumentando, representando el 66,6 % de todas las transferencias con óvulos propios. Esto se ha asociado con una caída continua del promedio de número de embriones frescos transferidos a 1,6. Como se informó en el pasado, las tasas de embarazo y parto después de TEC fueron más altas que después de las transferencias frescas, independientemente de la cantidad de embriones transferidos. Esto puede parecer sorprendente, teniendo en cuenta que una gran proporción de los ciclos TEC son el resultado de nuevas transferencias fallidas. La razón principal es la proporción de transferencias en estadio de blastocistos, que es mucho mayor en TEC (86,3 %) en comparación con solo el 53,6 % después de transferencias frescas (embrión en división). Nuevamente, esto muestra que la selección del mejor blastocisto para la transferencia es lo que produce los mejores resultados, ya sea a través de la evaluación de la morfología o después de la adición de PGT.
El número de centros y ciclos que notifican PGT aumenta año tras año. En el 2020, el 76,6 % de los centros comunicaron PG del 24,1 % de aspiraciones con al menos un ovocito maduro. Se utilizó PGT en 27,287 blastocistos, la mayoría de los cuales se examinaron mediante secuenciación de última generación (NGS). La proporción de aneuploidías fue de 49,8 % de embriones en mujeres de < 34 años, 59,9 % de embriones en mujeres de 35 a 39 años y 77,1 % de embriones en mujeres ≥ 40 años. Además, la proporción de aneuploidías en 3,166 embriones generados a partir de donantes de óvulos (edad media 25,5 años) fue del 36,1 %. Como se ve en la Tabla 2, el uso de PGT redujo las tasas de aborto espontáneo y aumentó las tasas de parto en todas las edades, incluidas las receptoras de ovocitos.
De hecho, hay un beneficio en el uso de PGT para lograr una mayor eficiencia reproductiva en todas las edades. Sin embargo, la pregunta es si es rentable en todas las edades, lo que dependerá en gran medida de las políticas de financiación de la salud reproductiva. Independientemente de la riqueza de un país, cuando la mayoría de los tratamientos se financian con dinero de su bolsillo, la mayoría de los consumidores pertenecen a un subgrupo de personas de ingresos medios o altos. En este subgrupo existe una tríada formada por familias con menos hijos, retraso en la maternidad y una progresiva búsqueda de certezas. Con esto en mente, la cuestión del beneficio absoluto del PGT prevalece sobre el equilibrio entre los costos para el beneficio buscado. Esto explica en parte el creciente uso de la tecnología PGT para asegurar, en la medida de lo posible, el nacimiento de niños sanos.
A diferencia de años anteriores, el informe de la REDLARA calcula la tasa de parto acumulada de las aspiraciones que tuvieron lugar solo duran te 2020. En esta cohorte de 11,101 aspiraciones, solo 4,344 (39 %) tenían embriones sobrantes disponibles para futuras transferencias. Por lo tanto, si se calculan los nacimientos acumulados a partir de toda la cohorte, la mayoría de las mujeres (61 %) no tendrán una segunda oportunidad de nacimiento derivada del ciclo de aspiración inicial. Lo más probable es que esto se deba a la alta proporción (34 %) de mujeres de 40 años o más. Cuando la tasa de parto acumulada se calculó solo entre las mujeres que tenían embriones congelados excedentes disponibles para futuras transferencias, la posibilidad de un nacimiento después de una nueva transferencia ya era mayor en todas las edades. El delta generado por el TED posterior (acumulativo) también fue mayor. Otro hallazgo interesante es el mejor resultado después de la transferencia secuencial de dos blastocistos (1+1) en comparación con la transferencia simultánea de dos blastocistos, y se ve mejor en mujeres ≤ 34 años. Aunque las diferencias en las tasas de parto no son muy grandes, la tasa de nacimientos múltiples es casi 20 veces mayor tras la transferencia simultánea de dos blastocistos (1,6% frente a 30,5%, respectivamente) que tras 1+1. El impacto de los partos múltiples en términos de mortalidad perinatal y partos prematuros y prematuros extremos se multiplica por 4 a 9 veces. En el 2020, el 65 % de todos los partos múltiples fueron en mujeres ≤ 34 años y receptoras de ovocitos. Por lo tanto, una estrategia de blastocistos 1+1 en estos dos grupos de mujeres debería reducir significativamente los partos múltiples, manteniendo tasas de parto aceptables.
Reproducción asistida en mujeres mayores de 40 años mediante fertilización asistida con óvulos propios. Instituto de Medicina Reproductiva Clínica Ricardo Palma (IMRCRP)
El IMRCRP reporta a la REDLARA, y parece importante presentar un informe de los últimos 6 años reportados, es decir 2017-2022, ya que los autores de este artículo trabajamos en el Instituto.
La distribución de pacientes que acuden al Instituto, por edad, es semejante al informe de la REDLARA. En el Instituto solo se realiza ICSI cuando está indicado, principalmente por factor masculino. Es así como la proporción de ICSI en ≥ 40 años fue de 32 % y de FIV convencional de 68 %. Nuestros resultados no demuestran una diferencia en la tasa de fecundación (FIV 69 % e ICSI 72,8 %), mientras que la tasa de blastocisto fue mayor en FIV que en ICSI (39,4 % vs 27,5 %; p < 0,001).
Las transferencias embrionarias se realizan en estadio de blastocisto en 98 % de los procedimientos, la mayoría con estudio de PGT-A (72,6%), incrementando el porcentaje con los años.
Se realizaron 784 ciclos de aspiraciones foliculares para FIV/ICSI y vitrificación de óvulos, de un total de 510 pacientes (Figura 8). Luego de descartar los ciclos sin óvulos recuperados o inmaduros, 599 ciclos fueron a FIV/ICSI y 131 ciclos fueron para vitrificación de óvulos. Con el objetivo de formar embriones, se desvitrificaron los óvulos en 63 casos, con una sobrevida de ovocitos de 87,5 %. Después de separar los ciclos FIV/ICSI con falla de fecundación total o ciclos sin desarrollo embrionario, quedaron 453 pacientes con al menos 1 blastocisto. El 72,6 % de las pacientes prefirió realizar estudio genético PGT-A; de estas, el 41 % tuvo al menos 1 embrión euploide para transferir y el 59 % no tuvo embriones euploides, por lo tanto, no se transfirieron (Figura 8).
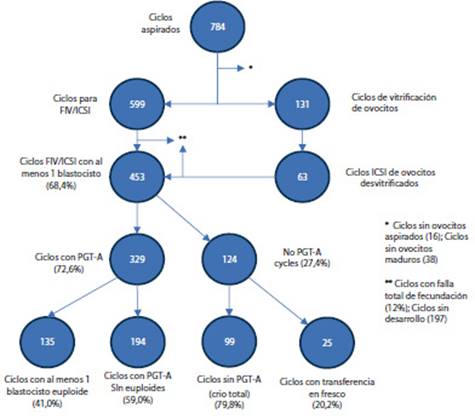
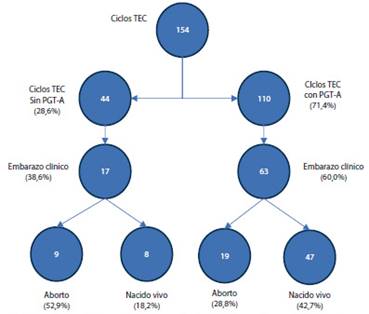
Figura 8 Ciclos aspirados y resultados en pacientes ≥ 40 años con óvulos propios entre el 2017 y 2022 en el instituto de medicina reproductiva clínica Ricardo Palma.
Las transferencias embrionarias se realizaron en estadio de blastocisto en el 98 % de los procedimientos. El 2 % restante fue realizado en tercer día de desarrollo embrionario en transferencia en fresco. En estos 6 años de estudio, el 14 % de las transferencias fueron con embriones en fresco, mientras que el 86 % restante fue en ciclo diferido o TEC. Cabe destacar que todos los ciclos en los que se congelaron embriones, fuera o no en casos de PGT, se realizaron en estadio blastocisto.
De los ciclos con PGT-A (71,4 %) se transfirieron 110 pacientes, consiguiendo 60 % de embarazo clínico y 42,7 % de nacidos vivos, a diferencia de cuando se realizó la TEC sin PGT-A, en el que la tasa de embarazo clínico fue 38,6 % y de nacido vivo 18,2 %. Como era de esperar, la tasa de aborto fue más alta en quienes no se realizó PGT-A (Figura 9). Es importante resaltar que el promedio de embriones transferidos fue 1,16 (IC 95%, 1,10 a 1,22).
Conclusiones
El 34 % de los procedimientos de FIV-ICSI son en mujeres de ≥ 40 años (pacientes con menos óvulos y mayor porcentaje de embriones aneuploides, tasa más alta de abortos) a diferencia del informe SART (E.E. U.U.) 26 %. Por lo tanto, este capitulo es muy importante para centrar-nos más en el contexto de nuestra realidad. La tendencia observada con el tiempo, y debido a los resultados demostrados, lo ideal es transferir blastocistos no embriones en desarrollo, realizar PGT para así poder seleccionar el embrión euploide y disminuir el porcentaje de abortos.
Las tasas de éxito en mujeres ≥ 40 años son bajas: la TRN por transferencia es de 18,2 % sin PGT y 42,7 % con PGT; las tasas mejoran si tienen más óvulos y más blastocistos. Por tal motivo, recomendamos acumulación de óvulos o embriones a través de múltiples procedimientos.
El objetivo ideal es transferir un solo embrión para así evitar un embarazo múltiple que conlleva con frecuencia complicaciones obstétricas, más en pacientes ≥ 40 años, las cuales simplemente por edad presentan embarazo de alto riesgo.
Es importante, difundir los resultados para el asesoramiento de nuestra población, difundir e incentivar la congelación de óvulos antes de los 36 años, para tener mayor número de óvulos y mejores resultados.











 text in
text in