INTRODUCCIÓN
En 1973, Torrent-Guasp 1,2 consideró al miocardio como una banda muscular cardíaca, demostrando mediante disecciones que está constituido por un conjunto de fibras musculares retorcidas sobre sí mismas que asemejan una cuerda, aplanada lateralmente, que al dar dos vueltas en espiral define un helicoide que delimita la arquitectura básica de los dos ventrículos. Además, que la contracción secuencial iniciada desde el límite del asa basal en la base de la arteria pulmonar hasta la porción ascendente del asa apical que alcanza la aorta garantiza la función cardiaca como bomba aspirante, impelente, descrita siglos atrás por Erasistrato de Alejandría (400 a. C.).
La arquitectura que sirve de base a la propuesta de Torrent-Guasp, independiente de la disposición tridimensional de los cardiomiocitos considerados de manera individual, divide al miocardio en dos asas que forman la base (asa basal) y el vértice del corazón (asa apical). Ambos bucles están separados por un pliegue central de 180° que determina direcciones helicoidales macroscópicamente identificables (espirales dentro de espirales), recordando el principio de autosimilitud y dimensión fractal descrito por Mandelbrot 3). Su estructura tridimensional global asemeja una superficie geométrica no orientable de triple torsión, a modo de una cinta de Moebius 1,4,5).
Los hallazgos y propuestas de Torrent-Guasp fueron confirmadas en el corazón fetal por nosotros 6), logrando desplegar la banda helicoidal en sus dos componentes, basal y apical, siguiendo la disección estandarizada también continuada por Antúnez-Montes 4). Cada uno de estos componentes tiene dos segmentos: la basal -con segmentos anterior y posterior- que nace en la raíz de la arteria pulmonar y el asa apical con segmentos descendentes y ascendentes hacia la aorta, en una disposición tridimensional 3,6-10).
MacIver DH y col. 11 señalan que la banda no existe como una entidad anatómica con bordes definidos, y concluyen que la discusión sobre la existencia de una banda miocárdica única de doble hélice debe llegar a su fin. Otros autores que cuestionan su existencia son Anderson y col. (12). Las técnicas de resonancia (RMN) mediante tensor de difusión de imágenes 9 han venido aportando evidencias acerca de los hallazgos de Torrent-Guasp e, independientemente de los planos de los cardiomiocitos en sistema multiplanar, estos se disponen sobre una arquitectura helicoidal de doble hélice.
Para entender cómo el miocardio pueda cumplir la misión que requiere una significativa fuerza energética, la pregunta que surge es, ¿A cuál punto de apoyo recurre para ejecutar su función contráctil? En ese sentido resulta fundamental citar a Trainini y col. 13,14): ‘La reflexión inevitable que surge es que, para efectuar la torsión, el miocardio debería realizarlo sobre un punto de apoyo, al igual que un músculo esquelético lo hace en una inserción firme’. Consideración seguida de dos preguntas: ¿Existe en el corazón humano esta estructura? Si es real este apoyo, ¿cómo se insertan las fibras del músculo cardíaco en dicha estructura?
La literatura veterinaria 15-19 refiere la existencia de una formación denominada os cordis en bóvidos, ovejas y chimpancés, ubicándose dicha estructura en el mismo sitio en el que Trainini y col. 20 la han hallado tanto en bóvidos como humanos. Nunca se le asignó a su presencia ninguna función ni significado. Asimismo, se carece de descripción y función en el ser humano, a no ser la aportada por Trainini y col. 13,14,21-23). Estos autores concluyen que dicha estructura, a la que denominan fulcro o palanca miocárdica, ‘constituye el punto de apoyo donde se insertan fibras del asa cardiaca miocárdica descrita por Torrent-Guasp’ y está localizado en un plano en continuidad con la aorta, debajo y por delante de ella, pero independiente a los trígonos. Su ubicación es equidistante a estos. Es una estructura de características ósea, cartilaginosa y tendinosa, y de allí que su denominación como os cordis u ossa cordis debe ser sustituida por la de fulcro o palanca miocárdica.
OBJETIVOS
En esta investigación se desea demostrar y describir a través de disecciones la existencia del fulcro en corazones fetales. Asimismo, lograr que los participantes expertos en ecocardiografía fetal demuestren ecográficamente la visibilidad del fulcro, así como la técnica y ventanas para su óptima visualización y medición, de manera de registrar sus dimensiones según la edad gestacional. También, registrar su cinetismo durante el ciclo cardíaco, empleando técnicas como la ecografía 2D, modo TM, Doppler color, espectral, tridimensión con software STIC, HD Flow y la técnica del moteado (speckle-tracking). Finalmente, presentar una hipótesis acerca de su mecánica durante la sincronizada torsión y detorsión ventricular en el ciclo cardiaco.
MATERIAL Y MÉTODOS
Se realizó una investigación observacional, prospectiva y longitudinal en la que se estudiaron 6 corazones provenientes de fetos con edades comprendidas entre las 20 y 24 semanas de edad gestacional, productos de abortos espontáneos. Se procedió, por parte del autor principal, a la fijación y disección minuciosa y progresiva de los especímenes, logrando mediante disección dirigida en diferentes planos visualizar el fulcro y sus conexiones con segmentos de ambas asas, basal y apical. Posteriormente, las imágenes de las disecciones se remitieron a los colaboradores, quienes siguiendo los hallazgos anatómicos realizaron una búsqueda dirigida hacia el fulcro, con lo cual se describió la técnica ecocardiográfica para su visualización, su forma, cinetismo y dimensiones de acuerdo a la edad gestacional. Para cumplir con estos objetivos, se estudiaron 50 pacientes con embarazos normales, desde las 18 hasta las 37 semanas de gestación, empleando US2D, modo TM, y tridimensional con software STIC, HD Flow y técnica de strain y speckle-tracking.
RESULTADOS
En todos los especímenes de corazón fetal disecados se pudo constatar macroscópicamente la ubicación del fulcro. La disección del miocardio logró descubrirlo por debajo y delante de la raíz de la aorta, en un plano inferior al trígono derecho, implantado como una estructura complementaria entre los elementos de la unión atrioventricular, sin continuidad con la válvula aórtica. Se presentan imágenes anatómicas en las figuras 1 y 2.
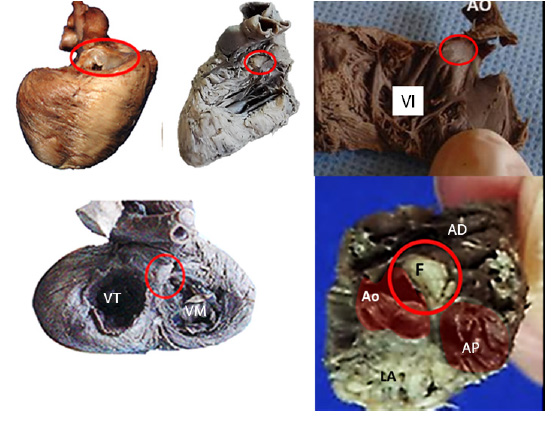
Figura 1 Piezas anatómicas que muestran el fulcro (F) en el interior del círculo rojo. Arteria pulmonar (AP) y aorta (Ao), los anillos valvulares de tricúspide (VT) y mitral (VM), atrio derecho (AD) y ventrículo izquierdo (VI).
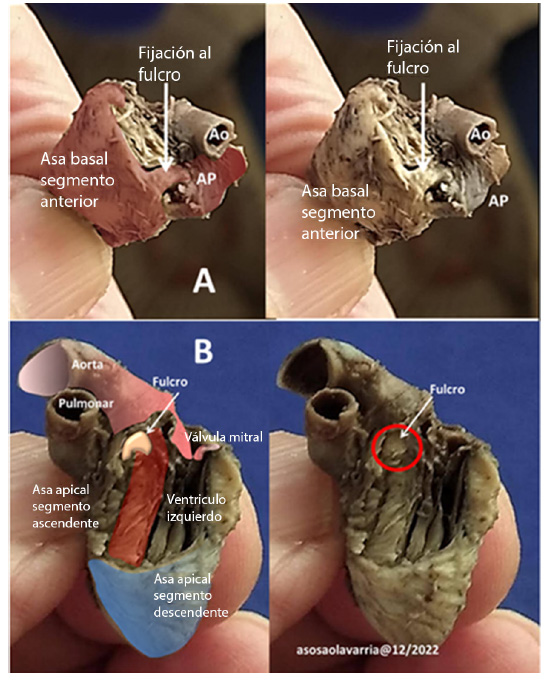
Figura 2 En A: Disección orientada a demostrar la fijación de fibras del asa basal (segmento anterior) al extremo derecho del fulcro. B: Disección orientada a demostrar la fijación de fibras del asa apical (segmento ascendente) al extremo inferior del fulcro (dentro del círculo rojo).
Ecográficamente, se demostró la presencia del fulcro, partiendo del plano tetracameral y ubicando el tracto de salida del ventrículo izquierdo (eje largo de aorta), adyacente a la pared derecha del tronco arterial, por debajo de su válvula. También se logró visualizarlo en el eje corto de grandes vasos por debajo y a la derecha del anillo de la aorta. Su forma varía de acuerdo con el plano de sección, entre redondeada, rectangular o triangular. Y en el plano atrio-ventricular, en exploración con el modo M se observó su onda de desplazamiento vertical. El plano que muestra su forma triangular fue el utilizado para obtener los diámetros mayor y menor (figura 3 A y B). Las inserciones de fibras miocárdicas sobre el fulcro (figura 2) se detectaron en imágenes ecográficas. Las del asa basal parten (en su segmento derecho) hacia el borde anterior y extremo derecho del fulcro; las insertadas en la pared posterior de este provienen de las fibras del segmento endocárdico descendente y, finalmente, fibras del segmento ascendente de la lazada apical o apexiana se insertan en su extremo izquierdo (figura 3 B y C).
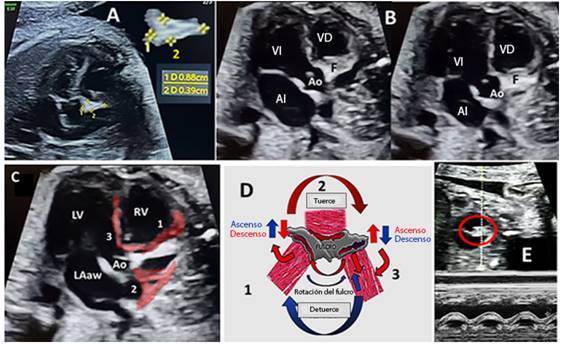
Figura 3 (A, B, C, D, E). Imagen US 2D de corazón fetal donde se muestran cámaras cardiacas la aorta (Ao) y el fulcro (F). Ecográficamente se distingue partiendo del plano tetracameral (A) y ubicando el tracto de salida del ventrículo izquierdo (VI), eje largo de la arteria aorta (Ao), (B) adyacente a la pared derecha del tronco arterial, por debajo de su válvula, pero es también visualizado en el eje corto de grandes vasos por debajo y a la derecha del anillo de la aorta. El primero de los planos descritos resulta el óptimo de su forma triangular para su medida en diámetro mayor y menor. En C, imagen donde se destacan (rojo) las fibras que se insertan en el fulcro (1, 2 y 3). En D, esquema que muestra los movimientos del fulcro, y en E, registro en TM de dicha estructura con desplazamiento en dos direcciones.
La relación del fulcro con la arteria coronaria derecha se muestra en la figura 4. El desplazamiento registrado con modo TM se muestra en la figura 3E. Su dinámica rotacional en el plano de 2D se determinó mediante STIC 3D y 4D HDL Flow, y moteado (speckle-tracking) (figura 5).
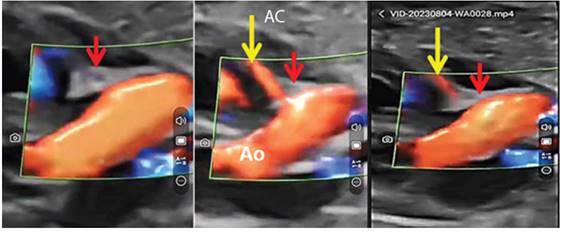
Figura 4 Imágenes Doppler color que muestran la aorta (Ao), el fulcro (flechas rojas) y arteria coronaria (AC) derecha (flecha amarilla).
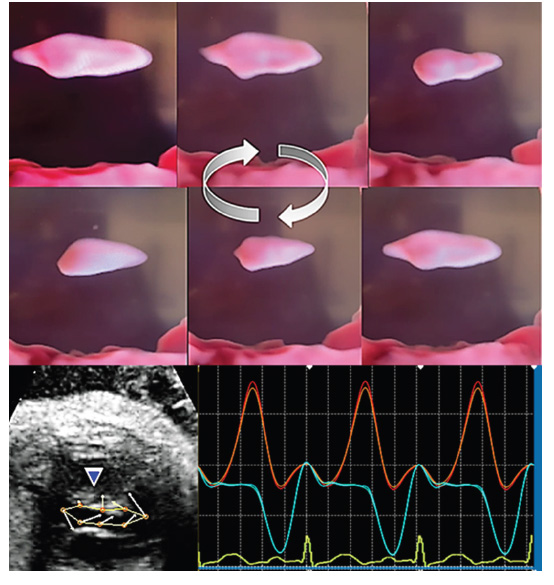
Figura 5 Imágenes en 3D con software STIC, HD Flow (tope) que muestra el fulcro en diferentes posicionas obtenidas cuadro a cuadro en video y que demuestran movimiento rotacional. En la parte inferior desplazamiento del fulcro registrado mediante speckle-tracking.
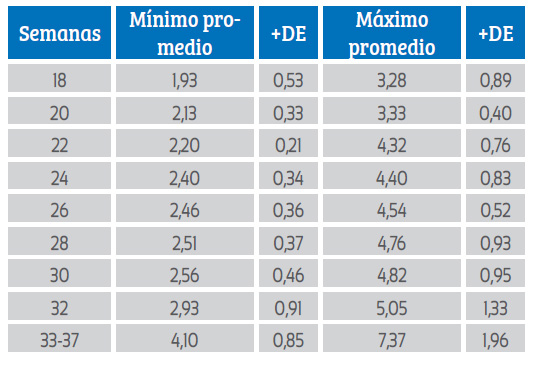
Las medidas obtenidas (máximas y mínimas) desde las 18 semanas de gestación hasta las 37 semanas calculando su promedio y desviación estándar para cada uno se muestran en la tabla 1.
Tabla 1 Fulcro cardíaco fetal. Diámetros (en mm), promedio de valor máximo, mínimo y sus respectivas desviaciones estándar según la edad gestacional en semanas
Se presenta una hipótesis acerca del movimiento mixto del fulcro (figura 3D), en balancín, con desplazamiento longitudinal hacia el ápex con reposición hacia su posición inicial (base); y además su rotación bidireccional siguiendo la contracción secuencial (torsión-detorsión) de la banda miocárdica helicoidal (BMH). La dinámica rotacional del mismo se identificó durante la sístole y diástole empleando método ultrasonográfico (3D) y de moteado (figura 5). Se demostró que el fulcro exhibe inicialmente un giro en dirección de las manecillas del reloj y posteriormente, cuando inicia la contracción del segmento ascendente, el fulcro gira en sentido contrario al de las manecillas del reloj, coincidiendo el final del giro con la apertura de la válvula mitral. Ello permite el llenado rápido del ventrículo izquierdo. Sumado al giro, también hay un desplazamiento longitudinal del fulcro siguiendo el acercamiento de la base al ápex y posteriormente su ascenso a su posición original.
DISCUSIÓN
En el año 2022, Best y col. 15 enumeraron las funciones propuestas del ossa cordis, señalando que las investigaciones en los mamíferos han sugerido dos teorías principales y otras complementarias. En bovinos y camellos se ha propuesto que el músculo cardíaco se ancla en el ossa cordis mejorando la contracción; en bovinos, ovinos y nutrias se ha sugerido que protege al corazón de daños en circunstancias de alto estrés mecánico; y en chimpancés, caballos, gatos y perros, su presencia se ha asociado con enfermedades cardiovasculares.
En los humanos, el fulcro, pequeña estructura ósteo-condroide y tendinosa dentro del corazón, ayuda a anclar la banda miocárdica para ayudar a la contracción. Está ubicado frente a la aorta, justo debajo del trígono derecho, la banda miocárdica inserta parte de sus fibras en este a manera de un tendón músculo-osteoide. El análisis histológico de corazones de animales y de humanos 5,13,16-19,24-26 ha mostrado la presencia de miocitos cardíacos dentro del fulcro. Además, se indica que el motivo de esta inserción en el ossa cordis podría ayudar a estabilizar los corazones durante la contracción y relajación. Y no queda la menor duda a partir de los trabajos de Trainini y col. 25-28) de la existencia de esta estructura en el corazón humano, desde la etapa prenatal, infantil y adultez, que sirve de punto de apoyo para que el corazón pueda torcerse y destorcerse, desplazar y reponer la unión atrio ventricular, alternando así y de manera activa poderosas fuerzas de compresión y succión según el momentum del desplazamiento y la torsión.
Anteriormente, Torrent Guasp junto a Kocica y col. 1,27) habían sugerido la necesidad de un punto de apoyo mecánico en el corazón. Se le llamó ‘hemoesqueleto dinámico’ mediante una explicación física, aplicando los principios de la palanca de primer grado; el volumen de sangre adquirido en los ventrículos como fluido no compresible sería el punto de apoyo. Los mismos autores denominaron a este fenómeno como fulcrum radius, siendo que el apoyo que brinda el miocardio circundante variará según los cambios consecutivos del volumen de sangre intraventricular. De aquí el término ‘dinámico’, concluyendo que, en cuanto mayor es el hemoesqueleto, menor es el efecto palanca y viceversa 1).
En los trabajos de Trainini y col. 13,14,20-23 se completó la investigación con estudios de imágenes histológicas, radiográficas simples, resonancia magnética nuclear y tomografía computada, encontrando en todos los corazones humanos y bovinos estudiados un núcleo subyacente al trígono derecho de estructura histológica ósea-condroide-tendinosa. El análisis microscópico reveló en corazones bovinos una matriz osteocondral trabecular. En todos los corazones humanos se determinó que el fulcro se halla formado por tejido condroide. En esta estructura, no descrita por otros autores, tiene inserción de fibras miocárdicas desde el origen y el final de las asas miocárdicas, y en él se insertan fibras del segmento derecho, del segmento descendente y del ascendente, origen y fin del músculo cardíaco. Su función tiene en común dar sostén al miocardio para poder generar la potencia, fenomenología electrofisiológica que necesita cualquier músculo. Por lo tanto, su presencia es constante en todos los corazones analizados, tanto de bóvidos como humanos, siendo la torsión y la detorsión responsable del mejor llenado y vaciado cardíaco 28-30).
El cinetismo del fulcro que proponemos es el siguiente: cuando ocurre la contracción del asa basal en sus dos segmentos (derecho e izquierdo), el ventrículo derecho (VD) comprime y eyecta su precarga. En este momento, el fulcro en su extremo donde se fijan fibras del segmento anterior del asa basal se desplaza hacia abajo y hacia la pared externa del VD, mientras que el extremo opuesto donde se insertan fibras del segmento ascendente del asa apical se eleva; cuando este segmento se contrae, hace descender el extremo izquierdo y se completa la eyección final en el ventrículo izquierdo (VI); así se cumple el movimiento de balancín. Cuando el corazón se tuerce y se destuerce, el fulcro rota en un sentido y luego se repone. El tercer componente de este movimiento mixto ocurre cuando la unión atrio-ventricular (AV) se desplaza hacia la punta y luego regresa, el fulcro desciende y asciende. Todo este cinetismo ocurre de manera secuencial y sincronizada en función a la duración del ciclo cardíaco, y la actividad atrial es tan solo un complemento de la eficiencia de la bomba 30,31).
La reflexión inevitable que surge es que, para efectuar la torsión, el miocardio debe realizarlo sobre un punto de apoyo, al igual que un músculo esquelético, y lo hace en una inserción firme, el fulcro o palanca mecánica del corazón. Si aceptamos como válidos los argumentos de Torrent-Guasp y los complementamos con los hallazgos de Trainini y col. 13,14,20-23), debemos concluir que se están abriendo nuevos caminos para el entendimiento de una nueva fisiología o electro biomecánica cardíaca que tendrá amplias repercusiones en el manejo de múltiples condiciones que afectan el rendimiento cardiaco 7). Los resultados proporcionados por Torrent-Guasp, los aportes de Trainini y las teorías de llenado y vaciado ventricular perfectamente sincronizados nos han permitido intentar descifrar algunos de los jeroglíficos del Doppler cardíaco fetal 29).
En relación con el origen del tejido del fulcro, hasta ahora la única fuente aceptada de cartílago en el corazón es la cresta neural cardíaca, un ectomesénquima multipotente cuyos derivados celulares cardíacos se limitan principalmente al tabique aorta-pulmonar, las válvulas pulmonar y aórtica en desarrollo y los tejidos circundantes. Sin embargo, informes recientes han revelado que el epicardio embrionario, es decir, la capa de tejido que recubre el músculo cardíaco también contribuye de forma significativa a diversos tejidos conectivos cardíacos. El epicardio se desarrolla a partir del proepicardio, una masa de progenitores celómicos situada en el polo venoso del corazón embrionario. Duran y col. 24 señalan que la presencia de tejido cartilaginoso en los corazones embrionarios y adultos de distintas especies de vertebrados es un hecho bien documentado. Sin embargo, aunque históricamente se ha considerado que la cresta neural embrionaria es la principal fuente de cartílago cardíaco, los resultados publicados recientemente sobre el amplio potencial conectivo de las células del linaje epicárdico sugieren que también podrían diferenciarse en condrocitos. Estos resultados, al igual que los de Palmquist-Gómez y col. 32), son relevantes para la comprensión de la complejidad celular cardíaca y de las respuestas de los tejidos conectivos cardíacos a estímulos patológicos. De hecho, la diferenciación del cartílago se inicia mediante la condensación del tejido mesenquimal conectivo bajo la señalización instructiva proporcionada por factores de crecimiento clave como las BMP y los FGF y la regulación maestra de los factores de transcripción clave Sox9. Este proceso de diferenciación da lugar a la síntesis activa de una matriz extracelular (MEC) característica enriquecida en colágeno II, condroitín sulfato, ácido hialurónico y varios proteoglicanos.
LIMITACIONES
Para la ejecución del presente trabajo no se encontró obstáculo alguno, quedando pendiente evaluar la posible utilidad de la amplitud del movimiento del fulcro en función del rendimiento cardíaco y la presencia de esta estructura en cardiopatías congénitas, incluyendo anomalías estructurales y del ritmo.
CONCLUSIONES
El fulcro cardíaco se encuentra en el punto intermedio de las asas (basal y apical), garantizando un punto de apoyo o pivote para la contracción efectiva del miocardio helicoidal. Al servir como palanca de fibras cardíacas provenientes de las asas experimenta, como consecuencia de la contracción secuencial, desplazamiento de tipo mixto, tiene rotación horaria y antihorario siguiendo la torsión y detorsión, desciende, asciende y se balancea.
La hipótesis derivada de este estudio es que cuando ocurre la despolarización del asa basal en sus dos segmentos, el VD comprime y eyecta su precarga. En este momento el fulcro, en su extremo donde se fijan fibras del asa basal, se desplaza hacia abajo mientras que el extremo opuesto, donde se insertan fibras del segmento ascendente del asa apical, se eleva facilitando la eyección final en el ventrículo izquierdo. Cuando el corazón se tuerce y destuerce, el fulcro gira en un sentido y en otro contrario, hasta que la unión atrio-ventricular se repone.
Tanto el llenado como el vaciado de los ventrículos es producto de un movimiento activo; en la torsión comprime y eyecta, y en ese momento ejerce poderosa fuerza de succión en las aurículas, que entonces se relajan (diástole atrial). En la detorsión ventricular, succiona hacia esta cavidad y comprime a las aurículas. Estas coadyuvan a la adquisición de precarga ventricular mediante la sístole atrial.
En el presente trabajo se confirman esos hallazgos morfológicamente y mediante ultrasonografía, y a través de estos se encuentra una explicación lógica desde el punto de vista físico y fisiológico que enriquece nuestros conocimientos sobre la capacidad del miocardio de cumplir su misión aspirante e impelente.











 text in
text in 



