Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de la Facultad de Medicina Humana
Print version ISSN 1814-5469On-line version ISSN 2308-0531
Rev. Fac. Med. Hum. vol.19 no.3 Lima July/Sep 2019
http://dx.doi.org/10.25176/RFMH.v19i3.2153
CASO CLÍNICO
Miocardiopatía no compactada asociada a defectos cardiacos congénitos. Reporte de caso HNERM-EsSalud
Non compacted miocardiopathy associated with congenital heart defects. Case report HNERM-EsSalud
Ismael Catalán1,a, Marlene Carril2,b, Haylin Looc, María Loo3,d
1 Instituto Nacional de Salud del Niño San Borja, Lima-Perú.
2 Hospital Nacional Edgardo Rebagliati Martins, Lima-Perú.
3 Instituto de Investigación en Ciencias Biomédicas (INICIB), Universidad Ricardo Palma, Lima-Perú.
a Médico asistente.
b Médico asistente unidad de cardiología pediátrica.
c Médico ocupacional.
d Médico Investigador.
RESUMEN
El presente caso corresponde a un paciente de un mes de vida, sexo masculino con diagnóstico de miocardiopatía no compactada asociada a defectos cardiacos congénitos. La miocardiopatía no compactada recién es incluida por la American Heart Association (AHA) como entidad propia a partir de la segunda mitad de la década pasada. El diagnóstico principalmente es ecocardiográfico. La sintomatología en menores de un año puede empezar con falla cardiaca. La evolución es variable con tendencia a la mejoría en algunos casos para finalmente en décadas posteriores se hace más pronunciada la falla cardiaca, eventos tromboembólicos, arritmias malignas y muerte súbita. El manejo esta en medicamentos para falla cardiaca, evitar arritmias malignas y eventos tromboembólicos.
Palabras clave: Miocardiopatía no compactada; Defectos cardiacos congénitos; Falla cardiaca; Ecocardiografía. (fuente: DeCS BIREME)
ABSTRACT
The present case corresponds to a 1-month-old male patient with a diagnosis of non-compacted cardiomyopathy associated with congenital heart defects. Noncompacted cardiomyopathy is newly included by the AHA as its own since the second half of the last decade. The diagnosis is mainly echocardiographic. Symptoms in children under one year may start with heart failure. The evolution is variable and tends to improve in some cases. Finally, in later decades, heart failure, thromboembolic events, malignant arrhythmias and sudden death become more pronounced. The management is in medicines for heart failure, to avoid malignant arrhythmias and thromboembolic events.
Key words: Non-compacted cardiomyopathy; Congenital heart defects; Cardiac failure; Echocardiography. (source: MeSH NLM)
INTRODUCCIÓN
La miocardiopatía no compactada (MCNC), representa una detención en el proceso de compactación miocárdica, caracterizándose por la presencia de múltiples trabeculaciones y de recesos profundos entre trabeculaciones, además de una capa compactada delgada1.
Dicho proceso de compactación ocurre normalmente entre la quinta y octava semana de vida fetal y se caracteriza por la compactación gradual del miocardio, transformación de grandes espacios intertrabeculares en capilares y evolución de la circulación coronaria. Dicho proceso típicamente progresa de epicardio a endocardio y de base a ápex2.
La verdadera incidencia de miocardiopatía no compactada es desconocida como resultado de los criterios diagnósticos y nomenclatura inconsistente3. La prevalencia de miocardiopatía no compactada es 0,01% en adultos y 0,14% en niños4.
La miocardiopatía no compactada se ha identificado como la más frecuente luego de la miocardiopatía dilatada e hipertrófica, representando entre 5-9% de las cardiomiopatías en niños5.
se puede presentar de forma aislada, asociada a cardiopatía congénita, con componente genético y hereditario entre 18 – 50%5.
La ecocardiografía se considera de referencia para el diagnóstico. Chin et al. en los años 90 dio las pautas iniciales6 de una patología poco entendida e incluida en la clasificación de miocardiopatías por la AHA a partir de la segunda mitad de la década pasada7.
El conocimiento de esta patología es importante para planificar el manejo, pronóstico y valorar el estudio familiar, además de valorar patología extracardiaca.
REPORTE DE CASO
Lactante menor previamente sano que un día antes del ingreso de manera brusca presenta pobre lactancia, irritabilidad y dificultad respiratoria, ingresa por emergencia de un Hospital cercano, encontrando frecuencia cardiaca de 280, recibe amiodarona y remite el cuadro. El paciente es trasladado al Hospital Nacional Edgardo Rebagliati Martins (HNERM) para estudio. donde presenta 2 episodios de taquicardia supraventricular (TSV), remitiendo con adenosina, quedando hospitalizado en Unidad de Cuidados Especiales hasta su estabilización hemodinámica. Antecedentes personales: Peso al nacer 3308 g, edad gestacional 38 semanas, lactancia mixta, ganancia ponderal de 29,7 g/d. Antecedentes familiares: Hermanos no antecedentes de cardiopatía. Padre de 38 años sano, madre de 43 años sana. Examen físico: Peso: 4,2 kg, FC: 146, FR: 58, T: 36.6 ºC, PA: 85/65 mmHg, STO2: 98% (FIO2 21%). No dismorfismo, despierto, ventilando espontáneamente, llenado capilar menor de 3 segundos. Ap resp: No rales. Ap cv: Precordio normodinámico, RCRR, SS II/VI BEI, pulsos periféricos palpables, de buena intensidad. Abdomen: Hígado 2,5 cm debajo del reborde costal derecho. Neurológico: Fontanela normotensa, tono y reflejos adecuados.
Pruebas complementarias
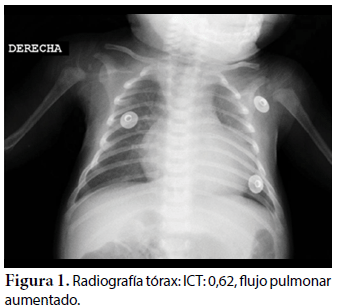
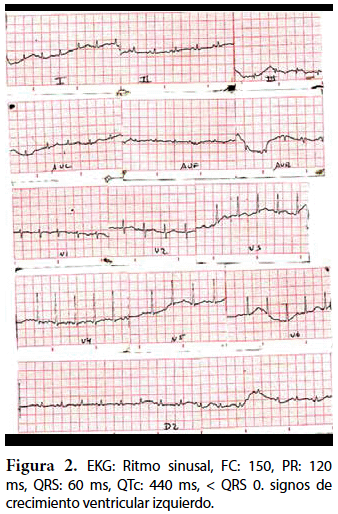
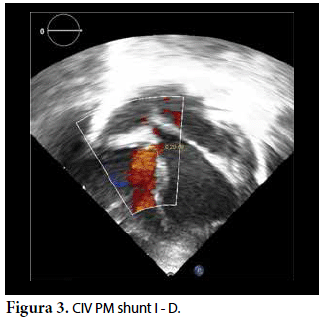
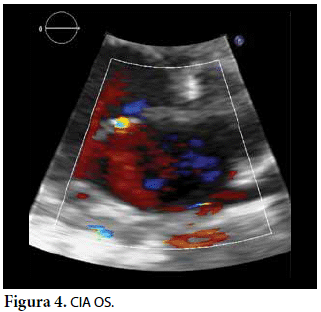
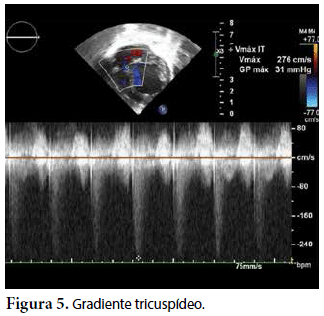
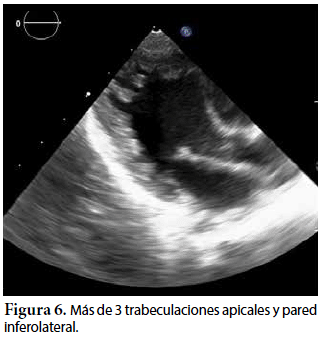
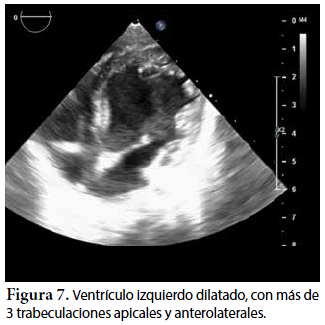
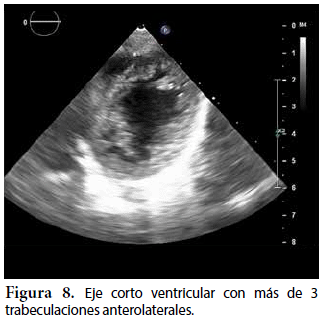
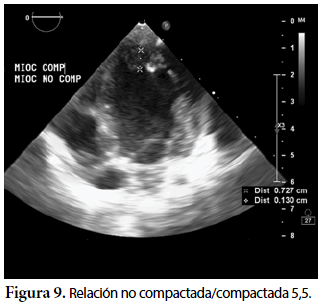
Ecocardiografía: DDVD: 16, DDSIV: 3, DDVI: 28, DSVI: 19 mm (+3DE), DPPVI: 3, R Ao: 11 mm, AI: 13 mm (0,05 DE), FE: 42% ( Simpson), gradiente de regurgitación tricuspídea 31mmHg (figura 5), gradiente V Ao 0,9 m/s (3 mmHg), gradiente VP 1,3 m/s (8mmHg), presión sistólica de arteria pulmonar 36 mmHg anillo mitral: 19,3 mm (+2DE), anillo tricuspídeo: 20,7 mm (+2DE). Situs solitus, Levocardia, 4 venas drenan en AI, suprahepáticas colapsan bien, VCI y VCS drenan AI. Concordancia AV, regurgitación tricuspídea y mitral leve. Concordancia VA, válvulas sigmoideas competentes. Ventrículo izquierdo dilatado, con SIV desplazado a la derecha, más de 3 trabeculaciones a nivel de la punta del VI y pared ínferolateral y anterolateral (figuras 6, 7, 8), con recesos entre las trabeculaciones y entrada de flujo sanguíneo, miocardio no compactado/compactado de 5.5 (figura 9,10). Coronarias normales. Comunicación interventricular de 2 mm shunt de izquierda a derecha (figura 3), comunicación interauricular de 2 mm shunt izquierda a derecha (figura 4), PCA de 1,5 mm.
Laboratorio: Glucosa: 97 mg/dl, urea: 15 mg/dl, creatinina: 0,26 mg/dl, Hb: 12 mg/dl, plaquetas: 346 000, TP: 15, TTP: 49, troponina I: 0,373, CreatininKinasa 192 U/l, CK -MB: 5,47 ng/ml, VSG: 19 mm/h fibrinógeno: 238 mg/dl calcio: 10 mg/dl, fósforo: 5,4 mg/dl, magnesio:2 mEq/l, sodio: 138 mEq/l, K: 5 mEq/l, cloro: 109 mEq/l.
Diagnóstico definitivo
Miocardiopatía no compactada juvenil, asociada a defectos cardiacos congénitos.
Diagnóstico diferencial
-
Miocarditis.
-
Miocardiopatía dilatada.
-
Miocardiopatía secundaria a arritmia cardiaca.
Manejo
Se inició manejo de falla cardiaca con diuréticos, inhibidor ECA, betabloqueador y agente antiagregante plaquetario.
DISCUSIÓN
La miocardiopatía no compactada viene siendo reconocida como entidad separada de las otras miocardiopatías7. A la fecha se cree que es debido a una detención en la embriogénesis normal del corazón, con detención del proceso de compactación8. Conocer la etiología de la enfermedad se encuentra limitada por la heterogeneidad genética, con un limitado entendimiento de la regulación de la trabeculación miocárdica y compactación8.
A la fecha no solo se considera que sería causada por alteración genética, se ha encontrado transmisión familiar en 18 -50% de pacientes adultos, con variabilidad fenotípica a lo largo del tiempo, pudiendo cambiar a cardiomiopatía dilatada o hipertrófica9. También se ha encontrado el desarrollo de hipertrabeculación en pacientes jóvenes deportistas10 y en mujeres gestantes11 con reversión posterior, considerando que esta enfermedad podría ser también adquirida.
Estudios genéticos han demostrado que la deficiencia de la proteína citoplasmática FKBP 12 asociada a los receptores BMP/ activina/ TGFB1 conducen a una deficiente regulación de la trabeculación y compactación del miocardio ventricular8 y conlleva entonces a una hipertrabeculación. A la fecha los genes involucrados en la no compactación son FbKp1a, G4.5/ proteína TAZ, delección cromosoma 14-3-3, proteína ZASP, proteína TNNT2, proteína MYH7, proteína TPM1, proteína MYBPC3, proteína ACTC1, entre otros12.
El caso presentado cumple los criterios ecocardiográficos propuestos por Jenni et al1, Chin el al2 y Stöllberger et all3 y más recientemente lo propuesto por Lai et all3: Apariencia de dos capas de miocardio con capa compacta delgada y capa no compacta gruesa, incremento del número de trabeculaciones pared lateral y ápex VI, trabeculaciones que se mueven sincrónicamente con el miocardio, perfusión de los recesos intertrabeculares y función ventricular anormal.
La edad de presentación es variable, pero con mayor cantidad de diagnósticos en menores de un año y predominantemente de sexo masculino14 como en el caso presentado.
La presentación clínica va desde asintomático15, falla cardiaca, arritmias16, eventos tromboembólicos y muerte súbita. Nuestro paciente se presentó con falla cardiaca más taquicardia supraventricular.
La radiografía de tórax muestra cardiomegalia e hiperflujo pulmonar, no específica de esta patología. El estudio EKG muestra signos de crecimiento ventricular izquierdo, prolongación del segmento QT, datos que también son reportados en la literatura16. La herramienta diagnóstica clave es la ecocardiografía, sin embargo, se debe considerar que ningún parámetro es Gold Estándar ya que sólo valoran parámetros morfológicos. Se consideran las mejores vistas paraesternal eje corto y apical 4 cámaras, pero no se debe dejar de lado las otras vistas. El segmento más comprometido es el ápex ventricular, los otros segmentos varían de acuerdo al estudio17; sin embargo, hay que considerar que mientras más segmentos estén comprometidos existe un peor pronóstico18,19.
La valoración funcional del miocardio no compactado en pacientes asintomáticos se podría hacer valorando el strain longitudinal por la técnica de speckle tracking20,21 y así determinar precozmente disfunción ventricular y tratamiento precoz.
El manejo del paciente con miocardiopatía no compactada asilada o asociada a defectos cardiacos congénitos, como en nuestro paciente, se encamina a manejar la falla cardiaca extrapolado de la miocardiopatía dilatada ya que no existen estudios prospectivos al respecto12, evitar eventos embólicos sistémicos22 y prevención de arritmias malignas. En el paciente reportado se inició manejo de falla cardiaca y uso de antiagregantes plaquetarios.
El pronóstico de estos pacientes es variable, y se ha reportado que dilatación ventricular, función ventricular disminuida, edad menor de un año, dismorfismos, entre otros constituyen pacientes con peor pronóstico23; aunque en otro estudio menciona como factores de peor pronóstico tener fracción de eyección menor de 50 e hipoplasia de la pared posterior del ventrículo izquierdo24. Según las curvas de seguimiento los pacientes pediátricos que inician con falla cardiaca tienden a mejorar en el tiempo, pero al final se manifiesta un deterioro de la función cardiaca progresiva al igual que el adulto, requiriendo incluso trasplante cardiaco25.
La miocardiopatía no compactada es predomiantemente genética con presentación clínica variable, en algunos casos como el paciente asociado a defectos cardiacos congénitos, por lo que requiere consejo genético, diagnóstico genético y screening cardiológico familiar26.
CONCLUSIÓN
La MCNC va en aumento en los últimos años, puede ser aislada o asociada a defectos cardíacos congénitos, el diagnóstico es principalmente por criterios ecocardiográficos; en el niño pequeño, se manifiesta con falla cardíaca. La expresión fenotípica puede cambiar a miocardiopatía dilatada o hipertrófica como variabilidad fenotípica de los genes involucrados.
La carga genética familiar es generalmente autosómica dominante y predomina en el sexo masculino. El manejo es extrapolado de la miocardiopatia dilatada y es manejo de falla cardíaca, prevención de arritmias malignas y de eventos embólicos sistémicos.
Mientras que a menor edad es el diagnóstico, menor función ventricular y menor pared compacta del ventrículoizquierdo peor pronóstico, requiriendo en algunos pacientes trasplante cardíaco.
REFERENCIAS BIBLIOGRÁFICAS
1. Jenni R, Oechslin E, Schneider J, et al. Echocardiographic and pathoanatomicalcharacteristics of isolated left ventricular non-compaction: a step towards classification as a distinct cardiomyopathy. Heart 2001; 86:666–71. [ Links ]
2. Pignatelli R, McMahon J, Dreyer W, et al. Clinical Characterization of Left Ventricular Noncompaction in Children. A Relatively Common Form of Cardiomyopathy. Circulation. 2003; 108:2672-78. [ Links ]
3. Beroukhim RS and KingIn MEE. Other Anomalies of the Ventricular Myocardium. Lai WW, Mertens LL, Cohen MS, Tal Gevaeditores. Echocardiography in Pediatric and Congenital Heart Disease. Second Edition. United Kingdom: John Wiley & Sons Ltd; 2016. p. 719 – 736.
4. Sert A, Aypar E, Aslan E, OdabasD. Isolated right ventricular noncompaction in a newborn. Pediatr Cardiol. 2013;34(8):1896-8. [ Links ]
5. Hoedemaekers Y, Caliskan K, Michels M, et al. The Importance of Genetic Counseling, DNA Diagnostics, and Cardiologic Family Screening in Left Ventricular Noncompaction Cardiomyopathy. Circ Cardiovasc Genet. 2010; 3:232-239. [ Links ]
6. Chin T, Perloff J, Williams R, et al. Isolated Noncompaction of Left Ventricular Myocardium. Circulation 1990; 82:507-13. [ Links ]
7. Maron B, Towbin J, Thiene G, et al. Contemporary Definitions and Classification of the Cardiomyopathies: An American Heart Association Scientific Statement from the Council on Clinical Cardiology, Heart Failure and Transplantation Committee; Quality of Care and Outcomes Research and Functional Genomics and Translational Biology Interdisciplinary Working Groups; and Council on Epidemiology and Prevention. Circulation. 2006; 113:1807-1816. [ Links ]
8. Zhang W, Chen H, Qu X, et al. Molecular mechanism of ventricular trabeculation/compaction and the pathogenesis of the left ventricular noncompaction cardiomyopathy (LVNC). Am J Med Genet C Semin Med Genet. 2013; 163(3): 144–56. [ Links ]
9. Weir-McCall JR, Yeap PM, Papagiorcopulo C, et al. Left Ventricular Noncompaction: Anatomical Phenotype or Distinct Cardiomyopathy? J Am Coll Cardiol. 2016;68(20):2157-65. [ Links ]
10. Gati S, Chandra N, Bennett RL, et al. Increased left ventricular trabeculation in highly trained athletes: do we need more stringent criteria for the diagnosis of left ventricular non-compaction in athletes? Heart. 2013 Mar;99(6):401-8. [ Links ]
11. Gati S, Papadakis M, Papamichael N, et al. Reversible De Novo Left Ventricular Trabeculations in Pregnant Women: Implications for the Diagnosis of Left Ventricular Non-Compaction in Low Risk Populations. Circulation. 2014;130(6):475-83. [ Links ]
12. Bennett C and Freudenberger R. The Current Approach to Diagnosis and Management of Left Ventricular Noncompaction Cardiomyopathy: Review of the Literature. Cardiol Res Pract. 2016; 2016:517- 23.
13. Stöllberger C, Finsterer J, Blazek G. Left ventricular hypertrabeculation/ noncompaction and association with additional cardiac abnormalities and neuromuscular disorders. Am J Cardiol. 2002; 90:899–902. [ Links ]
14. Pignatelli RH, McMahon CJ, Dreyer MJ, et al. Clinical characterization of left ventricular noncompaction in children: a relatively common form of cardiomyopathy. Circulation. 2003; 108:2672-8. [ Links ]
15. Sabaté Rotés A, Huertas-Quinones VM, Betrián P, et al. Miocardiopatía no compactada: características clínicas, evolutivas y pronósticas en edad pediátrica. Resultados de un estudio multicéntrico. An Pediatr (Barc). 2012;77(6):360-365. [ Links ]
16. Miyake CY, MS, Kim JJ. Arrhythmias in Left Ventricular Noncompaction. Am J Cardiol 2009; 104:984–9. [ Links ]
17. Aras D , Tufekcioglu O, Ergun K, et al. Clinical features of isolated ventricular noncompaction in adults long-term clinical course, echocardiographic properties, and predictors of left ventricular failure. J Card Fail. 2006 Dec;12(9):726-33. [ Links ]
18. Punn R1, Silverman NH. Cardiac segmental analysis in left ventricular noncompaction: experience in a pediatric population. J Am SocEchocardiogr. 2010 Jan;23(1):46-53.
19. Punn R, Silverman N. Cardiac Segmental Analysis in Left Ventricular Noncompaction: Experience in a Pediatric Population. J Am SocEchocardiogr2010; 23:46-53. [ Links ]
20. Ari ME, Cetin II, Kocabas A et al. Decreased Deformation in Asymptomatic Children with Isolated Left Ventricular Non-compaction and Normal Ejection Fraction. PediatrCardiol. 2016 Jan;37(1):201-7. [ Links ]
21. Bellavia D, Michelena HI, Martinez M. Speckle myocardial imaging modalities for early detection of myocardial impairment in isolated left ventricular non-compaction. Heart. 2010 Mar;96(6):440-7. [ Links ]
22. Chen K, Williams S, Chan A, et al. Thrombosis and embolism in pediatric cardiomyopathy. Blood Coagulation and Fibrinolysis 2013, 24:221–230. [ Links ]
23. Arunamata A, Punn, Cuneo B. Echocardiographic Diagnosis and Prognosis of Fetal Left Ventricular Noncompaction. J Am SocEchocardiogr 2012; 25:112-20. [ Links ]
24. Wang C, Takasaki A, Watanabe Ozawa S, et al. Long-Term Prognosis of Patients with Left Ventricular Noncompaction. Circ J 2017; 81: 694–700. [ Links ]
25. Zetina-Tun HJ a, Careaga-Reyna G, Galván-Díaz y Sánchez-Uribe M. Trasplante cardiaco: una opción para tratamiento del miocardio no compactado aislado de ventrículo izquierdo. Primer caso en México. Cir Cir. 2016 Oct 20. pii: S0009-7411(16)30071-8.
26. Hoedemaekers YM, Caliskan K, Michels M, et al. The importance of genetic counseling, DNA diagnostics, and cardiologic family screening in left ventricular noncompaction cardiomyopathy. Circ Cardiovasc Genet. 2010 Jun;3(3):232-9. [ Links ]
Contribuciones de autoría: Los autores participaron en la generación, recolección de información, redacción y versión final del artículo original.
Financiamiento: Autofinanciado.
Conflicto de interés: Los autores declaran no tener conflictos de interés en la publicación de este artículo.
Correspondencia:
María Elena Loo Valverde.
Dirección: Unidad de Cardiología Pediátrica, Hospital Rebagliati Seguro Social, EsSalud.
Av Edgardo Rebagliati 490, Jesús María Lima-Perú.
Teléfono: +2654901
Correo: maryloovalverde@gmail.com
Recibido: 02 de abril 2019
Aprobado: 20 de mayo 2019














