INTRODUCCIÓN
Más de 3 millones de personas murieron de Enfermedad Pulmonar Obstructiva Crónica (EPOC) en 2012, lo que representa el 6% de todas las muertes en todo el mundo1-2. En Brasil, la EPOC se considera la cuarta causa de muerte, afecta a más de 6 millones de personas y victimiza a aproximadamente 30 000 personas por año3. Los datos indican que 2/3 de todas las autopsias en hombres y 1/7 en mujeres muestran signos de enfisema pulmonar4. El estudio PLATINO, realizado en cinco regiones metropolitanas de América Latina, mostró que la prevalencia de EPOC en la población mayor de 40 años en São Paulo fue de 15.8%5.
La limitación crónica del flujo aéreo, característica de la EPOC, está causada predominantemente por una asociación de enfermedades de las vías respiratorias pequeñas (bronquiolitis obstructiva) y la destrucción del parénquima pulmonar (enfisema pulmonar), que promueve una afección de hiperinflación pulmonar6.
Ante la exposición crónica a patógenos, incluido el humo del cigarrillo, se produce una inflamación crónica en el parénquima pulmonar, lo que provoca un desequilibrio entre las enzimas proteolíticas y antiprotolíticas7. Por lo tanto, cualquier factor que aumente la producción o actividad de las proteasas, especialmente las elastasas, y/o reduzca o incluso inhiba las anti-elastasas, promueve la destrucción de la estructura elástica pulmonar. La anti-elastasa más importante es la alfa-1-antitripsina, y la principal fuente de elastasa son los neutrófilos, que se elevan junto a los macrófagos, linfocitos T y eosinófilos en los fumadores8. La alfa-1-antitripsina, que actúa para defender el tejido pulmonar contra las elastasas, está inactiva debido a la acción de las sustancias oxidantes liberadas por el humo del cigarrillo9. Por lo tanto, el enfisema pulmonar es el resultado del efecto elastolítico destructivo en fumadores con baja actividad anti-elastasa. Como la elastasa se expresa casi exclusivamente por los neutrófilos, los fumadores tienen más neutrófilos en su lavado bronco alveolar (BAL) que los no fumadores, por lo que los neutrófilos se consideran los mayores culpables de causar enfisema pulmonar7.
A partir de estos datos, es probable que exista una respuesta inflamatoria compleja en el pulmón enfisematoso. No se sabe exactamente cómo los diversos tipos de células inflamatorias contribuyen a la destrucción de las paredes alveolares, pero la especulación razonable es que los neutrófilos, macrófagos y eosinófilos degradan directamente la matriz extracelular alveolar mediante la liberación de proteinasas, mientras que los linfocitos T influyen en el reclutamiento celular. Proteínas inflamatorias que liberan proteinasas10.
En la EPOC, el diafragma actúa contra el aumento de las cargas mecánicas debido a la limitación del flujo de aire y los cambios en la conformación del tórax debido a la condición de hiperinflación pulmonar. Se sugiere que esta sobrecarga mecánica impuesta en el diafragma simula el entrenamiento de resistencia11. La fuerza y la resistencia caracterizan el rendimiento muscular del diafragma. Por lo tanto, la pérdida de estas características da como resultado debilidad muscular diafragmática y, en consecuencia, su peor rendimiento mecánico12. La literatura ha demostrado sistemáticamente que las personas con EPOC grave generan menos presión inspiratoria máxima y presión transdiafragmática en maniobras voluntarias en comparación con las personas sin la enfermedad13,14. Por lo tanto, la fuerza muscular se considera un factor limitante en el desempeño del diafragma en pacientes con EPOC. Los músculos escaleno y esternocleidomastoideo (ECOM) son músculos inspiratorios con acciones similares en la pared torácica, que generan un desplazamiento craneal del esternón y las costillas. Sin embargo, estos músculos tienen diferentes patrones de actividad. Los escalenos son músculos inspiratorios activados en cada ciclo ventilatorio, incluso durante el reposo, mientras que los ECOM son músculos accesorios de inspiración y no se contraen durante la respiración basal, sino que lo hacen solo después de alcanzar aproximadamente el 70% de la capacidad inspiratoria15.
A partir de estos datos, el presente estudio tuvo como objetivo evaluar los cambios histopatológicos presentes en los pulmones y los músculos respiratorios (diafragma y ECOM) de los cadáveres afectados por la EPOC.
MÉTODOS
Diseño del estudio
Este es un estudio descriptivo con hallazgos de imágenes de biopsia histológica utilizando una muestra no probabilística. La recolección de muestras se realizó en el Servicio de Verificación de la Muerte (SVO) de la Universidad Estatal de Ciencias de la Salud de Alagoas (UNCISAL), de abril a septiembre de 2012. El Comité de Ética de UNCISAL (CEP) aprobó el Protocolo 1796/2011 y los responsables legales de los cadáveres autopsiados fueron informados de los procedimientos y firmaron el formulario de consentimiento informado (CF) adjunto al protocolo general de admisión al SVO. Inicialmente, la información sobre el cadáver se recopiló del formulario de obituario de SVO, completada por el tutor legal, en la que se consideraron el género, la edad, la raza, la profesión, el origen y la presencia de antecedentes de tabaquismo, considerados los principales criterios de inclusión en el estudio.
Treinta y seis (36) cadáveres con diagnóstico histopatológico de EPOC confirmado por la presencia de antracosis pulmonar, engrosamiento septal y bullas enfisematosas se incluyeron en el estudio. Se excluyeron del estudio los cadáveres sin lóbulo o pulmón resultantes de cirugía ablativa o malformación congénita, con una presencia significativa de adherencias pleurales que sufrieron lesiones parenquimatosas por el procedimiento de necropsia y cadáveres con comorbilidades como enfermedad neuromuscular y malformación ósea estructural de la caja torácica. Así, se excluyeron del estudio ocho cadáveres, tres porque no presentaron los hallazgos histopatológicos esperados para la EPOC; cuatro por presentar adherencias pleurales intensas y uno por ser diagnosticado con enfermedad neuromuscular (enfermedad de Parkinson).
Biopsias pulmonares y musculares
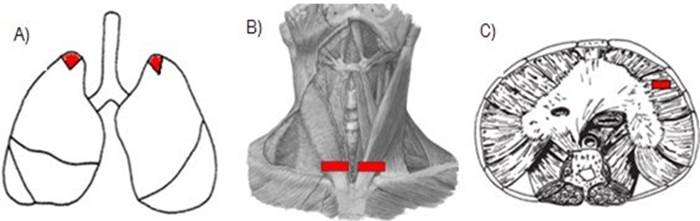
El material para el análisis se recolectó mediante el procedimiento de necropsia estándar, que realizó una sección longitudinal desde la región de manubrio hasta la cicatriz umbilical para acceder a las estructuras torácicas y abdominales de las cuales se recolectaron muestras bilaterales de los ápices pulmonares (Figura 1.A). Las secciones de ECOM se realizaron bilateralmente en el lado ventral cerca de su inserción en el manubrio del esternón (Figura 1. B). Mientras que el músculo del diafragma se seccionó en su región lateral-costal derecha (Figura 1. C).
Procesamiento histológico
Se obtuvieron 5 fragmentos de tejido de cada cadáver para hacer un total de 288 láminas histológicas, lo que permitió la identificación y localización de cambios histopatológicos, por medio de dos tinciones diferentes. Para la visualización histológica, los tejidos se fijaron con formaldehído diluido al 10%, se deshidrataron con diferentes concentraciones de etanol, se clarificaron con xilol y se incluyeron en parafina. Luego, el material de parafina se cortó a 5 μm en espesor de micrótomo y las secciones desparafinadas se rehidrataron y se sometieron a tinción con hematoxilina-eosina (HE) para la tinción estructural de todos los tejidos evaluados y la tinción tricrómica de Masson para fibrosis en tejidos musculares. Por lo tanto, fue necesario elaborar dos lâminas histológicas para cada tejido muscular, usando para una muestra la coloración por el método HE y el otro por el tricrómico de Masson. El parénquima pulmonar se evaluó solo mediante tinción con HE. Las láminas histológicas se analizaron mediante microscopía óptica convencional y el diagnóstico histopatológico de las biopsias fue realizado por un patólogo de SVO, que desconocía los objetivos del estudio.
RESULTADOS
El perfil sociodemográfico de los cadáveres mostró que predominaban el género masculino (63,9%, n=23), la raza mulata (66,7%, n=24), la profesión relacionada con el área urbana (77,8%, n=28), la residencia en la capital (61,1%, n=22) y la causa de muerte relacionada con enfermedades cardiopulmonares (80,6%, n=29,Tabla 1). El tiempo medio de tabaquismo de la muestra fue 31,3 ± 19,6 años.
TABLA 1. Perfil sociodemográfico de la muestra biopsiada de cadáveres con EPOC.
| Biopsias (n=36) | |
|---|---|
| Genero | |
| Femenino | 36,1% (13) |
| Masculino | 63,9% (23) |
| Grupo de edad (años) | 67,2 ± 17,4 |
| Raza | |
| Branco | 30,5% (11) |
| Mulato | 66,7% (24) |
| Negro | 2,8% (1) |
| Profesión | |
| Zona Rural | 22,2% (8) |
| Zona Urbana | 77,8% (28) |
| Procedencia | |
| Capital | 61,1% (22) |
| Interior | 38,9% (14) |
| Tiempo de tabaquismo (años) | 31,3 ± 19,6 |
| Causa de muerte | |
| Enfermedades Cardiopulmonares | 80,6% (29) |
| Otras enfermedades | 19,4% (7) |
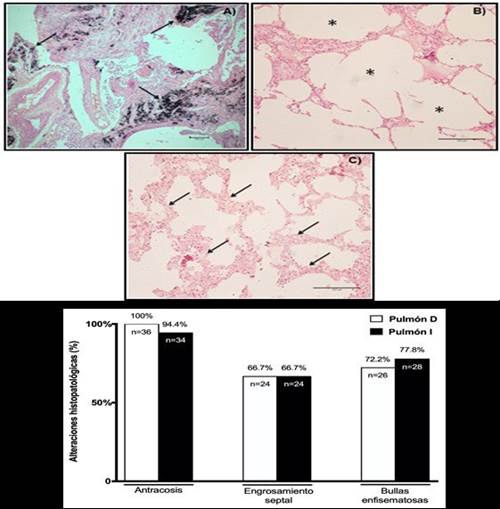
Figura 2.Visualización al microscopio de las biopsias de pulmón y las alteraciones histopatológicas. Imágenes de cortes histológicos de tejido pulmonar teñido con hematoxilina-eosina (HE) en cadáveres con EPOC. A) Antracosis pulmonar (aumento 4x). B) Burbujas enfisematosas. (10x aumentos). C) Engrosamiento septal (aumento 10x). D) Gráfico representativo de los resultados de las biopsias de pulmón derecho (Pulmón D) y izquierdo (Pulmón I) en cadáveres con EPOC.
Con respecto a las biopsias de diafragma, los hallazgos más relevantes fueron la presencia de tejido adiposo interpuesto (33,3%, n=12) y atrofia muscular (25%, n=9), y en menor medida, el distanciamiento de las fibras musculares (19,4%, n=7) y la instalación de fibrosis (2,8%, n=1). Los resultados de las biopsias de diafragma se pueden ver en laFigura 3. A, B, C, D y E, respectivamente.
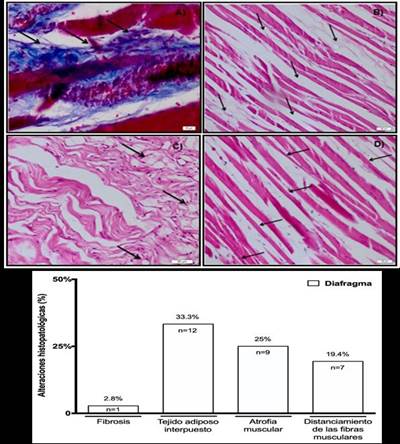
Figura 3.Visualización al microscopio de las biopsias de músculo de diafragma y las alteraciones histopatológicas. Imágenes de cortes histológicos de músculo de diafragma teñidos con la técnica tricrómica de Masson en cadáveres con EPOC: A) Fibrosis muscular (aumento de 40x). Imágenes de láminas histológicas de diafragma teñidas con técnica hematoxilina-eosina (HE) en cadáveres con EPOC: B) Atrofia muscular (aumento 10x). C) Tejido adiposo interpuesto (aumento 20x). D) Fibras separadas (aumento 20x). E) Gráfico representativo de los resultados de las biopsias de músculo de diafragma en cadáveres con EPOC.
Las biopsias de ECOM mostraron resultados que convergieron en el distanciamiento de las fibras (ECOM D: 19,4%, n=7; ECOM I: 16,7%, n=6) y la hipertrofia muscular (ECOM D: 13,9%, n=5; ECOM I: 11,1%, n=4), y en menor medida, atrofia muscular (ECOM D y I: 11,1%, n=4), tejido adiposo interpuesto (ECOM D: 5,6%, n=2; ECOM I: 8,3%, n=3) y engrosamiento del tendón (ECOM D y I: 5,6%, n=2). Los resultados de las biopsias de ECOM se pueden ver en laFigura 4. A, B, C, D y E, respectivamente.
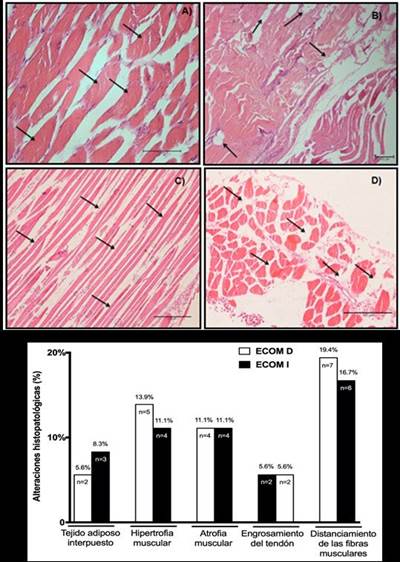
Figura 4.Visualización al microscopio de las biopsias de los músculos esternocleidomastoideos (ECOM) y las alteraciones histopatológicas. Imágenes de cortes histológicos de los músculos esternocleidomastoideos (ECOM) teñidas con la técnica hematoxilina-eosina (HE) en cadáveres con EPOC: A) Hipertrofia de la fibra (aumento 20x). B) Tejido graso interpuesto entre las miofibrillas (aumento 4x). C) Atrofia muscular (aumento 10x). D) Fibras alejadas del ECOM (aumento 10x). E) Gráfico representativo de los resultados de las biopsias entre los músculos esternocleidomastoideos derecho (ECOM D) e izquierdo (ECOM I) en cadáveres con EPOC.
DISCUSIÓN
La antracosis es una lesión caracterizada por la acumulación de polvo de carbón en los pulmones y, con la consiguiente reacción del tejido a su presencia. De todos los factores exógenos que causan problemas al cuerpo, el más frecuente es el carbón presente como principal contaminante del aire atmosférico. El carbón se inhala como partículas lo suficientemente pequeñas para alcanzar los alvéolos y es fagocitado por macrófagos que pueden devolver su carga de carbón al tejido pulmonar intersticial donde entran a los pulmones. para ser depositados preferentemente en los ganglios linfáticos hiliares y mediastínicos16.
Por lo tanto, los individuos los fumadores exhiben una pigmentación pulmonar ennegrecida que, cuando se observa debajo de la pleura, está dispuesta en líneas que rodean la periferia de los lóbulos pulmonares. La evidencia de antracosis por contaminación no parece ser un factor predisponente para ninguna enfermedad pulmonar. Sin embargo, cuando se asocia con fumar, agrava los efectos dañinos en los pulmones, este hecho se ha demostrado en estudios realizados con mineros del carbón, y se observó que entre los mineros solo los fumadores desarrollaron alteraciones pulmonares suficientes para producir síntomas17.
Las ampollas enfisematosas se producen debido a la disminución irreversible en la cantidad de fibras elásticas de los septos alveolares debido a la reducción de la renovación del tejido elástico y su síntesis cualitativamente defectuosa que corresponde a una alteración subpleural o intraparenquimatosa de más de 1 cm de diámetro y se encuentran rodeados por una pared fibrosa que consiste en pleura visceral, restos de septo alveolar, vasos sanguíneos y antracosis, y su interior está lleno de aire18. Además, histológicamente, el engrosamiento septal se explica en la mayoría de los casos por un intenso proceso inflamatorio que tiende a cicatrizar, así como por la exacerbación de la reticulina y las fibras de colágeno en los tabiques alveolares19.
La hiperinflación pulmonar representa uno de los factores críticos capaces de alterar la función de los músculos respiratorios, especialmente cuando induce un acortamiento del diafragma, lo coloca en una posición subóptima, reduce su relación entre la longitud y la tensión y genera su desventaja mecánica, obsrvada en nuestro estudio. Además, las fibras diafragmáticas pueden alterar su disposición mecánica llevando a una capacidad reducida para generar fuerza11. Por lo tanto, si no hubiera adaptaciones en la longitud del músculo a la hiperinflación crónica, el diafragma permanecería en un estado acortado durante la respiración y su capacidad para contribuir a la presión inspiratoria se reduciría20.
En el presente estudio, se evidenció que la mayoría de los individuos presentaban cambios estructurales en el diafragma, en los cuales la atrofia muscular era el hallazgo histopatológico más frecuente. La atrofia del diafragma se puede justificar por el aumento de la tasa de proteólisis que se produce en las proteínas musculares dañadas o alteradas. Algunos autores han señalado la posibilidad de que el diafragma y otros músculos respiratorios tengan grados significativamente altos de lesión muscular debido a la apoptosis mionuclear y/o al estrés oxidativo debido a la sobrecarga19.
La degradación de proteínas dañadas o proteínas objetivo que conducen al proceso de atrofia y acortamiento de la fibra muscular se considera uno de los primeros pasos para el proceso de ubiquitinación a través de la proteasoma. Los datos bibliográficos indican que hay un aumento de la actividad de la proteasoma, indicado por la activación de la vía de la ubiquitina-proteasoma, en el diafragma de los pacientes con EPOC12. Por lo tanto, estos datos sugieren que el daño permanente a las fibras del diafragma puede estar relacionado con sobrecargas inspiratorias y/o cambios en la conformación torácica, lo que contribuye al proceso de remodelación muscular.
La presencia de tejido adiposo interpuesto se encontró en una gran cantidad de biopsias de músculos con diafragma reportado por nuestro estudio lo cual se haya avalado por Conte et al21que señalan que el envejecimiento del músculo estriado esquelético es un fenómeno complejo, que consiste en varias alteraciones fisiológicas y morfológicas, como la sustitución de las fibras musculares por tejido adiposo y fibrótico, así como una disminución en la síntesis de proteínas, lo que provoca una reducción de la fuerza y la eficiencia muscular21. Otro factor predisponente para la interposición del tejido adiposo es la presencia de atrofia muscular que se encuentra en los músculos lumbares multifidiales en pacientes con dolor de pierna evaluado mediante imágenes de resonancia magnética22.
A partir de esta evidencia, Kader et al. caracterizaron como atrofia muscular leve el reemplazo de menos del 10% de la masa muscular multifidio con tejido adiposo y fibroso; como atrofia muscular moderada la sustitución entre el 10% y el 50%; la atrofia severa es el reemplazo de más del 50% del tejido muscular asociado con la atrofia de otros músculos paravertebrales.
De manera similar, el presente estudio encontró la presencia de atrofia muscular en las biopsias de diafragma, lo que refuerza el hecho de que el tejido muscular puede ser reemplazado por tejido adiposo, confirmado por imágenes histológicas de adipocitos interpuestos entre las miofibrillas. La eliminación de las miofibrillas se puede justificar por la reducción del área de la sección transversal de la fibra diafragmática en la condición de EPOC grave, que puede representar una adaptación estructural beneficiosa, facilitando el transporte de oxígeno y la difusión a través de los capilares en las fibras musculares para satisfacer la demanda metabólica del tejido12. Otro estudio informó que los niveles de ARN mensajero en el diafragma y el factor de crecimiento vascular endotelial aumentan en los pacientes con EPOC, lo que sugiere una condición de angiogénesis mejorada23. De esta manera, el desprendimiento de fibras puede ocurrir como un mecanismo adaptativo del tejido muscular en la distribución de nuevos capilares.
La presencia de fibrosis, tejido cicatricial conectivo compuesto por la acumulación de colágeno en el diafragma, fue otro hallazgo interesante. La sobrecarga mecánica puede tener importantes efectos perjudiciales sobre los músculos respiratorios e inducir lesiones12. Los estudios muestran que los modelos experimentales sometidos a sobrecargas respiratorias altas presentaban lesiones en el diafragma24,25. A la lesión tisular le sigue la activación de células satélite que proliferan y se diferencian en nuevas células musculares que contribuyen al proceso de reparación con la formación de cadenas pesadas de miosina25. Sin embargo, algunos estudios han sugerido que la diferenciación de las células satélite del diafragma en nuevas células musculares se ve afectada en la condición de EPOC14,20.
Por lo tanto, debido al deterioro del mecanismo de reparación, la sustitución del tejido muscular por el colágeno ocurre como un intento de prevenir lesiones adicionales. Las lesiones y la acumulación de colágeno conducen a la pérdida de la capacidad del individuo con EPOC para generar fuerza. La reducción en el volumen de las fibras musculares en funcionamiento puede ser compensada por hipertrofia o aumento de la activación muscular, sin embargo, debido a que el diafragma está en desventaja mecánica, es incapaz de hipertrofia, promoviendo en algunos casos la atrofia de sus fibras19. Un estudio ortopédico ha demostrado que las áreas de sobrecarga muscular pueden llevar a una inflamación del tendón con degeneración y desorganización de las fibrillas de colágeno, una condición asociada con el engrosamiento del tendón26.
Curiosamente, el diafragma de los pacientes con EPOC moderada y grave se consideró tres veces más susceptible a la ruptura de sus sarcómeros cuando se sometió a ventilación frente a cargas inspiratorias adicionales en comparación con los pacientes sin EPOC27. Según estos resultados, los datos de un estudio de cadáveres necropsiados con EPOC grave revelaron que un aumento agudo en la sobrecarga respiratoria crónica induce una lesión diafragmática extensa y acumulación de colágeno19.
Con respecto a las alteraciones tisulares del ECOM encontradas en el presente estudio, se sugiere que el efecto de la hiperinflación pulmonar en los músculos inspiratorios, como el intercostal, el escaleno y el ECOM, conduce a un aumento en el diámetro de la caja torácica, lo que limita la eficiencia biomecánica de estos músculos11. El cambio del tipo de fibra que se produce en direcciones opuestas en el diafragma y otros grupos musculares ha demostrado ser uno de los cambios más frecuentes en los músculos respiratorios de las personas con EPOC. Por lo tanto, mientras que el cambio en el tipo de fibra diafragmática está asociado con la ganancia de fuerza (fibras musculares de tipo I)28,29.
Es importante destacar que también se observó hipertrofia de ECOM en el presente estudio en un gran número de biopsias. Según Hudson y sus colegas, los pacientes con EPOC necesitan un reclutamiento adicional de los músculos accesorios inspiratorios, especialmente los músculos del ECOM, en un intento por mantener las presiones adecuadas de llenado pulmonar, lo que sugiere que la hipertrofia del ECOM es un intento compensatorio para mejorar su capacidad de ejercicio genera fuerza inspiratoria, ya que el diafragma tenía una capacidad reducida y era más resistente a la fatiga29.
Curiosamente, algunas biopsias de ECOM mostraron atrofia muscular, lo que corrobora los datos de la literatura que muestran que el envejecimiento favorece la pérdida de motoneuronas y, en consecuencia, la denervación de la unión neuromuscular. Estos cambios se producen de manera desigual entre los diferentes grupos musculares, afectando preferentemente a las fibras de tipo II que tienden a estar más presentes en el ECOM y causan cierto grado de atrofia muscular30.
Se encontraron limitaciones que impidieron un detallar los cambios histopatológicos encontrados en los nervios frénicos en la condición de EPOC. La primera limitación fue la baja adherencia de los familiares a autorizar el formulario del consentimiento informado (ICF) de los cadáveres para la extracción de tejidos para investigación científica. La técnica histológica utilizada en la investigación fue otro obstáculo, ya que no identificó con precisión los cambios patológicos. Por lo tanto, una técnica alternativa para una mejor visualización e identificación de las estructuras en cuestión sería la microscopía electrónica asociada con un software adecuado para mediciones, que ayudaría a profundizar los pesos relacionados con los resultados de este estudio.
CONCLUSIÓN
Los datos del presente estudio indican que existen cambios histológicos estructurales en el diafragma y en los músculos respiratorios ECOM de los cadáveres afectados por la EPOC, presumiblemente debido a la condición de hiperinflación pulmonar y a los cambios biomecánicos consecuentes en la caja torácica. Sin embargo, se necesitan más estudios para aclarar si tales cambios corresponden a un mecanismo compensatorio para optimizar la ventilación pulmonar o si es una consecuencia de una disfunción sistémica estructural.











 texto em
texto em