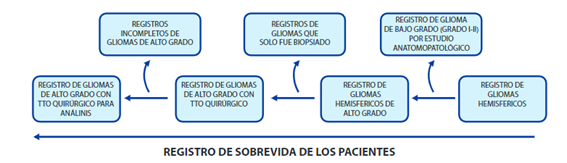
INTRODUCCIÓN
El glioma es un tumor primario del sistema nervioso central y es clasificado en grados I-IV de acuerdo a criterios histopatológicos1, según los criterios de clasificación de la OMS 2007, los grados III-IV son denominados de alto grado2.
El término de "glioma alto grado" se incluyen una serie de nombres de tumores como: glioblastoma multiforme (GBM), astrocitoma anaplásico (AA) y oligodendroglioma anaplásico (OA). El GBM es el tumor más frecuente y corresponde el 80% de los gliomas y el más agresivo, y afectan aproximadamente 2-3 personas de cada 100,000 anualmente3,4.Sin embargo, el pronóstico general de glioma sigue siendo pobre a pesar de los tratamientos agresivos, especialmente en pacientes con glioma de alto grado, cuyo promedio de tiempo de supervivencia después de la cirugía es de sólo 12 a 15 meses para glioblastoma y de 2 a 5 años glioma anaplásico.5-7
El tratamiento de los pacientes con gliomas de alto grado sigue siendo un desafío para la terapia moderna. El pronóstico de estos pacientes es pobre, la mediana de la supervivencia del paciente tras el diagnóstico es de aproximadamente 1 año5,8.La necesidad de un diagnóstico histológico de tejido tumoral en cada caso y la importancia de la descompresión en pacientes sintomáticos están bien establecidos, sin embargo, todavía existe controversia respecto a la extensión de la resección quirúrgica a realizar. Aunque muchos neurocirujanos recomiendan que los gliomas pueden resecar la forma más amplia posible9,10, las revisiones rigurosas de la literatura han puesto de manifiesto que hay poca evidencia científica de que el tratamiento quirúrgico agresivo prolonga significativamente la supervivencia11,12).
El tratamiento estándar de los gliomas de alto grado es el tratamiento multidisciplinario, pero sobretodo el tratamiento es quirúrgico13,14. La resección quirúrgica total es fundamental para aumentar la sobrevida de los pacientes, asociada a quimioterapia y radioterapia adyuvante post-quirúrgica. En el pasado el tratamiento quirúrgico se acompañaba de importantes secuelas que conducían a una baja calidad de vida. Justamente, la máxima resección posible permite un mejor efecto de la radioterapia en el control de la enfermedad aumentando la sobrevida de los pacientes. La quimioterapia es parte del manejo multidisciplinario de los gliomas, observándose una mejora en la sobrevida al asociarse con la radioterapia15,16.
Debido a que los factores de supervivencia en nuestro medio aún no están claros, y el impacto sobre la salud que esta enfermedad puede tener en la población, es necesario conocer un perfil de pacientes con mayor y menor posibilidad de sobrevivir, para una mejor toma de decisiones, basada en la evidencia de nuestro medio.
MÉTODOS
Diseño y área de estudio
Estudio analítico, longitudinal de supervivencia, retrospectivo. Realizado en pacientes postoperados de glioma de alto grado del periodo 2010-2014 en el servicio de neurocirugía del Hospital Nacional Edgardo Rebagliati Martins.
Población y muestra
Población son todos los pacientes operados de glioma, que fueron atendidos en consultorio y emergencia del servicio de neurocirugía del Hospital Nacional Edgardo Rebagliati Martins. Muestra no aleatoria consecutiva. Se recolectó información de las historias clínicas de los pacientes postoperados de glioma de alto grado del periodo 2010-2014.
Criterios de inclusión: 1) Pacientes con edad mayor a 18 al momento del diagnóstico; 2) Pacientes con diagnóstico de glioma de alto grado confirmado por estudio anatomo-patológico; y 3) Pacientes que se les haya realizado algún tipo de tratamiento quirúrgico.
Criterios de exclusión: 1) Pacientes que se les haya realizado más de una intervención quirúrgica; y 2) Pacientes que cuenten con estudio de imágenes incompleto; 3) Pacientes que hayan presentado complicaciones postquirúrgicas inherentes a la técnica operatoria; y 4) Historias clínicas incompletas.
Variables e instrumentos
Variables dependientes
Supervivencia Global (PS): Son los meses de vida desde el momento de la intervención quirúrgica hasta la muerte a causa de la enfermedad. Su expresión final fue en meses. Se midió a través del el método de rangos logarítmicos y el análisis de regresión de riesgos proporcionales de Cox.
Supervivencia libre de progresión (SLP): Son los meses de vida desde el momento de la intervención quirúrgica hasta la reaparición de recidiva tumoral. Su expresión final fue en meses. Se midió a través del el método de rangos logarítmicos y el análisis de regresión de riesgos proporcionales de Cox.
Variables independientes
Grado histológico: Definido por las características microscópicas del tejido tumoral y clasificado según la OMS, definido por el informe anatomo-patológico. En el estudio, se midió en: (1) grado III o (2) IV.
Edad: Es el tiempo de vida del paciente toma desde su nacimiento, el cual ha sido medida en años registrada en su hoja de filiación de su seguro de salud. Se categorizó en tres etapas: (1) 14 - 30 años; (2) 31 - 60 años; y (3) > 60 años.
Sexo: Es el tipo de genero se masculino o femenino registrado en su hoja de filiación de su seguro de salud (cualitativa - nominal).
Convulsiones: Es el movimiento tónico clónico generalizado que forma parte del cuadro sintomático al momento del diagnóstico. Se categorizó en “si” y “no” según lo que registra la historia clínica.
Capacidad de realizar tareas rutinarias: Es la forma cuantificar la capacidad de los pacientes con cáncer de realizar tareas rutinarias y/o cotidianas. Para ello utilizaremos la Escala de Karnofsky (EK). Se categorizó con un punto de corte “≥ 70” y “ < 70” según lo que registra la historia clínica.
Localización del glioma: Es la ubicación de la lesión tumoral en el hemisferio cerebral, visualizado en resonancia magnética cerebral. Se categorizó en: (1) Frontal; (2) Parietal; (3) Occipital; (4) Temporal; (5) Más de 1 área implicada; y (6) Infratentorial.
Diámetro del tumor: Es la medición en centímetros del mayor diámetro (en cualquier dimensión) en las imágenes FLAIR y/o secuencia T2 de resonancia magnética. Se categorizo en (1) ≥ 5 cm y (2) < 5 cm.
Envuelve área elocuente: Es la ubicación del tumor en áreas que dominan las funciones sensitivo- motoras (giro precentral y postcentral), áreas del lenguaje (área temporal superior, área frontal inferior y área parietales inferiores), ganglios basales, área visual (cortex visual calcarino). Se categorizo en “si” cuando comprometió dichas áreas, y en “no” si no las comprometía.
Extensión de la resección quirúrgica: Es el porcentaje de extracción del tumor tomando en cuenta las imágenes prequirgicas y postquirúrgicas. Se categorizo en: (1) Total; (2) Parcial; y (3) Biopsia.
Tratamiento Coadyuvante: Es la presencia de tratamiento de Radioterapia y/o Quimioterapia después de la cirugía. Evidenciado en la historia clínica por las sesiones que ha recibido. Se categorizó en: (1) RT/QT; (2) RT; y (3) No RT.
Procedimientos
Selección de Pacientes
En la base de datos del archivo de historias del Hospital Nacional Edgardo Rebagliati Martins, se escogió 200 historias de pacientes con glioma de alto grado que recibieron tratamiento quirúrgico, craniectomía más exéresis de tumor, entre los años 2010 - 2014. Todos los pacientes presentan confirmación histológica de glioma de alto grado, grado III y IV según el sistema de clasificación de la organización mundial de la salud.
Adquisición de las variables
Los siguientes datos se obtuvieron de los registros médicos de los pacientes: (1) Los datos demográficos (edad y sexo) y la Capacidad de realizar tareas rutinarias (KFS) antes de la operación. (2) Los síntomas clínicos preoperatorios: hipertensión intracraneal, la irritación y síntomas de agotamiento de los nervios y de su duración. (3) Imagen de resonancia magnética (MRI) preoperatoria: antes de la operación, de contraste de MRI se realizó para determinar si había hemorragia o necrosis del tumor, el tumor lugar, la extensión de la invasión tumoral y el tamaño del tumor. La extensión de la invasión del tumor se basa en el número de lóbulos con altas señales en T2 de MRI ponderada. (4) Tratamiento de: (a) la resección quirúrgica: la extensión de la resección del tumor durante la operación por neurocirujanos y durante el estudio de imágenes post operatorias analizada por radiólogos. Resección total de la masa del tumor era residuo de tumor en menos del 5% (para proteger importantes funciones neurológicas). Resección subtotal era la eliminación de más de 80% de la masa del tumor. (b) Postoperatorio Radioterapia : radioterapia postoperatoria fue dada a los pacientes a una dosis de rutina : 40-60 Gy/28 día a la apuesta del tumor y la región edematosa periférica 2 cm fuera de ella , además de con 10 a 14 Gy aplicados a la región del cerebro que rodea a 2 cm. (c) La quimioterapia postoperatoria: la quimioterapia habitual (200 mg temozolomide/m2 área de superficie corporal) se administró a los 4-6 curso del tratamiento y durante la radioterapia la dosis de temozolomida se redujo a la mitad . (5) Los datos patológicos postoperatorios: basada en exámenes patológicos, los pacientes fueron diagnosticados con astrocitoma anaplásico, oligodendroglioma anaplásico o anaplásico glioma mixto y con grados III y IV. (6) Seguimiento de los datos: incluyen resultado de la enfermedad con PS y SLP. Los datos de seguimiento se recogieron principalmente cuando los pacientes visitaron clínicas de consulta externa y en las entrevistas telefónicas con los pacientes y / o sus familiares. El resto de datos se obtuvieron de los registros médicos.
Análisis estadístico
Las medidas de resumen de los datos se presentaron como medias ± desviaciones estándar para los datos paramétricos y como medianas con IQRs para datos no paramétricos. Los métodos estadísticos se realizaron con el programa SPSS v13.0. Se utilizó el análisis de supervivencia de Kaplan-Meier, el método de rangos logarítmicos y el análisis de regresión de riesgos proporcionales de Cox para analizar el efecto de las diferentes variables con el tiempo de PS y SLP. Un valor de p inferior a 0,05 fue considerado estadísticamente significativo.
Aspectos éticos
Los datos fueron recolectados por los investigadores del estudio. A su vez, se obtuvo el permiso del nosocomio para que la investigación sea llevada a cabo. Finalmente, la información de los participantes se entregó en una hoja de cálculo de Microsoft Excel 2016 sin identificadores biológicos, manteniendo la confidencialidad de los datos.
RESULTADOS
De un total de 305 pacientes con gliomas de alto grado, que fueron identificados en la base de datos recolectada, 278 cumplieron con los criterios de inclusión. De estos 136 fueron varones y 142 mujeres; la edad mediana del total fue 51años. El glioma de alto grado más frecuente fue el grado IV (51,4%). La mayoría de los gliomas de alto grado tuvieron ubicación supratentorial (252 pacientes, 90,7%); el 23,4% de los pacientes su tumor tuvo ubicación en áreas elocuentes; el 65,5% de los pacientes tuvieron tumores con un diámetro ≥ 5cm. El tratamiento quirúrgico inicial fue la resección en el 95,7% de los casos. Solo a 12 pacientes se les realizó biopsia. 174 (62,6%) pacientes presentaron un estado funcional mayor o igual a 70% en la escala de karnofsky. Cefalea estuvo presente en el 69,1%. Además, un 20,5% de los pacientes presentó síndrome de hipertensión endocraneana (SHE). En el tratamiento coadyuvante el 83,5% recibió radioterapia y el 60,8% recibió quimioterapia. El análisis del tiempo de SLP tuvo un rango de 5,6-80,3 con una media de 22,7 meses y el análisis del seguimiento del tiempo de supervivencia tuvo un rango de 4-83,2 y una media 26,2 meses.
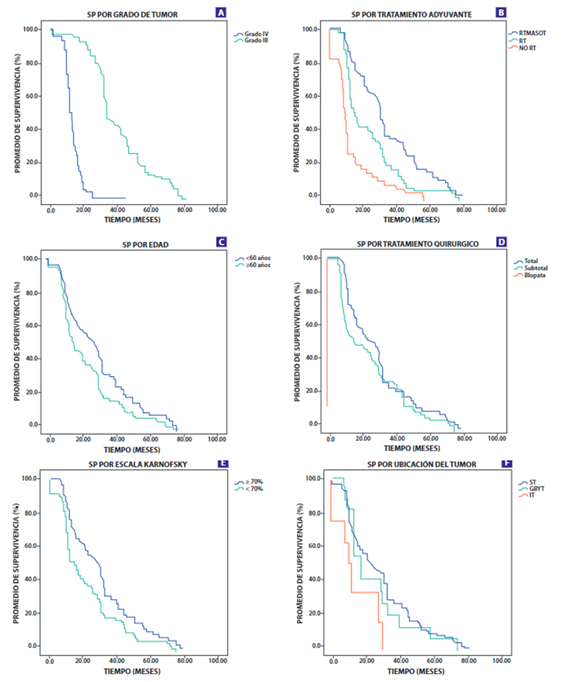
El grado del tumor, escala de Karnofsky, tratamiento quirúrgico, edad y tratamiento adyuvante fueron significativamente asociados con el PS que se aprecia en latabla N°2yFigura N°1. El PS para el tumor de IV grado fue 15,7 meses (IC 95% 14,2-17,1) y para el III grado fue de 38,4 meses (IC 95% 35,8- 40,9); los pacientes con edad menor de 60 años tuvieron una larga PS 32,6 meses (P=0,015); para los pacientes con una escala de Karnofsky mayor de 70% presentó también 32,6 meses de PS (IC 95% 29,5-35,6); los pacientes con tratamiento quirúrgico se les realizo resección total del tumor, subtotal y biopsia los cuales tuvieron un PS de 30,8, 28,6 y 7,3 meses respectivamente; el tratamiento adyuvante de radioterapia/quimioterapia tuvieron largos PS (p <0,001).
En el análisis multivariado el grado de tumor fue la variable que mayor correlación tuvo con el PS (HR=15,5; p <0,001); mientras que el tratamiento quirúrgico, edad, tratamiento adyuvante y karnofsky también correlacionan con el PS (p=0,07, p=0,025, p=0,018 y p=0,035 respectivamente)Tabla N°4.
Tabla N°3yFigura N°2se muestra el análisis de SLP. El SLP para el tumor de IV grado fue 11,3 meses (IC 95% 10,3-12,2) mientras que para el III grado es 32,8 meses (IC 95% 29,4-36,1); para el PS fue 15,7 meses (IC 95%: 14,2- 17,1) y 38,4 meses (IC 95% 35,8-40,9) respectivamente. En el análisis univariado el SLP varía significativamente con grado del tumor, tratamiento quirúrgico, edad, escala de karnofsky y tratamiento adyuvante. Los pacientes con un punto de corte a los 60 años tuvieron una variación significativa del SLP (p=0,01).
El análisis multivariado que se muestra en latabla N°4, indica que el grado de tumor, tratamiento quirúrgico, la edad y tratamiento adyuvante guardaron una significativa correlación con el SLP (p <0,001, p<0,001, p=0,01 y p=0,02 respectivamente) pero no se mostró correlación con la valoración del estado funcional (escala de karnofsky).
Tabla 1 Características generales de los pacientes con glioma de alto grado del periodo 2010-2014.
| Variable | n | % |
| Edad | ||
| 14-30 | 35 | 12.6 |
| 31-60 | 150 | 54.0 |
| 61 a más | 93 | 33.5 |
| Media | 49 | |
| Sexo | ||
| Masculino | 136 | 48, 9 |
| Femenino | 142 | 51.1 |
| Ubicación del Tumor | ||
| Supratentorial | ||
| Frontal | 58 | 20.9 |
| Parietal | 60 | 21.6 |
| Occipital | 10 | 3.6 |
| Temporal | 52 | 18.7 |
| Más de 1 área afectada | 72 | 25.9 |
| Tálamo y Ganglios basales | 18 | 6.5 |
| Infratentorial | ||
| Tronco encefálico | 2 | 0.7 |
| Cerebelo | 6 | 1.7 |
| Karnofsky | ||
| ≥ 70 | 174 | 62.6 |
| <70 | 104 | 37.4 |
| Área elocuente | ||
| No | 213 | 76.6 |
| SI | 65 | 23.4 |
| Resección del tumor | ||
| Total | 179 | 64.4 |
| Subtotal | 87 | 31.3 |
| Biopsia | 12 | 4 , 3 |
| Tumor de alto grado | ||
| Grado IV | 144 | 51.8 |
| Grado III | 134 | 48.2 |
| Diámetro del Tumor | ||
| <5 cm | 96 | 34.5 |
| ≥ 5 cm | 182 | 65.5 |
| Síntomas | ||
| Convulsiones | 84 | 30.2 |
| Cefalea | 192 | 69.1 |
| Hemiparesia | 85 | 30, 6 |
| Afasia | 50 | 18.0 |
| Disartria | 44 | 15.8 |
| SHTE | 57 | 20.5 |
| Otros | 52 | 18.7 |
| Tratamiento adyuvante | ||
| RT/QT | 162 | 58.3 |
| RT | 71 | 25.5 |
| NO RT | 45 | 16.2 |
Tabla 2. Mediana de supervivencia global por grupos de los pacientes con glioma de alto grado del periodo 2010-2014.
| Variable | Mediana (meses) | 95% CI | p ** |
| Grado de Tumor | |||
| Grado IV | 15.7 | 14.2 - 17.1 | <0.001 |
| Grado III | 39.4 | 35.8 - 40.9 | |
| Género | |||
| Masculino | 36.4 | 20.2 - 32.5 | 0.59 |
| Femenino | 30.8 | 24.1 - 37.4 | |
| Manifestaciones clínicas | |||
| Convulsiones | 32.1 | 26.8 - 37, 3 | 0.54 |
| SHTE | 29.5 | 21.1 - 35.4 | 0.82 |
| Karnofsky | |||
| ≥ 70% | 32.6 | 39.5 - 35.6 | 0.005 |
| <70% | 21.4 | 13.0 - 37.8 | |
| Diámetro del tumor | |||
| ≥ 5 cm | 24.7 | 17.3 - 32.0 | 0.54 |
| <5 cm | 30.8 | 26.1 - 35.4 | |
| Tipo de tratamiento quirúrgico | |||
| Total | 30.8 | 25.0 - 36.5 | <0.001 |
| Subtotal | 20.60 | 18 , 2 - 38.9 | |
| Biopsia | 7.3 | 4.6 - 9.9 | |
| Ubicación del tumor | |||
| Supratentorial | 29.6 | 24.6 - 34.5 | 0.56 |
| Ganglios basales y tálamo | 22.8 | 8.1 - 37.4 | |
| Infratentorial | 12,3 | 7.4 - 17.1 | |
| Edad | |||
| <60 años | 32.6 | 29.2 - 35.9 | 0.015 |
| ≥ 60 años | 22.4 | 17.5 - 27.2 | |
| Elocuencia | |||
| Si | 32.8 | 27.4 - 38.1 | 0 , 43 |
| No | 26.4 | 21.3 - 31.4 | |
| Tratamiento adyuvante | |||
| RT / QT | 32.9 | 30.1 - 35.6 | <0.001 |
| RT | 26.4 | 14.2 - 38.5 | |
| NO RT | 12.6 | 10.7 - 14.4 |
*95% IC: Intervalo de confianza al 95%. RT: radioterapia. RT/QT: combinación de radioterapia y quimioterapia. No RT: No recibió radioterapia. SHTE: Síndrome de hipertensión endocraneana. ** Valor p obtenido a través de la prueba Long Rank.
Tabla 3. Mediana de la supervivencia libre de progresión por grupos de los pacientes con glioma de alto grado del periodo 2010-2014.
| Variable | Mediana (meses) | 95% CI | p ** |
| Grado de tumor | |||
| Grado IV | 13.3 | 10.3 - 12.2 | <0.001 |
| Grado III | 32.8 | 29.4 - 36.1 | |
| Género | |||
| Masculino | 20.4 | 12.2 - 29.5 | 0.61 |
| Femenino | 24.8 | 17.9 - 31.6 | |
| Manifestaciones clínicas | |||
| Convulsiones | 28.6 | 21.5 - 35.6 | 0.57 |
| SHTE | 25.7 | 14.2 - 37.1 | 0.961 |
| Karnofsky | |||
| ≥ 70% | 29.7 | 25.1 - 34.2 | 0.045 |
| <70% | 14 , 6 | 9.9 - 19.2 | |
| Diámetro del Tumor | |||
| ≥ 5 cm | 20.8 | 14.1 - 27.5 | 0.62 |
| <5 cm | 27.9 | 21.7 - 34.0 | |
| Tipo de tratamiento quirúrgico | |||
| Total | 28.3 | 25 , 0 - 36.5 | <0.001 |
| Subtotal | 20.4 | 8.9 - 31.8 | |
| Biopsia | - | - | |
| Ubicación del tumor | |||
| Supratentorial | 24.8 | 18.8 - 30.7 | 0.58 |
| Ganglios basales y tálamo | 20.4 | 14.5 - 25.7 | |
| Infratentorial | 10.0 | 5.4 - 14.5 | |
| Edad | |||
| <60 años | 28.6 | 23.4 - 33.7 | 0.01 |
| ≥ 60 años | 15.4 | 9.5 - 21.2 | |
| Elocuencia | |||
| Si | 28.3 | 18 , 9 - 37.6 | 0.465 |
| No | 22.6 | 15.5 - 29.6 | |
| Tratamiento adyuvante | |||
| RT/QT | 30.4 | 28.5 - 32.2 | <0.001 |
| RT | 14.9 | 11.1 - 18, 6 | |
| NO RT | 9 | 7.6 - 10.3 |
** 95% IC: Intervalo de confianza al 95%. RT: radioterapia. RT/QT: combinación de radioterapia y quimioterapia. No RT: No recibió radioterapia. SHTE: Síndrome de hipertensión endocraneana. ** Valor p obtenido a través de la prueba Long Rank.
Tabla 4. Análisis multivariado con el modelo relación de riesgos (Hazard Ratio) proporcionales de COX para supervivencia libre de progresión (SLP) y la supervivencia global (PS).
| SLP | PS | |||||
| Variable | HR ajustado | 95% CI | P ** | HR ajustado | 95% CI | P ** |
| Grado de tumor | ||||||
| Grado IV | Ref. | Ref. | ||||
| Grado III | 25.1 | 14.6 - 42.9 | <0.001 | 15.5 | 9.4 - 25.4 | <0, 01 |
| Tratamiento quirúrgico | ||||||
| Total | Ref. | Ref. | ||||
| Subtotal | 0.49 | 0.33 - 0.70 | <0.001 | 0.6 | 0.41 - 0.87 | 0.07 |
| Edad | ||||||
| <60 años | Ref. | |||||
| ≥ 60 años | 1.7 | 1.23 - 2.44 | 0.02 | 1.47 | 1.4 - 2.07 | 0.025 |
| Tratamiento adyuvante | ||||||
| RT / QT | Ref. | Ref. | ||||
| RT | 0.58 | 0.41 - 0.81 | 0.02 | 0.667 | 0.47 - 0.93 | 0.018 |
| Karnofsky | ||||||
| ≥ 70% | Ref. | Ref. | ||||
| <70% | 1.3 | 0.91 - 1.88 | 0.146 | 0.7 | 0.52 - 0.97 | 0.035 |
* 95% IC: Intervalo de confianza al 95%. HR: Hazard Ratio. RT: radioterapia. RT/QT: combinación de radioterapia y quimioterapia. ** Valor p obtenido a través de la prueba Long Rank.
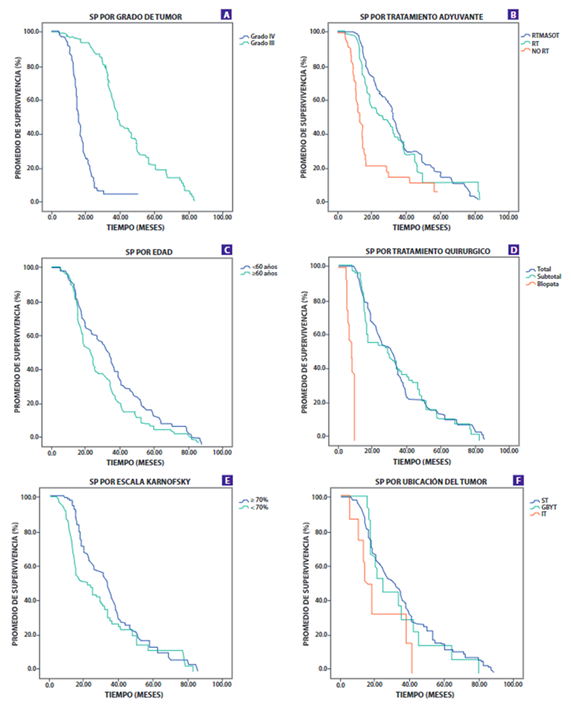
Figura 2. Gráficos de supervivencia mostrando la supervivencia global (PS) por grado de tumor (A), Tratamiento Adyuvante (B), edad (C), Tratamiento Quirúrgico (D), Karnosfsky (E) y Ubicación del tumor (F).
DISCUSIÓN
El Glioblastoma multiforme (tumor de IV grado) es la neoplasia primaria más agresiva del sistema nervioso central. Esta neoplasia ocurre principalmente entre los 60 y 70 años; en el presente estudio la mediana de la edad de los pacientes fue 51 años que es congruente con los estudios de McGirt y Liang.17,18) con una mediana 54 años. Además, los pacientes con un rango mayor o igual a 60 años presentaron menor promedio de supervivencia datos similares se encontraron en los estudios de Yong-jian19y Lacroix para la edad ≥ 65 años20y menor supervivencia libre de progresión(29).
Los hombres representan la mayor cantidad de pacientes con glioma alto grado; sin embargo, en nuestro estudio no hubo correlación con el PS ni SLP8,19,21.
En cuanto la manifestación clínica más frecuente en nuestro estudio fue la cefalea seguido de las convulsiones y el déficit motor13,22,23, sin embargo ninguna de ellas tuvo relación con la supervivencia de los pacientes; a diferencia del estudio de Liang, en el cual encontró asociación en la supervivencia, al separar síntomas que pertenecen o no al cuadro de hipertensión endocraneana.
En nuestro estudio la valoración del estado funcional del paciente se utilizó la escala de Karnofsky (KFS), la cual se consideró un buen estado funcional a un KFS≥70 el cual fue el más frecuente y se correlacionó con una mejor supervivencia (medina de 32,6 meses)24,otros estudios como Lacroix y Chaichana reportaron resultados similares pero con un KFS ≥8020,23, en cuanto a la SLP no se encontró asociación.
Los tumores de IV grado, llamados glioblastoma multiforme, son los tumores con un menor tiempo de supervivencia, así en nuestro estudio el PS fue de 15,7 meses estos se corrobora en la literatura con muchos estudios17,18,20,22-25ay en cuanto a SLP fue de 11,3 meses similar a los resultados de Ahmadloo22en una serie de 223 pacientes; tumor de III grado, llamados gliomas anaplasicos, la supervivencia fue de 38,4 meses y la SLP fue de 32,8 hallazgos similares se al estudio de Nuño26; según los datos de nuestro estudio el grado del tumor es un fuerte factor pronostico.
La ubicación del tumor es otras de las variables que se ha evaluado en nuestro estudio, en donde los tumores de ubicación supratentorial fueron los más frecuentes, y de estos los tumores que tuvieron mayor a 1 área afectada, la región parietal y frontal fueron los más afectados18, sin embargo no hubo correlación con el PS ni la SLP22,23,27, a diferencia de Kumar que encontró asociación entre la ubicación del tumor (lóbulo parietal) y la supervivencia4.En nuestro estudio también evaluamos la ubicación del tumor se encontraba en un área elocuente, la mayoría de los tumores no se encontraban en estas áreas y tampoco hubo correlación con el PS y la SLP, similares resultados existen en la literatura20,23. Pocos estudios toman la variable diámetro del tumor con un punto de corte entre 4 o 5 cm diámetro, nuestro estudio utilizó este último, sin encontrar correlación19,22,24.
En cuanto al tratamiento de los tumores, la opción quirúrgica sigue siendo la elección para el manejo de esta patología, siendo la resección total o casi total la que brinda mejor PS (mediana de 30,8 meses) al compararse con la subtotal (mediana de 20,6 meses) o la biopsia (mediana de 7 meses), además forma un buen factor pronostico23,24similar a la mayoría de estudios; así también influye en la SLP con una mediana 28,3 y 20,4 para la resección total y la subtotal respectivamente22,23. El tratamiento adyuvante con radioterapia y quimioterapia o una combinación de estos, mejora el promedio de supervivencia y la SLP, así también es un buen factor pronóstico22,23; en este punto en referencia coincide con muchos de los estudios publicados.
Hay que considerar algunas limitaciones del estudio. En primer lugar, la población de estudio es solamente de un hospital, por lo que extrapolar todos estos resultados a la población puede no ser completamente recomendable; sin embargo, dado que el nocosomio es un lugar donde llegan la mayoría de casos del país, puede hacerse cierta inferencia, y los resultados no deberían variar en la magnitud del resultado. Luego, podemos considerar el sesgo de Berkson, que nos habla del impacto de trabajar con personas enroladas en un hospital; pero, al tratarse de un estudio de un solo brazo, donde busca solo cuáles son los factores pronósticos para el glioma de alto grado, su impacto sobre el resultado no debería ser importante.
CONCLUSIÓN
Según los datos de nuestro estudio, la edad, el estado funcional, el tratamiento quirúrgico, el tratamiento adyuvante y el grado del tumor son factores pronósticos de supervivencia global en pacientes con glioma de alto grado; en contraste para la supervivencia libre de progresión los factores pronósticos fueron la edad, tratamiento quirúrgico, tratamiento adyuvante y el grado del tumor.











 text in
text in