INTRODUCCIÓN
El sarampión es una de las enfermedades más contagiosas que afectan al ser humano y es responsable de más de 100 000 muertes cada año y que antes de la introducción y uso generalizado de su vacuna fue responsable de más de 2 millones de muertes anuales.1Este virus se transmite por vía respiratoria y la enfermedad comienza con fiebre, tos, coriza y conjuntivitis, seguida de una erupción característica.2Según el Centro de Control de Enfermedades (CDC) Las complicaciones del sarampión son más probables en los niños menores de 5 años y los adultos mayores de 20. En dichas complicaciones las más comunes incluyen infecciones del oído (1/10 casos) con el concomitante riesgo de producir pérdida auditiva permanente y diarrea ( < 1/10 casos). Mientras que las complicaciones más severas del sarampión se expresan como neumonía (1/20 casos) y encefalitis (1/1 000 casos), las cuales ponen en serio riesgo la vida del paciente.3
La epidemiología molecular del sarampión es una excelente herramienta para detectar las importaciones, vincular casos y demostrar la ausencia de transmisión sostenida del virus. A medida que la diversidad genética de este disminuye, se requieren estudios de genotipificación extendida e incluso el secuenciamiento del genoma completo para una vigilancia molecular efectiva. Mantener una vigilancia de alta calidad para los casos de sarampión, que incluye el genotipado es fundamental para monitorear la eliminación sostenida del mismo.4 La vacuna frente a sarampión es segura y económica. De este modo, se conoce que entre 2000 y 2017 disminuyó la cifra de defunciones en un 80 % en todo el mundo y en 2017, alrededor del 85% de los infantes recibieron una dosis de vacuna contra el sarampión antes del primer año de edad, a través del sistema común de salud, con respecto al 72 % en el año 2000. Con ello se estima que entre 2000 y 2017, la vacuna contra el sarampión evitó unos 21,1 millones de muertes, lo que la convierte en una de las mejores inversiones en salud pública. Sin embargo, al finalizar 2017 la enfermedad causó 110 000 defunciones en todo el mundo, la mayoría entre niños menores de cinco años. (5
En 2016 la región de las Américas (RAM) fue declarada la primera zona del mundo en erradicar el sarampión. Esto culminaba un largo esfuerzo de 22 años, que involucró una amplia administración de la vacuna contra el sarampión, las paperas y la rubéola en el continente, y que mostraba sus frutos luego de superar el brote de Venezuela en 2002 y el último caso reportado en julio de 2015 en Brasil. De este modo la OPS/OMS y el Comité Internacional de Expertos para la Eliminación del Sarampión y la Rubéola recomendaba a todos los países de la RAM que fortalezcan la vigilancia activa y mantengan la inmunidad de su población a través de la vacunación para así mantener la eliminación de esta enfermedad.6
En los últimos años se ha reportado un incremento en el número de casos de sarampión en la RAM, y aunque en un principio la mayoría representaban casos esporádicos e importados, dos linajes del genotipo D8 han alcanzado un preocupante éxito en su diseminación. Por otro lado, la reciente pandemia producida por el virus SARS-CoV-2 ha ocasionado la restricción de la movilización urbana y el distanciamiento social en muchos países, cuyo efecto colateral podría ser la disminución de casos de sarampión. Sin embargo, esto tendría que ser evaluado con el tiempo. Ante ello la presente revisión describe la situación actual y epidemiología molecular del virus sarampión, la dinámica de transmisión del virus y la amenaza que este representa en el escenario de la erradicación. De este modo, poder enfocar adecuadamente la prevención de los casos y establecer medidas de contención que permitan hacerle frente a este problema.
MÉTODOS
La búsqueda y análisis de la información se realizó en un periodo de cinco meses (primero de noviembre de 2019 al 31 de marzo de 2020) para lo cual se emplearon las siguientes palabras: measles, epidemiology molecular, América, outbreak, genotype, epidemic. A partir de la información obtenida se realizó una revisión bibliográfica de un total de 254 artículos publicados en las bases de datos PubMed, Hinari, SciELO y Medline. Así mismo, se tomaron en cuenta los informes epidemiológicos de la Organización Panamericana De La Salud (OPS) y entidades gubernamentales de distintos países de América. Mediante el gestor de búsqueda y administrador de referencias Mendeley, de ellos se utilizaron 43 citas seleccionadas para realizar la revisión, todas dentro de los últimos cinco años.
DESARROLLO
Aspectos moleculares del virus del sarampión
El virus sarampión (VS) es un virus de simetría helicoidal, ARN de polaridad negativa no segmentado, perteneciente a la familia Paramyxoviridae y al género Morbillivirus, con aproximadamente 15 900 nucleótidos codificando ocho proteínas virales y que posee además una ARN polimerasa unida al ARN. La nucleocápside helicoidal está rodeada por una envoltura lipídica y posee tres proteínas relevantes en patogenia, la proteína M (no glicosilada), la glicoproteína HN (glicosilada) con actividad hemaglutinina y neuroaminidasa y la glicoproteína F, que participa en fenómenos de fusión. Se transmite por aerosoles con puerta de entrada en el aparato respiratorio o por contacto directo con secreciones respiratorias originando una enfermedad sistémica. El ser humano es el único reservorio conocido de éste virus.7
La infección producida por el sarampión inicia luego de la unión de la hemaglutinina (H) a su receptor celular; pronto la proteína de fusión (F) induce fusión viral con la membrana celular liberando su complejo ribonucleoproteico al citoplasma para que luego de transcripción y replicación, se generen nuevas partículas virales que germinan fuera de la célula. Desde el año 2000 se identificó al receptor CD150, como el sitio diana para la adherencia del virus, este se encuentra en la superficie de timocitos, macrófagos, células dendríticas además de linfocitos T y B.8
Del mismo modo, la lectina tipo C expresado por células dendríticas, también fue identificado como receptor del virus sarampión; los cuales apuntan a estos para suprimir o modular los interferones de tipo I que desempeñan un papel central en la defensa innata y adaptativa frente a virus.9Estos hechos explican la gran afectación de elementos de la inmunidad celular en el huésped, traducido en la inmunosupresión propia de esta enfermedad.
La OMS ha reconocido 24 genotipos de sarampión filogenéticamente distintos, designados como A, B1, B2, B3, C1, C2, D1-D11, E, F, G1, G2, G3, H1 y H2, en las que las letras identifican el clado principal y los números subclados. La genotipificación, es herramienta fundamental de la vigilancia epidemiológica promovida por la OMS y parte del diagnóstico, además permite analizar brotes epidémicos y determinar el origen autóctono o importado de un tipo en particular.7
El genotipado como herramienta esencial en la epidemiología molecular del virus sarampión
Un aspecto importante de la vigilancia de enfermedades es la capacidad de diferenciar linajes, tipos o variantes de un patógeno. Este proceso generalmente se denomina tipificación y por lo general, los patógenos del mismo género o especie se tipifican de acuerdo a sus características fenotípicas, como marcadores bioquímicos o serológicos, los cuales se emplean en gran parte para bacterias entéricas como Salmonella, Streptococcus pneumoniae y E. coli y para virus como el de la gripe, por ejemplo. Sin embargo, para una serie de patógenos, incluido el sarampión, no hay suficientes diferencias fenotípicas para emplear este método de tipificación. Por lo tanto, la OMS recomienda utilizar la secuencia exacta o "variante" de los últimos 450 nucleótidos del gen de la nucleoproteína (N) (denominada "N-450"), como mínimo, para epidemiología molecular y la secuencia completa del gen de la hemaglutinina (1854 nt) para información adicional. Dado que el genoma del sarampión muta muy lentamente, generalmente los casos en el mismo brote o cadena de transmisión tienen secuencias N-450 idénticas, y las diferencias, incluso de un nucleótido, suelen ser suficientes para excluir la transmisión directa entre dos casos.4,10
Para la nomenclatura del virus sarampión (VS) se toman en cuenta el origen de los aislamientos a partir de una secuencia derivada de ARN extraído en cultivo celular (MVi) o extraídos directamente de la clínica (MVs). Así mismo otros datos que se incluirán en el nombre de la secuencia son: ciudad o estado/ provincia donde ocurrió el caso (necesario). País, designación de la carta ISO-3 (requerida). Fecha de inicio de la erupción por semana epidemiológica (1-53) y año (requerido). Si no se conoce la fecha de inicio de la erupción, se utilizará la fecha de recolección de la muestra. Si estas dos fechas no están disponibles, se utilizará la fecha en que la muestra llegó al laboratorio. Para muestras históricas donde solo se conoce el año, debe utilizarse como la semana epidemiológica “0”. Si el año y mes se conocen, pero no la semana o el día epidemiológico, luego la semana epidemiológica debe definirse como la segunda semana completa en ese mes. El genotipo puede colocarse entre corchetes (opcional). Por último existe una designación especial para secuencias derivadas de encefalitis por inclusión de sarampión (MIBE) o casos de panencefalitis esclerosante subaguda (SSPE), o casos sospechosos con antecedentes de vacunación reciente y virus de la vacuna detectados (VAC). Los siguientes ejemplos ilustran la nomenclatura actual: MVi/HuluLangat.MYS/26.11(D8) y MVs/ NewYork.USA/17.11(G3)(SSPE).11
Bases de datos disponibles para almacenamiento de secuencias del virus sarampión
Debido a la importancia de las actividades de vigilancia molecular para los virus del sarampión, ahora se hace imprescindible poder comparar la información de secuencia, además de la información del genotipo. Los genotipos contienen múltiples linajes distintos. Por lo tanto, la comparación de secuencias es el medio más sensible para obtener información importante con el fin de determinar vías de transmisión, el origen de la infección, distinguir los casos esporádicos de los casos de brotes y confirmar el fracaso de la vacuna.12
Sin embargo, para hacer posible el monitoreo en tiempo real de las cadenas de transmisión del sarampión, la información de secuencia y genotipo debe ser reportada a las bases de datos centralizadas de manera oportuna. En este sentido, la base de datos de acceso público, GenBank (http://www.ncbi.nlm.gov), es uno de los principales repositorio de información sobre la secuencia del sarampión sin embargo su uso está más extendido para temas de investigación que para notificación epidemiológica. Ante ello, varios sistemas o bases de datos diferentes están disponibles para recopilar y difundir información genotípica sobre el sarampión, la cual varía ampliamente en cuanto a si se trata de datos agregados o individuales, si incluye solo información de genotipo y si la información de secuencia está disponible. De este modo tenemos a la Red Europea de Laboratorios de Sarampión y Rubeola (LabNet) y centralized information system for infectious diseases (CISID) que forman parte del programa de la OMS / Europa sobre enfermedades prevenibles por vacunación e inmunización que desde 2002, han recopilado datos mensuales sobre los casos de sarampión por edad y estado de vacunación de los Estados Miembros de la Región Europea. En el CISID muchos estados miembros también reportan información detallada basada en casos. El programa proporciona regularmente comentarios sobre la epidemiología del sarampión y el funcionamiento de los sistemas de vigilancia.13
La base de datos Measles Nucleotide Surveillance (MeaNS),14es un proyecto conjunto entre la Agencia de Protección de la Salud (Londres, Reino Unido) y la OMS. Actualmente, la base de datos recopila información sobre la secuencia completa del gen de la hemaglutinina (H) del sarampión, la secuencia completa del gen de la nucleoproteína (N) o la secuencia de los 450 nucleótidos COOH-terminal del gen N (N-450). El objetivo de MeaNs es desarrollar una base de datos de nucleótidos con acceso a la red y con control de calidad para la Red de Laboratorios de Sarampión de la OMS. Esta base de datos se utiliza como una herramienta para rastrear la diversidad de secuencias de sarampión y monitorear la eliminación de cepas de virus. Actualmente, esta base de datos cuenta con más de 55 757 registros de muestra y 56 797 secuencias virales, a la fecha de redacción del presente artículo.10
Para las secuencias N-450 comúnmente detectadas, Measles Nucleotide Surveillance (MeaNS)14designa una variante de secuencia. Ejemplos de variantes de secuencia son MVs/Manchester.GBR/10.09 (genotipo D4) y MVs/Taunton.GBR/27.12 (genotipo D8). Los miembros de la Red Europea de Laboratorios de Sarampión y Rubeola (LabNet) interrogan la base de datos de MeaNS para determinar a qué variante de secuencia es idéntica la secuencia de su caso de sarampión. La variante de secuencia se convierte en la característica definitoria de los casos y brotes de sarampión, y se utiliza para identificar fácilmente las secuencias de sarampión coincidentes de otros casos posiblemente conectados.4
Distribución actual del virus sarampión
Durante 2000 - 2018, el número de casos de sarampión reportados en todo el mundo disminuyó 59 %, de 853 479 en 2000 a 353 236 en 2018, la incidencia anual de sarampión disminuyó 66 %, de 145 a 49 casos por millón de habitantes y las muertes estimadas disminuyeron 73 %, de 535 600 a 142 300 por año.15El panorama cambió en 2019. Datos provisionales de la OMS indican que durante 2019 se notificaron más casos de sarampión en todo el mundo que cualquier año desde 2016 (500 000 casos confirmados en más de 180 países), eclipsando los 353 236 casos confirmados de sarampión reportados a la OMS en 2018.16En cuanto a los linajes que circularon en los países de Europa desde 2006 hasta 2013, de acuerdo a los datos de secuencia de VS depositados en la base MeaNS, se calculó el período de circulación para cada variante a nivel de país y para toda la región. De este modo, se sabe que las variantes de MV "D5-Okinawa" "D4-Hamburg", "D4-Manchester" y "D8-Frankfurt-Main" se difundieron ampliamente en Europa continental causando brotes grandes y duraderos con propagación secundaria que dieron lugar a brotes adicionales. Brotes en todo el país (epidemias) con miles de casos de sarampión se produjeron en cuatro países: Suiza, Francia, Bulgaria y Rumania y se caracterizaron por la detección continua de la misma variante de VS durante más de 12 meses, lo que sugiere una transmisión endémica. El período de circulación de los cuatro linajes varió de 18 a 44 meses. Este tipo de transmisión de larga duración que afecta a individuos predominantemente no vacunados en diferentes grupos de difícil acceso y en la población general no es compatible con el objetivo de eliminación del sarampión.17
En la actualidad países europeos, asiáticos y africanos están teniendo brotes de sarampión considerables. Los brotes actuales afectan Etiopia, Filipinas, Georgia, Kazajstán, Kirguistán, Madagascar, Myanmar, República Democrática del Congo, Sudán, Tailandia y Ucrania, causando muchas muertes, sobre todo en niños pequeños.18De este modo, Francia padece de un brote que comenzó en Nueva Aquitania en noviembre de 2017, Italia ha reportado 2 517 casos de sarampión durante 2018 y en noviembre de este último se elevó un plan de vacunación que apunta a coberturar a 800 000 niños hasta la edad de 16 años en 2019. Ucrania ha notificado 115 000 infecciones y 41 muertes durante el 2019, desde que comenzó el último brote en 2017, siendo el país más afectado en la región europea. Esta situación es consecuencia de la caída en la cobertura de vacunación. Entre 2008 y 2016, el número de niños elegibles que fueron vacunados completamente contra el sarampión se redujo del 95 % al 31 %. Lo que representa la cobertura más baja en la Región Europea de la OMS y entre las más bajas del mundo.16,19
Al 17 de noviembre de 2019, la República Democrática del Congo reportó 250 270 casos sospechosos de sarampión con 5 110 muertes relacionadas con el mismo.20En Madagascar durante septiembre de 2018 y febrero de 2019, se reportaron 67 422 casos, incluyendo 828 muertes, La mayoría (84 %) de estas ocurridas en niños menores de nueve meses de edad. El genotipo circulante en el brote actual es el B3, frecuente en África y Europa,16en Israel existen 3 125 casos confirmados con dos muertes reportadas desde marzo de 2018 hasta enero de 2019. El 62 % de los casos han ocurrido en el distrito de Jerusalén concentrados en las comunidades judías ultraortodoxas.16A noviembre de 2019, los brotes de sarampión en curso más preocupantes se registran en Yemen con 5 847 casos, Sudán, con 3 659 casos, Somalia, con 2 795 casos, Pakistán, con 1 978 casos, Túnez, con 1 367 casos y Iraq, con 1 222 casos confirmados.20Países como Japón, China y Taiwán, sufrieron brotes entre marzo y mayo del 2018 donde fue interesante observar que las cadenas de transmisión subsiguientes en poblaciones altamente vacunadas tanto en Japón como en China y Taiwán, así mismo el número de reproducción efectiva de la segunda generación detectado fue> 1 tanto para Japón como para China.21
Durante 2016 - 2018, se detectaron seis de los 24 genotipos de sarampión reconocidos. El número de genotipos detectados disminuyó de seis (B3, D4, D5, D8, D9 y H1) en 2016 a cuatro (B3, D4, D8 y H1) en 2018.22Los genotipos de virus aislados de casos de sarampión fueron reportados por 95 (73 %) de los 131 países que reportaron al menos un caso de sarampión en 2018. Entre los 24 genotipos reconocidos de virus del sarampión, once se detectaron durante 2005 - 2008, ocho durante 2009 - 2014, seis en 2016, cinco en 2017 y cuatro en 2018, excluyendo las reacciones a la vacuna y los casos de panencefalitis esclerosante subaguda, una enfermedad neurológica progresiva mortal causada por una infección persistente por el virus del sarampión. En 2018, entre 7 155 secuencias de virus de sarampión reportadas, 3 011 (42 %) fueron del genotipo B3; 20 (0,3 %) fueron D4; 3 774 (53 %) fueron D8; y 350 (5 %) fueron H1. Los genotipos B3 y D8 representaron el 95 % de las secuencias informadas (Figura 1).22
Distribución de genotipos del virus sarampión en Latinoamérica
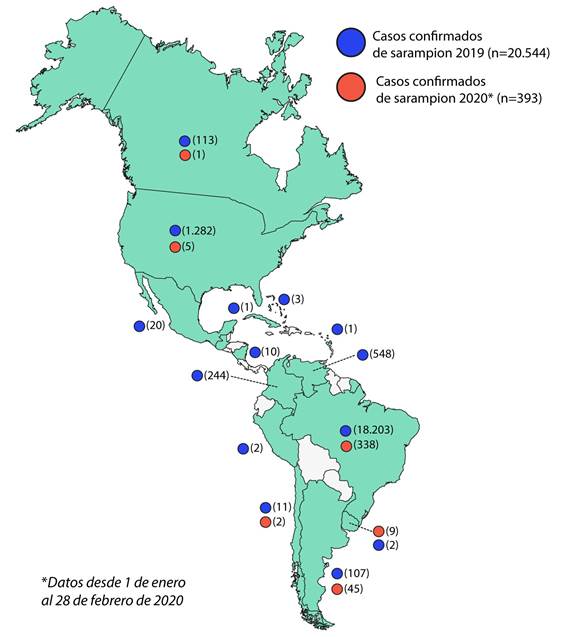
Hasta principios del 2017 la transmisión endémica se había eliminado en muchas áreas del mundo, incluidos todos los países del Hemisferio Occidental y la RAM. El análisis de virus aislados de casos de sarampión y brotes en las Américas indicaba que no existía una transmisión continua de un genotipo o genotipos endémicos. Más bien, la diversidad de genotipos detectados en los últimos 15 años era indicativa de múltiples fuentes importadas de virus. Cinco genotipos diferentes se asociaron con casos importados en la RAM desde 2007 hasta 2009 (D4, D5, D8, B3 y H1). Algunos se asociaron con casos aislados, mientras que otros fueron responsables de brotes relativamente pequeños, por otro lado hacia el norte en 2010, ocurrió un brote en Canadá debido a la importación del virus por viajeros y atletas que asistieron a los Juegos Olímpicos de Invierno. Donde se detectó al genotipo H1 y 2 cepas distintas de D8. (10) Entre la SE 1 y SE 47 de 2019 se han reportado en Canadá 113 casos confirmados de sarampión en 7 provincias del país. Del total de casos confirmados, 73 fueron genotipificados, identificandose el genotipo B3 (20 casos) y el genotipo D8 (53 casos), similares a los que están circulando a nivel global.23
En 2019, la situación en la RAM cambió. Muchos países de la región se han visto afectados por pequeños brotes, algunos de los cuales se están haciendo sostenidos, poniendo en peligro la erradicación de esta enfermedad. De este modo, a principios de 2019, el genotipo D8 linaje MVi/HuluLangat.MYS/26.11 predominaba en países como Brasil, Colombia y Venezuela, cuya circulación había sido identificada por primera vez en Venezuela en 2017. Mientras que en 2018 la mayor proporción de este linaje en la RAM se registró en Brasil y Venezuela; en 2019 la mayor proporción proviene de Estados Unidos, Venezuela, Colombia y Brasil.24Sin embargo, desde la ocurrencia de un brote en un crucero en el estado de São Paulo (SE 8 de 2019), adicionalmente se ha detectado la circulación del genotipo D8, con tres diferentes linajes: MVs/FrankfurtMain.DEU/17.11, MVi/Delhi.IND/01.14/06 y MVs/Gir Somnath.IND/42.16, siendo este último el más detectado, en países como Brasil, Venezuela, Argentina, Chile, Colombia (Figura 2);23finalizando el 2019, con 20 554 casos confirmados de sarampión, incluidas 19 defunciones en 14 países y territorios de la región (Figura 3).25El genotipo D8 linajes MVi/HuluLangat.MYS/26.11 y MVs/Gir Somnath.IND/42.16 se presentan como principales amenazas en la erradicación del virus sarampión para la RAM. Al finalizar 2018, la República Bolivariana de Venezuela presentó 5 643 casos, incluidas 73 defunciones que estuvieron muy relacionadas al linaje MVi/HuluLangat.MYS/26.1126y durante 2019 con 548 casos, incluidas 3 defunciones, sigue siendo uno de los países con mayores casos de la región después de Brasil.25 La crisis que afecta a Venezuela, hace que la contención a este virus sea complicada, además la migración está propiciando la diseminación a países vecinos como Brasil o Colombia. En este último, ya desde el año 2016 Gonzales M et al.27informaban de que la población infantil no estaba totalmente protegida contra el sarampión y las infecciones por el virus de la hepatitis B, en un estudio de seroprevalencia desarrollado en 170 niños sanos de nueve municipios de Quindío-Colombia. De este modo, el ocho de marzo de 2018, en el Municipio de Medellín, un niño de 14 meses recién llegado de Venezuela, desarrolló la erupción sugerente de sarampión y posteriormente fue hospitalizado. Las pruebas de laboratorio confirmaron que tenía el virus. Fue uno de los primeros casos en Colombia desde que el sarampión fue declarado eliminado en la RAM en 2016.28
De este modo, en Colombia al finalizar 2019 se han notificado 244 casos confirmados de sarampión incluida 1 defunción. La genotipificación de 119 casos reveló que en por lo menos 91 casos se trata del genotipo D8, linaje MVi/HuluLangat.MYS/26.11 y dos del linaje MVs/Gir Somnath.IND/42.16 en las 26 muestras restantes, el linaje se encuentra en estudio.23,25Ante ello, cada uno de los distritos de este país, que informaron al menos un caso confirmado en 2019 implementaron medidas de control de brotes, incluido el rastreo de contactos, el mapeo de cadenas de transmisión y el aumento de la vigilancia en las instalaciones de atención médica. El país también intensificó los esfuerzos de vacunación para poblaciones en riesgo y áreas a lo largo de la frontera con Venezuela así mismo los trabajadores de salud vacunaron con éxito a 59 721 niños y aumentaron la cobertura de la vacuna contra el sarampión por encima del nivel del 95 % necesario para prevenir los brotes.28
Otro de los países más afectados por este virus es Brasil. En 2019, fueron notificados 64 765 casos sospechosos de sarampión, de los cuales 18 203 fueron confirmados (incluidas 15 defunciones). Brasil, al igual que el resto de los países en esta región, ha estado expuesto a la importación de casos desde otras regiones, generando casos aislados. Sin embargo, esa situación cambió a partir de un caso importado desde Venezuela en febrero de 2018 hasta inicios de 2019, debido al brote iniciado en el estado de Roraima tras la migración de población venezolana, predominaba la circulación del genotipo D8, linaje MVi/HuluLangat.MYS/26.11.25Al seguir el rastro de este linaje, hallamos que el primer caso confirmado del virus por laboratorio tuvo lugar el 23 de marzo de 2018, en una mujer de 20 años que vivía en el distrito norte de Manaus, estado de Amazonas. Empezó con una erupción el 21 de febrero de 2018 y se presentó con fiebre, tos, coriza y conjuntivitis. Fue identificada durante la investigación del caso de su hijo de un año de edad que presentó los mismos síntomas.29Ahora sabemos que el sarampión ingresó al país con migrantes venezolanos y las poblaciones indígenas que viven cerca de las fronteras venezolanas sin embargo fue el bajo número de brasileños vacunados lo que ayudó a la propagación de la enfermedad debido a la disminución de la cobertura de la vacuna. Aunque a principios de 2019 el linaje MVi/HuluLangat.MYS/26.11 fue el principal responsable de los casos en Brasil, se supo también que otros linajes del genotipo D8 fueron notificados nuevamente a partir de casos importados (desde Israel y Noruega), iniciando nuevas cadenas de transmisión, detectándose la circulación de tres linajes diferentes del genotipo D8: MVs/FrankfurtMain.DEU/17.11, MVi/Delhi.IND/01.14/06 y MVs/Gir Somnath.IND/42.16, siendo este último el más detectado, generando un brote considerable actualmente (SE 1 y la SE 5 de 2020)25.
Por otro lado los Estados Unidos durante 2019 ha tenido un número considerable de casos confirmados de sarampión (1 282 casos) causados por los genotipos D8 o B3 de sarampión de tipo salvaje, (Figura 2) que representa uno de los más grandes brotes que afecta a ese país en los últimos 10 años (Figura 3).30Después de su erradicación en el año 2000 el virus se presentó en 2013 en la ciudad de New York producto de una importación producida por un adolescente no vacunado convirtiendolo hasta ese momento, en el mayor brote de sarampión desde 1992, por tal motivo Rosen J et al.31realizaron una evaluación epidemiológica y análisis de costos por brote, examinando todos los casos de sarampión (58 personas en estudio), concluyendo que los rechazos a las vacunas debido a la negativa de los padres, el retraso intencional a la atención médica y la notificación inoportuna jugaron un papel fundamental en la propagación del brote. En 2019 se ha declarado a los Estados Unidos en emergencia de salud pública debido al gran aumento en los casos de sarampión importados, particularmente en las áreas de judíos ortodoxos como Brooklyn (285 casos) y el vecino Condado de Rockland (168 casos).32Estos brotes están relacionados a viajeros con antecedentes de viaje a Israel, Ucrania y Filipinas. La mayoría de los casos no estaban vacunados.30
La cobertura de 2 dosis altas de vacunación contra el sarampión en los Estados Unidos ha sido fundamental para limitar la transmisión, sin embargo, el aumento de la actividad mundial contra el sarampión representa un riesgo para la eliminación en los Estados Unidos especialmente cuando los viajeros no vacunados la adquieren en el extranjero y regresan a las comunidades con bajos índices de vacunación. Ante esta situación, las autoridades en salud deben asegurar que las personas estén al día con la vacuna contra el sarampión, las paperas y la rubéola (incluso antes del viaje internacional) e informar rápidamente todos los casos sospechosos.
Actualmente, Argentina, está viviendo uno de los mayores brotes de sarampión desde su eliminación endémica alcanzada en 2000. El brote en curso (registrado desde la SE 35 de 2019) se ubica en la Ciudad Autónoma de Buenos Aires y las Regiones Sanitarias V, VI, VII y XII de la provincia en mención. Hasta la fecha de redacción del artículo, el Ministerio De Salud Argentina ha confirmado 144 casos incluida una defunción (no vista desde 1998). Tres de estos casos presentan antecedente de viaje a Estados Unidos y otros tres a Brasil (todos con genotipo y linaje en estudio), en los demás 138 casos no se pudo establecer el origen y el genotipo identificado fue D8 linaje MVs/Gir Somnath.IND/42.16 de amplia circulación en la región de las Américas (Figura 2). Ante esta situación, el Ministerio de Salud de la Nación, en consenso con las jurisdicciones y las comisiones asesoras, recomiendan continuar con las medidas de contención del brote en curso a través de las estrategias intensificadas de vacunación con la oportuna detección y notificación de los casos ante la sospecha.33
El mismo panorama está ocurriendo en México, que enfrenta un brote de sarampión no visto desde hace 20 años. De acuerdo con el último reporte de la Secretaria de Salud, se han confirmado 108 casos de sarampión en lo que va del 2020,34cifra en ascenso desde la última epidemia de sarampión ocurrida en 1989 - 1990. La tasa de afectados oscila entre los 4 meses hasta los 68 años de edad, la mayoría sin antecedentes de vacuna. En 2019 de los 20 casos confirmados de sarampión, entre casos importados y relacionados con importación, se identificó el genotipo B3, linaje MVi/Ibadan.NGA/0.97 y el genotipo D8, linaje MVi/Manchester.GBR/30.94, relacionados con cepas de distribución americana y europea (Figura 2).23En 2020, de los 108 casos confirmados hasta la fecha de redacción, solo en cinco casos se ha identificado el genotipo D8 linaje MVs/Gir Somnath.IND/42.16, los restantes son materia de investigación. Para hacer frente al brote, sumado a la actual pandemia del COVID-19 que hace más crítica la situación del país, el gobierno de la Ciudad de México dispuso cercos epidemiológicos y de contención, con una aplicación total de 25 000 vacunas en la población susceptibles y con antecedentes de viaje previo.34
En contraste con lo que sucede en Venezuela, Colombia, Brasil, Estados Unidos, Argentina y México el resto de países que conforman la RAM, sólo han sufrido brotes esporádicos del VS. De este modo países como las Bahamas ha notificado tres casos confirmados de sarampión hasta la fecha de redacción de este artículo: dos importados y uno relacionado con importación. El caso más reciente es importado y corresponde a una menor de tres años, que viajo en vuelo directo desde Canadá a la ciudad de Nassau (Las Bahamas). El genotipo y linaje de este caso notificado está pendiente. Este es el tercer caso confirmado de sarampión en este país desde 1997.23Al respecto, este archipiélago caracterizado por climas tropicales y temporadas de huracanes, basa su economía principalmente en el turismo con una expansión poblacional más lenta en los grupos de edad inferior e indicadores financieros favorables. El sistema de salud de este país no parece tener problemas, sin embargo en algunas zonas han proliferado los barrios marginales informales donde habitan principalmente migrantes pobres. Como las Bahamas dependen principalmente de un sistema de pozos y cisternas que se contaminan fácilmente con los tanques sépticos y la intrusión de agua salada, estos asentamientos son motivo de preocupación. Los pozos de los barrios marginales suelen estar mal construidos y se cavan cerca de sistemas de alcantarillado inadecuados, lo cual aumenta los riesgos y ante la introducción del VS, estas zonas podrían representar un importante foco de diseminación.35
Otro país del caribe que ha notificado casos de sarampión es Costa Rica, entre la SE 1 y la SE 17 de 2019 notificaron 10 casos confirmados del virus, tres de ellos importados y siete relacionados con importación (Figura 3). El genotipo identificado en los tres casos importados fue D8 y el linaje MVs/Gir Somnath.IND/42.16.24 Es meritorio mencionar que países como Paraguay y Bolivia en 2019 no presentaron casos de sarampión y se mantiene hasta la fecha de redacción de la presente. Y en este último se debe a la implementación de un exitoso plan de respuesta ante la reintroducción del sarampión en su territorio instaurado en marzo de 2018.36,37
Sin embargo, países como Chile (11 casos), Uruguay (9 casos), Perú (2 casos) y Cuba (1 caso) reportaron un número limitado de casos confirmados durante 2019 (Figura 3), en los cuales también se ha detectado la presencia del genotipo D8, linaje MVs/Gir.Somnath.IND/42.1625y aunque la diseminación en este ha sido restringida, la OMS alertó en 2019 de que unos veinte millones de niños no reciben las vacunas esenciales o lo hacen de manera incompleta, razón por la cual la tasa de inmunización global sigue estancada en un 86 %, de este modo se sabe que la cobertura frente a sarampión en Perú bajó de 96 % a 85 %, en Brasil bajó del 99 % al 84 %, del 97 % al 83 % en Ecuador y del 95 % al 81 % en el caso de El Salvador,38estos datos revelan la gran amenaza para la erradicación del sarampión a la que están expuestas estos países. Además, un hecho más preocupante fue notificado en un informe de la Dirección Regional de Salud de la provincia constitucional del Callao - Perú, en el que se menciona que más de 20 mil niños, de entre 2 y 10 años de edad, de los distritos de Ventanilla, Mi Perú y Bellavista no cuentan con inmunidad frente al sarampión, y que la principal causa de ello sería la oposición a las vacunas que presentan los padres.39Esto sin duda representa las primeras señales reportadas de la corriente anti-vacunas en Latinoamérica, la cual debe ser vigilada y analizada debido al impacto negativo que están produciendo sobre todo en países europeos y en América del Norte.40Y que de hacerse extensivo en países en vías de desarrollo con dificultades en los sistemas de salud producirían efectos devastadores no solo en la contención del sarampión sino de muchas otras enfermedades.
Amenazas a la erradicación del sarampión en la región de las Américas
En la actualidad, existen principalmente 4 amenazas que ponen en peligro el éxito de la erradicación del Sarampión en la RAM. Primero, los arraigos culturales y religiosos de ciertas comunidades que presentan cierta renuencia a la vacunación, lo cual se ha evidenciado en el brote que afecta a New York y New Jersey en Estados unidos, donde la comunidad judío- ortodoxa ha sido relacionada a la importación de los casos de sarampión en 2018 y 2019,41en segundo lugar, los movimientos anti vacunas que en la actualidad han conseguido miles de adeptos y que más allá de fundamentos religiosos o culturales son motivados por ideas conspirativas42y que como mencionamos anteriormente estaría dando sus primeras señales en Latinoamérica. La disminución en la cobertura de vacunación y su inevitable efecto sobre la tasa de inmunización frente al virus y por último las crisis políticas y económicas que aquejan a países como Haití y Venezuela, que han afectado gravemente la salud pública de sus habitantes. El efecto de la crisis en este último ha sido difícil de cuantificar desde que el Ministerio de Salud de Venezuela dejó de publicar estadísticas sobre éste tema en 2016. Desde entonces, los brotes de enfermedades prevenibles por vacunación contra el sarampión y la difteria se han extendido por toda la región.43
Un tema aparte, es la expansión mundial del virus SARS-CoV-2 en todo el mundo. No sabemos exactamente como impactará este evento en la epidemiologia del resto de enfermedades, debido a que la cuarentena podría tener efectos positivos como la disminución de contagios por vías de contacto directo y fómites o negativos como la reemergencia de ciertos microorganismos por la reducción de presión selectiva. Ante ello, el grupo de expertos de la OMS de asesoramiento estratégico en materia de inmunización concluyó que la eliminación del sarampión se encuentra seriamente amenazada y que la enfermedad ha resurgido en diversos países que habían logrado eliminarla, o estaban cerca de conseguirlo.5
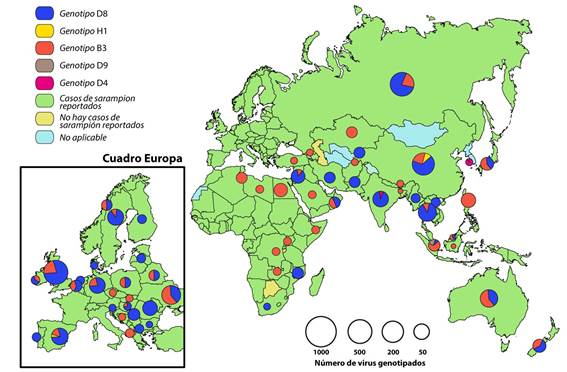
Figura 1. Distribución global de genotipos de sarampión, Febrero 2019 a enero 2020.Fuente: Base de datos MeaNS (genotipos) y base de datos de Inmunizaciones de la OMS. Gráficos de picos proporcionales al número de virus secuenciados. Figura adaptada a partir del Boletín semanal de Sarampión/ Rubéola: Organización Panamericana de la Salud. S/R Gráficos 2020-11. Disponible en: bit.ly/2w8ZY2W
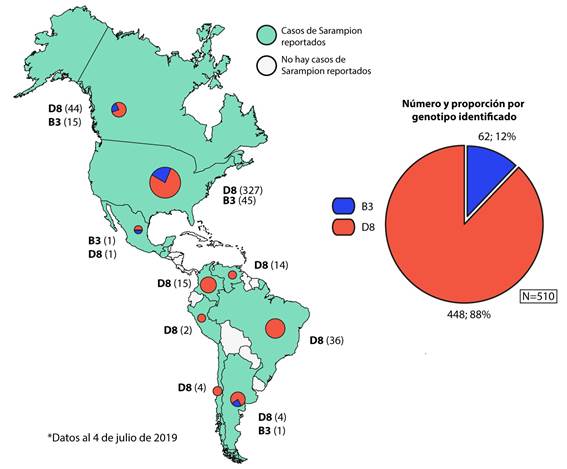
Figura 2 Genotipos identificados en casos confirmados de sarampión en la región de las Américas, 2019*.Datos de secuenciación de vigilancia de nucleótidos del sarampión de la OMS (MeaNS). Figura modificada a partir del Boletín Semanal de Sarampión/Rubéola: Organización Panamericana de la Salud. S/R Gráficos 2019-29. Disponible en bit.ly/2JC7J4s
CONCLUSIÓN
Los países más afectados por el brote sarampión en la RAM actualmente son Venezuela, Colombia, Brasil, Estados Unidos, Argentina y México, en cada uno se presenta un factor desencadenante distinto. Mientras que la crisis política y social que afecta a Venezuela, es el génesis de ésta y otras enfermedades en este país, la migración masiva y un déficit en las tasas de vacunación e inmunidad colectiva o de grupo parecen haber propiciado el incremento de casos tanto en Colombia, Brasil, Argentina y México, en cuanto a Estados unidos, el constante flujo migratorio y factores socio-culturales y religiosos han producido que la enfermedad se extienda con facilidad. Ante esto último, se hace necesario evaluar el impacto de las corrientes anti vacunas en los distintos países de Latinoamérica, debido a que en la actualidad, junto con la baja tasa de inmunización y las migraciones, representan una de las principales causas del resurgimiento de enfermedades prevenibles, y aunque su tendencia está documentada en países europeos y asiáticos, se desconoce su impacto en países latinoamericanos. Por último, el genotipo D8, linaje MVs/Gir Somnath.IND/42.16 y linaje MVi/HuluLangat.MYS/26.11 se presentan como la mayor amenaza en la actualidad para la erradicación del sarampión en la RAM debido al éxito de su diseminación por lo que se debe enfatizar su vigilancia y notificación inmediata.











 text in
text in