INTRODUCCIÓN
El campo de la biotecnología, tiene diferentes metodologías aplicadas a la regeneración, proliferación y cultivo celular. Actualmente, se busca utilizar nuevas tecnologías y complementarlas con características que permitan su aplicación en el área de medicina y salud humana.
La técnica de electrospinning combina la biología y la tecnología de impresión para la creación de nanofibra en “scaffolds” que proporcionen un soporte semejante a la proteína fibrosa de la Matriz extracelular. Para la creación de nanofibra se utilizan solventes orgánicos y ácidos que por su interacción molecular permiten la formación de una estructura nanofibrosa definida; sin embargo, la utilización de estos productos desnaturaliza proteínas, factores de crecimiento1y pueden alterar e inhibir la producción de otros componentes intrínsecos de las células para su desarrollo.
Los polímeros naturales brindan propiedades que se mimetizan con las funciones biológicas como la señalización celular, pero no tienen control sobre sus características estructurales, como el diámetro de la fibra. Por otro lado, los polímeros sintéticos permiten el control de la estructura, no obstante, la capacidad de señalización disminuye2. El colágeno de animales ha sido ampliamente estudiado como un biomaterial para la producción de nanofibra; sin embargo, otros materiales como el alginato o sábila no han sido estudiados a fondo, a pesar de que estos materiales pueden ser de mayor utilidad, ya que son menos tóxicos para las células insertadas en los scaffolds, en comparación con los materiales sintéticos. El producto debe tener las características necesarias para que la proliferación y estructuración celular se acople correctamente a las nanofibras y culminen en la formación de un tejido apto para su implantación1.
El PVA es un polímero semicristalino, altamente hidrófilo, no tóxico y biocompatible, con propiedades de resistencia, solubilidad en agua, permeabilidad a gases y características térmicas. El grado de hidrólisis tiene un efecto directo sobre la resistencia de la nanofibra, ya que el PVA es un elemento muy higroscópico al contener una mayor cantidad de agua o de humedad causa una reducción en su capacidad mecánica3.
Factores como el voltaje, tensión superficial, conductividad eléctrica, peso molecular del polímero y volatilidad del solvente intervienen en la morfología y estructuración de las nanofibras.
En esta revisión analizaremos la utilización de la tecnología de Electrospinning y los parámetros que influyen en la elaboración de nanofibra, los diferentes biomateriales y las aplicaciones en nanofármacos y producción de “scaffolds”.
TÉCNICA DE ELECTROSPINNING
Permite la producción de fibras poliméricas con diámetros variables entre 3 nm y 5 μm como mínimo4. Consta de un mecanismo eléctrico que puede ser manejado por diferentes variables, según la clasificación de Doshi y Reneker, estas se dividen en: solución, propiedades, variables controladas y parámetros ambientales.
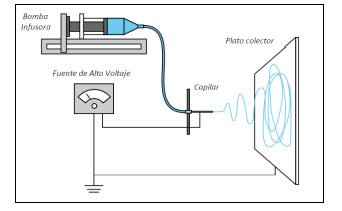
La técnica de electrospinning. El ensamblaje del montaje consta de tres componentes principales: una fuente de alto voltaje que posee dos electrodos los cuales son conectados a la salida de la aguja metálica y otro directo al plato colector, una aguja metálica y un plato colector (lámina de metal conductor). Para impulsar la solución del polímero a través del capilar hacia la placa colectora, se utiliza una bomba de infusión. La tensión superficial de la gota que se forma en el extremo de la aguja es vencida por la fuerza del campo eléctrico, la gota se distorsiona formando el cono de Taylor, esta distorsión provoca la expulsión del polímero cargado eléctricamente en dirección al colector formando hilos delgados, si, el colector es rotatorio es posible la preparación de fibras poliméricas alineadas5.
El control de los diferentes parámetros proporciona características únicas a la fibra obtenida por electrospinning por lo que el proceso de ejecución es muy importante. Cabe resaltar, que para cada polímero y disolvente utilizado será diferente sus parámetros de disolución.
Parámetro de solución
Concentración de la solución polimérica: El tamaño y morfología de la fibra está directamente relacionado con la concentración de polímeros, influenciando la viscosidad relacionados con el enredo de las cadenas poliméricas, a menor enredo menor viscosidad. Si la concentración está muy diluida las fibras se rompen antes de llegar al plato colector debido a la tensión superficial, por el caso contrario si está muy concentrada no se podrá formar la fibra por su alta viscosidad, impedimento para el paso de solución a través del capilar.
La conductividad de disolución: Cuando se adiciona sales a la solución se incrementa la conductividad y por ende la fuerza eléctrica para el estiramiento de la fibra, esto influye directamente en el diámetro de la fibra.
Efecto dieléctrico del disolvente: El disolvente cumple dos funciones importantes en el proceso de electrospinning, uno es disolver las moléculas del polímero para formar el chorro con una carga eléctrica, el segundo es llevar estas mismas moléculas de polímero disueltas hasta el tubo colector.
Parámetros de procesamiento
Voltaje: Principal parámetro, ya que únicamente un voltaje que supere el umbral podrá generar el cono de Taylor que será expulsado hacia el tubo colector. Este voltaje alto brindará un mayor estiramiento, promoviendo la reducción del diámetro de la nanofibra.
Flujo de salida: Cuando el flujo de salida es de mayor diámetro incrementa el tamaño de la fibra, produciendo defectos en ella. Por el contrario, un mínimo valor de diámetro del flujo de salida ayudaría a mantener el cono de Taylor estable dando tiempo necesario para la evaporación del solvente antes de llegar al tubo colector.
Distancia entre la punta de la aguja y el plato colector: La variación de la distancia entre aguja-colector puede o no tener efecto en el grosor y forma de la fibra, ocasionando apariciones de beads, grumos o fibras húmedas. Una distancia pequeña evitará que el solvente se evapore y el polímero salga en forma de hilo. Al trabajar con una distancia mucho mayor la fibra podría quebrarse debido a su propio peso.
Es importante un método de optimización con los parámetros más relevantes como la distancia aguja-colector, flujo de salida, voltaje y concentración de la solución6.
Biomateriales
Las fibras poliméricas producto de soluciones de polímero tienen propiedades de guía intrínseca óptica, además de condiciones mecánicas específicas.
Los biomateriales se clasifican en materiales biodegradables y no biodegradables. Pueden utilizarse dependiendo de la liberación, si ocurre solo por difusión o por difusión y degradación del andamio simultáneamente.
Las nanofibras provienen principalmente de polímeros biodegradables como ácido poliláctico (PLA), policaprolactona (PCL), ácido poli (láctico-co-glicólico) (PLGA), y óxido de polietileno (PEO). De igual forma se ha realizado Electrospinning con polímeros naturales como: quitosano, colágeno, ácido hialurónico, celulosa, seda y otros materiales entre los que es posible nombrar PLLA, PEG7.
Polímeros Naturales:
Andamios de colágeno
El colágeno es una molécula trimérica que consta de tres cadenas α de polipéptidos, estas se entrelazan en una triple hélice para formar homotrímeros o heterotrímeros. Las secuencias helicoidales triples se componen de repeticiones Gly-X-Y, siendo X frecuentemente prolina e Y a menudo 4-hidroxiprolina. Cada colágeno contiene al menos un dominio helicoidal triple (COL) ubicado en la MEC, así como regiones no colagenosas (no Gly-X-Y) (dominios NC).
La intercalación de los dominios COL entre los dominios NC hace que el colágeno sea una proteína multidominio. Los dominios NC participan en el ensamblaje estructural y brindan al colágeno actividades biológicas. Hasta la fecha, se han identificado 28 tipos diferentes de colágeno. Los tipos de colágeno I, II y III son los colágenos más comunes y se denominan colágenos clásicos formadores de fibrillas8.
En el tejido natural, el colágeno es la proteína con estructura fibrilar más abundante de la MEC (Matriz extracelular), que contribuye al andamiaje extracelular. El colágeno representa una función importante en el mantenimiento de la Integridad biológica y estructural de la MEC y presta soporte físico a los tejidos. Posee fuentes extensas como hueso, cartílago, tendón, ligamento, vaso sanguíneo, nervio, piel; ya que es la principal proteína estructural de la mayoría de los tejidos duros y blandos. Además, el colágeno ofrece baja inmunogenicidad, buena permeabilidad, biocompatibilidad y biodegradabilidad, y tiene funciones para regular la morfología, adhesión, migración y diferenciación de las células. Debido a estas características, este polímero natural resulta un biomaterial prometedor para los andamios en la ingeniería de tejidos. Sin embargo, los andamios de colágeno carecen de resistencia mecánica y estabilidad estructural tras la hidratación, lo que limita sus aplicaciones en tejidos particulares9.
Ácido hialurónico
El hialuronano es un polisacárido abundante que se encuentra casi exclusivamente en las articulaciones, permitiendo que las células se unan para la regeneración del cartílago. El Ácido hialurónico es un polímero asociado a soluciones acuosas que se caracteriza por presentar altos niveles de viscosidad, debido a este factor no se pueden desarrollar los procesos típicos del Electrospinning para obtener exitosamente una corriente de chorro constante. Por ello, se establece la metodología Electrospinning “blowing-assisted” (asistido por soplado). En este proceso la muestra debe girarse con ayuda del flujo de aire a temperaturas elevadas, de esta manera, se amplía la ventana de procesamiento8.
Los andamios de nanofibras electrohiladas de Ácido hialurónico con un conveniente grado de post-reticulación, pueden ser aplicados para reparación de cartílago. Los parámetros críticos para el procesamiento de membranas nanofibrosas no tejidas por electrospinning “blowing-assisted” con Ácido hialurónico, mediante los métodos de reología y microscopía electrónica de barrido demostraron que la temperatura de soplado de aire es el parámetro más efectivo para asegurar la formación de nanofibras de Ácido hialurónico. A medida que la temperatura del aire soplado aumentó de 25 a 57° C, la formación de nanofibras se volvió consistente y uniforme10.
Quitosano
El quitosano es un polisacárido compuesto de acetamido 2 deoxi-β-D glucano, (N-acetil D glucosamina y 2 amino 2 deoxi β-D glucanos, que se obtiene por desacetilación parcial de quitina.
El quitosano es un biopolímero catiónico y en solución acuosa tiene efectos polielectrolíticos, el uso de disolventes orgánicos muy tóxicos como hexafluoroisopropanol (HFIP) o ácido trifluoroacético (TFA) desnaturalizan sus propiedades y estructura natural y rompe aún más las interacciones entre cadenas. Sin embargo, para la elaboración de micro o nanofibras electrohiladas de quitosano los disolventes comunes utilizados son ácido trifluoroacético (TFA) o soluciones compuestas de ácido acético diluido. Otra opción es la neutralización utilizando compuestos alcalinos o reticuladores como glutaraldehído y genipina, aunque puede causar la pérdida parcial o total de las características naturales. Además, es poco soluble con solventes orgánicos comúnmente disponibles, lo que perjudica la formación de fibras continuas y el ajuste de la viscosidad ideal.
La naturaleza del quitosano complica la capacidad para la formación de fibras, afectando sus propiedades, ante esta situación se recomienda usar una baja concentración de ácido acético diluido y un agente formador de fibra11.
Alginato
El alginato es una familia completa de copolímeros lineales que contienen bloques de residuos de β-manuronato y α-L-guluronato unidos. Los bloques están compuestos de residuos G consecutivos, residuos M consecutivos y residuos M y G alternados. Los alginatos extraídos de diferentes fuentes difieren en el contenido de M y G, así como la longitud de cada bloque.
Se obtiene típicamente de algas pardas (Phaeophyceae) como Laminaria hyperborea o por biosíntesis bacteriana se puede producir alginato bacteriano a partir de Azotobacter y Pseudomonas. Ha sido ampliamente investigado y utilizado para muchas aplicaciones biomédicas, debido a su biocompatibilidad, baja toxicidad, costo relativamente bajo y gelificación suave. Además, los geles de alginato también son prometedores para el trasplante de células en la ingeniería de tejidos12.
Fosfolípidos
La lecitina es una mezcla natural de fosfolípidos y lípidos neutros, forma micelas inversas cilíndricas en soluciones no acuosas. Como la concentración de la lecitina se eleva en solución, la morfología micelar cambia de esférica a cilíndrica, y a concentraciones más altas las micelas cilíndricas se superponen y se enredan de manera similar a la de las cadenas de polímero en soluciones semildiluídas o concentradas. El agua y otras moléculas polares sirven para unir los grupos de cabeza de fosfato entre los fosfolípidos.
Las fibras electrohiladas de fosfolípidos como la lecitina, con diámetros de 1 a 5 micrómetros, ofrecen el potencial para la fabricación directa de membranas biológicas, de alta superficie sin el uso de múltiples pasos sintéticos, o tratamientos superficiales posteriores al procesamiento de Electrospinning13.
Polímeros Sintéticos:
Los polímeros sintéticos electrohilados incluyen Ácido poliglicólico (PGA), Poliglicólico de lactida (PLGA), Policaprolactona (PCL), Poliuretano (PU), Ácido poliláctico (PLA), Poliestireno (PS) y alcohol polivinílico (PVA).
Copolímeros sintéticos
El uso de copolímeros es un esquema viable para generar nuevos materiales de propiedades deseables. Cuando se implementa adecuadamente, el rendimiento de los andamios elaborados mediante Electrospinning basados en copolímeros se puede mejorar significativamente en comparación con el de los homopolímeros. Por ejemplo, los poliésteres hidrófobos biodegradables generalmente tienen buenas propiedades mecánicas, pero carecen de afinidad celular para la ingeniería de tejidos. La incorporación de un segmento de polímero hidrofílico adecuado puede aumentar la afinidad celular. Además de la afinidad celular, las propiedades mecánicas, la morfología, la estructura, el tamaño y la distribución de los poros, la biodegradabilidad y otras propiedades físicas también se pueden adaptar mediante el uso de copolímeros. Con los copolímeros anfifílicos como moléculas protectoras para encapsular las moléculas del fármaco, los andamios electrohilados pueden usarse para la liberación del fármaco de manera controlada8.
Mezcla de Polímeros
Las mezclas o combinación de polímeros tienen una ventaja sobre los copolímeros en que no están limitadas por esquemas sintéticos. Por lo tanto, los andamios nanofibrosos formados al mezclar diferentes polímeros entre naturales y sintéticos, se convierten en una opción atractiva, especialmente para los polímeros naturales los cuales presentan más complicaciones al modificar su estructura interna para la obtención de fibras. Estos polímeros resultan los más adeptos para las aplicaciones biomédicas.
Mezcla de Polímeros Naturales
Colágeno- Quitosano (CC)
La mezcla de Colágeno-Quitosano (CC) pueden modificar las propiedades mecánicas y biológicas para imitar el tejido natural de la matriz extracelular (MEC).
La adición de quitosano modifica las características helicoidales del colágeno, cambiando las propiedades físicas al introducir enlaces de hidrógeno adicionales.
Se han investigado en detalle los diversos factores que afectan el comportamiento a la tracción de los biomateriales CC electrohilados como las fibras individuales y la membrana fibrosa. En términos de la morfología de la fibra de las mezclas CC, el diámetro de la fibra disminuye al aumentar el contenido de quitosano y estas fibras presentarían mayor resistencia a la tracción en contraste con las fibras de mayor diámetro.
En el caso de las membranas CC electrohiladas, el aumento de la resistencia a la tracción final se observa al disminuir el contenido de quitosano. Las propiedades mecánicas dependen del diámetro de la fibra y la relación de colágeno a quitosano en las fibras12.
Mezcla de Polímeros Naturales y Sintéticos
Los polímeros naturales generalmente poseen propiedades mecánicas débiles; sin embargo, la mezcla entre polímeros naturales y sintéticos combina las características favorables como la resistencia y durabilidad del polímero sintético y la afinidad celular específica de un polímero natural. Por lo tanto, los andamios electrohilados con base en mezclas de polímeros naturales y sintéticos mejorarían tanto las propiedades físicas como la funcionalidad biológica de las fibras.
PLGA con PEG-g-CHN (Quitosano)
La adición de PEG-g-Quitosano disminuye la temperatura de transición vítrea de PLGA, resultando en la disminución de la resistencia a la tracción en la rotura y un aumento de la presión del andamio.
Los andamios compuestos de PLGA/quitina efectúan mejores resultados que los andamios de PLGA puro en queratinocitos humanos. La estructura única de PEG-g-Quitosano también ha mostrado la capacidad de liberación controlada de medicamentos hidrofílicos de andamios PLGA electrohilados. Se han realizado estudios utilizando mezclas de PEG-g-CHN y PLGA con diferentes proporciones para fabricar andamios de electrohilado para liberación de medicamentos, observándose el decrecimiento significativo de la velocidad de liberación inicial del medicamento del andamio y el tiempo de liberación prolongado. De acuerdo a la tasa de liberación manifestada, se concluye que los andamios de polímero PLGA con PEG-g-CHN, mecánicamente fuertes y compatibles, podrían ser candidatos adecuados para aplicaciones en la biomedicina, específicamente en tratamientos de prevención en cirugías8.
PLGA con copolímeros PEG- PLA
Las ventajas combinadas del ajuste de la composición, la capacidad de carga de medicamentos y la capacidad de manejo y la biocompatibilidad como suministro; ya que el material es relativamente hidrofóbico, ubican a estos andamios como candidatos potenciales para evaluaciones y aplicaciones clínicas adicionales.
Se evaluó el uso potencial de un andamio compuesto de PLGA, copolímero dibloque PEG-PLA y cefoxitina sódica para prevenir la adhesión inducida por la cirugía. Este andamio basado en electrohilado de PLGA medicado fue capaz de prevenir por completo cualquier formación de adherencia después de 28 días, con propiedades de barrera física, pero con la capacidad de suministro de medicamentos14.
Aplicaciones en la biomedicina
Diseño de Scaffolds
El incremento de nuevos biomateriales obtenidos por la técnica de Electrospinning, tienen diferentes tipos de aplicaciones que son derivadas de sus propiedades únicas, como su alta relación superficie/volumen, porosidad, propiedades fisicoquímicas y la versatilidad de la técnica en el desarrollo de la microfibra15. En las últimas décadas, la aplicación más frecuente por esta técnica es la de soporte o sustrato celular “scaffolds” en ingeniería de tejidos. Los scaffolds permiten controlar y adaptar la anatomía de una estructura en el cual la forma externa del soporte debe ser adecuada a la necesidad del tejido, la nanofibra puede ser inoculada con nutrientes, factores de crecimiento o genes que estimulan la regeneración tisular. Se han realizado aplicaciones scaffolds en el área biomédica para la formación de cartílagos, huesos, arterias, regeneración de piel y nervios. (Figura N.º 2)
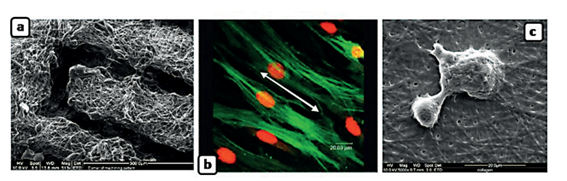
Figura N.°2 a) Preparación de soporte a partir de nanofibras electrohiladas de policaprolactona (PCL). b) Soporte a partir de fibras alineadas de poliácido láctico (PCL) para el crecimiento de células coronarias c) Soporte de fibras electrohiladas de colágeno en un cultivo de células madres.15
La acumulación de radicales libres en nuestras células está relacionada con desórdenes neurológicos, enfermedades cardiovasculares y cáncer, por ello se han implementado estudios para poder capturar las moléculas de radicales libres usando nanofibras con agentes antioxidante16. En este mismo estudio se realizó tratamiento para células cancerosas desarrollando nano convectores que utilizando agentes de formación de imágenes permite dirigirlas a los tumores.
Ingeniería de Tejidos Óseos
Las enfermedades relacionadas con el tejido óseo causan daños estructurales en la superficie del cartílago articular del hueso, produciendo dolor intenso y discapacidad a millones de personas alrededor del mundo. Se sabe que el tratamiento médico va dirigido a aliviar el daño, más no a mejorar las lesiones. Es debido a esto que se necesita una técnica especializada en la reconstrucción ósea. La nanoestructura de fosfato cálcico (CaP) es un biomaterial usado para la fabricación de scaffolds, en la regeneración de hueso, ya que imita el componente orgánico del hueso. Una de las aplicaciones de (CaP) es su uso como nanoestructura en el que combina polímeros naturales o sintéticos con nanoestructuras de CaP, este compuesto es usado como una estrategia exitosa, ya que, el hueso por sí mismo es un nanocomponente del HA y el colágeno, cuya composición contiene (CaP).Otra aplicación interesante de CaP es la interacción que realiza con células madre, es un nanomaterial ideal para la reparación ortopédica, ya que su nivel de acción va más allá de un simple relleno para el hueso. Sirve como scaffolds proveyendo un soporte para la adhesión celular en el que proporciona señales químicas y mecánicas y regula el comportamiento celular promoviendo el proceso de regeneración del hueso.
CONCLUSION
Los polímeros naturales y sintéticos se usan en combinación para manipular y aprovechar las propiedades de los materiales como estabilidad térmica, resistencia mecánica y propiedades de barrera, dependiendo de la aplicación específica.
El diámetro de la fibra obtenida por electrospinning depende de los parámetros de solución, siendo las más importantes: la concentración, viscosidad, conductividad de la solución del polímero y los efectos dieléctricos del solvente, a esto agregamos las variables del proceso, intensidad del campo eléctrico, voltaje, el flujo de salida y distancia de trabajo entre punta de la aguja y el tubo colector; estos parámetros determinan la obtención de nanofibra específica y deseada, o por el contrario, con beats, grumos o fibras húmedas, que no son requeridas ni viables en el diseño de nanoestructuras.
Es así que en la literatura encontramos que la matriz extracelular natural impulsa gran cantidad de señales que generan la diferenciación celular, proliferación, adhesión y migración. La producción de nanofibra en scaffolds por ingeniería de tejidos considera muchos parámetros que afectan la respuesta celular en el desarrollo de esta técnica. Un grosor mayor o menor de las fibras conduce a las células a una diferenciación ya sea a un alargamiento de estas, o un mayor o menor desplazamiento, las fibras largas o cortas implican una mayor o menor velocidad de desplazamiento celular, así mismo, la densidad y la porosidad de la estructura, conduce a una mayor o menor proliferación celular.
El uso de las nanofibras es una técnica innovadora que permite la creación de estructuras Scaffolds con propiedades y características únicas resaltando su porosidad, lo que lo hace importante para la producción de nuevas aplicaciones en el área de la biomedicina, textil y de alimentos. La creación de estos avances tecnológicos permite incrementar la producción usando una variedad de biomateriales reduciendo los costos.
Contribuciones de autoría: Los autores participaron en la génesis de la idea, el diseño, la recolección de la información, el análisis de los resultados y la preparación del manuscrito
Financiamiento: Autofinanciado.
Conflicto de interés: Los autores declaran no tener conflictos de interés en la publicación de este artículo.











 text in
text in