INTRODUCCIÓN
La vía periférica intravenosa es frecuente y ampliamente utilizada para la terapéutica actual; la lesión por extravasación (LpE), produce clínica que va desde dolor, edema, hasta reacciones locales (Tabla 1).
Tabla 1. Características de la lesión por extravasación.
| Características de la extravasación | |||
| Daño tisular(3,10,11) | Factores asociados(10,12) | Tiempo de necrosis* | |
| Vesicantes Irritantes | Osmolaridad Citototoxicidad Presión de infusión Acción vasoconstrictora | Vasopresores :4 hrs Contraste radiológico:6hrs QT: 72hrs(3). | |
| Clasificación Loth y Evans(3,9,10). Reproducible en niños | |||
| Leve: Volumen mínimo Poco dolor Leve edema No eritema No ampollas Resuelve 24-48 hrs. | Moderado: Hasta 5 ml Reacción inflamatoria hasta 10 cm Sensibilidad, eritema No ampollas. | Grave: Más de 5 ml Dolor intenso Marcado edema, Ampollas. | |
| Imágenes Diagnósticas Radiografia/Ultrasonografía: Sirve para extravasación de medios de contraste radiológico(11) | |||
| Superficial: Afecta piel y TCS alrededor de la punción | Subfascial o intracompartimental: Se acumula en un compartimento | ||
| Enfoque Terapeutico | |||
| Conservador (2, 3, 10-12) : Lesión leve: Compresión Compresas frías/calientes Vendajes Analgésicos Aspirar 5ml de sangre antes del retiro del catéter(12) Éxito 79-89% (3,10) | Intervencionista: Procedimiento de drenaje Lavados Quirúrgicos Aplicación antídotos Sin diferencias con valor estadístico | Antídotos: Hialorunidasa en primeras 2 hrs de la lesión o en irrigación(3) Corticosteroides infiltrados: no ha tenido eficacias (úlceras)(12) | |
| Complicaciones(10, 12) | |||
| Agudos Síndrome Compartimental por Extravasación Úlceras Isquemias cutáneas | Secuelas Cicatrices contráctiles | Síndromes dolorosos | |
Con una incidencia del 0,01% a 6,5% en centros oncológicos y de radiodiagnóstico1, en hospitalización se reportan valores del 1.79%2al 11% en la población pediátrica3,4. En el síndrome compartimental (Volkmann, 1881) el edema por LpE modifica la presión de los compartimentos de una extremidad o región anatómica; el traumatismo de la extremidad es la principal causa desencadenante4. Pare y Moore reportan de 1990 a 2014, 51 casos de síndrome compartimental secundario a lesión por extravasación (SCE), con posibles factores predisponentes: infusión presurizada, población con restricción para la comunicación, medicamentos (ceftriaxona, manitol, propofol, gluconato de calcio, dopamina), nutrición parenteral5. El SCE es considerado como de etiología iatrogénica, afectando a pacientes pediátricos hasta en 40%1. Pocos reportes en la literatura médica describen todas las aristas de esta causa-efecto5.
En niños pequeños la comunicación es difícil, por lo que aumenta el riego de desarrollo del síndrome compartimental1,4,5, provocando episodios como: síndromes dolorosos (18,3%)1,4,6, contractura de Volkmann (2,3%) y amputaciones secundarias (2,3%)4,6. Estas secuelas funcionales, estéticas, psicológicas afectan al núcleo familiar, provocando procesos médico-legales de los cuales el 44% se resuelven favorablemente al personal de salud7. El Reino Unido reporta un aumento del 2-4% en casos de negligencia en cirugía pediátrica secundarios a casos de extravasación8.
La escasa publicación médica y epidemiológica a nivel mundial, la importancia de diagnosticar el SCE, el tratamiento como urgencia quirúrgica5, y los desenlaces clínicos y legales, motivan la realización de este informe de caso clínico y revisión de la literatura.
REPORTE DE CASO
Masculino de 9 meses de edad, producto de segunda gesta, de 38 semanas, obtenido por cesárea por desproporción céfalopélvica, sin otros antecedentes. Consultado por pediatría quien diagnostica neumonía viral sobreinfectada bacteriana (Citometría hemática: Hb: 11.1 g/dl, leucocitos totales 22100 céls/campo, Neutrófilos 50%, Plaquetas totales 322 mil), se hospitaliza para tratamiento intravenoso (IV), aporte de oxígeno y terapia respiratoria. Manejo por pediatría: Cefepime (50mg/kg/dosis c/8hrs), Paracetamol (15mg/kg/dosis c/6hrs); líquidos IV: Solución Mixta (150ml/kg/día a 57 ml/hr) y Salbutamol-Bromuro de Ipratropio (3 gotas/kg/nebulización c/8hrs). La canalización IV se realiza por enfermera de la unidad de cuidado intensivo pediátrico del hospital, a nivel dorsal del miembro superior derecho.
A 3 horas de hospitalización y canalización IV, el paciente presenta irritabilidad y edema en acceso venoso, iniciando manejo conservador (elevación de la extremidad, compresas tibias) y se administra analgésico. En este momento, por la evolución y hallazgos clínicos se considera una LpE. Una hora después es valorado por Cirugía de Mano por exacerbación de la irritabilidad y el edema, ya con ampollas en dorso de la mano y antebrazo, llanto a la extensión pasiva de los dedos, llenado capilar distal de 3 segundos (Figura 1). En este punto se considera que la LpE grave ha desarrollado SCE, por lo que se diagnóstica SCE grave. Se decide manejo quirúrgico. La evolución clínica se describe en laTabla 2y laFigura 1. Se realizan 4 intervenciones (Tabla 2,Figura 1). En el post-operatorio de los dos primeros procedimientos se evidencia anemia (7.4 g/dl y 8.5 g/dl, respectivamente), con hemotrasfusión de paquete globular (10ml/kg una dosis en cada ocasión). Se realiza una curación bajo anestesia (Figura 1), cambio de vendajes y curación en habitación cada 48hrs (3 curaciones).
Tabla 2. Evolución clínica: manejo inicial y manejo quirúrgico.
| Manejo inicial | |||||
| Valoración | A 2hrs de ingreso | 4 hrs del ingreso | 5 hrs del ingreso (Figura 1) | ||
| Sintomas | Irritable, llanto no controlable | Persiste irritable, llanto no controlable | Sin modificación | ||
| Vitalografía | Estable | ||||
| Acceso venoso | Permeable sin infiltración | Edema circunscrito a la zona de punción de menos de 3 cm | Edema en mano y antebrazo, tenso y más de 3 cm, lesiones ampulosas; exacerba llanto a la extensión pasiva de los dedos, llenado capilar de 3 seg., temperatura de la extremidad sin cambios | ||
| Manejo médico | Elevación de la extremidad Dosis de analgésico | Se retira acceso venoso, se aplican compresas tibias, analgésico. | Valoración por cirugía de mano: Se diagnostica SCE grave secundario a LpE. Requiere faciotomías de urgencia. | ||
| Manejo quirúrgico | |||||
| 1a Intervención | 2a Intervención | 3a Intervención | 4a Intervención | ||
| Tipo | Faciotomías | Aseo quirúrgico | Aseo quirúrgico | Aseo quirúrgico | |
| Descripción | 1 dorsal y 1 volar antebrazo (Túnel del Carpo, compartimento central de la mano). 2 compartimentos dorsales de los interóseos Aseo quirúrgico (2000 ml/SS0.9%) | 500 ml/SS0.9% No requiere desbridación | No infección, secreción, hematomas. | Aplicación de hidrogel de agua purificada y nanopartículas de plata en lesiones tipo esfacelación (sylvrSTAT (R)). | |
| Viabilidad muscular | 4 C´s de Scully presentes: color, consistencia, contracción muscular, capacidad de sangrado | ||||
| Viab. Ext. | LLC: 2 seg. Temperatura similar a corporal | ||||
| Cierre de heridas | PAT de afrontamiento, no a interóseos, con P5/0 | Cierra de herida en interóseos | Cierre de las heridas y M4/0 y P5/0 | Sin modificación | |
| Momento de realización | A 2 hrs el diagnóstico (Figura 1.) | A 72 hrs de anterior intervención | A 48 hrs de anterior intervención (Figura 1) | A 48 hrs de anterior intervención | |
| Evolución Post-Quirúrgica | 12 hrs: No analgesia extra Sueño y VO normales LLC: 2 seg MA de los dedos POE: 96% | 12hrs: Igual al postoperatorio de 1era intervención POE: 98% | |||
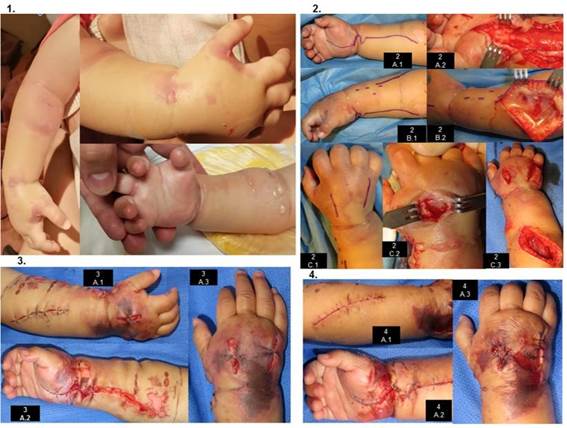
Figura 1. Hallazgos clínicos en la valoración inicial por cirugía de mano 2. Primera cirugía. A.1 abordaje volar. A.2 faciotomía volar. B.1 Abordaje dorsal para el ante-brazo. B.2 Faciotomía del compartimento dorsal. C.1 Abordaje dorsal par la mano. C.2 Liberación del compartimento de los interóseos. C.3 Vista dorsal del antebrazo y la mano con las faciotomías realizadas, se evidencia músculos macroscópicamente viables. 3. Tercera cirugía: cierre inicial con puntos simples en heridas dorsales (A.1 y A.3), en cara volar se modifican los puntos de afrontamiento y se aproxima la herida de la región del antebrazo con puntos subdérmicos. (A.2) El edema ha disminuido; en dorso de la muñeca se delimita un área de necrosis entre faciotomías y en el primer espacio de los metacarpianos. 4. Curación bajo anestesia. A.1 herida en proceso de cicatrización. A.2 Esfacelación de la región de muñeca volar, con heridas bien afrontadas. A.3 Herida de faciotomías afrontadas, el area necrótica se removió.
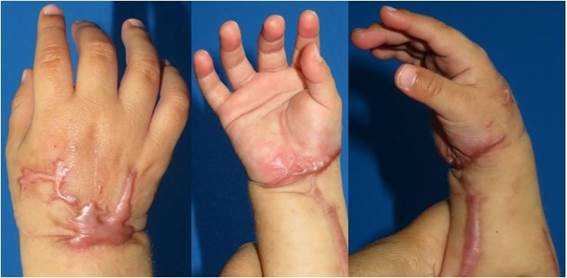
Una semana después del egreso presenta heridas limpias sin dehiscencias, extremidad clínicamente viable y movilidad espontánea; el paciente empieza a incorporarla de forma progresiva en sus actividades cotidianas. Posteriores controles (2ª. semana, 1 mes, 5 meses) muestran gradualmente recuperación del tono y volumen muscular, corroborando en consulta el uso de la extremidad voluntariamente en actividad cotidiana (Figura 2).
DISCUSIÓN
Las LpE ocurren cuando el líquido de una línea IV se filtra al espacio extravascular5de causa no intencionada por el personal de salud9. Clínicamente es importante diferenciar la LpE de reacciones tisulares simples (mediada por histamina, reacción de brote, espasmos o flebitis). La LpE se presenta con edema en la zona circundante a la canalización3,9. Cuando este edema modifica las presión de los compartimentos de una extremidad desencadena un síndrome compartimental. Se resumen los medicamentos, clasificación (Loth y Evans)3,8,9enfoque terapéutico y complicaciones en la Tabla 1.
En el caso clínico se presenta una LpE grave, en quien las medidas conservadoras no remediaron la lesión, desencadenando un SCE. No se consideró apoyo diagnóstico adicional, ya que estudios de imagen o complementarios no modifican el diagnóstico ni la conducta terapéutica. En el SCE la extremidad superior es la afectada en la mayoría de casos3, y se asocia a fractura en 18% y de lesión del tejidos blando hasta en 23%6como desencadenantes. De acuerdo con Matsen, la secuencia fisiopatológica del SCE está dada por: aumento de la presión del compartimento (que genera pérdida del flujo arterial), aumento de la presión tisular y edema, con desarrollo de un círculo vicioso de isquemia y necrosis4,5,10. En niños se han descrito factores de riesgo como fragilidad vascular, panículo adiposo en extremidades superiores que puede enmascarar edemas5, y los ya mencionados de LpE.
Las manifestaciones clínicas clásicas descritas por Griffiths (5 P´s: Signos tempranos: parestesias, edema y dolor. Signos tardíos: disminución del pulso, palidez) reportan baja sensibilidad para el diagnóstico de SCE (26%) con sólo un signo presente, pero si hay tres signos mejora el porcentaje a 93%6,14-16). Estos signos son difíciles de evidenciar en población menor de 3 años, donde se requiere un juicio más preciso. Hallazgos como irritabilidad referida por los padres o enfermería e insatisfacción con el tratamiento analgésico, pueden ser relevantes para el diagnóstico de SCE en niños. Noonan y cols. definen las 3 A´s (Ansiedad, Agitación, aumento Analgésico)11,13. En el caso clínico fueron estos signos y síntomas los que desde un inicio alarmaron al personal de salud en hospitalización.
El uso de medidores de presión intracompartimental (como el de Whiteside y posteriores modificaciones)11, está tomando auge, ya que la sintomatología y la medición de la presión del compartimento hacen más exacto el diagnostico (Sensibilidad=94%, Especificidad=98% Valor Predictivo Positivo=93% y Valor Predictivo Negativo=99%)12, con valor de corte para diagnóstico de 30 mmHg. Este dato está revisión en cirugía ortopédica pediátrica, pues el compartimento en niños tiene niveles basales entre 5,2-9,7 mmHg y el valor de corte podría considerarse en 20mmHg12,13. Además, en la práctica diaria el paciente pediátrico no tolera la medición y monitoreo (2 horas mínimo) pues es un procedimiento invasivo y doloroso. Se están estudiando alternativas como la línea arterial en la extremidad sospechosa de síndrome compartimental, o la medición en quirófano después del acto anestésico13. En el caso clínico presentado no se realizó medición de la presión compartimental pues es el diagnóstico clínico de SCE era claro. Sin embargo, estudios posteriores sobre la medición de la presión del compartimento posterior al acto anestésico aportarían información para aclarar la cifra de corte adecuada en la población pediátrica.
El caso presentado era claro de SCE: un paciente pediátrico menor de 3 años, la canalización con uso de bomba de infusión, presencia de las 3 A´s, los hallazgos de LpE grave en su extremidad, lo que indicaba intervención quirúrgica urgente.
El objetivo del tratamiento es liberar la presión generadora de isquemia y necrosis en el compartimento muscular. La faciotomía salva al músculo, pero la evolución de la piel no se modifica (Mubarack y Owen 1975)4. Es considerada como “Gold Standard” para el tratamiento del SCE4-8,10,13, 17-19). El tiempo entre que se instaura el SCE y la realización de la faciotomía se recomienda idealmente sea no mayor a 6 hrs.7con rangos de tolerancia hasta 8-12 horas4,11, aunque se describió sin secuelas un paciente pediátrico con faciotomía a las 72hrs7. El saber la anatomía del antebrazo (volar superficial, volar profundo, dorsal y lateral) y de la mano (tenar, aductor, hipotenar, central, interóseos) al momento de la descompresión de los compartimentos de la extremidad superior6,10es tan importante como realizar un diagnóstico precoz. Dentro de los actos quirúrgicos se recomienda: 1. Abordajes desde el tercio distal de brazo (lacertus fibroso) que incluya el túnel del carpo. Hay autores que consideran realizar solo el abordaje volar, esperar 10 min y medir intraoperatoria la presión del compartimento dorsal, pues llega a regularizarse evitando una herida6,14y todo lo que esto conlleva, aunque los abordajes dorsal y volar siguen siendo lo indicado. 2. Usar el abordaje de Henry o Thomas sin evidencia de cambios a la descompresión, en la mano liberar el compartimento central y los dorsales de los interóseos. 3. Asociar un aseo quirúrgico.14,154. Vigilar las características macroscópicas del músculo; el sangrado secundario a la faciotomía inicial no debe considerarse como signo de viabilidad del músculo13. 5. El cierre primario en la faciotomía inicial no es recomendado. 5. Se dejan las heridas cubiertas por apósito húmedo más inmovilización10,14. La terapéutica del caso presentado se guió por el tratamiento estandarizado: dos abordajes para los compartimentos del antebrazo y de la mano, y aplicación de puntos parciales en las heridas para evitar retracciones cutáneas. Se consideró no realizar inmovilización con férula al no estar frente a una causa traumática.
Se ha descrito que después de la faciotomía el paciente presenta un edema por reperfusión entre las primeras 24 a 48 horas, por lo que se recomienda un nuevo aseo en 48-72 horas, con la finalidad es evaluar el estado muscular mediante los criterios de Scully (4 C´s: color, consistencia, contracción muscular, capacidad de sangrado) y realizar la desbridación de ser necesario. Acciones adicionales como puntos en piel para evitar retracción, y terapia de presión negativa pueden disminuir hasta en 2 días la estancia hospitalaria6,15. El niño con síndrome compartimental iatrogénico llega a requerir entre 2 a 3 lavados adicionales, el cierre de primera intención diferido es posible y el uso de injertos de piel en esta población llega a utilizarse en 21% de los casos6,13,15. Las faciotomías se asocian con morbilidades a corto plazo (infección 6.7%, transfusiones 7.7% y aumento en estancia hospitalaria de 15.8 días); a largo plazo estas heridas son cosméticamente desagradables para el paciente y generan contracturas articulares o retracción de piel15. El porcentaje de pacientes con SCE de etiología no traumática que reciben descompresión y que registran evolución favorable es de 56-58%7, contrastando con aquellos de etiología traumática, donde el impacto favorable se ha registrado hasta en un 90%8,11,13. El paciente sujeto de este escrito requirió dos transfusiones sanguíneas secundarias al sangrado por el fenómeno de reperfusión, sin presentar deterioro de su estado de salud. Aunque se realizaron puntos para evitar la retracción y cierre primario diferido, la piel del paciente presentó áreas de necrosis tanto dorsal como volar, no tributarias a manejo con injerto de piel. Los días de hospitalización fueron 16 días, la mayoría en la Unidad de Cuidado Pediátrico Intermedio (14 días después de la cirugía de Urgencia hasta el egreso); hasta su última consulta no ha presentado complicaciones relacionadas con isquemia muscular. Los controles se seguirán realizando y se considerarán nuevas intervenciones si el deseo de familiares es el manejo de la cicatrices. La relación médico-paciente con el servicio de cirugía de mano ha sido clara, respetuosa y directa desde el mismo momento de la valoración, antes y después de las intervenciones, evolución en hospitalización y en la consultas de control, lo que puede ser un factor que ha evitado trámites legales.
CONCLUSIÓNES Y RECOMENDACIONES
Difundir los protocolos de acción frente a la extravasación a todo el personal asistencial en hospital y activar la vigilancia estricta son medidas fundamentales para su detección precoz, favoreciendo la consideración del diagnóstico de extravasación como diferencial en el paciente pediátrico.
Es importante considerar la valoración por parte del servicio de pediatría y también del servicio quirúrgico según cada institución.
Una vez con el diagnóstico de SCE en el paciente pediátrico, es muy importante procurar la medición de la presión compartimental tanto en el momento posterior a la anestesia como en el transoperatorio. Esta área es una oportunidad para la investigación y generación de información médica.











 texto en
texto en