INTRODUCCIÓN
En el Perú, dentro de las estrategias para el abordaje de la infección por el virus de Inmunodeficiencia humana (VIH) se encuentra la cobertura del diagnóstico1, tal es así que se dispone de pruebas serológicas de cribado (ELISA, quimioluminiscencia y pruebas rápidas) y de confirmación: inmunofluorescencia indirecta (IFI) e inmunoblot (IB) o western blot (WB)2,3. La IFI es una prueba con tecnología propia4, bastante económica y constituye el 95% de las confirmaciones a nivel nacional, sin embargo cuando el resultado es indeterminado o inespecífico se recurre al IB o WB por tener superior rendimiento diagnóstico3.
El IB comercial de la marca Fujirebio INNO-LIA HIV I/II Score (Inmunoensayo en Línea: sensibilidad 100,0% y especificidad 96.7%) es el kit más usado como prueba de segunda opinión a las muestras que no resolvió la IFI5, siendo a la vez aplicada en numerosos estudios como estándar de oro6-10, pero su principal desventaja radica en que sus costos son elevados, aproximadamente 800 dólares para 20 determinaciones5.
Entre las marcas comerciales disponibles de WB se encuentran MP Diagnostics HIV BLOT 2.2 (sensibilidad: 100,0%; especificidad: 91,9%)11, Biorad NEW LAV-BLOT I (sensibilidad: 87,0%; especificidad: 99,5%)12y Biokit bioblot HIV-1 Plus (sensibilidad: 100,0%; especificidad: 91,9%)13. A pesar de que estas tres marcas no reportan resultados falsos positivos y negativos (sólo indeterminados), su uso es muy limitado debido a los precios costosos atribuidos a sus kits (1,000 a 1,200 dólares para 18 determinaciones)11-13.
El western blot, inmunoblot o inmunoelectrotransferencia es una prueba útil en la identificación de anticuerpos contra el VIH; consiste en la separación de los antígenos virales por electroforesis en geles de poliacrilamida, luego transferidos a una membrana de nitrocelulosa, que será expuesto posteriormente con los anticuerpos del suero o plasma problema y al entrar en contacto con una antiinmunoglobulina marcada con una enzima, reaccionarán inmunológicamente dando lugar a un patrón de bandas, las cuales serán interpretadas bajo alguno de los criterios descritos por los organismos internacionales14.
Cabe decir que, en Perú alrededor de 1,200 muestras anuales son resueltas mediante inmunoblot/western blot15, cuyos gastos llegan a ser superiores a los 60,000 dólares al año. Por lo tanto, debido a la necesidad de un western blot de bajo costo con tecnología propia y frente a los elevados precios de los kits comerciales, nos planteamos el siguiente objetivo: Estandarizar y validar un western blot para el diagnóstico del virus de inmunodeficiencia humana.
MÉTODOS
Diseño y área de estudio
Estudio observacional prospectivo de estandarización y validación de una prueba diagnóstica realizado durante el 2017 y 2018 en el Instituto Nacional de Salud (INS) de Perú. Bajo este enfoque, el diseño es apropiado para estimar la capacidad de una medida que permita discriminar entre personas con enfermedad y sin enfermedad.
Población y muestra
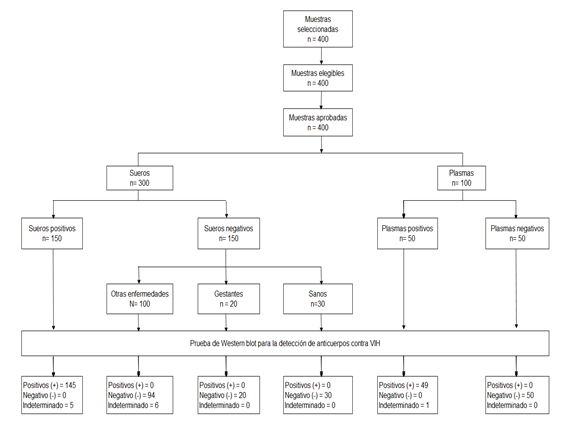
La población estuvo conformada por los sueros y plasmas que pertenecieron a la seroteca y plasmoteca del Laboratorio de Referencia Nacional de VTS-VIH/SIDA del INS durante los años 2016 y 2017. La estimación del tamaño de muestra fue definido por conveniencia, usándose un muestreo no probabilístico, contando con 400 muestras referentes: 150 sueros positivos a VIH-1; 150 sueros negativos a VIH-1 (30 de individuos sanos y 120 de individuos con las siguientes condiciones: veinte con sífilis, veinte de gestantes, veinte con enfermedad reumatoide (ER), veinte con hepatitis B, veinte con HTLV-1, diez con citomegalovirus y diez con dengue); 50 plasmas positivos y 50 plasmas negativos a VIH-1. La prueba de Referencia o Estándar de oro, fue el IB comercial (INNO-LIA™* HIV I/II Score; Fujirebio, Bélgica)5.
Variables e instrumentos
La estandarización y validación de una prueba diagnóstica, implicó considerar las siguientes variables: Sensibilidad, Especificidad, Índice de validez, Valor predictivo positivo (VPP), Valor predictivo negativo (VPN), Índice de Youden y Razón de verosimilitud negativa. Para alcanzar a medir dichas variables, previamente se realizaron tres etapas:
Optimización en la preparación del antígeno de VIH-1.- Se preparó los cultivos celulares de la línea H9/HTLV-IIIB infectadas con VIH-1, siguiendo la metodología descrita por Romero-Ruiz et tal16. El sobrenadante celular fue lavado y centrifugado tres veces con solución salina fisiológica (SSF) al 0.9% a 4,400 rpm por 15 minutos entre 2 a 8°C. Luego se re suspendió el sedimento o pellet con SSF. Para efectuar la lisis viral y celular se usó un sonicador, a 6 periodos de 60 decibeles con 2 minutos por periodo y un minuto de reposo entre periodos manteniendo la cadena de frío (2 a 8°C).
El producto sonicado fue centrifugado a 1,500 rpm por 10 minutos y su sobrenadante fue registrado como antígeno de VIH-1. Finalmente, se usó el método de Bradford17para cuantificar las proteínas del antígeno de VIH-1.
Estandarización en la preparación de las tiras de Western blot.- esta etapa fue estandarizada siguiendo la metodología de electroforesis en geles de poliacrilamida con dodecil sulfato de sodio (SDS-PAGE)18. Se usó la cámara de electroforesis vertical Mini-Protean (Bio-rad) para geles (tamaño del gel: 8.3 por 7.3 cm) de 1.0 mm. Se optimizó el porcentaje de acrilamida para preparar el gel de resolución, estableciéndose dos concentraciones (mixtas) 9% (3,8 cm) y 15% (2 cm). El tratamiento del antígeno, la separación y transferencia electroforética, se realizó siguiendo la metodología descrita por Miranda et al19. Finalmente, se estableció la concentración óptima del antígeno de VIH-1 para preparar las tiras de WB, siendo de 2,71 µg/mm.
Optimización en la reacción Inmunoenzimática de la prueba de Western blot.- el óptimo del volumen que se estableció en todos los pasos de ésta etapa fue de 1 mL. Las tiras blot fueron incubadas tres horas en PBS/tween-leche (PBS/0,1M NaCL, 0,05 M Na2 PO4, pH 7,2; Tween 20/0,3% tween 20; leche/5% de leche) conteniendo los sueros o plasmas del estudio a una dilución 1/40. Seguidamente, las tiras de nitrocelulosa fueron lavadas cinco veces con PBS/Tween-20 e incubadas por una hora en PBS/tween-leche conteniendo el conjugado Anti IgG humano ligada a una peroxidasa, a la dilución de 1/1000. Nuevamente se lavaron las tiras tres veces con PBS/Tween-20 y dos veces con PBS. Las bandas fueron reveladas frente a una solución de substrato (peróxido de hidrógeno 30% a 1uL/mL y diaminobencidina a 0.5 mg/mL en PBS pH 7.2) y se paró la reacción lavando las tiras con agua destilada.
Procedimientos
Lectura, interpretación y validación de la prueba de Western blot.- para el criterio de positividad, se consideró las directrices del Consorcio para la normalización de las serologías de retrovirus (CRSS)11-14,20: POSITIVO: Una banda de p24 o p31 y una banda de ENV (gp41 o gp120). NEGATIVO: Ninguna banda vírica específica presente. INDETERMINADO: Cualquier banda vírica específica presente, pero el patrón no cumple los criterios para positivo. Con estos criterios se validó el WB, realizándose las lecturas e interpretaciones de las 400 muestras referentes incorporadas al estudio.
Análisis estadístico
El análisis estadístico se estimó haciendo uso de una tabla de contingencia, el programa Epidat v3.1 y Excel. Se informó los porcentajes de la Sensibilidad, Especificidad, Índice de validez, Valor predictivo positivo (VPP), Valor predictivo negativo (VPN), Índice de Youden y Razón de verosimilitud negativa, considerando un nivel de confianza de 95% (IC 95%).
Consideraciones éticas
El protocolo del estudio fue aprobado por el Comité Institucional de Ética en Investigación del Instituto Nacional de Salud de Perú con el código: OI-022-14 y con Resolución Directoral N°: 418-2014-DG-OGITT-OPE/INS. Asimismo, la Oficina General de Investigación y Transferencia Tecnológica dio su conformidad al informe final del presente estudio con MEMORANDO N° 027-2019-OGITT/INS.
RESULTADOS
Entre nuestros hallazgos, logramos mostrar ocho bandas importantes, correspondientes a las proteínas víricas de VIH-1: p17, p24, p31, p39, gp41, p55, p66 y gp120. De estas las que fueron tomadas como bandas diagnósticas específicas según el CRSS, fueron: p24, p31, gp41 y gp120 (Figura 1).
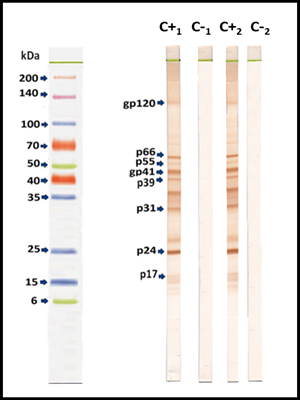
Figura 1: Patrón de reactividad de la prueba de western blot para la detección de anticuerpos: (C+1) positivo a VIH en suero; (C-1) negativo a VIH en suero; (C+2) positivo a VIH en plasma; (C-2) negativo a VIH en plasma
Entre otros hallazgos, resaltamos que frente a las muestras de suero se tuvo once resultados indeterminados (5 del panel positivo y 6 del panel negativo) y frente a las muestras de plasmas hubo un indeterminado procedente del panel positivo. Dichos resultados de la prueba de WB, se muestran en el diagrama de flujo de muestras incorporadas al estudio (Figura 2).
Un destaque importante de esta prueba de WB, es que no mostró falsos positivos y negativos. No obstante, sólo algunas muestras de suero tuvieron resultados indeterminados: sífilis (2/20), hepatitis B (2/20), ER (1/20) y HTLV-1 (1/20) (Tabla 1).
Tabla 1. Validación de la prueba de Western blot para la detección de anticuerpos contra VIH usando muestras positivas negativas e interferentes.
| Western Bloth VIH | ||||||
|---|---|---|---|---|---|---|
| Condición | Cantidad | Verdaderos Positivos | Falsos Positivos | Verdaderos Negativos | Falsos Negativos | Indeterminados |
| Sueros | ||||||
| VIH-1 | 150 | 145 | - | 0 | 0 | 5 |
| Sifilis | 20 | - | 0 | 18 | - | 2 |
| Gestantes | 20 | - | 0 | 20 | - | 0 |
| ER* | 20 | - | 0 | 19 | - | 1 |
| Hepatitis B | 20 | - | 0 | 18 | - | 2 |
| HTLV-1 | 20 | - | 0 | 19 | - | 1 |
| CMV** | 10 | - | 0 | 10 | - | 0 |
| Dengue | 10 | - | 0 | 10 | - | 0 |
| Sanos | 30 | - | 0 | 30 | - | 0 |
| Plasmas | ||||||
| VIH-1 | 50 | 49 | - | 0 | 0 | 1 |
| Negativos a VIH-1 | 50 | - | 0 | 50 | - | 0 |
| Total | 400 | 194 | 0 | 194 | - | 12 |
Guión: no aplica dato, *enfermedad reumatoide, **citomegalovirus
Entre los principales logros, mostramos que los resultados de los parámetros de validación (sensibilidad, especificidad, VPP, VPN e Índice de Validez) para nuestra prueba de WB, fueron superiores a 96,0%; del mismo modo, el índice de Youden con los valores de 0,93 y 0,98, confirma una mínima posibilidad de obtener falsos positivos o falsos negativos; así como una razón de verosimilitud negativa baja de 0,03 y 0,02, que es coherente con los demás resultados (Tabla 2).
Tabla 2. Parámetros de la prueba de Western blot para la detección de anticuerpos contra VIH frente a muestras de sueros y plasmas
| Western Bloth VIH | ||
|---|---|---|
| Parámetros | Suero | Plasma |
| Valor IC (95%) | Valor IC (95%) | |
| Sensibilidad (%) | 96,7 (93,5 - 99,9) | 98,0 (93,1-100,0) |
| Especifidad (%) | 96,0 (92,5 - 99,5) | 100,0 (99,0 - 100,0) |
| Indice de Validez (%) | 96,3 (94,0 - 98,6) | 99,0 (96,6 - 100,0) |
| Valor predictivo +(%) | 96,0 (92,6 - 99,5) | 100,0 (99,0 - 100,0) |
| Valor predictivo -(%) | 96,6 (93,4 - 99,9) | 98,0 (93,3 - 100,0) |
| Indice de Youden | 0,93 (0,88 - 0,97) | 0,98 (0,94 - 1,02) |
| Razón de verosimilitud | 0,03 (0,01 - 0,08) | 0,02 (0,0 - 0,14) |
IC 95%: Intervalo de confianza al 95%
DISCUSIÓN
La prueba de referencia que usamos en el presente estudio, es la más utilizada en el Perú 2,3,6,15 y en otros países 5,7-10 en el inserto reporta una sensibilidad de 100% y especificidades de: 96.7% (banco de sangre) y 96.1% (muestras clínicas); éste kit tiene incorporado proteínas recombinantes y péptidos sintéticos del VIH-1 y VIH-25. La sensibilidad y especificidad de nuestro WB usando proteínas antigénicas de la lisis del VIH-1, fue superior a 96.0%, aun así, no tuvimos falsos negativos y positivos, lo que nos permite deducir que nuestros resultados para los mismos parámetros son similares.
Los kits de Western blot NEW LAV BLOT I (Biorad)12y bioblot HIV-1 plus (Biokit)13empleando el criterio de positividad de la CRSS, reportan sensibilidades de 99,5% y 94,9% y especificidades de 87.0% y 91,9% respectivamente. A la vez informan que no tuvieron falsos negativos y positivos, sólo indeterminados12,13. Asimismo, el kit de Inmunoblot Recom Line HIV-1 & HIV-2 IgG (Mikrogen diagnostik)21, reporta una sensibilidad del 100% y especificidades de: 99,3% (banco de sangre), 98,5% (muestras clínicas) y 96,4% (interferentes). Nuestra prueba de WB para los mismos parámetros, mostró resultados comparables a las tres marcas comerciales descritas de western blot/Inmunoblot.
Debido a los resultados indeterminados que se obtuvieron, no se logró una sensibilidad del 100.0%; esto podría deberse a que los anticuerpos frente a p24 y p31 disminuyen durante el curso en la fase SIDA, lo que provoca un desplazamiento de la interpretación de positivo a indeterminado11; no obstante, desconocemos si las muestras procedieron de pacientes en esa fase.
Para establecer la especificidad (sueros), los resultados indeterminados representaron el 4,0% (6/150); cabe decir que, para los cálculos en otros estudios de validación, no consideran a los indeterminados en el rubro de los falsos positivos22, siendo así tendríamos una especificidad global del 100,0%, en las 144 muestras (144/144). En general los (12/400) indeterminados que obtuvimos (Tabla 1), no afecta la eficiencia diagnóstica de nuestro WB, ya que la Norma técnica peruana indica realizarles a los indeterminados la prueba de PCR ARN viral-VIH-1(carga viral) o PCR ADN proviral-VIH-12.
Nuestra prueba estandarizada y validada, siguió un diseño de WB desarrollada para parásitos, el cual tuvo muy buenos resultados en Perú19,23-25. Las diferentes marcas comerciales de inmunoblot/western blot para VIH usan conjugado que contiene la enzima fosfatasa alcalina, el sustrato 5-Bromo-4-cloro-3- indolil fosfato (BCIP) y como cromógeno el nitro azul de tetrazolio5,11-13,21; mientras que en nuestro WB usamos un conjugado que contiene peroxidasa, el sustrato peróxido de hidrógeno y como cromógeno la diaminobencidina, similar a estos reactivos fueron usados en el kit de WB DAVIH-BLOT procedente de Cuba, el cual mostró buen rendimiento diagnóstico frente a muestras de suero, orina y fluido oral26.
Además de ello el formato de tamaño de tiras y el volumen a usar es similar a la prueba de Referencia5, mientras que las demás marcas comerciales usan tiras blot de mayor tamaño y en consecuencia requieren el uso del doble de volumen de reactivos. Las condiciones mencionadas son importantes de resaltar debido a que nuestra metodología, economiza, ya que usa menos reactivos, a la vez que preparamos nuestro propio antígeno viral, teniendo como ventaja que el INS cuenta con el Laboratorio de Nivel de Bioseguridad III, siendo donde se realiza el mantenimiento y desarrollo de los cultivos celulares de la línea H9/HTLV-IIIB infectadas con VIH-1. En consecuencia, nuestra prueba de WB tendría un costo de hasta diez veces menor al de los kits comerciales.
La prueba de WB fue estandarizada y validada en laboratorio, siendo una limitante del estudio en completar su validación en campo, con la finalidad de que pueda implementarse a los laboratorios de referencia del Perú.
CONCLUSIÓN
Los resultados de los parámetros obtenidos en la prueba de WB para la detección de anticuerpos contra VIH, la califican como una prueba de buen rendimiento diagnóstico y la hace útil para la confirmación serológica, En consecuencia, recomendamos su uso en el Laboratorio de Referencia Nacional de Virus de Transmisión Sexual del INS, como un ensayo alternativo a las pruebas confirmatorias comerciales además de reducir los costos de manera significativa en la confirmación del VIH.











 texto en
texto en