INTRODUCCIÓN
El melanoma maligno (MM) es una neoplasia maligna, afecta meninges, membranas mucosas y ojos. Produce una lesión pigmentada, plana o exofítica, de crecimiento rápido; en etapas iniciales es curable. La falta de atención conlleva a metástasis linfáticas o hematógenas con mortalidad alta1,2. Representa 4% de todos los tumores malignos de la piel, siendo responsable de 80% de las muertes por este tipo de neoplasias. En los Estados Unidos (EE.UU.) es el quinto cáncer más común entre hombres y mujeres. En el mundo, se producen 50 mil fallecimientos por año por MM3-5.
Se presenta a cualquier edad, el 41% se diagnostican antes de los 55 años, a partir de los 70 años son más comunes las variantes histológicas de tipo nodular y lentiginoso acral (58%) y en jóvenes predominan los de extensión superficial (74%)6,7.
En México, la Clínica de Melanoma del Instituto Nacional de Cancerología (INCAN) reportó un incremento de casi 500% en los últimos años. Es muy común que los pacientes con tumores de la piel busquen atención médica en etapas avanzadas, lo que provoca que en la mayoría de los casos ya no sean candidatos a tratamiento o presenten enfermedad metastásica en el momento del diagnóstico y después del tratamiento inicial6. El tratamiento sistémico ofrece tasas diversas de respuesta.
Aunque la mayoría de los pacientes presentan enfermedad localizada en el momento del diagnóstico y pueden presentar curación de la enfermedad con la extirpación quirúrgica del tumor primario in situ; en nuestro medio por las características fenotípicas de la población mexicana, gran parte son diagnosticados cuando presentan metástasis, etapa en la cual el tratamiento se encuentra limitado, siendo la mortalidad elevada6.
El Instituto Mexicano del Seguro Social (IMSS), es una de las instituciones públicas más importantes de Latinoamérica, encargado de atender aproximadamente el 60% de la población. En el año 2018 se contabilizaron 3 079 casos de melanoma en la población mexicana, constituyendo 3% de las neoplasias malignas cutáneas y 65% de las muertes por cáncer5-7.
La Temozolomida es un medicamento aprobado por la Food and Drug Administration (FDA) para el tratamiento del glioblastoma y desde hace una década para el tratamiento del melanoma metastásico4, a dosis de 200 mg/m2 por día, durante cinco días, cada 28 días5, sin embargo, hay poca bibliografía sobre los resultados del manejo del MM con este fármaco.
El objetivo de este estudio fue informar la respuesta al tratamiento con Temozolomida en pacientes con MM metastásico mediante los criterios de RECIST, además de determinar el tipo de variedad histológica, la topografía del melanoma como lesión primaria, las principales regiones metastásicas del MM y la relación entre la presencia de ulceración e indice de Breslow con la respuesta a tratamiento con Temozolomida.
MÉTODOS
Tipo y diseño: Estudio descriptivo, transversal, en pacientes con MM metastásico en estadio III o IV.
Pacientes: Se incluyeron pacientes mayores de 18 años de edad, con expediente clínico completo, que tuvieran tomografía axial computada (TAC) o resonancia magnética nuclear (RMN) inicial y de control al finalizar el tratamiento, en donde se identificaran lesiones diana para seguimiento de evolución manejados con Temozolomida a 200 mg/m2/día, durante cinco días cada 28 días (hasta 12 ciclos en ausencia de progresión de la enfermedad o con toxicidad inaceptable); se excluyeron pacientes con diagnóstico de segundo tumor primario, antecedente de enfermedad autoinmune o con tratamientos previos con corticosteroides o terapia biológica.
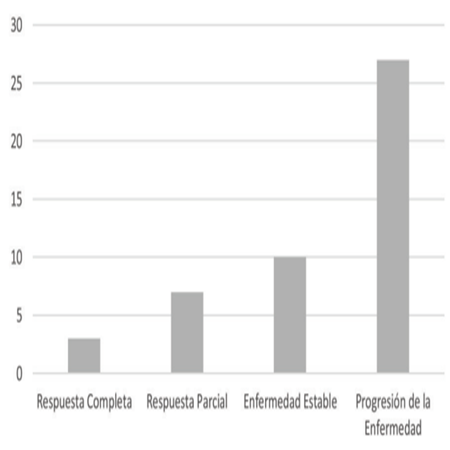
Procedimiento: Los datos fueron tomados del expediente clínico. Una vez identificados los pacientes, se procedió a revisar los estudios contrastados de imagen para identificar las lesiones metastásicas diana, realizar la medición del diámetro plano mayor previo al tratamiento, así como al finalizarlo despues de un periodo de 12 meses de tratamiento. La respuesta al tratamiento fue evaluada de acuerdo con los criterios radiológicos de Evaluación de Respuesta en Tumores Sólidos (RECIST), determinando así Respuesta Completa (RC), Respuesta Parcial (RP), Enfermedad Estable (EE) o Progresión de la Enfermedad (PE), en por lo menos un tumor detectado por TAC o RMN.
Análisis estadísticos: Se realizó un diseño no probabilístico con un muestreo por conveniencia. La estadística fue descriptiva, se halló medidas de tendencia central y dispersión, medias para variables ordinales y frecuencias para nominales.
La distribución de las variables se determinó por las pruebas de hipótesis de Levene y Kolmogorov-Smirnov reforzado con Lilliefors, las cuales mostraron distribución normal p>0,05.
Para demostrar la hipótesis se utilizó regresión logística binaria, se tomó como variable dependiente el grado de RECIST y se dicotomizó en 1, respuesta completa a tratamiento (RC) y en 0 cualquiera de las otras respuestas. Las variables independientes fueron tipo de melanoma, región topográfica, región de metástasis y espesor de Breslow, el cual se define como el grosor o profundidad de lesión tumoral reportada en milimetros en el estudio histopatológico.
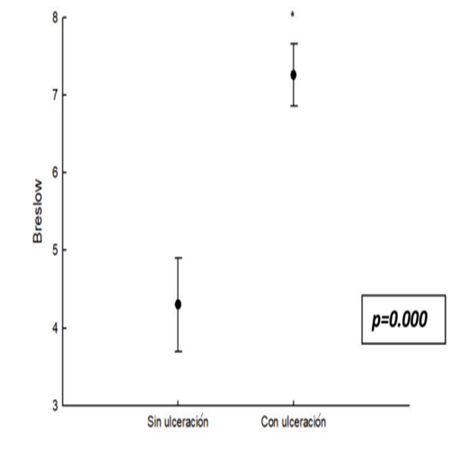
Se utilizó Prueba de Fisher para riesgo (OR), intervalos de confianza, χ2 Wald. La diferencia de medias entre los espesores de Breslow en pacientes sin y con ulceración se determinó con t de Student.
El programa estadístico utilizado fue SPSS, v 23 para Windows y R con su IDE R estudio versión 4,2.
Ética:Este trabajo cumple con los lineamientos éticos en materia de investigación, fue debidamente autorizado por el Comité local de ética en investigación de salud del Hospital de Especialidades Centro Medico Nacional General de Division “Manuel Ávila Camacho”, Puebla, México, el 30 de agosto del 2021, con número de registro R-2021-2101-090; en todo momento se mantuvo el anonimato y los datos fueron utilizados únicamente con fines científicos.
RESULTADOS
Se recabaron expedientes de 51 pacientes con diagnóstico de MM en tratamiento con Temozolomida, en el periodo del 1 de enero de 2016 al 31 de diciembre de 2020. De la población total se excluyó el expediente de un paciente que estaba en tratamiento con anticuerpos monoclonales, se eliminaron tres expedientes por no contar con reporte histopatológico.
Se incluyeron en el estudio expedientes de 47 pacientes, de los cuales 25 fueron hombres y 22 mujeres, siendo el promedio de edad de 54,5 años (22 a 85 años).
La variedad histológica más frecuente en esta población fue en primer lugar el melanoma nodular 11(23%), seguido del acral lentiginoso 10(21%) y melanoma epitelioide 10(21%) respectivamente, encontrando el 30(66%) de las lesiones primarias en miembros pélvicos. En cuanto a las lesiones metastásicas se observó que se presentó en mayor frecuencia metástasis pulmonares, representando el 17(36%). (Tabla 1)
Tabla 1. Relacion de Factor de riesgo/protector para RECIS Progresiva,así como características de la población incluida en el estudio
| Factor | Frecuencia | B(X2) | Valor de p | Odds Ratio | IC 95% | |
| MET ganglionar | 13 | 2,09 (4,57) | 0,030 | 7,11 | 1,21 | 49 |
| Breslow>4 | 32 | - | 0,007 | 0,059 | 0,01 | 0,5 |
| Tipo de Melanoma | ||||||
| Melanoma epiteloide | 10 | - | 0,104 | - | - | - |
| Melanoma nodular | 11 | - | 0,060 | - | - | - |
| Léntigo maligno | 8 | - | 0,270 | - | - | - |
| Acral lentiginoso | 10 | - | 0,591 | - | - | - |
| Amelánico | 2 | - | 0,828 | - | - | - |
| Fusiforme | 3 | - | 0,739 | - | - | - |
| Desmoplásico | 1 | - | 0,240 | - | - | - |
| Coroideo | 1 | - | 0,384 | - | - | - |
| Extensión superficial | 1 | - | 0,384 | - | - | - |
| Región topográfica | ||||||
| Cabeza | 10 | - | 0,591 | - | - | - |
| Tórax | 5 | - | 0,281 | - | - | - |
| Abdomen | 2 | - | 0,828 | - | - | - |
| Miembro pélvico | 30 | - | 0,886 | - | - | - |
| Metástasis | ||||||
| MET pulmonar | 17 | - | 0,333 | - | - | - |
| MET satélite | 8 | - | 0,886 | - | - | - |
| MET SNC | 9 | - | 0,751 | - | - | - |
| MET nodular | 11 | - | 0,898 | - | - | - |
| Úlcera | ||||||
| Frecuencia | 27 | - | 0,230 | - | - | - |
B=Beta, X2= Chi cuadrada, IC= Intervalos de conanza, MET= Metástasis, X= Promedio
Dentro del objetivo primario, en la tasa de respuesta al tratamiento con Temozolomida, este estudio demostró que de acuerdo con los criterios de RECIST se obtuvo una Respuesta Completa en 3(6,3%) de los pacientes, Respuesta Parcial en 7(14,8%), Enfermedad Estable en 10(21%) y Progresión de la Enfermedad en 27(57,4%) pacientes. (Figura 1)
No se observaron diferencias significativas entre la variedad histológica y la región topográfica de la lesión primaria, para presentar progresión de la enfermedad; sin embargo, se identificó que el sitio de lesión metastásico y la presencia de Breslow en la lesión primaria, son un factor significativo para la evolución y la respuesta al tratamiento, encontrando que las metástasis ganglionares son un factor de mejor pronóstico o factor protector (Odds ratio=0,123), y Breslow se asoció a un factor de riesgo para presentar progresión de la enfermedad (Odds ratio=0,059), como se muestra en laTabla 1.
Por último, se estableció que la presencia de ulceración se asocia a índice mayor de Breslow, y como resultado riesgo mayor de progresión de la enfermedad (p=<0,001,t de Student). (Figura 2)
DISCUSIÓN
El MM es un tumor que tiene un efecto significativo en la sociedad; afecta a personas de todas las edades, observándose un aumento en personas en edad productiva, representando un problema de salud pública grave y potencialmente mortal en Latinoamérica. En las últimas décadas se han recolectado datos epidemiológicos en países latinoamericanos respecto a las características sociodemográficas y factores de riesgo de MM en estas regiones. Encontramos similitudes, en el promedio de edad de diagnóstico ya que en la bibliografía de países latinoamericanos reportaron un promedio de 60 años, y en la localización anatómica siendo la extremidad inferior la más afectada en pacientes de raza mestiza, lo cual coincide con esta población de estudio8. También reportamos diferencias, en los artículos de revisión de la Fuente-García8y Zegarra-del Carpio9, reportaron que la variedad histológica más frecuente en México y Perú fue el tipo acral lentiginoso (23 y 31%), en esta población de estudio se encuentra discreta mayoría del melanoma nodular (23 vs 22%), el cual se caracteriza por ser la forma histológica más agresiva, ya que presenta crecimiento vertical desde un inicio8-10.
A pesar de los tratamientos que se han desarrollado en la última década para pacientes con melanoma metastásico, por múltiples limitaciones, en nuestro medio se continúa utilizando principalmente la quimioterapia citotóxica a base de Dacarbazina y Temozolomida. La Temozolomida es un agente citostático alquilante oral derivado de la Dacarbazina, el cual se caracteriza por las ventajas de ser absorbido rápidamente por vía oral, cruzar la barrera hematoencefálica debido a su tamaño molecular pequeño, así como una toxicidad relativamente baja11,12.
En pacientes con melanoma avanzado, es imperativo una penetración alta en el SNC porque la mayoría de los casos de metástasis cerebrales son una causa importante de incapacidad, y en muchos casos conducen directamente a la muerte13,14. En el estudio clínico realizado en Perú por Lozano-Espinoza15reportaron principalmente metástasis a ganglios regionales al momento del diagnóstico en 50% de la población, y 11,5% con metástasis a distancia, principalmente a pulmón, estómago y médula espinal. Hoffman et al.16, han reportado que la incidencia de metástasis cerebrales se encuentra entre el 10-40%, lo cual se puede equipar en nuestra población, ya que las metástasis en el sistema nervioso central (SNC) se presentan en 19,1%, observando tendencia a la progresión de la enfermedad en pacientes con este tipo de lesión metastásica.
Se han descrito múltiples ensayos clínicos en los que se evaluó la eficacia de Temozolomida como agente único; destaca el reporte de Quirt et al.17, quién realizó una revisión de nueve ensayos de fase I o II, donde las tasas de respuesta observadas variaron de 1% a 29%, con respuestas completas observadas en 1% a 17% de los pacientes; en este estudio realizado en la población mexicana según criterios de RECIST el 6,3% de los pacientes presentan respuesta completa y 14,8% una respuesta parcial. A pesar de que la variedad histológica y la región topográfica de la lesión primaria no tuvieron relevancia significativa para la respuesta al tratamiento, se observa que las metástasis en la región ganglionar, representa la mayor parte de la población que tuvo respuesta completa al tratamiento con Temozolomida, así mismo se asoció la presencia de úlcera en la lesión primaria como factor principal de mal pronóstico para progresión de la enfermedad.
Dentro de las limitaciones de este estudio se encuentra el sesgo de selección y el tamaño de la muestra, así como la limitación en el periodo de estudio para determinar la sobrevida de los pacientes en tratamiento con Temozolomida; a pesar de que se han realizado revisiones sistemáticas de respuesta a tratamiento con Temozolomida como monoterapia, las diferencias en el número de población, las características de la misma, y las dosis establecidas de Temozolomida, no es completamente equiparable a este estudio.
Así mismo, en México no se han realizado estudios de respuesta a tratamiento a base de este citotóxico, por ello los resultados de este estudio de investigación son relevantes, ya que se enfoca en evaluar la respuesta a tratamiento, para proponer el mejor uso de la Temozolomida en MM, el cual presentó respuesta completa en pacientes con metástasis ganglionares y satelitales. En múltiples paises de América Latina, las limitaciones geográficas o financieras pueden impedir el acceso de los pacientes a la atención médica básica, o el acceso a tratamientos de primera elección actuales para melanoma en estadios avanzados, como inhibidores de PD-1 principalmente pembrolizumab y nivolumab, así como inhibidores de CTLA-4 como ipilimimab18. Los resultados de este estudio abren la discusión al costo/beneficio de terapias como inmunoterapia las cuales han demostrado aumento en vida libre de enfermedad, principalmente en el sector de salud público, para ofrecer mejor supervivencia y calidad de vida en esta oncopatogenia, asi como hacer enfasis en las medidas y campañas de prevención primaria.
CONCLUSIÓN
La Temozolomida como monoterapia es una opción terapéutica razonable si la cirugía no es apropiada; presenta tasas bajas de respuesta parcial y completa con resultados mejores en metástasis ganglionares. La variedad histológica más frecuente es el melanoma nodular. La presencia de ulceración en la lesión primaria, al momento del diagnóstico, representa un pronóstico y factor de riesgo malos para la respuesta a tratamiento de melanoma.











 texto en
texto en